Ефективність терапії пацієнтів з неходжкінськими лімфомами з використанням препарату ритуксимаб
Крячок И.А., Филоненко К.С. , Губарева А.А., Титоренко И.Б., Алексик Е.М., Кадникова Т.В. , Новосад И.О., Мартынчик А.В., Кущевой Е.В., Пастушенко Я.В., Куценко Л.Б.
Резюме. Для дослідження ефективності терапії пацієнтів з В-клітинними неходжкінськими лімфомами з або без використання препарату ритуксимабу обрано групу зі 210 пацієнтів. Проведено ретроспективний аналіз безпосередніх та віддалених результатів лікування. У групі пацієнтів, які отримували курси хіміотерапії з включенням препарату ритуксимаб (досліджувана група), виявлено збільшення частоти безпосередніх відповідей на лікування на 23% порівняно з групою пацієнтів, які отримували стандартні курси хіміотерапії (контрольна група). Показник 5-річної загальної виживаності у досліджуваній групі становив 69,4±6,4%, у контрольній групі — 49,1±7,3% (р<0,05).
Резюме. Для исследования эффективности терапии пациентов с В-клеточными неходжкинскими лимфомами с или без использования ритуксимаба выбрана группа из 210 пациентов. Проведен ретроспективный анализ непосредственных и отдаленных результатов лечения. В группе пациентов, которые получали курсы химиотерапии с включением препарата ритуксимаб (исследуемая группа), выявлено увеличение частоты непосредственного ответа на лечение на 23% по сравнению с группой пациентов, которые получали стандартные курсы химиотерапии (контрольная группа). Показатель 5-летней общей выживаемости составил 69,4±6,4% в исследуемой и 49,1±7,3% в контрольной группе (р<0,05).

Вступление
Неходжкинские лимфомы (НХЛ) — это злокачественные опухоли лимфоидной ткани, которые объединяют целый ряд хронических лимфопролиферативных заболеваний, отличающихся между собой по степени злокачественности, характеру, объему поражения, особенностям клинического течения и характеризуются клональной пролиферацией В- или Т-лимфоцитов.
За последние 40 лет подходы к лечению НХЛ значительно изменились: от назначения лучевой терапии (60–80-е годы прошлого века) и монохимиотерапии алкилирующими цитостатическими препаратами (хлорамбуцил, циклофосфамид) к назначению курсов полихимиотерапии (ПХТ) по схемам CHOP, CVP, СНОЕР и прочих и высокодозовой химиотерапии (ВДХТ) с трансплантацией костного мозга (ТКМ). При проведении рандомизированных исследований было доказано, что использование современных протоколов лечения больных с НХЛ позволяет увеличить уровень общих ответов на терапию, общую выживаемость больных, длительность ремиссии и уменьшить вероятность возникновения рецидива.
Одним из последних достижений онкологии является применение лечебных моноклональных антител (МКАТ) в терапии НХЛ. Механизм действия МКАТ существенно отличается от действия цитостатических препаратов. Они воздействуют на клетки-мишени, которые несут определенные антигены, и практически не оказывают воздействия на другие клетки, органы и ткани. Внедрение МКАТ в практику лечения больных НХЛ открыло новые возможности и перспективы в достижении наилучших результатов терапии данной группы.
Одним из первых препаратов группы МКАТ, одобренных для лечения НХЛ, стал препарат ритуксимаб — МКАТ к CD20-антигену. CD20 — поверхностный антиген, который экспрессируется более чем на 90% лимфоцитов, не исчезает и не трансформируется на нео-пластических клетках [12]. Этот антиген является негликозилированным мембранным белком В-лимфоцитов с молекулярной массой 35 кДа, участвующим во внутриклеточной передаче сигнала, дифференцировании В-лимфоцитов и мобилизации кальциевых каналов [16, 17]. Этот антиген появляется как ранний маркер дифференцирования В-клеточной линии и экспрессируется с разной антигенной плотностью как на нормальных, так и на злокачественных популяциях В-лимфоцитов. Однако антиген отсутствует на полностью зрелых В-лимфоцитах (например плазматических клетках), ранних популяциях В-клеток и стволовых клетках, что делает его подходящей мишенью для терапии МКАТ при НХЛ [14]. Антитела против CD20-антигена были получены для применения как в исследовательской работе, так и в практике терапии В-клеточных лимфом.
Термин «CD20-антитело» включает иммуноглобулины и их фрагменты, которые специфически реагируют с белком CD20-ангигена или его пептидом. Антитела к CD20 могут включать антитела человека, химерные антитела, биоспецифические и гуманизированные антитела.
Ритуксимаб известен в качестве торговых брендов MabThera®, RITUXAN®, а также Rituximab, IDEC — C2B8 и С2В8, и был первым, одобренным к использованию Управлением по контролю за пищевыми продуктами и лекарственными средствами США (US Food and Drug Administration — FDA) МКАТ, разработанным в IDEC Pharmaceuticals (патенты США № 5843439; 5776456 и 5736137) препаратом для лечения В-клеточных НХЛ [8, 16]. Препарат зарегистрирован для лечения индолентных НХЛ в США в 2001 г. и в Украине в 2003 г. Этот препарат является мышиным химерным МКАТ против CD20. В экспериментах in vivo и in vitro показано, что ритуксимаб вызывает разрушение клеток НХЛ с помощью комплементопосредованного механизма, антителозависимой клеточной цитотоксичности, а также путем непосредственной индукции апоптоза [2, 3, 11, 15]. Многочисленные исследования доказали значительное улучшение как непосредственных, так и отдаленных результатов терапии пациентов НХЛ с использованием ритуксимаба [19, 20]. Подход с добавлением этого препарата к курсам ПХТ позволяет достичь удовлетворительных результатов лечения, обеспечивая достаточно высокие показатели выживаемости пациентов с НХЛ [19, 20].
Использование МКАТ к CD20-антигену приводит к таргетному разрушению CD20-позитивных опухолевых клеток. Исследования A. Aviles и соавторов (2001) и P. Zinzani и соавторов (2004) свидетельствуют, что концентрация ритуксимаба в сыворотке крови увеличивается после каждого введения препарата и в достаточной концентрации определяется даже через 3 мес после окончания лечения, а возобновление уровня В-лимфоцитов после назначения ритуксимаба отмечают через 6–9 мес [1, 18]. Следовательно, благодаря своим уникальным свойствам, CD20-антитело является отличным кандидатом для проведения как индукционной, так и поддерживающей терапии НХЛ [9, 10].
Материалы и методы
В отделении онкогематологии Национального института рака (ранее Институт онкологии АМН Украины) в 2001–2010 гг. находились на лечении 110 больных с НХЛ, которые получали лечение с препаратом ритуксимаб (37 женщин и 73 мужчины) в возрасте 19–76 лет (медиана возраста составила 46 лет). Эти пациенты были включены нами в исследуемую группу, в которой изучались непосредственные и отдаленные результаты лечения. В качестве контрольной группы исследовали эффективность лечения у 100 пациентов, которым проводилась терапия аналогичными схемами без применения данного препарата.
Диагноз НХЛ у всех больных был установлен на основании критериев, изложенных в последних классификациях опухолей кроветворной и лимфоидной тканей ВОЗ (2001 и 2008 г.) с помощью иммуногистохимического исследования, которое следовало за гистологическим исследованием с использованием панели моноклональных антител к Т- и В-лимфоцитам, миеломоноцитарным клеткам, а также ряду нелинейных антигенов [13]. Иммунофенотип опухолевых клеток изучали на материале биопсии в парафиновых блоках. Во всех случаях были выявлены В-клеточные лимфомы с высокой экспрессией CD20-антигена, что позволило использовать для лечения этих больных препарат ритуксимаб [13]. Среди них наибольшую группу составили диффузные крупноклеточные лимфомы (75 больных, в том числе медиастинальная форма — 7 (68%)), мелкоклеточные лимфомы (12 больных — 11%), неуточненные В-клеточные (9 пациентов — 8%), а также другие виды — 14 больных (мантийноклеточные — 5, маргинальной зоны — 5, лимфоплазмоцитарная — 1, фолликулярная — 2, В-ХЛЛ — 1). Локализированные стадии (І и ІІ) выявлены у 27 пациентов (20%), генерализированные (ІІІ и IV) — у 83 (80%). Из них І стадия — у 7, ІІ — у 20, ІІІ — у 15, IV — у 68 пациентов. В-симптомы (лихорадка температура тела выше 38 °С, ночная потливость, уменьшение массы тела >10% от начального за последние 6 мес) отмечены у 46 пациентов (42%). Поражение костного мозга выявлено при исследовании материала стернальной пункции у 24 больных (21%). Экстранодальные очаги определены у 53 пациентов: поражение печени — в 11 случаях (22% экстранодальных локализаций), легких — в 10 случаях (20%), желудка — в 9 случаях (18%), костей и суставов 8 (12%) и других органов — в 15 (почек, надпочечников, брюшины, кожи и подкожно-жировой клетчатки по 3 случая, толстого кишечника, поджелудочной железы, плевры, мягких тканей передней грудной стенки по 2 случая, отдельные случаи поражения слюнной железы, щитовидной железы, пищевода, перикарда, головного мозга, матки с придатками, молочных желез, диафрагмы; всего 28%). (табл. 1).
В составе терапии первой линии ритуксимаб был назначен 78 пациентам (71%), в качестве терапии второй линии (для лечения рецидива, первично-рефрактерной формы) — 32 больным (29%). Химиотерапию получили 82 (75%) пациента, химио-лучевую терапию — 28 больных (см. табл. 1).
Всего за время лечения пациенты получили от 1 до 8 курсов ПХТ с использованием ритуксимаба (медиана — 4,2 курса). 75% пациентов начали лечение с использованием ритуксимаба в 2006–2010 гг.
Контрольная группа, в состав которой вошли 100 пациентов, была аналогичной по половым, возрастным и клинико-лабораторным признакам. (см. табл. 1)
| Признак | Количество больных | ||||
|---|---|---|---|---|---|
| исследуемая группа | контрольная группа | ||||
| Абсолютное число | % | Абсолютное число | % | р | |
| Пол | |||||
| Мужчины | 37 | 32 | 32 | 32 | <0,05 |
| Женщины | 73 | 68 | 68 | 68 | |
| Возраст, годы | |||||
| Диапазон | 19–76 | 18–79 | |||
| Медиана | 46 | 48 | |||
| Экстранодальное поражение | 51 | 48 | 48 | 48 | |
| Печени | 11 | 10 | 10 | 10 | |
| Легкие | 10 | 12 | 12 | 12 | |
| Желудок | 9 | 9 | 9 | 9 | |
| Кости и суставы | 8 | 5 | 5 | 5 | |
| Другое | 15 | 12 | 12 | 12 | |
| Поражение костного мозга | 24 | 21 | 21 | 21 | |
| НХЛ В-клеточные | |||||
| Крупноклеточная | 75 | 68 | 66 | 66 | |
| в том числе медиастинальная | 7 | 6 | 19 | 19 | |
| Мелкоклеточная | 12 | 11 | 15 | 15 | |
| Неуточненные | 9 | 8 | 10 | 10 | |
| Другое | 14 | 7 | 9 | 9 | |
| Линия терапии | |||||
| Первая | 78 | 71 | 69 | 69 | |
| Рецидив | 32 | 29 | 31 | 31 | |
| Стадия заболевания | |||||
| Локальные стадии | 27 | 20 | 19 | 19 | |
| I | 7 | 5,5 | |||
| II | 20 | 13,5 | |||
| Генерализованные стадии | 83 | 80 | 81 | 81 | |
| III | 15 | 16,2 | |||
| IV | 68 | 64,9 | |||
Непосредственные результаты лечения были оценены в соответствии с международными критериями ответа на лечение: показатели общего ответа на лечение, полной ремиссии (ПР), частичной ремиссии (ЧР), стабилизации заболевания (СЗ), прогрессии заболевания (Cheson, 1999 и 2007) [4]. Отдаленные результаты оценивали по показателям 5-летней общей выживаемости (ОВ) и бессобытийной выживаемости (БСВ), медианы выживаемости.
Проведены корреляционный анализ, сравнение средних величин, анализ с применением критерия χ2, построение таблиц и кривых выживаемости по методике Каплана — Майера, с оценкой достоверности разницы выживаемости.
Ритуксимаб вводили в комбинации с химиотерапевтическими препаратами в составе схем СНОР (циклофосфамид 750 мг/м2 в/в 1-й день, доксорубицин 50 мг/м2 в/в 1-й день, винкристин 1,4 мг/м2 в/в 1-й день, преднизолон 60 мг/м2 р.о. в 1–5-й дни) и СНОР-like, с добавлением блеомицина или этопозида один раз в 21 день [5, 6, 7]. Ритуксимаб вводили после премедикации препаратами парацетамола (1 г) перорально, дифенгидрамина (1% 1 мл) и дексаметазона (8 мг) в/в. Необходимая доза вводилась растворенной в 500 мл 0,9% раствора хлорида натрия в пластиковой таре по схеме, наращивая скорость каждые 30 мин. Введение проводили с помощью системы Infusomat или Exadrop по схеме.
Пациенты контрольной группы получали терапию аналогичными схемами без применения препарата ритуксимаб.
Результаты и обсуждение
Медиана наблюдения составила 24 мес (подавляющее большинство пациентов начали терапию с ритуксимабом в 2006–2010 гг.) (3–110 мес). Непосредственный ответ на лечение в обеих группах был следующим. В исследуемой группе позитивный ответ на лечение (ПР или ЧР) достигнут у 81 больного (79%), а в контрольной группе — у 64 (64%). При этом ПР достигли: в группе с ритуксимабом — 48 пациентов (44%), в контрольной группе — 37 пациентов (37%). ЧР достигли 39 (35 %) и 27 (27%) пациентов соответственно. Прогрессию или стабилизацию процесса отмечали у 23 пациентов исследуемой группы (21%) и 36 больных контрольной группы (табл. 2, рисунок). При этом все пациенты с прогрессией заболевания в исследуемой группе получили не более 4 курсов ПХТ с добавлением ритуксимаба.
| р<0,05 | Получали ритуксимаб | Не получали ритуксимаб | ||
|---|---|---|---|---|
| Количество больных | % | Количество больных | % | |
| Общий ответ на лечение | 87 | 79 | 64 | 64 |
| Полная ремиссия | 48 | 44 | 37 | 37 |
| Частичная ремиссия | 39 | 35 | 27 | 27 |
| Прогрессирование или стабилизация | 23 | 21 | 36 | 36 |
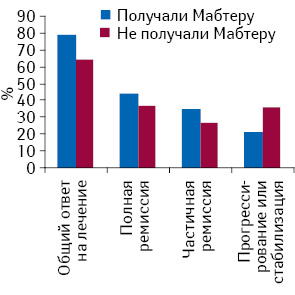
Ремиссии в исследуемой группе были более стойкими, чем в контрольной группе, что иллюстрируют показатели отдаленных результатов лечения (табл. 3).
| Показатель | Исследуемая группа, % | Контрольная группа, % | р |
|---|---|---|---|
| 5-летняя ОВ | 69,4±6,4 | 49,1±7,3 | <0,05 |
| Медиана ОВ | Не достигнута | 40 мес. | |
| 5-летняя БСВ | 64,2±7,5 | 42,5±9,1 | |
| Медиана БСВ | Не достигнута | 35 мес |
При изучении отдаленных результатов выявлено, что в исследуемой группе общая 5-летняя выживаемость составила 69,4±6,4%, в контрольной группе — 49,1±7,3% (р<0,05). Медиана ОВ в исследуемой группе не достигнута, в контрольной группе составила 40 мес. Бессобытийная 5-летняя выживаемость составила 64,2±7,5 и 42,5±9,1% соответственно (р<0,05). Медиана БСВ в исследуемой группе не достигнута, в контрольной группе — 35 мес.
Применение ритуксимаба оказалось эффективным как в лечении первичных пациентов, так и в терапии рецидивов НХЛ. Общая 5-летняя выживаемость составила 73,6±10,1% при лечении первичных лимфом и 47,0±11,5% при лечении рецидива.
При этом среди пациентов, которые получили от 1 до 3 курсов ПХТ с использованием ритуксимаба, общая 5-летняя выживаемость составила 50,2±10,8%, медиана — 30 мес, в группе пациентов, которые получили 4–8 курсов ПХТ с использованием ритуксимаба, общая 5-летняя выживаемость составила 76,0±8,3%, медиана — не достигнута (табл. 4).
| Показатель, р<0,05 | 5-летняя ОВ, % | Медиана ОВ |
|---|---|---|
| 1–3 курса | 50,2±10,8 | 30 мес |
| 4–8 курсов | 76,0±8,4 | Не достигнута |
Выводы
1. Ритуксимаб увеличивает частоту непосредственного ответа на лечение на 23%, в том числе частоту ПР на 11%, ЧР на 11% и уменьшает число случаев прогрессии заболевания на 12%.
2. Достигнутые ремиссии после использования препарата ритуксимаб были более стойкими, что демонстрирует повышение 5-летней БСВ, составившей 64,2±7,5% в исследуемой группе и 42,5±9,1% — в контрольной, р<0,05.
3. Ритуксимаб влияет на отдаленные результаты лечения, достоверно увеличивая показатели 5-летней выживаемости пациентов (5-летняя ОВ составила 69,4±6,4% в исследуемой группе, и 49,1±7,3% в контрольной группе, р<0,05).
4. Добавление ритуксимаба к курсам ПХТ повышает эффективность лечения как в качестве первой, так и второй линий терапии.
5. Эффективность применения препарата ритуксимаб зависит от количества проведенных курсов ПХТ с использованием этого препарата и повышается с увеличением количества курсов ПХТ, проведенных с препаратом ритуксимаб.
Литература
- 1. Aviles A., Leon M.I., DiazMaqueo J. С et al. (2001) Rituximab in the treatment of refractory follicular lymphoma — six doses are better than four. J. Hematother. Stem. Cell. Res.10(2): 313–316.
- 2. Bannerji R., Kitada S., Flinn I.W. (2003) Apoptotic- regulatory and complement-protecting protein expression in chronic lymphocytic leukemia: relationship to in vivo rituximab resistance. J. Clin. Oncol., 21: 1466–1471.
- 3. Bellosillo В., Villamor N., Lopez-Guillermo A. et al. (2001) Complement-mediated cell death induced by rituximab in B-cell lymphoproliferative disorders is mediated in vitro by a caspase-independent mechanism involving the generation of reactive oxygen species. Blood. 98: 2771–2777.
- 4. Chesson B., Horning S., Coiffier B. еt al. (1999) Report of an International Workshop to standardize Responce Criteria for Non-Hodgkin’s lymphomas. J. Clin. Oncol., 14( 4): 1244–1253.
- 5. Coiffier B., Lepage E., Brier J. et al. (2002) Chop chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse Large-B-cell lymphoma. N. Engl. J. Med., 346: 235–242.
- 6. Czuczman M.S., Grillo-Lopez A.J., White С.A. et al. (1999) Treatment of patients with low-grade B-cell lymphoma with the combination of chimeric anti-CD 20 monoclonal antibody and CHOP chemotherapy. J. Clin. Oncol.,17: 268–276.
- 7. Fisher R.I., Gayon E.R., Dahlberg S. (1993) Comparison of standard regimen (CHOP) with three intensive chemotherapy regimens for advanced Non-Hodgkin’s lymphoma. N. Engl. J. Med., 328: 1002–1006.
- 8. Grillo-Lopez A.-J., White С.A., Varns С. et al. (1999) Overview of the clinical development of rituximab: first monoclonal antibody approved for the treatment of lymphoma. Semin. Oncol., 26: 66–73.
- 9. Hainsworth J., Litchy S., Burris H. et al. (2002) Rituximab as first line and maintenance therapy for patients with indolent non-Hodgkin’s lymphoma. J. Clin Oncol., 20: 4261–4267.
- 10. Howard O., Gribben J., Neuberg D. et al. (1999) Rituxan. CHOP induction therapy in newly diagnosed patients with mantlecell lymphoma. Blood, 94: 631a.
- 11. Manches O., Lui G., Chaperot L. et al. (2003) In vitro mechanisms of action of rituximab on primary non-Hodgkin lymphomas. Blood, 101: 949–954.
- 12. McLaughlin P., Grillo-Lopez A.J., Link B.K. et al. (1998) Rituximab chimeric anti-CD 20 monoclonal antibody therapy forrelapsed indolent lymphoma: half of patients respond to a four-dose treatment program. J. Clin. Oncol., 162: 825–2833.
- 13. NCCN Clinical practice guidelines in oncology (2008) Non-Hodgkin’s lymphoma. 3. http://www.nccn.org/ professionals/ physician_gls/pdf /nhl.pdf
- 14. Pedersen I.M., Buhl A.M., Klausen P. et al. (2002) The chimeric anti-CD 20 antibody rituximab induces apoptosis in B-cell chronic lymphocytic leukemia cells through a p38 mitogen activated protein-kinase-dependent mechanism. Blood; 99: 1314–1319.
- 15. Reff M.E., Carner K., Chambers K.S. et al. (1994) Depletion of В cells in vivo by a chimeric mouse human monoclonal antibody to CD 20. Blood; 83: 435–445.
- 16. Selenko N., Maidic O., Draxier S. et al. (2001) CD 20 antibody (C2B8)-induced apoptosis of lymphoma cells promotes phagocytosis by dendritic cells and cross-priming of CD8+ cytotoxic T cells. Leukemia (Baltimore); 15: 1619–1626.
- 17. Shan D., Ledbetter J.A., Press O.W. (1998) Apoptosis of malignant human В cells by ligation of CD 20 with monoclonal antibodies. Blood; 91: 1644–1652.
- 18. Zinzani P.L., Pulsoni A., Perrotti A. et al. (2004) Fludarabine plus mitoxantrone with and without rituximab versus CHOP with and without rituximab as front-line treatment for patients with follicular lymphoma. J Clin Oncol.; 22 (13): 2654–2661.
- 19. Pfreundschuh M., Trümper L., ЗВterborg A. et al. (2006) CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognЗВis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group.Lancet Oncol.; 7(5): 379–391.
- 20. R-CHOP-14 in patients with diffuse large B-cell lymphoma: feasibility and preliminary efficacy. Halaas J.L., Moskowitz C.H., Horwitz S. et al. (2005) Leuk Lymphoma. Apr; 46(4): 541–7.
x














Leave a comment