Лікування ВІЛ-асоційованих неходжкінських лімфом в еру високоактивної антиретровірусної терапії
Крячок И.А., Скрипец Т.В., Ульянченко Е.О., Титоренко И.Б., Алексик Е.М., Мартынчик А.В., Филоненко Е.С., Новосад И.О.
Резюме. Терапія пацієнтів з ВІЛ-асоційованими лімфоми на сьогодні є одним з актуальних питань не тільки для онкогематології, але і фахівців з інфекційних хвороб. Лікування ВІЛ-асоційованих лімфом ґрунтується як на результатах великих багатоцентрових досліджень за участю ВІЛ-негативних пацієнтів і відповідних національних і міжнародних стандартів, а також на даних клінічних досліджень, які були проведені у ВІЛ-позитивних пацієнтів.
Резюме. Терапия пациентов с ВИЧ-ассоциированными лимфомами на сегодня является одним из актуальных вопросов не только для онкогематологов, но и специалистов по инфекционным болезням. Лечение ВИЧ-ассоциированных лимфом основывается как на результатах больших многоцентровых исследований с участием ВИЧ-отрицательных пациентов и соответствующих национальных и международных стандартов, так и на данных клинических исследований, которые были проведены у ВИЧ-положительных пациентов.
 Уровень заболеваемости лимфомами у ВИЧ-инфицированных пациентов выше по сравнению с общей популяцией. Наиболее часто возникает неходжкинская диффузная В-крупноклеточная лимфома (ДВККЛ) — лимфома Беркитта (ЛБ) [1]. У ВИЧ-инфицированных пациентов повышается также частота заболеваемости лимфомой Ходжкина (ЛХ). Первичная эффузионная (выпотная) лимфома (ПЭЛ) составляет 3–4% случаев всех ВИЧ-ассоциированных лимфом. Данный тип лимфомы характеризуется наличием выпота в серозных полостях и отсутствием какого-либо объемного образования. Однако в настоящее время данный тип лимфомы связывают не с ВИЧ-инфекцией, а с инфицированием HHV-8 (human herpesvirus-8) [2].
Уровень заболеваемости лимфомами у ВИЧ-инфицированных пациентов выше по сравнению с общей популяцией. Наиболее часто возникает неходжкинская диффузная В-крупноклеточная лимфома (ДВККЛ) — лимфома Беркитта (ЛБ) [1]. У ВИЧ-инфицированных пациентов повышается также частота заболеваемости лимфомой Ходжкина (ЛХ). Первичная эффузионная (выпотная) лимфома (ПЭЛ) составляет 3–4% случаев всех ВИЧ-ассоциированных лимфом. Данный тип лимфомы характеризуется наличием выпота в серозных полостях и отсутствием какого-либо объемного образования. Однако в настоящее время данный тип лимфомы связывают не с ВИЧ-инфекцией, а с инфицированием HHV-8 (human herpesvirus-8) [2].
До эры высокоактивной антиретровирусной терапии (ВААРТ) заболеваемость неходжкинскими лимфомами (НХЛ) у ВИЧ-положительных пациентов была в 60–200 раз выше, чем у ВИЧ-отрицательных пациентов, а медиана выживаемости составляла всего 5–6 мес.
При появлении ВААРТ показатель заболеваемости значительно снизился, однако все еще выше в 11–25 раз по сравнению с общей популяцией [3]. Внедрение ВААРТ не только способствовало снижению заболеваемости ВИЧ-ассоциированными лимфомами, но также улучшило прогноз у таких пациентов, в первую очередь за счет лучшего контроля над репликацией вируса и повышения иммунной функции больного.
Стадирование ВИЧ-положительных пациентов с лимфомами проводится по общепринятой классификации Ann-Arbor, по аналогии с ВИЧ-отрицательными больными.
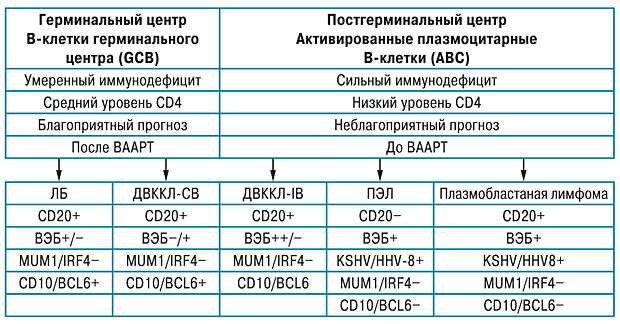
Этиология. Вирус Эпштейна — Барр (ВЭБ) — наиболее часто фиксируемый онкогенный вирус при ВИЧ-ассоциированных лимфомах, его выявляют приблизительно в 40% случаев. Почти все случаи первичной лимфомы центральной нервной системы (ПЛЦНС) и ЛХ ассоциированы с ВЭБ, так же, как и 80–90% ДВККЛ иммунобластного типа. Для сравнения, ВЭБ определяется при ЛБ в 30–50% случаев и плазмобластной лимфоме — в 50% случаев и обычно отсутствует при центробластных лимфомах [4]. ВЭБ-положительные ВИЧ-ассоциированные лимфомы часто экспрессируют латентный мембранный белок 1 (LMP1), кодируемый геном (LMPJ) ВЭБ. LMP1 представляет собой трансмембранный белок, способный активировать клеточную пролиферацию путем активирования сигнальных путей NF-kB, и может индуцировать гиперэкспрессию BCL2.
Молекулярная генетика. Существует целый ряд генетических мутаций при НХЛ. ЛБ ассоциируется с активацией гена MYC. При связи с ВИЧ-инфекцией чаще отмечают ЛБ спорадического, а не эндемического характера [5]. До 20% ВИЧ-ассоциированных ДВККЛ также имеют транслокацию MYC гена, что заставляет задуматься об их биологической схожести с ЛБ [6]. Мутация BCL определяется в 20% центробластных ДВККЛ и 60% ПЭЛ. При ВИЧ-ассоциированных лимфомах экспрессия генов схожа с экспрессией у ВИЧ-отрицательных пациентов (таблица).
При ДВККЛ из клеток герминального центра (GCB) экспрессируются маркеры CD10 и BCL6, а при ДВККЛ из активированных В-клеток (ABC) определяются маркеры IRFM4/MUM1 [7]. Примечательной особенностью ДВККЛ ABC подтипа является очень высокий уровень экспрессии BCL2 (в 4 раза выше, чем при GCB подтипе).
Таблица. Вирусные и генетические мутации у пациентов
с ВИЧ-ассоциированными лимфомами
| Гистологический подтип | ВЭБ+, % | KSHV/ HHV-8+, % |
Общие повторяющиеся хромосомные мутации |
|---|---|---|---|
| ДВККЛ | MYC (10%) | ||
| Центробластная | 30 | 0 | BCL6 (20% центробластных ДВККЛ) |
| Иммунобластная | 80–90 | 0 | ТР53 (40%) |
| Плазмобластная лимфома | >50 | 80 | Нет |
| ПЭЛ | 100 | 100 | Нет |
| ЛБ | 30–50 | 0 | MYC (100%) ТР53 (50–60%) |
| ПЛЦНС | 100 | 0 | BCL6 (30–40%) |
| ЛХ | 80–100 | 0 | Нет |
KSHV — Kaposi’s sarcoma-associated herpesvirus — герпесвирус, ассоциированный с саркомой Капоши.
Диагностика и оценка ВИЧ-ассоциированных лимфом. ВИЧ-ассоциированные ДВККЛ делятся на 2 подварианта: центробластный и иммунобластный. Центробластная лимфома характеризуется наличием центробластов с округлыми ядрами, светлым ядерным хроматином и 2–5 ядрышками, которые нередко прилегают к мембране ядра. Цитоплазма клеток базофильная. Они часто экспрессируют маркеры герминального центра: CD10+ и BCL6+, CD20+ (см. таблицу). При иммунобластной лимфоме клетки имеют округлые или овальные ядра с крупным, расположенным центрально ядрышком. Цитоплазма клеток интенсивно базофильная. Клетки при данном варианте лимфомы могут составлять до 90% опухолевых клеток. Клетки опухоли характеризуются частыми митозами и высоким уровнем Ki-67/MIB-1 [8]. Центробластный тип представляет приблизительно 25% ВИЧ-ассоциированных лимфом, а иммунобластный — всего 10%. Опухолевые клетки иммунобластной лимфомы могут терять экспрессию CD20 из-за коэкспрессии ВЭБ. Маркеры CD30, CD38, CD71 чаще экспрессируются при иммунобластном типе лимфомы.
Опухолевые клетки при ПЭЛ варьируют в диапазоне от крупных иммунобластных до клеток, характерных для анапластической крупноклеточной лимфомы. Обычно экспрессируются CD45, CD30, CD38, и CD138 антигены. Также, как обсуждалось ранее, данный тип лимфомы ассоциируется с KSHV/HHV-8 и ВЭБ [9].
Плазмобластные лимфомы обычно имеют позитивную экспрессию CD38, CD138 и MUM1/IRF4 и негативную CD20 и CD45. ВЭБ определяется в более чем 50% случаев, что имеет биологическую схожесть с ПЭЛ [8, 9].
ВИЧ-ассоциированная ЛБ делится на 3 отдельных подтипа. Классический тип составляет около 30% всех ВИЧ-ассоциированных лимфом и морфологически напоминает классическую ЛБ у ВИЧ-отрицательных пациентов. ЛБ с плазмоцитоидной дифференциацией характеризуется клетками среднего размера с обильной цитоплазмой. При других видах определяется значительный ядерный полиморфизм с меньшим, но более видимым ядром. Все типы имеют высокий уровень дифференциации с экспрессией CD19, CD20, CD79a, CD10 и редко отрицательной экспрессией BCL2.
ВИЧ-ассоциированная ЛХ обычно представлена смешанно-клеточным вариантом и ВЭБ-позитивна практически во всех случаях. Интересным является факт, что в эру ВААРТ произошло увеличение количества случаев диагностирования ЛХ (вариант нодулярного склероза) у пациентов с высоким уровнем CD4 (рис. 1) [10].
План обследования пациентов. Пациентам с ВИЧ-ассоциированной лимфомой рекомендуется проводить тщательный сбор анамнеза. Обязателен детальный сбор информации о ВИЧ-инфекции, оппортунистических инфекциях, наличии резистентности ВИЧ к специфической терапии, иммунной функции, вирусном контроле и антиретровирусной терапии. Физикальное обследование включает оценку размеров лимфатических узлов, печени и селезенки. Из лабораторных исследований необходимо провести общий анализ крови, биохимический анализ крови (обязательно исследование лактатдегидрогеназы и мочевой кислоты), определение уровня CD4 клеток, вирусной нагрузки. Необходимым является серологический анализ крови на гепатит В и С. Аспирация и биопсия костного мозга должны быть проведены в начале установления диагноза, так как поражение костного мозга при лимфоме возникает в 20% случаев [7]. Пациентам с агрессивными В-клеточными лимфомами необходимо выполнить люмбальную пункцию для анализа цереброспинальной жидкости методом проточной цитометрии и цитологическое исследование для исключения лептоменингеальной лимфомы, которая проявляет себя симптомами менингита, менингоэнцефалита или менингорадикулита.
Важным является проведение компьютерной томографии (КТ) шеи, органов грудной, брюшной полости, малого таза. Рекомендуется также проведение магнитно-резонансной томографии головы. Роль позитронно-эмиссионной томографии (ПЭТ) у пациентов с ВИЧ-ассоциированными лимфомами мало изучена.
Прогностические факторы. Прогноз у пациентов с ВИЧ-ассоциированными лимфомами значительно улучшился в эру ВААРТ. При первичной диагностике определяется количество CD4 лимфоцитов и международный прогностический индекс (IPI score: возраст, лактатдегидрогеназа, ECOG≥2, III–IV стадия). Риск возникновения лимфомы с поражением ЦНС или ПЛЦНС у ВИЧ-ассоциированных пациентов тесно связан с количеством CD4 клеток. В одном из исследований (база ВИЧ-пациентов французского госпиталя), в период 1993–1994 гг. и 1997–1998 гг. проанализирована частота заболеваемости лимфомой ЦНС и ПЛЦНС у пациентов с разным количеством CD4 клеток. Установлено, что заболеваемость при лимфоме с поражением ЦНС возрастала с 15,6 до 253,8 случая на 10 000 человек в год, а при ПЛЦНС — с 2,0 до 93,9 на 10 000 человек в год у пациентов с уровнем СD4 >350 клеток/мкл в сравнении с уровнем CD4 <50 клеток/мкл [7].
Терапевтические подходы. Терапия ВИЧ-ассоциированных лимфом особенно активно развивается последние 20–30 лет за счет улучшения контроля над репликацией вируса и сохранения иммунной функции пациента. На протяжении данного периода главными вопросами оставались:
- возможность проведения эффективной цитотоксической терапии в адекватных дозах;
- влияние цитотоксической терапии на иммунную функцию и риск развития инфекционных осложнений.
Интенсификация доз. До начала применения ВААРТ медиана выживаемости пациентов с ВИЧ-ассоциированными лимфомам составляла 5–6 мес в связи с инфекционными осложнениями, резистентностью к химиотерапии. В исследовании L.D. Kaplan и соавторов обследовано 84 пациента с ВИЧ-ассоциированными НХЛ [11]. Результаты показали, что высокие дозы циклофосфамида ассоциируются с низкой выживаемостью из-за инфекционных осложнений, которые стали главными причинами смерти пациентов. В протоколе 142 AIDS Clinical Trials Group (ACTG) [11] изучена эффективность применения стандартных доз метотрексата, блеомицина, доксорубицина, циклофосфамида, винкристина, дексаметазона (m-BACOD) с поддержкой колониестимулирующими факторами (КСФ) в сравнении с редукцией доз без поддержки КСФ. По результатам исследования, курс с применением стандартных доз показал уровень ответа у 52% против 41% пациентов при проведении курса с редукцией дозы и снижение уровня гематологической токсичности, а медиана выживаемости составила 6,8 мес против 7,7 мес. Данные результаты стали основанием для следующих выводов: снижение доз химиотерапии является более приемлемой опцией для пациентов с ВИЧ-ассоциированными лимфомами.
Эра ВААРТ и роль ритуксимаба. Применение ВААРТ при ВИЧ-ассоциированных лимфомах решает несколько задач:
- клиническую: улучшение качества и увеличение продолжительности жизни пациентов;
- иммунологическую: восстановление количественных и качественных показателей иммунной системы;
- вирусологическую: снижение вирусной нагрузки до <50 копий/мл;
- терапевтическую: адекватно проводимая специфическая терапия для достижения клинических, иммунологических и вирусологических целей;
- эпидемиологическую: снижение распространения ВИЧ-инфекции.
Пациенты с сохраненной иммунной функцией имеют низкий риск развития инфекционных осложнений, что позволяет назначать схемы химиотерапии в полном объеме и, как было описано ранее, имеют более благоприятную биологию опухоли. В мультицентровом рандомизированном исследовании NHL-HIV-93 III фазы было оценено 485 пациентов с ВИЧ-ассоциированными лимфомами. При параллельном проведении ВААРТ и химиотерапии результаты показали, что применение ВААРТ существенно связано с показателями выживаемости, в то время как интенсификация СНОР-подобных режимов без ВААРТ — нет [12].
Преимущество применения ритуксимаба доказано при терапии ДВККЛ, не связанных с ВИЧ-инфекций, однако его роль для ВИЧ-ассоциированных лимфом остается дискутабельной. В исследовании AIDS-Malignancies Consortium Trial 010 — AMC [11] оценивали потенциальные риски и преимущества добавления ритуксимаба к схеме СНОР. Смертность, связанная с инфекционными осложнениями у пациентов, которые получали курс R-CHOP, составила 14% в сравнении с 2% без добавления ритуксимаба. Из 14% умерших пациентов у 60% уровень CD4 клеток достигал <50/мкл.
Вслед за исследованием АМС французской группой было организовано исследование II фазы, в котором изучали R-CHOP при ВИЧ-ассоциированных НХЛ. Полный ответ (ПО) на терапию составил 77% и 2-летняя выживаемость — 75%. В исследовании AMC пациенты были разделены на группы [13]. В первой группе ритуксимаб в стандартной дозе вводили одновременно с курсом ЕРОСН, а во второй группе ритуксимаб применяли 1 раз в неделю (всего 6 нед) после полного объема химиотерапии. В первой группе у 35 (73%) из 48 пациентов (95% доверительный интервал (ДИ) 58–85%) зафиксирован ПО. Во второй группе только у 29 (55%) из 53 (95% ДИ 41–68%) пациентов получен ПО. Токсичность была сопоставима в обеих группах. У пациентов с количеством CD4 клеток <50/мкл был выше уровень смертности, связанной с инфекционными осложнениями [13].
На основании результатов данного исследования в настоящее время использование R-EPOCH рекомендуется как оптимальная опция для всех пациентов с агрессивными ВИЧ-ассоциированными лимфомами [7].
В опубликованном исследовании K. Dunleavy и соавторов главной стратегий была модификация стандартного R-Da-EPOCH в Short Course-EPOCH-RR (SC-EPOCH-RR — етопозид 50 внутривенно (в/в), винкристин 0,4 в/в, доксорубицин 10 в/в, день 1–4-й, циклофосфамид 750 в/в, день 5-й, преднизолон 60 per os, день 1–5, КСФ 300 мкг подкожно, день 6–15-й, ритуксимаб 375 в/в, день 1-й и 5-й). Ранее была продемонстрирована высокая эффективность 6 курсов химиотерапии по схеме DA-EPOCH у пациентов с ВИЧ-ассоциированными лимфомами. Выживаемость без прогрессирования и общая выживаемость составили 73 и 60% соответственно. На основании этого высказано предположение, что добавление ритуксимаба позволит повысить эффективность и сократить количество курсов химиотерапии (рис. 2) [8]. В период 5-летнего наблюдения у пациентов, которым была проведена терапия по схеме SC-EPOCH-RR, уровень выживаемости без прогрессирования и общей выживаемости составили 84 и 68% соответственно. При этом 79% пациентов получили всего 3 курса химиотерапии.
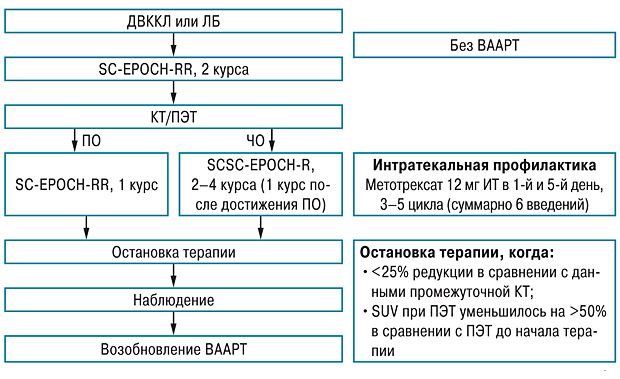
При терапии пациентов с ВИЧ-ассоциированными НХЛ необходимо также проводить профилактику рецидива ЦНС. В данном исследовании пациенты получали 12 мг метотрексата интратекально, начиная с 3-го курса химиотерапии, каждые 3 нед (суммарно 6 введений, 3–5 курсов). Если пациент имел лептоменингеальные симптомы и верификация диагноза была проведена с помощью цитологического исследования или методом проточной цитометрии, тогда они получали индукцию интратекально: метотрексат 2 раза в неделю до отрицательных результатов проточной цитометрии (минимум 4 нед). Далее проводили консолидацию на протяжении 6 нед и поддерживающую терапию 1 раз в месяц (всего 6 мес). Обязательно осуществляли профилактику Pneumocystis jiroveci и Micobacterium avium, если уровень CD4 был <100 клеток/мкл [8].
Роль ВААРТ параллельно с химиотерапией. Риски и польза продолжения ВААРТ параллельно с химиотерапией при агрессивных лимфомах были интерпретированы разными исследователями очень неоднозначно.
Одной из первых оценок проведения ВААРТ одновременно с химиотерапией стало нерандомизированное исследование АМС, в котором химиотерапию ВИЧ-ассоциированных больных НХЛ проводили в комбинации с ВААРТ [14]. Пациенты в первой группе получали стандартный курс по схеме СНОР, во второй группе проводили терапию по схеме СНОР с редукцией доз. В каждой группе параллельно применяли ВААРТ с использованием ставудина, ламивудина и индинавира. ПО был зафиксирован у 48 и 30% соответственно. Нейтропения III и IV степени отмечена в первой группе у 12%, а во второй группе — 25% пациентов. Гепатотоксичность в обеих группах была сопоставима. Вирусная нагрузка снизилась от среднего базового показателя с 29 000 до 500 копий/мл.
Выводы
За последние 2 десятилетия после появления ВААРТ прогноз у пациентов с ВИЧ-инфекцией значительно улучшился.
На сегодня терапевтической опцией при ВИЧ-ассоциированных ДВККЛ и ЛБ являются курсы по схемам R-CHOP и R-DA-EPOCH.
Терапия других видов лимфом проводится согласно стандартам и локальным протоколам, как при ВИЧ-отрицательных лимфомах, однако следует осуществлять четкий контроль вирусной нагрузки каждые 3–6 мес. При достижении отметки 500 клеток/мм или резком снижении уровня клеток CD4 следует немедленно начинать ВААРТ, поскольку при снижении уровня лимфоцитов CD4 до 200 клеток/мм значительно возрастает риск оппортунистических инфекций — вирусных, бактериальных, грибковых и протозойных заболеваний, сопутствующих ВИЧ (туберкулез, пневмония, герпес и пр.).
В связи с недостаточной доказательной базой касательно параллельного назначения ВААРТ с химиотерапией данная опция все еще остается дискутабельной.
Список использованной литературы
1. Raphael M., Said J., Borisch B. et al. (2008) WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues (ed 4th). Lyon: IARC Press: 340–342.
2. Белохвостикова Т.С., Хороших, Каня О.Н. и др. (2011) Случай диагностики первичной выпотной лимфомы у ВИЧ-инфицированной пациентки. Клин. онкогематол., 4(4): 340–343.
3. Hentrich M., Hensel M., Hoffmann Ch. et al. (2014)
HIV-assoziierte Lymphome (https://www.onkopedia.com/de/onkopedia/guidelines/hiv-assoziierte- lymphome/@@view/html/index.html).
4. Ambinder R.F. (2001) Epstein — Barr virus associated lymphoproliferations in the AIDS setting. Eur. J. Cancer, 37(10): 1209–1216.
5. Carbone A. (2003) Emerging pathways in the development of AIDS-related lymphomas. Lancet Oncol., 4(1): 22–29.
6. Dave S.S., Fu K., Wright G.W. et al. (2006) Molecular diagnosis of Burkitt’s lymphoma. N. Engl. J. Med., 354(23): 2431–2442.
7. Dunleavy K., Wyndham H. (2012) How I treat HIV-associated lymphoma. Blood, 119(14): 3245–3255.
8. Little R.F., Pittaluga S., Grant N. et al. (2003) Highly effective treatment of acquired immunodeficiency syndrome-related lymphoma with dose-adjusted EPOCH: impact of antiretroviral therapy suspension and tumor biology. Blood, 101(12): 4653–4659.
9. Klein U., Gloghini A., Gaidano G. et al. (2003) Gene expression profile analysis of AIDS-related primary effusion lymphoma (PEL) suggests a plasmablastic derivation and identifies PEL-specific transcripts. Blood, 101(10): 4115–4121.
10. Biggar R.J., Jaffe E.S., Goedert J.J. (2006) Hodgkin lymphoma and immunodeficiency in persons with HIV/AIDS. Blood, 108(12): 3786–3791.
11. Kaplan L.D., Straus D.J., Testa M.A. et al. (1997)Low-dose compared with standard-dose m-BACOD chemotherapy for non-Hodgkin’s lymphoma associated with human immunodeficiency virus infection: National Institute of Allergy and Infectious Diseases AIDS Clinical Trials Group. N. Engl. J. Med., 336(23): 1641–1648.
12. Mounier N., Spina M., Gabarre J. et al. (2006) AIDSrelated non-Hodgkin lymphoma: final analysis of 485 patients treated with risk-adapted intensive chemotherapy. Blood, 107(10): 3832–3840.
13. Sparano J.A., Lee J.Y., Kaplan L.D. et al. (2010) AIDS Malignancy Consortium. Rituximab plus concurrent infusional EPOCH chemotherapy is highly effective in HIV-associated B-cell non-Hodgkin lymphoma. Blood, 115(15): 3008–3016.
14. Ratner L., Lee J., Tang S. et al. (2001) Chemotherapy for human immunodeficiency virus-associated non-Hodgkin’s lymphoma in combination with highly active antiretroviral therapy. J. Clin. Oncol., 19(8): 2171–2178.














Leave a comment