Вплив інтратуморальної експресії hENT1 на виживаність хворих на рак підшлункової залози, які отримували гемцитабін та тегафур в ад’ювантному лікуванні
Дронов А.И.1, Земсков С.В.1, Грабовий О.М.2
- 1Кафедра загальної хірургії № 1, Національний медичний університет ім. О.О. Богомольця, Київ
- 2Національний інститут раку, Київ
Резюме. Рак підшлункової залози (РПЗ) є одним з найпоширеніших в структурі онкологічної смертності. Комбінації фторпіримідинів та гемцитабіну давно й активно використовується в паліативній хіміотерапії пацієнтів із РПЗ. В ад’ювантній терапії при РПЗ таку комбінацію вперше впровадили в Японії в 2002 р. Ця комбінація може впливати на довгострокову виживаність, але її ефект значно відрізняється серед різних груп пацієнтів, залежно від фенотипу пухлини. Мета нашого дослідження — встановлення взаємозв’язку між інтратуморальною експресією hENT1 та ефективністю схеми гемцитабін + тегафур (ГемТег) в ад’ювантному режимі у хворих на РПЗ. До дослідження залучено 62 пацієнти, яким було виконано радикальну резекцію з приводу РПЗ з 2012 по 2016 р. Усі хворі починали ад’ювантну хіміотерапію за новою схемою ГемТег не раніше ніж через 2 тиж після операції. Протокову аденокарциному підшлункової залози попередньо до імуногістохімічного дослідження діагностовано у всіх препаратах при рутинному гістологічному дослідженні. Експресію hENT1 визначали імуногістохімічно. Загальну виживаність оцінювали за методом Каплана — Мейєра, а порівнювали за допомогою log-rank тесту. При ад’ювантному лікуванні за схемою ГемТег виживаність хворих з високим рівнем hENT1 значно перевищувала виживаність пацієнтів із низьким рівнем hENT1 (р=0,005). Медіана загальної виживаності становила 36 та 20 міс для хворих із високим та низьким рівнем hENT1 відповідно. Таким чином, рівень виявленої імуногістохімічним методом експресії hENT1 у пухлинах хворих на РПЗ можна використовувати для прогнозування відповіді на поліхіміотерапію за схемою ГемТег в ад’ювантному режимі.

Рак підшлункової залози (РПЗ) є одним із найпоширеніших у структурі онкологічної смертності. Радикальна резекція дає шанс на довготривалу виживаність цим хворим, але, незважаючи на це, 5-річна виживаність не перевищує 20%. Тому вважається, що тільки хірургічного втручання недостатньо для успішного лікування пацієнтів із РПЗ, і після операції цим хворим завжди призначають ад’ювантну терапію. Останнім часом проведено декілька рандомізованих досліджень та метааналіз, які підтвердили ефективність ад’ювантної хіміотерапії, зокрема монотерапії фторпіримідинами та гемцитабіном, у хворих на РПЗ.
Комбінації фторпіримідинів та гемцитабіну давно й активно використовуються в паліативній хіміотерапії хворих на РПЗ, ефективність цих комбінацій доведено багатьма рандомізованими дослідженнями та метааналізами [1]. В ад’ювантній терапії РПЗ таку комбінацію (S1 + гемцитабін) вперше впровадили в Японії в 2002 р. [2].
S1 — комплексний пероральний препарат, який містить тегафур (метаболічний попередник 5-флуороурацилу (5-ФУ)), гімерацил — інгібітор дигідропіридиндегідрогенази (dihydropyrimidine dehydrogenase — DPD), фермент, який інактивує 5-ФУ в пухлинних та нормальних клітинах, та отерацил — фермент, який не проникає крізь кишкову стінку, гальмує перехід тегафуру в 5-ФУ безпосередньо в кишечнику й таким чином знижує гастроінтестинальну токсичність. Співвідношення складових становить 1:0,4:1 відповідно. Препарат користується популярністю в азійському регіоні, оскільки його максимально переносима доза приблизно в 3 рази вища для азійської раси порівняно з представниками кавказької, що може бути спричинено поліморфізмом гена цитохрому CYP 2A6.
Результати згаданого дослідження показали, що ця комбінація може впливати на довгострокову виживаність, але її ефект значно відрізняється серед різних груп пацієнтів і, як наслідок, в цілому не покращує результати. N. Kondo та співавтори провели пошук біомаркерів, які б слугували прогностичним критерієм ефективності схеми «S1 + гемцитабін» [3]. Як біомаркери було досліджено DPD та hENT1 (human equilibrative nucleotide trаnsporter 1). Останній є ключовим ферментом, який бере участь в транспорті гемцитабіну в пухлинну клітину, вплив його експресії на відповідь на гемцитабін широко обговорювався в літературі. Висока експресія цього ферменту корелює з відповіддю пухлини на терапію гемцитабіном, притому не впливає на прогноз хворих, яких лікують без застосування гемцитабіну. При цьому клінічна релевантність імуногістохімічного дослідження hENT1 не проявляється тільки при застосуванні моноклонального антитіла SP120 [3–5].
У результаті цього дослідження встановлено, що низька експресія DPD та висока експресія hENT1 у клітинах пухлини є позитивними прогностичними факторами, що впливають на довгострокову виживаність хворих на РПЗ при ад’ювантній терапії за схемою «S1 + гемцитабін».
У сьогоднішньому фармакологічному арсеналі в Україні серед фторпіримідинів немає аналогів препарату S1, але є доступний пероральний тегафур, який широко використовують у моно- та комбінованих режимах хіміотерапії [6].
На меті нашого дослідження було встановлення взаємозв’язку між інтратуморальною експресією TS й hENT1 та ефективністю схеми гемцитабін + тегафур (ГемТег) в ад’ювантному режимі хворих на РПЗ. У статті представлено тільки результати впливу hENT1 на загальну виживаність.
Об’єкт і методи дослідження
Дослідження проведено на клінічній базі кафедри загальної хірургії № 1 НМУ імені О.О. Богомольця в Київському центрі хірургії печінки, підшлункової залози і жовчних проток імені В.С. Земскова (Київська міська клінічна лікарня № 10). З 2012 по 2016 рр. в Центрі було виконано 118 резекцій з приводу РПЗ. До дослідження залучено 62 пацієнти. У них проведено 39 панкреатодуоденальних резекцій, 18 дистальних резекцій та 3 тотальні панкреатектомії. У таблиці наведено клініко-морфологічні характеристики пацієнтів.
Tаблиця. Клініко-морфологічні характеристики пацієнтів
| Характеристика пухлини | Висока експресія hENT1, n (%) (n=35) |
Низька експресія hENT1, n (%) (n=27) |
| Первинна пухлина Т2 | 16 (45,7) | 14 (51,9) |
| Первинна пухлина Т3/Т4 | 19 (54,3) | 13(48,1) |
| Нодальний статус N0 | 18 (51,4) | 13 (48,1) |
| Нодальний статус N1 | 17 (48,6) | 14 (51,9) |
| Ступінь диференціювання G1–G2 |
17 (48,6) | 5 (18,5) |
| Ступінь диференціювання G3–G4 |
18 (51,4) | 22 (81,5) |
Усі хворі починали ад’ювантну хіміотерапію за новою схемою ГемТег не раніше ніж через 2 тиж після операції, за умов відсутності хірургічних ускладнень та рівня гемоглобіну >90 г/л, лейкоцитів >3,5•109/л-1 та тромбоцитів >100•109/л-1. Застосування схеми ГемТег було ухвалено локальним етичним комітетом, усі пацієнти підписали інформовану згоду на участь в дослідженні. Схема складалася з 6 чотирьохтижневих циклів. Кожний цикл включав гемцитабін внутрішньовенно в 1; 8-й та 15-й день із розрахунку 1000 мг/м2, тегафур перорально по 400 мг 2 рази на добу протягом 21 дня + 7 днів перерви.
Імуногістохімічне дослідження для маркера hENT1 проводили у відділі патологічної анатомії Національного інституту раку Міністерства охорони здоров’я України за допомогою поліклонального анти-hENT1 антитіла кролячого походження Abnova (Taipei, о. Тайвань) у відповідності з протоколом виробника з використанням системи детекції EnVisionTM FLEX (Dako, Данія). Зрізи дофарбовували гематоксиліном Gill. Як позитивний контроль використано лімфоцити периферичної крові. Для негативного контролю проводили процедуру без застосування первинних антитіл. За результатами імуногістохімічної реакції експресію визначали як відсутню (0), слабку (1+) — забарвлення менш інтенсивне, ніж при позитивному контролі, помірну (2+) — забарвлення ідентичне позитивному контролю, та високу (3+) — забарвлення інтенсивніше, ніж у позитивному контролі. Низькою експресію hENT1 вважали забарвлення менше як у 50% пухлинних клітин з інтенсивністю ≤2+ (рис. 1), а високою — забарвлення 2+ більше як 50% пухлинних клітин (рис. 2). Протокову аденокарциному підшлункової залози попередньо до імуногістохімічного дослідження діагностовано у всіх препаратах при рутинному гістологічному дослідженні.
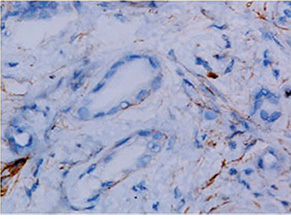
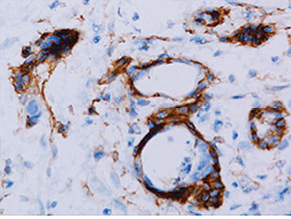
Усі хворі під час та після ад’ювантного лікування підлягали диспансерному спостереженню. Загальну виживаність проаналізовано шляхом побудови кривих Каплана — Мейєра. Виживаність в групах порівнювали за допомогою log-rank тесту.
Результати
Взагалі схема ГемТег задовільно переносилася хворими в ад’ювантному режимі. Редукції дози щонайменше на 25% потребували 29 (46,8%) пацієнтів.
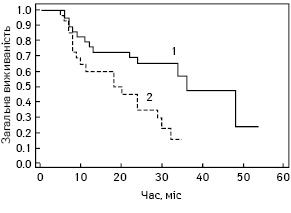
Медіана загальної виживаності на момент статистичної обробки даних становила 36 та 20 міс для хворих із високим та низьким рівнем hENT1 відповідно. Також на момент статистичної обробки ще не було пацієнтів, які б досягли 5-річної виживаності. Що стосується 3-річної виживаності, то серед хворих з високою експресією hENT1 вона становить 56%, а з низькою експресією hENT1 на цей момент — 0%.
Як можна побачити на рис. 3, загальна виживаність хворих із високим рівнем hENT1 значно перевищувала виживаність пацієнтів з низьким рівнем hENT1 (р=0,005). Медіана загальної виживаності становила 36 та 20 міс для хворих з високим та низьким рівнем hENT1 відповідно.
Висновки
Таким чином, високий рівень імуногістохімічної експресії hENT1 у пухлинах хворих на РПЗ можна використовувати для прогнозування відповіді на поліхіміотерапію за схемою ГемТег в ад’ювантному режимі. Медіана виживаності пацієнтів з високою експресією hENT1 на 16 міс більша, ніж у хворих з низькою експресією hENT1. Перевага у виживаності пацієнтів з високою експресією hENT1 є статистично значущою (р=0,005).
Список використаної літератури
1. Ciliberto D., Botta C., Correale P. et al. (2013) Role of gemcitabine-based combination therapy in the management of advanced pancreatic cancer: a meta-analysis of randomised trials. Eur. J. Cancer, 49: 593–603.
2. Murakami Y., Uemura K., Sudo T. et al. (2008) Adjuvant gemcitabine plus S-1 chemotherapy after surgical resection for pancreatic adenocarcinoma. Am. J. Surg., 195: 757–762.
3. Kondo N., Murakami Y., Uemura K. et al. (2012) Combined analysis of dihydropyrimidine dehydrogenase and human equilibrative nucleoside transporter 1 expression predicts survival of pancreatic carcinoma patients treated with adjuvant gemcitabine plus S-1 chemotherapy after surgical resection. Ann. Surg. Oncol., 19: 646–655.
4. Zhu Y., Qi M., Lao L. et al. (2014) Human equilibrative nucleoside transporter 1 predicts survival in patients with pancreatic cancer treated with gemcitabine: a meta-analysis. Genet. Test Mol. Biomarkers, 18(5): 306–312.
5. Ormanns S., Heinemann V., Raponi M. et al. (2014) Human equilibrative nucleoside transporter 1 is not predictive for gemcitabine efficacy in advanced pancreatic cancer: Translational results from the AIO-PK0104 phase III study with the clone SP120 rabbit antibody. Eur. J. Cancer, 50(11): 1891–1899.
6. Пуркалне Г., Козировскис В., Гериня-Берзиня А. (2016) Терапия тегафуром в комбинации с оксалиплатином (TegOX) для пациентов с метастатическим колоректальным раком. Latvijas RSTS, 1: 46–47.
Влияние интратуморальной экспрессии hENT1 на выживаемость больных раком поджелудочной железы, получавших гемцитабин и тегафур в адъювантном лечении
Резюме. Рак поджелудочной железы (РПЖ) является одним из наиболее распространенных в структуре онкологической смертности. Комбинация фторпиримидинов и гемцитабина давно и активно используется в паллиативной химиотерапии пациентов с РПЖ. В адъювантном лечении при РПЖ такую схему впервые применили в Японии в 2002 г. Эта комбинация может влиять на долгосрочную выживаемость, однако ее эффект значительно отличается у разных групп пациентов, в зависимости от фенотипа опухоли. Цель нашего исследования — установление взаимосвязи между интратуморальной экспрессией hENT1 и эффективностью схемы гемцитабин + тегафур (ГемТег) в адъювантном лечении больных РПЖ. В исследование включено 62 пациента, которым была выполнена радикальная резекция по поводу РПЖ с 2012 по 2016 г. Все больные начинали адъювантную химиотерапию по новой схеме ГемТег не ранее чем через 2 нед после операции. Протоковая аденокарцинома поджелудочной железы была предварительно диагностирована во всех препаратах при рутинном гистологическом исследовании. Экспрессию hENT1 определяли иммуногистохимически. Общую выживаемость оценивали по методу Каплана — Мейера, сравнивали с помощью log-rank теста. При адъювантном лечении по схеме ГемТег выживаемость пациентов с высоким уровнем hENT1 значительно превышала выживаемость больных с низким уровнем hENT1 (р=0,005). Медиана общей выживаемости составила 36 и 20 мес для больных с высоким и низким уровнем hENT1 соответственно. Таким образом, уровень выявленной иммуногистохимическим методом экспрессии hENT1 в опухолях больных РПЖ можно использовать для прогнозирования ответа на полихимиотерапию по схеме ГемТег в адъювантном режиме.
Ключевые слова: рак поджелудочной железы, гемцитабин, адъювантная терапия.
The impact of intratumoral hENT1 expression on survival in patients with pancreatic cancer treated with gemcitabine and tegafur in adjuvant setting
Summary. Pancreatic cancer (PC) is one of the most frequent causes of death in cancer mortality. Fluorpyrimіdine and gemcitabine is a popular combination in palliative treatment of PC. For the first time this combination was used in adjuvant setting in Japan in 2002. The combination can influence long term survival but its effect is different depending on tumor cell phenotype. The aim of this study is to investigate the relevance between intratumoral hENT1 expression and response to gemcitabine + tegafur (GemTeg) scheme in PC patients in adjuvant setting. 62 PC patients after curative resection from 2012 until 2016 were involved in the study. Adjuvant chemotherapy started at least after 2 weeks postoperatively using new regime GemTeg. Ductal adenocarcinoma of the pancreas was diagnosed at routine histological examination prior to immunohistochemical investigation. Overall survival was evaluated by Kaplan — Meyer and campared by log-rank test. The overall survival in among patients treated with GemTeg regime was statistically higher in those with high hENT1 expression then in those with low hENT1 expression (p=0,005). Median overall survival was 36 and 20 months for patients with high and low hENT1 expression, correspondingly. Consequently, the level of intratumoral immunohistochemical expression of hENT1 may predict the response to GemTeg adjuvant chemotherapy regime in patients with PC.
Key words: pancreatic cancer, gemcitabine, adjuvant setting.
Адреса:
Земсков Сергій Володимирович
02000, Київ, просп. Перемоги, 34
Національний медичний університет
імені О.О. Богомольця,
кафедра загальної хірургії № 1
Тел.: (044)524-59-42
E-mail: szemskov@yahoo.com














Leave a comment