Променеві критерії оцінки ефективності лікування хворих із метастатичним ураженням печінки (стан проблеми та результати досліджень)
Резюме. Представлено аналітичний огляд літератури оптимальних можливостей застосування сучасних променевих методів досліджень у пацієнтів із метастатичним процесом у печінці. В історичному аспекті зазначено оціночні критерії ефективності лікування відповідно до рекомендацій RECIST у різних версіях. На прикладі лікування пацієнтів із метастатичним колоректальним раком наведено облікові та оціночні критерії ефективності терапії.
 Проблема метастазування злоякісних пухлин є пріоритетною в сучасній онкології. За локалізацією метастатичного раку печінка є органом-мішенню для більшості злоякісних пухлин [1−3].
Проблема метастазування злоякісних пухлин є пріоритетною в сучасній онкології. За локалізацією метастатичного раку печінка є органом-мішенню для більшості злоякісних пухлин [1−3].
Точних статистичних даних про частоту метастатичного ураження печінки при злоякісних пухлинах немає, але можливий орієнтовний розрахунок, виходячи з рівня онкологічної захворюваності [4, 5]. Загальна кількість хворих із метастазами (МТС) в печінці становить третину пацієнтів зі злоякісними пухлинами різних локалізацій та в десятки разів перевищує їх кількість із первинним раком печінки.
У публікаціях про частоту метастатичного ураження печінки відзначено, що при раку травного каналу МТС в печінці виявляють майже у 80% пацієнтів: у 15−25% — на етапі первинної діагностики, а у 25−30% — упродовж клінічного перебігу захворювання [6–8].
Синхронні МТС в печінці виявляють майже у 30% хворих на рак товстої кишки (колоректальний рак — КРР). Серед пацієнтів, які були радикально прооперовані і не мали місцевого рецидиву, при подальшому моніторингу діагностують метахронні МТС, які й визначають тривалість життя хворих при поширеному процесі [9, 10]. У багатьох пацієнтів, за відсутності ураження пухлинним процесом інших органів, причиною смерті є саме МТС в печінці [11−14].
При сучасному підході до лікування за останні 10−15 років кардинально змінилося ставлення до хворих із поширеними формами КРР. Медіана тривалості життя таких пацієнтів значно збільшилася [15−17].
На сьогодні в підходах до лікування при поширеному КРР немає розбіжностей щодо доцільності виконання резекцій печінки з приводу МТС [18−20]. Проведення такого виду операцій залежить від віку хворого, загального стану організму, поширення процесу та функціонального стану печінки. Кількість метастатичних осередків у печінці не має вирішального значення при плануванні операції, важливішими є їхня локалізація та прогнозований обсяг резекції [21]. Наразі резекція печінки як етап комбінованого лікування дозволяє потенційно вилікувати хворого на КРР із МТС в печінці [22].
Сучасними критеріями резектабельності передбачено збереження не менше 20−30% паренхіми печінки, сформованої не менш ніж двома суміжними сегментами, з адекватним жовчовиділенням та збереженим кровотоком [23, 24].
У діагностичному алгоритмі на сьогодні є багато сучасних методик для виявлення уражень печінки з високими показниками чутливості, специфічності і точності, часом по декілька з них застосовують в одного пацієнта для визначення переваг того чи іншого методу [25, 26].
Втім триває пошук нових можливостей діагностичних методів, спрямованих на більш раннє виявлення МТС у печінці. Адже пізнє виявлення осередків у печінці зумовлене бідною та неспецифічною симптоматикою або зовсім безсимптомним перебігом процесу [27].
Сучасна діагностика МТС у печінці базується на даних анамнезу, результатах клінічних, лабораторних та інструментальних методів досліджень: анамнез не дає переконливих специфічних результатів; клінічні прояви залежать від наявності залучення у процес магістральних судин, жовчовивідних шляхів та функціонального стану печінки; розміри осередків та їх кількість мають другорядне значення; солідні МТС невеликих розмірів не дають суб’єктивних відчуттів [28, 29].
Аналіз наукових публікацій свідчить про широке застосування в клінічних умовах сучасних променевих методів (цифрова рентгенографія, комплексне ультразвукове дослідження (УЗД), спіральна комп’ютерна томографія (СКТ), магнітно-резонансна томографія (МРТ), позитронна емісійна томографія (ПЕТ), що відкрило якісно нові перспективи для більш раннього і точного виявлення метастатичного ураження печінки [31].
СКТ на сьогодні вважається класичним методом діагностики при злоякісних новоутвореннях печінки, рекомендованим (ВООЗ, 2002 р.) для стадіювання злоякісного процесу, а також для оцінки ефективності лікування [32]. Метод СКТ дозволяє уточнити локалізацію осередків у печінці з точною інтерпретацією ураження секторів (сегментів) та виявити МТС в інших органах. Чутливість СКТ у виявленні новоутворень у печінці наближається до 98%. Виконання СКТ-ангіографічних досліджень є основною методикою оцінки особливостей характеру печінкового кровотоку та васкуляризації метастатичних осередків шляхом аналізу кривої час — щільність та за розрахунками перфузійних індексів у різні фази проходження контрасту [33, 34].
СКТ передбачає отримання зображень печінки в період артеріальної фази, приріст якої становить більше 40 од. і триває в перші 20−30 с після початку введення контрастного препарату. За цей проміжок часу можна провести сканування усієї печінки та оцінити її артеріальну систему. Проведення наступної портальної (венозної) фази, 50–90 с від початку введення контрастного препарату, насичує паренхіму печінки та її венозне русло [35].
Характер контрастування залежить від ступеня васкуляризації МТС. Для МТС характерне позитивне контрастування перинодулярної зони в перші 20–30 с артеріальної фази. Патогномонічними для МТС є швидкий ефект вимивання контрасту та поява обідка навколо осередку в портальну фазу. Контрастування може бути поступовим, від периферії до центру. Для гіповаскулярних МТС типове негативне контрастування: у портальну фазу осередки гіподенсні на фоні підсиленої паренхіми [36].
СКТ із контрастуванням підвищує чутливість методу, адже швидке сканування дозволяє простежити динаміку контрастування печінки в цілому та провести реконструкції зображень із меншою товщиною сканів, а невеликі інтервали реконструкції підвищують відсоток виявлення метастатичних осередків печінки, особливо малих розмірів [37, 38]. Результати досліджень підтверджують специфічність зображень осередків в артеріальну та портальну фази сканування [39].
Гіперваскулярні осередки можуть бути пропущеними в 25−39% спостережень, оскільки швидко насичуються контрастним препаратом, як і нормальна паренхіма печінки [40, 41]. До того ж, поява жирової інфільтрації печінки, яка часто розвивається після поліхіміотерапії (ПХТ), утруднює виявлення МТС [42].
З огляду на темпи розвитку новітнього діагностичного обладнання, а саме СКТ та МРТ, можливості виявлення новоутворень у печінці значно розширилися [43, 44].
Результати МРТ-досліджень поєднують високу діагностичну інформативність за неінвазивності методики порівняно з СКТ; МРТ показує більш низьке розрізнення зображень, які схильні до артефактів, але з перевагами кращого контрастування м’яких тканин [45, 46].
При МРТ МТС в печінці за розмірами, формою та інтенсивністю сигналу на Т2-зваженому зображенні (ЗЗ) можуть імітувати кісти чи гемангіоми [31, 47], але частіше виявляються у вигляді множинних осередків округлої форми зі зміненою інтенсивністю сигналу. Виражена негомогенність зумовлена некрозом тканини, іноді з’являється обідок та нечіткість по контуру унаслідок інфільтративного росту. У структурі можна виявити кальцинати, специфічні для осередків КРР [48]. Візуальні характеристики досить варіабельні через структурні складові, що впливають на МРТ-зображення.
Венозна фаза довенного контрастування забезпечує візуалізацію максимальної кількості гіповаскулярних осередків у печінці із перифокальним гіперваскулярним контуром [49, 50]. МТС КРР в печінці на МРТ-зображеннях є переважно гіпоінтенсивними порівняно з паренхімою на преконтрастних Т1-ЗЗ, гіперінтенсивними — на Т2-ЗЗ та дифузійно-зважених зображеннях (diffusion-weighted imaging — DWI) [51]. Більшість МТС схильні до обмеження дифузії, тому включення DWI у протокол дослідження підвищує показники діагностичної ефективності у їх виявленні та додає окремі характеристики семіотики. Пікове накопичення гепатотропного контрасту гепатоцитами в гепатобіліарну фазу та поєднання з DWI підвищує чутливість у виявленні МТС, особливо малих розмірів [52–58].
Роль ПЕТ-КТ у діагностиці КРР продовжує набувати переваг при оцінці визначення поширення процесу, особливо для виявлення МТС у печінці, інших органах, для прогнозу лікування у пацієнтів із немотивованим підвищенням специфічних маркерів, коли інші діагностичні методи не дають відповіді. Деякі суперечливі моменти при базових ПЕТ-КТ-дослідженнях додають цінності при уточненні поширення процесу, що може змінити тактику лікування [59–61].
Одним із методів лікування зазначеної категорії хворих є ПХТ, результати якої залежать перш за все від локалізації пухлинних осередків у печінці, їх кількості, гістологічних характеристик та чутливості до протипухлинних препаратів [62, 63]. ПХТ дозволяє підвищити радикальність операції, що планується, за рахунок зменшення розмірів осередків та ерадикації мікрометастазів. Окрім того, оцінка лікувального патоморфозу в пухлині сприяє більш обґрунтованому вибору операційної тактики.
В останнє десятиріччя створено цілу низку нових препаратів спрямованої дії на пригнічення ангіогенезу в осередку, що і сприяло прогресу в лікуванні поширених форм пухлин травного каналу, у першу чергу метастатичного КРР. Застосування таких препаратів пов’язане із безпосередньою адекватною відповіддю та досягненням швидкого позитивного ефекту лікування, що підвищує відсоток резектабельності МТС.
Проведення ПХТ із застосуванням сучасних препаратів спрямованої дії на МТС дозволяє суттєво збільшити медіану виживаності та покращити якість життя пацієнтів із поширеним метастатичним ураженням печінки [64–67].
Перед променевими діагностами постає проблема об’єктивної оцінки ефективності проведеного лікування. Необхідна повна й достовірна оцінка із визначенням ефективності лікування, виявленням прогресування захворювання чи рецидиву в печінці у вигляді зменшення розмірів пухлинних осередків, їх стабілізації чи прогресування на фоні ПХТ.
До впровадження методу томографії в клінічну практику оціночних критеріїв реагування пухлини на ПХТ не застосовували. Першою спробою уніфікувати результати лікування була розробка (ВООЗ, 1979 р.) [68] критеріїв відповіді пухлини, що ґрунтувалися на розрахунках суми найбільших розмірів (sum of the products of diameters — SPD) за даними КТ. Саме для цих розрахунків були введені поняття: повна відповідь (complete response — CR) — пухлина не визначається протягом 4 тиж); часткова відповідь (particular response — PR) — ≥50% зменшення SPD від базових даних (строк >4 тиж); прогресування захворювання (progression disease — PD) — ≥25% збільшення розмірів одного чи більше новоутворень; стабілізація захворювання (stable disease — SD) — стан, що не характеризується вищенаведеними критеріями [69].
Саме збільшення/зменшення розмірів осередків стало однією із основних ознак оцінки ефективності лікування. Але через трудомісткість у вимірюванні та розбіжності в інтерпретації результатів було переглянуто існуючі та прийнято інші критерії оцінки відповіді солідних пухлин у версії RECIST (2000 р.), де було спрощено та уточнено ознаки реагування пухлини [70].
Основними відмінностями нової версії RECIST 1.0 стали: визначення мінімального розміру вимірюваних осередків із урахуванням результатів проведеної КТ, використання одномірних вимірів замість бімірних для оцінки загальної відповіді. Кількість вимірюваних осередків була обмежена до 5 в одному органі. Рекомендовані критерії широко застосовували як стандартний метод, особливо в клінічних протоколах, що потребували об’єктивної оцінки відповіді чи визначення часу до прогресування, порівняно зі стартовими результатами [71].
У новій модифікованій версії RECIST 1.1 [72] враховано особливості нових технологій променевих методів досліджень (таких як мультиспіральна КТ та високопольна МРТ). Основними нововведеннями нової версії стали: обмеження кількості мірних осередків до 2 в одному органі та оцінка лімфатичних вузлів (ЛВ) як таргетних (ЛВ <15 мм у короткому вимірі).
Результати багатьох досліджень демонструють, що оцінка відповіді пухлини не може базуватися тільки на зміні розмірів новоутворення [73]. Застосування препаратів спрямованої дії на ангіогенез пухлини сприяє швидким гемодинамічним змінам в осередку, що проявляються зменшенням васкуляризації всередині та перифокально, а в структурі пухлини домінуванням фіброзних змін над некротичними. Більш виражені морфологічні зміни проявляються раніше за метричні [74].
Низка проведених КТ-досліджень із застосуванням перфузії свідчить про перспективність моніторингу щодо відповіді на лікування антиангіогенними препаратами. Окремі цифрові параметри перфузії (потік та об’єм крові, середній час транзиту та час до піку) залишаються поки що додатковими, але важливими оціночними моментами, які ще треба уточнювати та стандартизувати [75–77].
Враховуючи те, що відповідь пухлини не може базуватися тільки на зміні розмірів, в останньому перегляді RECIST (у модифікації mRECIST 1.1, 2015 р.) враховано як маркери мірності, так і морфологічну перебудову пухлини при проведенні ПХТ, які при діагностичному моніторингу відображуються зміною щільності метастатичного осередку при контрастуванні [78].
Порівняльна оцінка ефективності різних променевих методів свідчить, що як оцінний метод доцільно і бажано рекомендувати застосовувати СКТ чи МРТ. Застосування комплексу методик УЗД у вирішенні цього завдання залишається додатковою опцією, яка може виконуватися у проміжках між обов’язковим виконанням СКТ чи МРТ [79]. Деякі нюанси результатів УЗД впливають на обрану тактику лікування із подальшою її зміною [80].
З огляду на дані EORTC, результати проведених досліджень щодо застосування ПЕТ-КТ розроблено критерії PERCIST — Positron Emission tomography Response Criteria In Solid Tumors. Основною передумовою їх створення та впровадження стали результати варіантів метаболічної відповіді низки пухлин. Саме позитивна відповідь застосування препаратів спрямованої цитостатичної дії проявляється в першу чергу суттєвим зниженням рівня поглинання 18-фтордезоксиглюкози і тільки потім — зменшенням розмірів пухлини. Тобто, метаболічна відповідь є більш швидкою та прогностично значущою порівняно з морфологічними параметрами.
За діагностування повного радіологічного регресу, коли раніше виявлений МТС стає невидимим для візуалізаційних методик із відсутністю метаболічної активності, немає впевненості у повній морфологічній відповіді. Зазначені променеві ознаки недостатньо корелюють із позитивним клінічним результатом [81]. Тому видалення зони раніше виявленого осередку в печінці залишається актуальним питанням [82].
При заключному гістологічному дослідженні видаленої зони пухлини в структурі тканини одночасно можуть бути: набряк, некроз, відкладення муцину, кальцію, геморагії, фіброз. Саме виражений поліморфізм зображення дозволяє оцінити морфологічні зміни в осередку та проаналізувати лікування.
Післяопераційний променевий моніторинг у хворих із МТС КРР після будь-якого виду лікування допомагає з’ясувати питання якості терапії, виявлення потенційного рецидиву з можливістю подальшого адекватного лікування. Безумовно, ця обставина підвищує значущість діагностичної складової у такої категорії пацієнтів.
Так, згідно з рекомендаціями NCCN [83] як метод спостереження за пацієнтами після лікування необхідно застосовувати МРТ чи СКТ (1-ша лінія) кожні 3–6 міс протягом 2 років після операції, у подальшому — 6 міс у період 3–5 років. Поки що ПЕТ-КТ відводиться роль методу виявлення позапечінкового ураження.
За підсумками аналітичного огляду літератури можна зробити висновок, що на сучасному етапі діагностика МТС у печінці є складною проблемою. Попри наявність великого арсеналу діагностичного обладнання, розроблених перспективних методик досліджень, підсумків численних публікацій та визначених напрямків подальшого лікування ця проблема далека від вирішення.
Лікувальний мультимодальний підхід до терапії пацієнтів із КРР, особливо із поширенням процесу в печінку, диктує необхідність адекватної діагностики на усіх етапах лікування із визначенням його ефективності.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Проведено та проаналізовано результати досліджень (проспективний аналіз) 196 хворих на КРР із МТС у печінці, які проходили обстеження та лікування в Національному інституті раку. Усі діагностичні дослідження виконано у відділенні променевої діагностики.
Усі пацієнти прооперовані з приводу КРР. Виконано операції в обсязі право- та лівобічної геміколектомії у 68, резекції сигмоподібної кишки — у 34, черевно-анальні резекції — у 38, резекції та екстирпації прямої кишки — у 56 пацієнтів. У всіх пацієнтів діагноз первинної злоякісної пухлини верифіковано гістологічно — аденокарцинома різного ступеня диференціювання (високо-, помірно-, низькодиференційована) — при морфологічному дослідженні операційного матеріалу.
Середній вік пацієнтів становив 57,4±10,5 року (17–73 роки). Серед пацієнтів чоловіків було 81 (41,3%), жінок — 115 (58,7%) осіб.
Результати проведених передопераційних досліджень у пацієнтів із синхронними МТС в печінці (27,2%) зіставлено з операційними даними та морфологічною верифікацією метастатичних осередків, що дало можливість визначити високу доказовість застосованих променевих методів досліджень. Морфологічну верифікацію метахронних МТС (72,8%) проводили шляхом діагностичних пункцій.
Комплекс променевих методів проведено в обсязі УЗД із застосуванням методик у стандартних режимах сканування (В-режим) та кольорового допплерівського картування.
СКТ- та МРТ-дослідження виконано із застосуванням довенного болюсного підсилення з урахуванням фазності контрастування.
УЗД-, СКТ- та МРТ-семіотику зіставлено з клінічним перебігом хвороби та даними морфологічного дослідження.
Комплексне УЗД за розробленим протоколом проводили перед початком лікування (етап вибору способу лікування), протягом періоду лікування (ультразвуковий моніторинг), після його завершення та під час контрольних амбулаторних візитів пацієнтів.
Оцінювали положення печінки, контури (рівні, нерівні, чіткі, нечіткі), визначали розміри (нормальна, збільшена, зменшена), ехогенність паренхіми (звичайна, знижена, підвищена; однорідна, неоднорідна).
МТС у печінці оцінювали за наступними сонографічними критеріями: кількість, розміри та локалізація, ехогенність та структура осередків, зв’язок із судинами та жовчними протоками, наявність периферичного обідка «halo» та показники допплерометричних досліджень.
Для визначення гемодинамічних порушень у печінці вимірювали параметри кровотоку у загальній печінковій артерії та ворітній вені, що характеризують артеріальне та венозне русло печінки. Протягом періоду лікування параметри кровотоку були повторно виміряні, результати переоцінені.
Виконання СКТ- чи МРТ-досліджень передбачало проведення базового дослідження із визначенням щільності чи інтенсивності паренхіми печінки в різні фази сканування та з уточненням локалізації МТС з точною інтерпретацією ураження секторів (сегментів), визначенням обсягу ураженої частки та виявленням МТС в інших органах — для стадіювання процесу. Проаналізовано такі показники: локалізація, кількість (умовно поодинокі осередки, множинні), розміри (для осередків, що вимірюються, і таких, що не можуть бути виміряними), контури (рівні/нерівні, чіткі/нечіткі), щільність осередків (наявність некрозу та кальцинатів), наявність інших додаткових новоутворень у печінці, ураження ЛВ. У режимі ангіографії визначено наявність інвазії в судинне русло, оцінено накопичення контрасту в артеріальному, венозному руслі, в метастатичних осередках, елімінацію в паренхіму печінки.
Оцінку результатів СКТ та МРТ проводили візуально, за даними реконструйованих аксіальних, фронтальних та сагітальних проекцій.
При оцінці результатів базових СКТ-досліджень довільно вибрано два осередки в печінці при множинному процесі (один при солідному ураженні) для подальшої оцінки при призначенні лікування.
Контрольні СКТ- та МРТ-дослідження проводили через 6–8 тиж для оцінки проведеного лікування.
Оцінку результатів лікування після ПХТ проводили візуально із визначенням основних показників, які характеризують можливу динаміку метастатичного процесу: якісні та кількісні показники при УЗД, СКТ та МРТ.
Статистичну обробку отриманих результатів досліджень проведено із використанням Excel (MS Office 2007, XP) та програми STATISTICA 10.0.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Визначення програми лікувальної тактики при метастатичному КРР повністю залежить від рівня, якості виконання та трактування результатів методів променевої діагностики (УЗД, МРТ, СКТ).
За даними комплексу променевих методів досліджень, у всіх пацієнтів перед ПХТ виявлено МТС за допомогою одного чи декількох методів діагностики (УЗД, СКТ, МРТ чи за їх поєднання). УЗД виконано у 72 пацієнтів, СКТ — у 127, МРТ — у 67. Білобарне ураження печінки виявлено в 147 (75%), в одній частці печінки (монолобарне) — у 49 (25%) випадках.
Кількість МТС не відігравала ключової ролі у призначенні лікування, але в більшості випадків був поширений метастатичний процес у печінці або осередки великих розмірів, що займали обидві частки. Проведення операції на печінці було відстроченим.
Розміри МТС — 0,5–20,0 см у діаметрі; серед них дрібні — до 1,0−2,0 см, середні — до 5 см та великі осередки — >5−10 см. Сумарний обсяг МТС визначено у проміжку 6,2−1900 см3 (у середньому 193±81,3 см3).
За результатами комплексного УЗД на етапі обстеження, у більшості досліджень виявлено гіпоехогенні МТС порівняно з нормальною паренхімою печінки. Мали різну форму, рівні та нерівні, чіткі та нечіткі контури, різноманітну ехогенність та ехоструктуру. Поряд із гіпо-, гіпер-, ізоехогенними осередками зі зміненою паренхімою печінки виявлено неоднорідні за структурою осередки з наявністю «halo» як результат компресії осередком нормальної паренхіми печінки. У структурі осередків великих розмірів визначалися множинні кальцинати, у центральній зоні превалювали ознаки некрозу у вигляді сформованих рідинних включень (симптом «мішені»), найбільш типові для КРР (табл. 1).
Таблиця 1. Варіанти ультразвукової структури МТС у печінці
| Ультразвукова структура МТС у печінці | Частота ознак,n (%) | |
| Структура осередків | Уточнення ультразвукових симптомів | |
| Переважно гіпоехогенна |
|
43 (59,7) |
| Переважно анехогенна, з дистальним підсиленням ультразвуку |
|
17 (23,6) |
| За типом «мішень» |
|
23 (31,9) |
| Переважно гіперехогенна |
|
13 (18,0) |
| Переважно ізоехогенна |
|
5 (6,9) |
| Змішаної ехогенності |
|
57 (79,1) |
| Складної акустичної будови |
|
49 (68,0) |
Дані не сумуються, оскільки в більшості досліджень одночасно виявляли МТС різної ехогенності та ехоструктури.
За даними базових СКТ-досліджень, виявлені МТС характеризувалися більш низькою щільністю, ніж сама нормальна паренхіма печінки. Щільність осередків у межах від +25 до +48 HU, чим визначалася неоднорідність структури. Найбільш специфічною ознакою була наявність гіповаскулярних новоутворень, які більш чітко візуалізувалися у портальну фазу (табл. 2).
Таблиця 2. Найбільш специфічні СКТ-ознаки МТС у печінці
| СКТ-ознаки | Частота ознак, n (%) |
| Гіподенсність відносно паренхіми печінки | 118 (92,9) |
| Миттєве гомогенне контрастування осередків в артеріальну фазу | 86 (67,7) |
| Поява периферичного гіперденсного обідка в артеріальну фазу (неоангіогенез) | 78 (61,4) |
| Периферичне вимивання контрасту та поступове заповнення центральних відділів МТС (симптом «периферичного вимивання») у портальну фазу | 109 (85,8) |
| Ізоденсність МТС у відстрочену фазу сканування відносно паренхіми печінки | 67 (52,7) |
| Осередки за типом мішені (зона некрозу) | 53 (41,7) |
За даними МРТ базових досліджень, МТС КРР мали гіпоінтенсивний МР-сигнал, який був нижчим від сигналу паренхіми печінки на нативних Т1-ЗЗ та візуально вищим (гіперінтенсивним) — на Т2-ЗЗ та DWI. При осередках, розміри яких перевищували 5,0 см, визначали перифокальну зону інфільтрації за рахунок компресії на печінкову паренхіму. При контрастуванні відзначено низький рівень накопичення контрасту, особливо в центральній зоні.
Для оцінки ефективності проведеної ПХТ застосовували оціночні критерії RECIST, основою яких є зміна розмірів осередків.
Разом із мірною оцінкою осередків оцінювали чіткість контурів, зміну структури, появу чи відсутність нових осередків, що характеризувало ефективність ПХТ. Після курсу ПХТ МТС мали тенденцію до зменшення. У структурі осередків з’являлися типові зони із високою ехогенністю чи підвищеною щільністю за результатами СКТ. Після 3–4 курсів відзначали зменшення розмірів на 40–60%, а в подальшому осередки (особливо малих розмірів) ставали невидимими (редукція осередків). Підкапсульні МТС після 5–6 курсів ПХТ значно зменшувалися, а у частини хворих — не виявлялися.
Оцінка перифокальної зони осередку мала значення для встановлення активності ангіогенезу. При базових СКТ- чи МРТ-дослідженнях в артеріальну фазу оцінюють стовщену зону паренхіми печінки в периферичних відділах пухлин. За наявністю (відсутністю) гіперваскулярної зони та її товщиною судять про активність злоякісного процесу. Стоншення цієї зони при контрольних дослідженнях свідчило про позитивний ефект лікування (рис. 1–4).
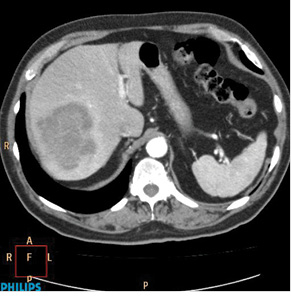
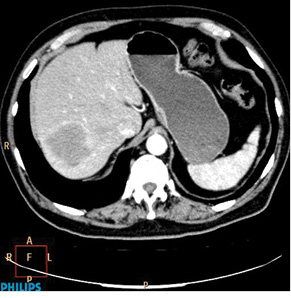

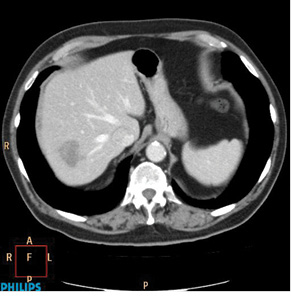
При контрольних МРТ-дослідженнях показники інтенсивності сигналу мало відрізнялися від базових зображень. Подібна тенденція відносно зміни розмірів та кількості осередків простежувалася, як при динамічних СКТ-дослідженнях (рис. 5, 6).
На контрольних дослідженнях визначали зменшення розмірів осередків, хоча кількісно така різниця була недостовірною.
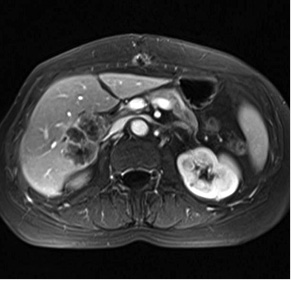
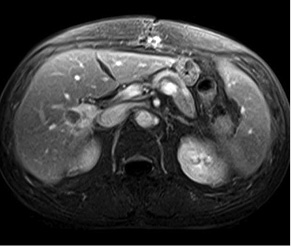
Зміна розмірів осередків не є основним критерієм оцінки ефективності лікування. При аналізі результатів в осередках, розміри яких мало змінилися протягом періоду лікування та без видимої зміни внутрішньої структури, стабілізацію розмірів трактували як ефективність терапії, а при видимих змінах внутрішньої структури — як позитивний ефект лікування (рис. 7).
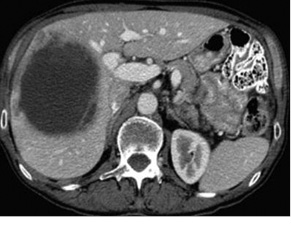
У групі проведених СКТ-досліджень виявлено появу неоднорідності осередків після ПХТ, яка частіше спостерігалася в осередках розміром > 5,0 см у вигляді зони із рідинним вмістом за рахунок некрозу, який при ПХТ мав тенденцію до збільшення. При контрольних дослідженнях у зоні осередків виявлено кальцинати у 22 (11,2%) пацієнтів (рис. 8). Такі зміни трактували як позитивний ефект лікування.
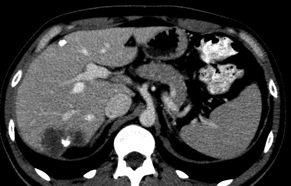
Середній період спостереження за пацієнтами становив 36 тиж. Позитивний ефект лікування визначено у 147 (75%) хворих, з них у 40 (27,2%) — часткову регресію. Майже в половині (46%) спостережень встановлено стабілізацію процесу. Повної радіологічної регресії в дослідженнях не отримали. Прогресування процесу визначено у 49 (23,4%) спостереженнях при масивному поширеному процесі в печінці. Відповідь на ПХТ була мінімальною або, навпаки, з’явилися ознаки, що характеризували прогресування метастатичного процесу: збільшення кількості та розмірів осередків, збільшення печінки, неоднорідність паренхіми порівняно з базовими дослідженнями.
Залежності помилкових висновків від кількості, розмірів та локалізації МТС у проведених дослідженнях не виявлено. Поширеність метастатичного процесу в печінці нівелювала мінімальні неточності в інтерпретації зображень та не вплинула на вибір лікування та оцінку його ефективності.
У проведених дослідженнях більше було хибнонегативних результатів, але не в базових дослідженнях, а після курсу ПХТ, коли і в осередку, і в паренхімі відбулися морфологічні зміни, які складно диференціювати.
У табл. 3 наведено дані про основні променеві ознаки динамічного моніторингу при проведенні ПХТ у пацієнтів із МТС в печінці.
Таблиця 3. Основні променеві ознаки динамічного моніторингу при проведенні ПХТ у пацієнтів із МТС в печінці
| Променева ознака | Метод дослідження (УЗД, СКТ, МРТ) | |
| n | % | |
| Зменшення/збільшення розмірів осередків | 122/74 | 62,2/37,7 |
| Зменшення/збільшення кількості осередків | 74/56 | 37,7/28,5 |
| Без зменшення/збільшення розмірів осередків | 66 | 33,6 |
| Зміна ехогенності/щільності/інтенсивності | 156 | 79,5 |
| Стоншення/потовщення перифокальної зони осередку | 43/52 | 21,9/26,5 |
| Наявність включень в осередках: | ||
|
23 | 11,7 |
|
54 | 27,5 |
|
69 | 32,2 |
| Променевий ефект зникнення осередку | 8 | 4,1 |
Дані не сумувалися, оскільки більшість ознак визначали одночасно.
Більшість ознак фіксували одночасно як в одному осередку, так і при множинному процесі, що характеризувало зміни в осередку при ПХТ. При динамічних дослідженнях, протягом періоду проведення ПХТ, у 62,2% пацієнтів встановлено зменшення розмірів осередків. Однаково часто визначали як збільшення, так і зменшення їх кількості. У третини (33,6%) пацієнтів відмічали стабільність розмірів МТС, що можна було б розцінити як неефективність лікування. Разом з тим, в осередках відмічали появу чи збільшення рідинного компонента, стоншення перифокальної зони (при УЗД обідок «halo» слабо виявлявся, при СКТ був стоншеним).
Але важливим моментом у більшості пацієнтів були відмічені структурні (79,5%) зміни в осередку, які трактували залежно від застосованого діагностичного методу: зміна ехогенності при УЗД (її підвищення чи зниження); зміна щільності — за СКТ; зміна інтенсивності відображеного сигналу за даними МРТ. Такі структурні зміни були оцінені як морфологічна перебудова метастатичного осередку та як позитивна відповідь на лікування.
Важливими є дані про осередки МТС, які стають невидимими (4,1%) при подальших діагностичних дослідженнях. Зона раніше виявленого МТС не відрізняється візуально від нормальної паренхіми печінки. Але в публікаціях є рекомендації про необхідність виконати резекцію органа, тому що результат про повну регресію не підтверджується результатами морфологічного дослідження. У зоні видаленої частки паренхіми печінки залишаються клітини МТС.
Коментарі до результатів
Вирішення тактичних завдань щодо подальшого лікування пацієнтів із метастатичним КРР повністю залежить від результатів діагностичних досліджень.
Сучасні, найбільш затребувані променеві методи (УЗД, СКТ та МРТ) значно розширили діапазон можливостей для планування лікування та оцінки його ефективності. Визначення поширення метастатичного процесу у печінці на діагностичному етапі не є складною проблемою. Більшість проведених УЗД демонструють досить різноманітну семіотику зображень метастатичних осередків та дають точну діагностичну картину поширення метастатичного процесу в печінці. Проведення СКТ як методу стадіювання злоякісного процесу та визначення поширення МТС у печінці показує високу точність дослідження. У складних випадках диференційної діагностики застосування МРТ цілком виправдане, особливо при МТС малих розмірів. Результати проведених досліджень демонструють достатньо високі показники чутливості СКТ та МРТ, які є зіставними (94,2 та 96,7% відповідно). Такі дані не суперечать за чутливістю результатам багатьох представлених досліджень.
Особливого значення надають проблемі оцінки ефективності лікування. Діагностичні зображення метастатичних осередків змінюються під впливом призначеного лікування і кардинально відрізняються від базових досліджень. Підвищення значення динамічних СКТ та МРТ в трактуванні перебігу метастатичного процесу в печінці спрямоване на точне визначення його ефективності з урахуванням оціночних критеріїв RECIST. Швидка зміна морфологічного субстрату метастатичного осередку не корелює зі зменшенням його розмірів, але оцінюється за рахунок зміни патоморфозу як позитивний ефект лікування. Променева та морфологічна оцінка осередків є перспективним напрямом досліджень у пацієнтів, які отримують спрямоване спеціальне лікування.
ВИСНОВКИ
За результатами проведеного аналізу численних публікацій наукової літератури та власного досвіду слід відзначити, що застосування сучасних променевих методів забезпечує високу точність діагностики метастатичного ураження печінки. Поєднання різних методів дозволяє встановити локалізацію, оцінити морфологічні характеристики осередкових уражень печінки, визначити обсяг ураження та планувати лікування.
Втім проблема метастатичного КРР залишається надзвичайно актуальною. Свідчення літератури та результати власних досліджень демонструють, що відсоток радикальних операцій на печінці є невисоким, тому більшість пацієнтів отримують ПХТ. З урахуванням реальних успіхів лікування кількість пацієнтів, яких можна прооперувати після ПХТ, збільшується.
Але, незважаючи на діагностичні успіхи, залишаються труднощі в інтерпретації зображень як при первинних дослідженнях, так і після проведення ПХТ, особливо у разі виявлення прогресування метастатичного процесу.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Федоренко З.П., Гулак Л.О., Михайлович Ю.Й. та ін.; ред. докт. мед. наук О.О. Колеснік (2015) Рак в Україні, 2013–2014. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України № 16. Київ. 106 с.
2. Weiss L., Grundmann E., Torhorst J. et al. (1986) Haematogenous metastatic patterns in colonic carcinoma: an analysis of 1541 necropsies. J. Pathol., 150(3):195–203.
3. Ганцев Ш.Х., Ишмуратова Р.Ш., Антабаев Р.Д. (2007) Лечение метастазов в печени при раке органов пищеварения. Росс. онкол. журн., 6: 27–29.
4. Barugel M.E., Wargas C., Krygier W.G. (2012) Metastatic colorectal cancer. Recent advances in its clinical management. Expert. Rev. Anticancer. Ther., 9: 1829–1847.
5. Jemal А., Bray F., Center М.М. et al. (2011) Global cancer statistics. Cancer J. Clin., 61(2): 69–90.
6. Verslype C., Libbrecht L. (2007) The multidisciplinary management of gastrointestinal cancer. The diagnostic and therapeutic approach for primary solid liver tumours in adults. Best. Pract. Res. Clin. Gastroenterol., 21(6): 983–96.
7. Garcia M. et. al. (2008) American Cancer Society (www.cancer.org). Accessed March.
8. Kinkel K., Lu Y., Both M., Warren R.S. et al. (2002) Detection of hepatic metastases from cancers of the gastrointestinal tract by using noninvasive imaging methods (US, CT, MR imaging, PET): a meta-analysis. Radiology, 224: 748–756.
9. Кит О.И. (2013) Проблема колоректального рака в начале ХХI века: достижения и перспективы. РЖГГК, 23(3): 65–71.
10. Barugel M.E., Wargas C., Krygier W.G. (2012) Metastatic colorectal cancer. Recent advances in its clinical management. Expert. Rev. Anticancer. Ther., 9: 1829–1847.
11. Патютко Ю.И. (2005) Хирургическое лечение злокачественных опухолей печени. Изд-во «Практическая медицина», Москва, 312 с.
12. Grundmann R.T., Grundmann R.T., Hermanek P., Merkel S. (2008) Diagnosis and treatment of colorectal liver metastases. Zentralbl. Chir., 133(3): 267−284.
13. Hopt U.T., Drognitz O., Neeff H. et al. (2009) Timing of resection in patients with colorectal carcinoma and synchronous liver metastases. Zentralbl. Chir., 134(5): 425–429.
14. Nigel Bird N., Ruth Bird R., Ali Majeed A. (2011) Effects of surgery and palliative chemotherapy in the treatment of colorectal liver metastasis. Surgical Science, 2: 312–317. doi:10.4236/ss.2011.26066.
15. Горчаков С.В., Правосудов И.В., Васильев С.В. и др. (2015) Анализ отдаленных результатов лечения больных колоректальным раком с метастазами в печень. Вестник СПбГУ. 11(4): 36–47.
16. Федянин М.Ю., Трякин А.А., Тюляндин С.А. (2012) Химиотерапия больных метастатическим раком толстой кишки. Онкол. колопроктол., 2: 26–34.
17. Chau I., Cunningham D. (2009) Treatment in advanced colorectal cancer: what when and how? Br. J. Cancer, 100(11): 1704–1719.
18. Kanas G.P., Taylor A., Primrose J.N. et al. (2012) Survival after liver resection in metastatic colorectal cancer: review and meta-analysis of prognostic factors. Clin. Epidemiol., 4: 283–301.
19. Абдулаев М.А., Напольская Е.В., Цикоридзе М.Ю. (2016) Современное состояние проблемы малоинвазивных методов локального лечения метастазов колоректального рака в печени (обзор литературы). Онкол. колопроктол., 1(6): 43–47.
20. Dimitroulis D., Nikiteas N., Troupis T. et al. (2010) Role of surgery in colorectal liver metastases: too early or too late? World J. Gastroenterol., 16(28): 3484–3490.
21. Patrlj L., Kopljar M., Kliček R. et al. (2014) The surgical treatment of patients with colorectal cancer and liver metastases in the setting of the «liver first» approach. Hepatobiliary Surg. Nutr., 3(5): 324–329. doi: 10.3978/j.issn.2304-3881.2014.09.12.
22. Патютко Ю.И. (2011) Хирургическое и комбинированное лечение больных колоректальным раком с метастатическим поражением печени. Онкол. колопроктол., 2 (1): 32–39.
23. Pawlik T.M., Schulick R.D., Choti M.A. (2008) Expanding criteria for resectability of colorectal liver metastases. Oncologist, 13 (1): 51–64.
24. Schmoll H.J., van Cutsem E., Stein A. et al. (2012) ESMO consensus guidelines for management of patients with colon and rectal cancer: a personalized approach to clinical decision making. Ann. Oncol., 23(10): 2479−2516.
25. Kinkel K., Lu Y., Both M. et al. (2002) Detection of hepatic metastases from cancers of the gastrointestinal tract by using noninvasive imaging methods (US, CT, MR imaging, PET): a meta-analysis. Radiology, 224: 748–756.
26. van Cutsem E., Verheul H.M., Flamen P. et al. (2016) Imaging in colorectal cancer: progress and challenges for the clinicians. Cancers (Basel), 8(9). pii: E81. doi: 10.3390/cancers8090081.
27. Кащенко В.А. (2008) Теоретическое обоснование оценки ангиогенеза в клинической гепатологии. Вест. СПУ, 11: 83–89.
28. Савченков Ю.Н., Багненко С.С., Труфанов Г.Е. и др. (2013) Современное состояние и проблемы лучевой диагностики метастатического поражения печени. Вестник Российской военно-медицинской академии, 3(43): 170–176.
29. Зогот С.Р., Акберов Р.Ф. (2013) Частота, лучевая семиотика метастазов в печень опухолей различной локализации по результатам комплексного лучевого исследования. Практич. медицина, 2(67): 119–122.
30. Mainenti P.P., Romano F., Pizzuti L. et al. (2015) Non-invasive diagnostic imaging of colorectal liver metastases. World J. Radiol., 7(7): 157–169.
31. Niekel M.C., Bipat S., Stoker J. (2010) Diagnostic imaging of colorectal liver metastases with CT, MR Imaging, FDG PET, and/or FDG PET/CT: a meta-analysis of prospective studies including patients who have not previously undergone treatment. Radiology, 257(3): 674–684.
32. Прокоп М., Галански М. (2007) Спиральная и многослойная компьютерная томография. Т. II. «МЕДпрогресс-информ», Москва, 710 с.
33. Ефанов М.Г., Вишневский В.А., Кармазановский Г.Г. и др. (2009) Спиральная компьютерная томография: возможности различных поколений томографов в определении нормальной сосудистой анатомии печени. Часть 1-я. Анатомия афферентных сосудов печени. Анн. хир. гепатологии, 2: 44–52.
34. Ефанов М.Г., Вишневский В.А., Кармазановский Г.Г. и др. (2009) Спиральная компьютерная томография: возможности различных поколений томографов в определении нормальной сосудистой анатомии печени. Часть 2-я. Анатомия эфферентных сосудов печени. Анн. хир. гепатологии, 3: 6−12.
35. Miles K.A., Griffiths M.R., Fuentes M.A. (2001) Standardised perfusion value: a universal CT contrast enhancement scale that correlates with FDG PET in lung nodules. Radiology, 220: 548–553.
36. Pandharipande P.V., Krinsky G.A., Rusinek H. et al. (2005) Perfusion imaging of the liver: current challenges and future goals. Radiology, 234: 661–673.
37. Marchal G., Vogl T.J., Heiken J.P., Rubin G.D. (2005) Multidetector-row computed tomography: scanning and contrast protocols. Springer, 131 p.
38. Khalil H.I., Patterson S.A., Panicek D.M. (2005)Hepatic lesions deemed too small to characterize at CT: prevalence and importance in women with breast cancer. Radiology, 235: 872–878.
39. Шпак С.А., Момот Н.В., Танасичук-Гажиева Н.В. и др. (2010) Особенности мультисрезовой компьютерной томографии в дифференциальной диагностике первичных злокачественных опухолей печени. Новоутворення, 2(6): 98−105.
40. Абдуллаев А.Г., Милонова В.И., Царенко И.А. (2005) Компьютерная томографическая диагностика объемных образований печени различного генеза. Хирургия, 6: 61–65.
41. Donato P., Coelho P., Rodrigues H. et al. (2007) Normal vascular and biliary hepatic anatomy: 3D-demonstration by multidetector CT. Surg. Radiol. Anat. 29: 575–582.
42. Zviniene К., Basevicius Z., Pundzius J. (2009) Comparative diagnostic value of computed tomography and contrast-enhanced ultrasonography in diagnosis of focal liver lesions. Medicina (Kaunas), 45(10): 751–763.
43. Rojas Llimpe F.L., Di Fabio F., Ercolani G., Giampalma E. et al. (2014) Imaging in resectable colorectal liver metastasis patients with or without preoperative chemotherapy: results of the PROMETEO-01 study. Brit. J. Cancer, 111: 667–673. doi:10.1038/bjc.2014.351 (www.bjcancer.com).
44. Багненко С.С., Труфанов Г.Е., Алентьев С.А. и др. (2012). Магнитно-резонансная томография в диагностике очаговых поражений печени с применением гепатотропного контрастного препарата. Вестн. Рос. военно-мед. академии, 1(37): 97–105.
45. Ратников В.А., Кузнецов С.В., Савельева Т.В. (2010) Магнитно-резонансная томография гепатобилиарной системы с применением примовиста: современное состояние проблемы. Лучевая диагностика и лучевая терапия,1(1): 53–63.
46. Muhi A., Ichikawa T., Motosugi U. et al. (2011) Diagnosis of colorectal hepatic metastases: comparison of contrast-enhanced CT, contrast-enhanced US, superparamagnetic iron oxide-enhanced MRI, and gadoxetic acid enhanced MRI. J. Magn. Reson. Imaging, 34: 326–335.
47. Donati O.F., Reiner C.S., Hany T.F. et al. (2010) 18F-FDG-PET and MRI in patients with malignancies of the liver and pancreas. Accuracy of retrospective multimodality image registration by using the CT-component of PET/CT. Nuklearmedizin, 49: 106−114.
48. Курпешев О.К., Осинский С.П., Флоровская Н.Ю. и др. (2013) Продолжительность жизни больных с метастазами колоректального рака в печени после неполных курсов химиотерапии или симптоматического лечения. Онкология, 15(4): 301−306.
49. Sheafor D.H., Frederick M.G., Paulson E.K. (1999) Comparison of unenhanced, hepatic arterial-dominant and portal venous-dominant phase helical CT for the detection of liver metastases in women with breast carcinoma. AJR Am. J. Roentgenol., 172: 961–968.
50. Van Leeuwen M.S., Noordzij J., Feldberg M.A. et al. (2009) Focal liver lesions: characterization with triphasic spiral CT. Radiology, 201: 327−336.
51. Акчурина Э.Д., Мершина Е.А., Синицын В.Е., Архипова И.М. (2011) Значение диффузионно-взвешенных изображений для диагностики очаговых поражений печени (обзор литературы). Диагностическая и интервенционная радиология, 2(5): 69–76.
52. Kenis C., Deckers F., De Foer B. et al. (2012) Diagnosis of liver metastases: can diffusion-weighted imaging (DWI) be used as a standalone sequence? Eur. J. Radiol., 81(5): 1016–1023.
53. Nasu K., Kuroki Y., Nawano S. et al. (2006) Hepatic metastases: diffusion-weighted sensitivity-encoding versus SPIO-enhanced MR imaging. Radiology, 239: 122–130.
54. Taouli B., Koh D.M. (2010) Diffusion-weighted MR imaging of the liver. Radiology, 254: 47–66.
55. Holzapfel K., Eiber M.J., Fingerle A.A. et al. (2011) Detection, classification, and characterization of focal liver lesions: value of diffusion-weighted MR imaging, gadoxetic acid-enhanced MR imaging and the combination of both methods. Abdom. Imaging., 37: 74–82.
56. Frankel T.L., Gian R.K., Jarnagin W.R. (2012) Preoperative imaging for hepatic resection of colorectal cancer metastasis. J. Gastrointest. Oncol., 3(1): 11–18.
57. Kim Y.K., Park G., Kim C.S. et al. (2012) Diagnostic efficacy of gadoxetic acid-enhanced MRI for the detection and characterization of liver metastases: comparison with multidetector-row CT. Br. J. Radiol., 85: 539–547.
58. Haider M.A., Amitai M.M., Rappaport D.C. et al. (2009) Multi-detector row helical CT in preoperative assessment of small (< or = 1.5 cm) liver metastases: is thinner collimation better? Radiology, 225(1): 137–142.
59. Chan K., Welch S., Walker-Dilks C., Raifu A. (2012) Ontario provincial Gastrointestinal Disease Site Group Evidence-based guideline recommendations on the use of positron emission tomography imaging in colorectal cancer. Clin. Oncol. (R. Coll. Radiol.), 24: 232–249.
60. Alberts S., Poston G. (2011) Treatment advances in liver-limited metastatic colorectal cancer. Clin. Colorectal Cancer, 10: 258–265.
61. Sacks A., Peller P.J., Surasi D.S. et al. (2011) Value of PET/CT in the management of liver metastases, part 1. AJR Am. J. Roentgenol., 197: 256–259.
62. Robinson P.J. (2009) The effects of cancer chemotherapy on liver imaging. Eur. Radiol., 19(7): 1752–1762.
63. Masi G., Fornaro L., Caparello C., Falcone A. (2011) Liver metastases from colorectal cancer: how to best complement medical treatment with surgical approaches. Future Oncol., 7(11): 1299–1323.
64. Базанов К.В., Кузнецов С.С., Терентьев И.Г (2015) Исследование влияния терапии цитостатиками на морфологическую структуру и кинетику роста рецидивного и метастатического колоректального рака. Естественные и технические науки, 1(79): 13−18.
65. Трякин А.А. (2010) Таргетная терапия колоректального рака, рака желудка и поджелудочной железы. Практическая Онкология, 11(3): 143–150.
66. Воронцова К.А., Черноглазова Е.В., Вышинская Г.В. (2015) Таргетные препараты во второй линии противоопухолевой терапии диссеминированного колоректального рака. Мед. сов., 8: 91–96.
67. Masi G., Salvatore L., Boni L. et al., on behalf of the BEBYP Study Investigators (2015) Continuation or reintroduction of bevacizumab beyond progression to first-line therapy in metastatic colorectal cancer: final results of the randomized BEBYP trial. Ann. Oncol. pii: mdv012.
68. World Health Organization (1979) WHO Handbook for reporting results of cancer treatment. WHO Publication No. 48, Geneva.
69. Miller A.B., Hoogstraten B., Staquet M., Winkler A. (1981) Reporting results of cancer treatment. Cancer, 47: 207–214.
70. Therasse P., Arbuck S.G., Eisenhauer E.A. et al. (2000) New guidelines to evaluate the response to treatment in solid tumors. J. Natl. Cancer Inst., 92: 205–216.
71. Eisenhauer E.A., Therasse P., Bogaerts J. et al. (2009) New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur. J. Cancer, 45: 228–247. doi:10.1016/j.ejca.2008.10.026.
72. Plathow C., Klopp M., Thieke C. et al. (2008) Therapy response in malignant pleural mesothelioma — role of MRI using RECIST, modified RECIST and volumetric approaches in comparison with CT. Eur. Radiol., 18:1635–1643. doi:10.1007/s00330-008-0918-9.
73. Therasse P., Arbuck S.G., Eisenhauer E.A. et al. (2009) New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J. Natl. Cancer Inst., 92: 205–216.
74. Engelmann B.E., Loft A., Kjær A. et аl. (2014) Positron emission tomography/computed tomography and biomarkers for early treatment response evaluation in metastatic colon cancer. Oncologist, 19(2): 164–172.
75. Kan Z., Phongkitkarun S., Kobayashi S. et аl. (2005) Functional CT for quantifying tumor perfusion in antiangiogenic therapy in a rat model. Radiology, 237: 151–158. doi:10.1148/ radiol.2363041293.
76. Meijerink M.R., van Cruijsen H., Hoekman K. et аl. (2007) The use of perfusion CT for the evaluation of therapy combining AZD2171 with gefitinib in cancer patients. Eur. Radiol., 17: 1700–1713. doi:10.1007/s00330-006-0425-9.
77. Kambadakone A.R., Sahani D.V. (2009) Body perfusion CT: technique, clinical applications and advances. Radiol. Clin. N. Am., 47: 161–178. doi:10.1016/j.rcl.2008.11.003.
78. Eisenhauer E.A., Therasse P., Bogaerts J. et al. (2009) New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur. J. Cancer, 45 (2): 228–247.
79. Maru D.M., Kopetz S., Boonsirikamchai P., Agarwal A. et al. (2010) Tumor thickness at the tumor-normal interface: a novel pathologic indicator of chemotherapy response in hepatic colorectal metastases. Am. J. Surg. Pathol., 34(9): 1287–1294.
80. Niekel M.C., Bipat S., Stoker J. (2010) Diagnostic imaging of colorectal liver metastases with CT, MR imaging, FDG PET, and/or FDG PET/CT: a meta-analysis of prospective studies including patients who have not previously undergone treatment. Radiology, 257(3): 674–84.
81. Wahl R., Jacene H., Kasamon Y., Lodge M. (2009) From RECIST to PERCIST: Evolving considerations for PET response criteria in solid tumors. J. Nucl. Med., 50 (Suppl. 1): 122S–150S.
82. van Kessel C.S., Buckens C.F., van den Bosch M.A. et al. (2012) Preoperative imaging of colorectal liver metastases after neoadjuvant chemotherapy: a meta-analysis. Ann. Surg. Oncol., 19: 2805–2813.
83. NCCN Clinical practice guidelines in oncology (2010) Colon cancer. J. Natl. Compr. Canc. Netw., V.1. (https://www.nccn.org/…gls/f_guidelines.asp).
Лучевые критерии оценки эффективности лечения больных с метастатическим поражением печени (состояние проблемы и результаты исследований)
Резюме. Представлен аналитический обзор литературы оптимальных возможностей применения современных лучевых методов исследований у пациентов с метастатическим процессом в печени. В историческом аспекте указаны оценочные критерии эффективности лечения согласно рекомендациям RECIST в разных версиях. На примере лечения пациентов с метастатическим колоректальным раком продемонстрированы учетные и оценочные возможности методов лучевой диагностики в определении основных критериев эффективности лечения.
метастазы колоректального рака в печени, лучевые методы диагностики, критерии RECIST, оценка эффективности лечения.
Адреса:
Лаврик Галина Василівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 258-63-38
E-mail: g.lavryk@gmail.com














Leave a comment