Рак підшлункової залози: критерії резектабельності
Щепотин И.Б., Лукашенко А.В., Колесник Е.А., Разумей Д.А., Приймак В.В., Шептицький В.В., Головко Г.С., Лаврик Г.В., Халилеев А.А.
Резюме. Рак підшлункової залози — пухлина з поганим прогнозом (загальна 5-річна виживаність становить менше 5%). Хірургічний метод лікування залишається єдиним, що дозволяє суттєво подовжити життя пацієнтам. Точність доопераційного стадіювання дуже важлива як для уникнення експлоративної лапаротомії у випадках розповсюдженого раку, так і для запобігання відмови в радикальному лікуванні пацієнтам із операбельними пухлинами. У даній статті проведено аналіз різноманітних діагностичних методів з боку їх прогностичної точності для визначення резектабельності пухлин.
Резюме. Рак поджелудочной железы — опухоль с плохим прогнозом (общая 5-летняя выживаемость составляет менее 5%). Хирургический метод лечения остается единственным, позволяющим существенно продлить жизнь пациентам. Точность дооперационного стадирования очень важна как для предотвращения эксплоративной лапаротомии в случаях распространенного рака, так и для исключения отказа в радикальном лечении пациентам с операбельными опухолями. Задачей данной статьи является обзор различных диагностических методов в свете их прогностической точности для определения резектабельности опухоли.
 Вступление
Вступление
Рак поджелудочной железы (РПЖ) занимает 6-е место в структуре заболеваемости и 4-е место в структуре смертности от злокачественных новообразований (40 тыс. умерших в год в Европе и 30 тыс. в США) [45, 1, 145]. Заболеваемость РПЖ постепенно увеличивалась в XX веке, данная тенденция сохранилась и в начале XXI века. РПЖ является причиной 22% смертей от злокачественных новообразований желудочно-кишечного тракта [45, 145].
В Украине ежегодно от РПЖ умирают около 4 тыс. человек, то есть практически столько же, сколько ежегодно регистрируется новых случаев РПЖ. Смертность среди мужчин составляет 12,2 на 100 тыс. мужского населения, среди женщин – 9 на 100 тыс. женского населения. В структуре смертности населения Украины от злокачественных новообразований относительная частота РПЖ у мужчин составляет 4,7% (6-е место), у женщин — 4,5% (9-е место) [1].
РПЖ — опухоль с плохим прогнозом, общая 5-летняя выживаемость составляет менее 5%. Хирургический метод лечения остается единственным, позволяющим существенно продлить жизнь пациентам [144, 3, 31, 6]. Точность дооперационного стадирования очень важна как для предотвращения эксплоративной лапаротомии в случаях распространенного РПЖ, так и для исключения отказа в радикальном лечении пациентам с операбельными опухолями [31, 127]. Только в 16% первичных случаев у больных РПЖ выявляют опухоли, ограниченные поджелудочной железой (I стадия), соответственно, в 85–90% случаев диагностируют распространенные, неоперабельные формы РПЖ [39, 149, 16, 125]. На сегодняшний день не достигнут консенсус относительно выбора оптимального метода оценки распространенности РПЖ на дооперационном этапе, так как нет исследований, обладающих высокой степенью достоверности [127, 119]. Критерий операбельности РПЖ – отсутствие отдаленных метастазов, в то время как критерии резектабельности включают целый ряд факторов, одним из наиболее существенных, и в то же время наиболее часто ошибочно трактуемых, является степень распространения опухоли на следующие сосуды: верхние брыжеечные артерию и вену, чревный ствол, общую и собственные печеночные артерии, портальную вену. Далее в тексте вышеперечисленные сосуды будут упоминаться как магистральные. По данным различных авторов, РПЖ может вовлекать магистральные сосуды в 21–64% случаев [6, 9, 15, 87].
Рассматривая критерии распространенности опухоли на сосуды, особое внимание следует уделить степени инвазии в основные артериальные стволы (печеночная артерия, верхняя брыжеечная артерия, чревный ствол), так как истинная инвазия в данные структуры является абсолютным противопоказанием к радикальному вмешательству [52, 140, 110]. Вовлечение ветвей прочих крупных сосудов, таких как гастро-дуоденальная, селезеночная артерия и др. не является противопоказанием к резекции [52]. Наиболее часто РПЖ распространяется на верхние брыжеечные сосуды, что обусловлено их анатомической близостью к головке, крючковидному отростку и телу поджелудочной железы [52, 51, 11, 42].
Частичная венозная инвазия не является абсолютным противопоказанием к радикальной операции [140, 110, 44, 50, 103]. Совершенствование методов лучевой диагностики с каждым годом позволяет все более точно определять уровень и степень поражения основных венозных стволов при РПЖ, что особенно важно при вовлечении в опухоль латеральной или задней стенки портальной либо верхней мезентериальной вены, когда интраоперационно данная инвазия выявляется только после пересечения поджелудочной железы [141]. Далее будет приведен анализ основных методов, позволяющих определить резектабельность РПЖ на дооперационном этапе.
Компьютерная томография (КТ)
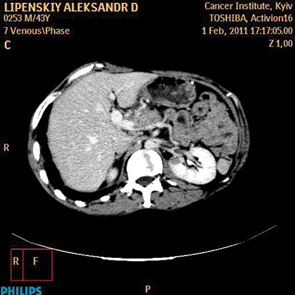
КТ — неинвазивная процедура, обладающая высокой чувствительностью (91%) и специфичностью (85%) при выявлении РПЖ [14]. В настоящее время для оценки магистральных сосудов широко применяется протокол КТ-ангиографии (рис. 1), который рассматривает 4 степени деформации сосудистой стенки. S.S. Phoa и соавторы [99] показали, что в зависимости от кривизны поверхностей опухоли и деформации сосудов степень D (вогнутая поверхность сосуда в зоне опухоли) соответствует риску инвазии 88% и прогнозируемой резектабельности 7%; степень Е (циркулярное вовлечение сосуда) — резектабельности 0%. E.M. Loyer и соавторы [80] установили, что при степени А (жировая прослойка между опухолью и сосудом) и степени В (неизмененная ткань поджелудочной железы между опухолью и сосудами) точность прогнозируемой резектабельности составляет 95%, таким образом, степени КТ оценки А и В относятся к благоприятным факторам прогноза (см. рис. 1).
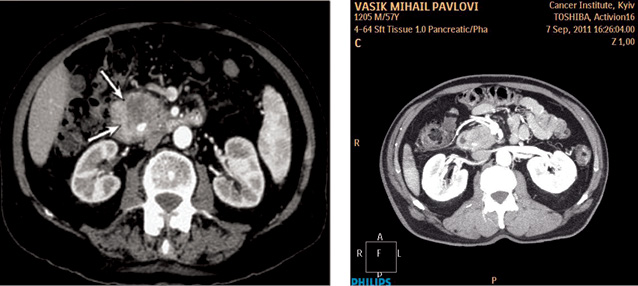
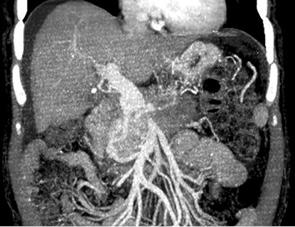
С другой стороны, протяженность контакта опухоли с сосудистой стенкой (в случае контакта более чем на 5 мм) является чувствительным диагностическим критерием (78% для портальной вены и 81% для верхней мезентериальной вены). Оценка степени циркулярного контакта с сосудом (более или менее 180°) также имеет высокую корреляцию с резектабельностью (34, 36, 37, 74). D.S. Lu и соавторы [81] отметили высокую специфичность (84%) и чувствительность (98%) данного критерия; точность прогнозируемой резектабельности составила 95%, нерезектабельности — 93%. S.S. Phoa и соавторы [99] определили прогностическую ценность комбинации факторов циркулярного контакта и степени кривизны деформации сосуда. При циркулярном контакте >90° и степени деформации сосудов D либо E чувствительность и специфичность оценки вовлечения сосуда составили соответственно 60 и 90% [99, 78]. Множественные деформации контура сосуда свидетельствуют о высоком риске инвазии, чувствительность и специфичность данного фактора составляют соответственно 45 и 99% для артерий и 63 и 100% — для вен [78]. В тоже время нужно помнить об эффекте опухолевого сдавления (mass effect) стенки венозного сосуда, имитирующего опухолевую инвазию, а также о возможности полной инвазии в артериальные стволы без видимой на КТ деформации сосудистого просвета. Характерным КТ-признаком поражения верхней брыжеечной артерии является эффект «висящей капли», чувствительность и специфичность которого составляет соответственно 91 и 98% [78] .
Основываясь на данных различных исследователей, H. Li и соавторы [78] выделяют следующие КТ-критерии вовлечения магистральных артерий: погружение артериального ствола в опухоль, комбинацию вовлечения опухолью более ½ окружности сосуда с нерегулярностью контура стенки либо со стенозом артерии (чувствительность — 79%, специфичность — 99%). Критерии распространения опухоли на вены портальной системы: окклюзия вены, вовлечение в опухоль более ½ окружности вены, нерегулярность контура стенки, стеноз сосуда, а также наличие эффекта «висящей капли» при оценке верхней брыжеечной вены (чувствительность — 92%, специфичность — 100%) (рис. 2, 3).
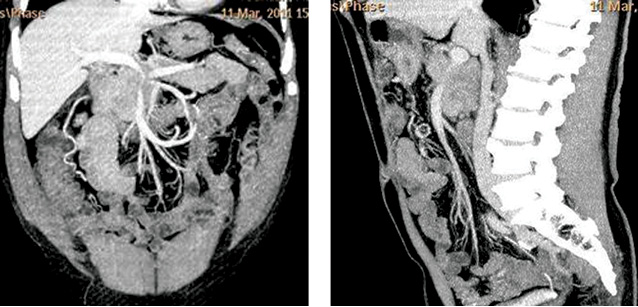
С целью выявления поражения сосудов КТ была использована во многих исследованиях (таблица). За последние годы следует отметить улучшение качества диагностического оборудования, которое позволяет выполнять 4–64 срезовые исследования, быстро, с тонким шагом среза, 3-фазные исследования с последующей обработкой изображений (3D-реконструкция, мультипланарная реконструкция) [17, 8, 72, 98, 77, 21, 100, 116].
| Исследования | n | Чувствительность, % |
Специфичность, % |
Точность прогноза резектабельности, % |
Точность прогноза нерезектабельности, % |
|---|---|---|---|---|---|
| Megibow [87] (1995) | 118 | 47 | 69 | 89 | 28 |
| Sugiyama [132] (1997) | 73 | 65 | 77 | НД | НД |
| McCarthy [85] (1998) | 67 | НД | НД | 55 (в) /94 (а) | 95 (в) /94 (а) |
| Böttger [16] (1998) | 255 | 22,2 | 96,4 | 72,7 | 74,1 |
| Sugiyama [131] (1999) | 91 | 64 | 79 | НД | НД |
| Nakao [96] (1999) | 55 | 82,1 | 74,1 | 76,7 | 80 |
| Pietrabissa [101] (1999) | 50 | 82 | 53 | НД | НД |
| Gress [43] (1999) | 151 | 15 | 100 | 100 | 60 |
| Squillaci [129] (2003) | 50 | 97 | 100 | 100 | 95 |
| Soriano [127] (2004) | 62 | 67 | 94 | 89 | 80 |
| Li [78] (2005) | 54 | 92 (в)/97 (а) | 100 (в)/99 (а) | НД | НД |
| Buchs [19] (2007) | 153 | 54,5 | 91,2 | 66,7 | 86,1 |
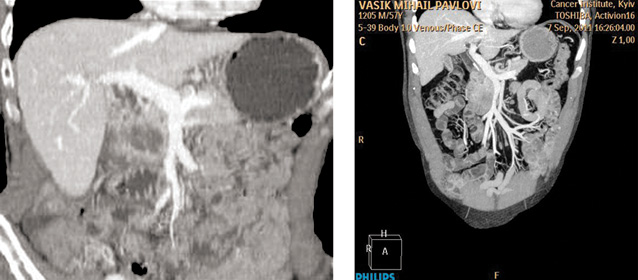
15 лет назад F. Yoshimi и соавторы [150] докладывали о первом случае 3D сосудистой КТ-реконструкции, позволивший оценить степень поражения портальной вены с большей точностью, чем при ангиографии. В настоящее время на современном оборудовании сканирование поджелудочной железы с шагом в 1 мм занимает 20 с, что позволяет определить объем поражения и оценить состояние сосудов более подробно, чем при ангиографическом исследовании. Кроме того, КТ-ангиография позволяет выполнять анатомическое исследование мелких сосудов поджелудочной железы с высоким показателем точности [23, 26, 147]. Косвенные КТ-признаки, такие как расширение перипанкреатических вен при отсутствии визуализации основных стволов свидетельствует о распространении опухоли на перипанкреатическую клетчатку [147]. Ряд исследователей делает акцент о важности времени (фазы) снятия КТ-изображения. При оценке поджелудочной железы портальная венозная фаза (60 с после внутривенного введения контрастного препарата) и панкреатическая фаза (40–70 с) предоставляют больше необходимой информации, чем артериальная фаза (18 с) или печеночная фаза (70–100 с) [86, 82, 142]. N.J. McNuty и соавторы [86] сообщают о том, что артериальная фаза может быть пропущена у пациентов, которым необходимо в дальнейшем КТ-ангиографическое исследование. Imbriaco и соавторы [56] показали, что 2-фазная спиральная КТ (СКТ) (артериальная — 20 с и отсроченная панкреатическая — 70 с) интересна, но по диагностической ценности сравнима с однофазной СКТ (ранняя панкреатическая — 50 с) (рис. 4, 5, 6).
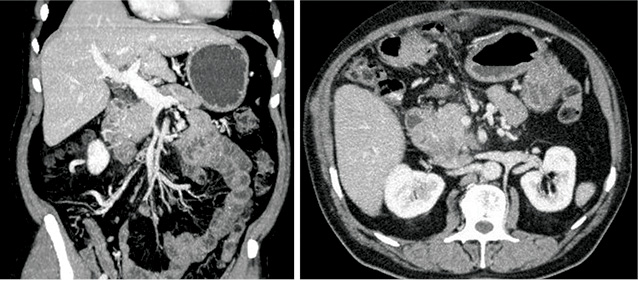
Магнитно-резонансная томография (МРТ)
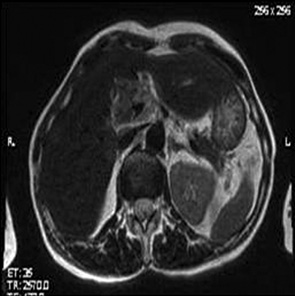
МРТ с холангиопанкреатографией, при условии контрастирования гадолинием либо мангафодипиром, предоставляет больше информации для оценки первичной опухоли и наличия метастазов при сравнении с СКТ [108, 120, 2, 111, 54, 67]. В настоящее время вопрос о том, является ли МРТ (включая МРТ-холангиографию и МРТ-ангиографию) единственным идеальным диагностическим методом, активно дискутируется [111, 138, 79, 75]. МРТ-критерии инвазии в крупные сосуды: окклюзия сосуда с наличием либо отсутствием коллатералей, опухолевая инфильтрация периваскулярной ткани, циркулярный контакт опухоли с сосудом более чем на ½ окружности, деформация сосуда по одной из стенок протяженностью более чем 2 см [120, 79, 22]. В усиленную Т1 фазу МРТ позволяет с точностью около 94% оценить степень сосудистой инвазии [124]. M.G. Romijn и соавторы [111] отмечают, что при использовании мангафодипира диагностика РПЖ производится с точностью 81%, значительно превышая бесконтрастное исследование. В других подобных исследованиях было установлено, что МРТ выявляет сосудистую инвазию с чувствительностью 47–83% и специфичностью более 95% [7, 59], при этом точность прогноза резектабельности составляет 70% [6, 126], нерезектабельности — 23–96% [87, 79, 117]. Современные технологии МРТ позволяют выполнять 3D-реконструкции, визуализировать перипанкреатические сосуды [22, 118, 59, 38, 123, 130]. Ряд исследователей определили оптимальные фазы снятия изображений при оценке РПЖ: 2-фазное исследование на 15 и 45 с после введения контрастного вещества (гадолиния) в абдоминальную аорту [70]. Точность МРТ-оценки сосудистой инвазии сопоставима с СКТ [40, 55]. Следовательно, в настоящее время МРТ может быть рассмотрена как дорогостоящая, длительная диагностическая процедура, которая может быть рекомендована пациентам с противопоказаниями к СКТ (аллергия на йодсодержащие контрастные препараты, почечная недостаточность, беременность) либо с недостаточной информативностью СКТ-данных [122] (рис. 7).
Ангиография
В настоящее время классическая ангиография не является частью диагностического протокола в большинстве современных клиник [134]. Данное исследование не позволяет выявлять и характеризовать первичный очаг [45] и может быть с легкостью заменено другими менее инвазивными методами, которые предоставляют больше информации относительно распространенности РПЖ. С другой стороны, предоперационная ангиография позволяет выявить сосудистые аномалии (анатомические варианты, приобретенные стенозы) и рассчитать возможные маневры хирургического вмешательства (реваскуляризация, переориентировка печеночного кровотока, эмболизация аневризм) [129, 13]. Ангиографические критерии поражения магистральних сосудов: стеноз сосуда либо окклюзия (с наличием либо отсутствием коллатералей) тромбоз сосуда, острый угол венозной стенки, окутывание сосуда опухолью [68, 46, 34, 58]. В 20% случаев ангиографическое исследование пропускает инвазию, так как данная методика предоставляет информацию только о просвете сосуда [46]. Ангиографические данные основываются на оценке изменения расположения сосуда, а также деформации его контура, в то время как в ряде случаев сосудистая инвазия не сопровождается вышеописанными изменениями. В подобных случаях более точным исследованием является внутрисосудистое ультразвукововое исследование, описанное далее. Таким образом, ангиография может выявлять только значительные поражения сосудов [58, 126].
Ангиографическое исследование позволяет оценить степень вовлечения магистральных сосудов с чувствительностью от 21% [3, 127] до 80% [16, 65] и специфичностью от 50% [46] до 83% [16]. Современные методы ангиографии при необходимости позволяют визуализировать портальную вену путем транспеченочного доступа.
Абдоминальное ультразвуковое исследование (УЗИ)
УЗИ — первый шаг на пути обследования пациентов с желтухой либо болью в животе [134]. Современное УЗИ в комбинации с допплер-исследованием при РПЖ позволяет оценить степень поражения магистральных сосудов на приемлемом уровне [134, 139, 24]. При чувствительности от 60% [137] до 90% [20] специфичность метода, по данным ряда авторов, может превышать 90% [146]. При этом точность прогноза резектабельности составляет 90% [146], нерезектабельности — 75% [4, 57]. По последним данным, УЗИ с использованием технологий 3D сосудистой реконструкции обладает высокой точностью в диагностике портальной инвазии (более 93%) [71]. При использовании цветного допплер-УЗИ выделяют следующие критерии инвазии в магистральные сосуды: отсутствие гиперэхогенной ткани между опухолью и стенкой сосуда, предлежание опухоли к стенке сосуда протяженностью более 2 см, циркулярный контакт опухоли с сосудом, циркулярные дефекты в стенке сосуда, окклюзия сосуда либо тромбоз [93, 106].
Следует отметить, что предоперационное УЗИ обнаруживает первичную опухоль с чувствительностью 100% и определяет наличие портальной инвазии со специфичностью и чувствительностью 92% [131]. В 22% случаев у пациентов с РПЖ допплер-УЗИ вносит изменения в терапевтическую стратегию [106].
Эндоскопическое УЗИ (ЭУЗИ)
ЭУЗИ — сравнительно молодая методика, позволяющая выполнять УЗИ через просвет желудочно-кишечного тракта [134, 118]. ЭУЗИ обладает высокой диагностической ценностью при оценке первичной опухоли [43], если принимать во внимание возможность тонкоигольной биопсии во время исследования. Метод показал чувствительность 96,6%, специфичность 99%, точность прогноза нерезектабельности 96,2%, резектабельности — 99,1% [73]. Выделяют следующие ЭУЗИ-критерии поражения магистрального сосуда: потерю гиперэхогенной стенки сосуда, прямую визуализацию опухоли в просвете сосуда, окутывание сосуда опухолью или окклюзию, отсутствие визуализации основного сосуда, наличие коллатералей, расстояние между сосудом и опухолью менее 3 мм, обрывчатый край сосудистой стенки [132, 7, 18, 113, 136, 151]. M. Sugiyma и соавторы [132] сообщают о преимуществе ЭУЗИ над СКТ и МРТ при диагностике поражения портальной вены [63, 19]. W.R. Brugge и соавторы [18] также сообщают о высокой чувствительности ЭУЗИ при диагностике ивазии в портальную и селезеночную вены.
По сравнению с венами степень вовлеченности артерий при помощи ЭУЗИ определить достаточно сложно [19, 112, 148]. По сводным данным, чувствительность метода составляет 50–100% [109, 121], специфичность — 58–100% [92, 102], точность прогноза резектабельности — 28–100% [92, 96], нерезектабельности — 18–93% [89, 94]. Последние данные об использовании 3D ЭУЗИ свидетельствуют о повышении точности определения поражения сосудов [103].
Внутрисосудистое УЗИ (ВУЗИ)
Значительные сложности в диагностике опухолевой инвазии возникают в случаях предлежания опухоли к верхней брыжеечной либо портальной венам. Некоторые исследователи приводят данные о том, что ВУЗИ может четко определить границы между опухолью и сосудистой стенкой [68]. Более того, ВУЗИ позволяет диагностировать портальный тромбоз, который иногда не выявляется при СКТ [68]. ВУЗИ можно проводить как путем транспеченочного доступа, так и путем мезентериальной катетеризации [69, 96, 47]. Выделяют следующие ВУЗИ-критерии степени распространения опухоли на сосуды: облитерацию эхогенного края сосуда гипоэхогенной опухолью, опухоль не дифференцируется от стенки сосуда, опухоль проникает в просвет сосуда [69, 96, 47, 66]. Одним из недостатков ВУЗИ является низкая специфичность метода в случае панкреатита [71, 105]. Кроме того, ВУЗИ обладает низкой проникающей способностью, позволяет производить только локальные исследования. Также слабостью метода является сложность пространственной ориентации, что усложняет трактовку изображения [72, 106]. Существуют всего несколько исследований, посвященных ВУЗИ в диагностике поражения сосудов, в основном они характеризуют степень поражения вен (чувствительность метода составляет 95%, специфичность — 90%, точность прогноза резектабельности — 90%, нерезектабельности — 95%) [96]. T. Kaneko и соавторы [66] были первыми, внедрившими ВУЗИ в стадирование РПЖ; в настоящее время используют 3D ВУЗИ с высокими показателями точности оценки поражения сосудов. E. Tezel и соавторы [135] сообщают, что контакт опухоли со стенкой портальной либо верхней брыжеечной вен протяженностью более чем 18 мм является фактором плохого прогноза. Использование ВУЗИ позволяет также устанавливать стенты [84] в случаях симптоматического лечения портального стеноза.
Судя по результатам исследований, ВУЗИ опережает СКТ и МРТ, однако, только при оценке венозной системы. Учитывая дороговизну и оперативный риск ВУЗИ, A. Nakao [96] рекомендует использование данного метода только в затруднительных случаях: при дифференцировке между компрессией и инвазией сосуда, когда стандартные неинвазивные методы являются малоинформативными.
Лапароскопия, лапароскопичекое УЗИ (ЛУЗИ)
За последние 30 лет [28] лапароскопия зарекомендовала себя как прекрасный малоинвазивный метод визуализации брюшины и печени с целью выявления отдаленных метастазов РПЖ [27, 76]. Для оценки сосудистой ивазии необходимо вскрытие сальниковой сумки, что открывает доступ к зоне дальнейшего исследования [25]. Очевидно, что визуальная оценка без ЛУЗИ не позволяет определить отношение опухоли к сосудам [10]. В настоящее время рутинную лапароскопию не рекомендуют при РПЖ, поражающем головку железы, так как влияние данной процедуры на дальнейшую лечебную тактику невелико (14–19%) [10, 104]. При поражении дистальных отделов поджелудочной железы лапароскопия может предотвратить до 50% эксплоративных операций [10]. Также лапароскопию широко применяют при проведении симптоматических вмешательств [104, 36, 88, 89]. Лапароскопия имеет свои недостатки: визуализация только поверхности печени и брюшной полости без возможности определить вовлечение сосудов, расположенных забрюшинно, значительные сложности процедуры при спаечном процессе [89, 97]. ЛУЗИ значительно расширило возможности лапароскопии лимфатических узлов, что позволяет сегодня проводить оценку паренхимы печени, магистральных сосудов [97, 35, 61, 91, 94, 107]. Инвазию в сосуды можно определять путем ЛУЗИ с точностью 95% при опухолях головки поджелудочной железы [107]. При ЛУЗИ выделяют следующие критерии поражения магистральных сосудов: потерю гиперэхогенности стенки сосуда (визуализация опухоли), облитерацию или тромбоз сосуда, фиксированный стеноз, окружение сосуда опухолью и ригидность сосудистой стенки, наличие опухоли в просвете сосуда [12, 62, 143].
Ряд исследований был посвящен изучению ЛУЗИ с точки зрения возможности прогноза резектабельности; только в некоторых принималась во внимание степень вовлечения магистральных сосудов. Согласно полученным данным, чувствительность метода составляет 50% [143], специфичность — 80% [101], точность в прогнозировании резектабельности — 93% [12], нерезектабельности — 73% [62]. Несмотря на эти результаты, ряд авторов не рекомендуют ориентироваться на ЛУЗИ в сомнительных случаях [49, 83, 115].
Позитронная эмиссионная томография (ПЭТ), а также ПЭТ в комбинации с СКТ
ПЭТ — неинвазивная методика визуализации, которая предоставляет информацию о метаболической активности клеток путем внутривенного введения 18F-фтордиоксиглюкозы (ФДГ), которая преимущественно накапливается в клетках опухоли [5, 29, 64]. ФДГ не метаболизируется, попадая внутрь клетки, что позволяет визуализировать зоны накопления препарата [108]. ПЭТ с высокой точностью диагностирует как небольшие опухоли (<2 см), так и метастазы, в том числе и опухолевую диссеминацию по брюшине [32, 41, 48, 60, 114]. ПЭТ позволяет проводить дифференциальную диагностику между РПЖ и воспалительным процессом [95, 105], а также между злокачественными и доброкачественными опухолями поджелудочной железы (чувствительность — 85–100%, специфичность — 67–99%), значительно опережая результаты СКТ [133, 30, 152]. Недостатками метода является ряд ложнонегативных данных в случае высокодифференцированных опухолей, небольших периампулярных опухолей, а также в случаях гипергликемии [152, 128, 33]. При нормогликемии диагностическая чувствительность ПЭТ составляет 93–98%, однако, при гипергликемии данный показатель снижается до 63% и менее (точность прогноза нерезектабельности снижается с 96% до 38%) [152, 128]. ПЭТ показала неудовлетворительные результаты при оценке распространения опухоли на регионарные лимфатические узлы [29, 32], данный метод не позволяет визуализировать сосуды, соответственно, определить степень инвазии [90]. Таким образом, ассоциация ПЭТ с СКТ (ПСКТ) предполагает повышение результативности обоих исследований [53]. S. Heinrich и соавторы [48] применили ПСКТ в дифференциальной диагностике злокачественных и доброкачественных опухолей, при этом точность прогноза резектабельности составила 91%, нерезектабельности — 64%. Чувствительность метода при выявлении РПЖ составила 93%, специфичность ПСКТ оказалась больше, чем СКТ (69% против 21% соответственно, р=0,07). Несмотря на полученные результаты, исследование показало низкую точность при оценке сосудистой инвазии. Возможно, использование ПСКТ по протоколу КТ-ангиографии позволит более качественно проводить визуализацию сосудов.
Заключение
При отсутствии отдаленных метастазов оценка степени вовлечения в опухолевый процесс магистральных сосудов — ключевой аспект в определении резектабельности РПЖ. Неверная оценка степени поражения сосудистых структур — наиболее частая ошибка на дооперацинном этапе. Очевидный факт, что ревизия при хирургическом вмешательстве и срочное гистологическое исследование на сегодня являются самыми точными методами определения истинной сосудистой инвазии. Однако совершенствование методов лучевой диагностики в настоящее время позволяет в большинстве случаев с высокой достоверностью определить распространение опухоли на крупные сосуды до операции. СКТ пока остается наилучшим средством дооперационной диагностики при РПЖ, дальнейшее совершенствование ПЭТ, возможно, позволит улучшить методику СКТ. Вопрос относительно преимуществ МРТ над СКТ остается открытым, ЭУЗИ является высокоинформативной методикой, однако, в значительной степени зависящей от специалиста. Таким образом, определение сосудистой инвазии остается одним из важнейших вопросов в хирургии поджелудочной железы.
Литература
1. Федоренко З.П., Гулак Л.О., Горох Є.Л. (2011) Рак в Україні 2009–2010 . Бюлетень національного канцер- реєстру України, №12.
2. Adamek H.E., Albert J., Breer H. et al. (2000) Pancreatic cancer detection with magnetic resonance cholangiopancreatography and endoscopic retrograde cholangiopancreatography: a prospective controlled study. Lancet, 356: 190–193.
3. Ahmad N.A., Kochman M.L., Lewis J.D. et al. (2001) Endosonography is superior to angiography in the preoperative assessment of vascular involvement among patients with pancreatic carcinoma. J Clin Gastroenterol.,32: 54–58.
4. Angeli E., Venturini M., Vanzulli A. et al. (1997) Color Doppler imaging in the assessment of vascular involvement by pancreatic carcinoma. AJR Am J Roentgenol., 168: 193–197.
5. Annovazzi A., Peeters M., Maenhout A. et al. (2003) 18-fluorodeoxyglucose positron emission tomography in nonendocrine neoplastic disorders of the gastrointestinal tract. Gastroenterology, 125: 1235–1245.
6. Arslan A., Buanes T., Geitung J.T. (2001) Pancreatic carcinoma: MR, MR angiography and dynamic helical CT in the evaluation of vascular invasion. Eur J Radiol., 38: 151–159.
7. Aslanian H., Salem R., Lee J. et al. (2005) EUS diagnosis of vascular invasion in pancreatic cancer: surgical and histologic correlates. Am J Gastroenterol., 100: 1381–1385.
8. Baek S.Y., Sheafor D.H., Keogan M.T. et al. (2001) Two-dimensional multiplanar and three-dimensional volume-rendered vascular CT in pancreatic carcinoma: interobserver agreement and comparison with standard helical techniques. AJR Am J Roentgenol., 176: 1467–1473.
9. Balci N.C., Semelka R.C. (2001) Radiologic diagnosis and staging of pancreatic ductal adenocarcinoma. Eur J Radiol., 38: 105–112.
10. Barreiro C.J., Lillemoe K.D., Koniaris L.G. et al. (2002) Diagnostic laparoscopy for periampullary and pancreatic cancer: what is the true benefit? J Gastrointest Surg., 6: 75–81.
11. Beger H.G., Rau B., Gansauge F. et al. (2003) Treatment of pancreatic cancer: challenge of the facts. World J Surg., 27: 1075–1084.
12. Bemelman W.A., de Wit L.T., van Delden O.M. et al. (1995) Diagnostic laparoscopy combined with laparoscopic ultrasonography in staging of cancer of the pancreatic head region. Br J Surg., 82: 820–824.
13. Biehl T.R., Traverso L.W., Hauptmann E. et al. (1993) Preoperative visceral angiography alters intraoperative strategy during the Whipple procedure. Am J Surg., 165: 607–612.
14. Bipat S., Phoa S.S., van Delden O.M. et al. (2005) Ultrasonography, computed tomography and magnetic resonance imaging for diagnosis and determining resectability of pancreatic adenocarcinoma: a meta-analysis. J Comput Assist Tomogr., 29: 438–445.
15. Bold R.J., Charnsangavej C., Cleary K.R. et al. (1999) Major vascular resection as part of pancreaticoduodenectomy for cancer: radiologic, intraoperative, and pathologic analysis. J Gastrointest Surg., 3: 233–243.
16. Böttger T.C., Boddin J., Düber C. et al. (1998) Diagnosing and staging of pancreatic carcinoma-what is necessary? Oncology, 55: 122–129.
17. Brügel M., Rummeny E.J., Dobritz M. (2004) Vascular invasion in pancreatic cancer: value of multislice helical CT. Abdom Imaging, 29: 239–245.
18. Brugge W.R., Lee M.J., Kelsey P.B. et al. (1996) The use of EUS to diagnose malignant portal venous system invasion by pancreatic cancer. Gastrointest Endosc., 43: 561–567.
19. Buchs N.C., Frossard J.L., Rosset A. et al. (2007) Vascular invasion in pancreatic cancer: evaluation of endoscopic ultrasonography, computed tomography, ultrasonography, and angiography. Swiss Med Wkly., V. 137: 286–291.
20. Casadei R., Ghigi G., Gullo L. et al. (1998) Role of color Doppler ultrasonography in the preoperative staging of pancreatic cancer. Pancreas., 16: 26–30.
21. Catalano C., Laghi A., Fraioli F. et al. (2003) Pancreatic carcinoma: the role of high-resolution multislice spiral CT in the diagnosis and assessment of resectability. Eur Radiol., 13: 149–156.
22. Catalano C., Pavone P., Laghi A. et al. (1998) Pancreatic adenocarcinoma: combination of MR imaging, MR angiography and MR cholangiopancreatography for the diagnosis and assessment of resectability. Eur Radiol., 8: 428–434.
23. Chong M., Freeny P.C., Schmiedl U.P. (1998) Pancreatic arterial anatomy: depiction with dual-phase helical CT. Radiology, 208: 537–542.
24. Clarke D.L., Thomson S.R., Madiba T.E., et al. Preoperative imaging of pancreatic cancer: a management-oriented approach // J Am Coll Surg. 2003. 196: 119–129.
25. Conlon K.C., Dougherty E., Klimstra D.S., et al. The value of minimal access surgery in the staging of patients with potentially resectable peripancreatic malignancy // Ann Surg. 1996. 223: 134–140.
26. Cunningham J.D., Glajchen N., Brower S.T. (1996) The use of spiral computed tomography in the evaluation of vessel encasement for pancreatic cancer. Int J Pancreatol., 19: 9–14.
27. Cuschieri A. (1988) Laparoscopy for pancreatic cancer: does it benefit the patient? Eur J Surg Oncol., 14: 41–44.
28. Cuschieri A., Hall A.W., Clark J. (1978) Value of laparoscopy in the diagnosis and management of pancreatic carcinoma. Gut., 19: 672–677.
29. Delbeke D., Pinson C.W. (2004) Pancreatic tumors: role of imaging in the diagnosis, staging, and treatment. J Hepatobiliary Pancreat Surg., 11: 4–10.
30. Delbeke D., Rose D.M., Chapman W.C. et al. (1999) Optimal interpretation of FDG PET in the diagnosis, staging and management of pancreatic carcinoma. J Nucl Med., 40: 1784–1791.
31. DeWitt J., Devereaux B., Chriswell M. et al. (2004) Comparison of endoscopic ultrasonography and multidetector computed tomography for detecting and staging pancreatic cancer. Ann Intern Med., 141: 753–763.
32. Diederichs C.G., Staib L., Vogel J. et al. (2000) Values and limitations of 18F-fluorodeoxyglucose-positron-emission tomography with preoperative evaluation of patients with pancreatic masses. Pancreas., 20: 109–116.
33. Diederichs C.G., Staib L., Glatting G. et al. (1998) FDG PET: elevated plasma glucose reduces both uptake and detection rate of pancreatic malignancies. J Nucl Med., 39: 1030–1033.
34. Dooley W.C., Cameron J.L., Pitt H.A. et al.(1990) Is preoperative angiography useful in patients with periampullary tumors? Ann Surg., 211: 649–654.
35. Doran H.E., Bosonnet L., Connor S. et al. (2004)Laparoscopy and laparoscopic ultrasound in the evaluation of pancreatic and periampullary tumours. Dig Surg., 21: 305–313.
36. Edwin B., Mala T., Mathisen O. et al. (2004) Laparoscopic resection of the pancreas: a feasibility study of the short-term outcome. Surg Endosc., 18: 407–411.
37. Fishman E.K., Horton K.M. (2001) Imaging pancreatic cancer: the role of multidetector CT with three-dimensional CT angiography. Pancreatology, 1: 610–624.
38. Fishman E.K., Horton K.M., Urban B.A. (2000) Multidetector CT angiography in the evaluation of pancreatic carcinoma: preliminary observations. J Comput Assist Tomogr., 24: 849–853.
39. Fritscher-Ravens A., Knoefel W.T., Krause C. et al. (2005) Three-dimensional linear endoscopic ultrasound-feasibility of a novel technique applied for the detection of vessel involvement of pancreatic masses. Am J Gastroenterol., 100: 1296–1302.
40. Gabata T., Matsui O., Kadoya M. et al. (1994) Small pancreatic adenocarcinomas: efficacy of MR imaging with fat suppression and gadolinium enhancement. Radiology, 193: 683–688.
41. Goh B.K., Tan Y.M., Chung Y.F. (2005) Utility of fusion CT-PET in the diagnosis of small pancreatic carcinoma. World J Gastroenterol., 11: 3800–3802.
42. Graf O., Boland G.W., Warshaw A.L. et al. (1997) Arterial versus portal venous helical CT for revealing pancreatic adenocarcinoma: conspicuity of tumor and critical vascular anatomy. AJR Am J Roentgenol., 169: 119–123.
43. Gress F.G., Hawes R.H., Savides T.J. et al. (1999) Role of EUS in the preoperative staging of pancreatic cancer: a large single-center experience. Gastrointest Endosc., 50: 786–791.
44. Gritzmann N., Macheiner P., Hollerweger A. et al. (2004) CT in the differentiation of pancreatic neoplasms–progress report. Dig Dis., 22: 6–17.
45. Guidelines for the management of patients with pancreatic cancer periampullary and ampullary carcinomas. Gut., 2005, 5(54): 1–16. Hannesson P.H., Lundstedt C., Dawiskiba S. et al. (2002) Transhepatic intravascular ultrasound for evaluation of portal venous involvement in patients with cancer of the pancreatic head region. Eur Radiol., 12: 1150–1154.
46. Hannesson P.H., Stridbeck H., Lundstedt C. et al. (1997) Intravascular ultrasound for evaluation of portal venous involvement in pancreatic cancer. Eur Radiol.,7: 21–25.
47. Heinrich S., Goerres G.W., Schäfer M. et al. (2005) Positron emission tomography/computed tomography influences on the management of resectable pancreatic cancer and its cost-effectiveness. Ann Surg., 242: 235–243.
48. Holzman M.D., Reintgen K.L., Tyler D.S. et al. (1997) The role of laparoscopy in the management of suspected pancreatic and periampullary malignancies. J Gastrointest Surg., 1: 236–243.
49. Horton K.M., Fishman E.K. Multidetector C.T. (2002) Angiography of pancreatic carcinoma: part 2, evaluation of venous involvement. AJR Am J Roentgenol., 178: 833–836.
50. Horton K.M., Fishman E.K. (2002) Volume-rendered 3D CT of the mesenteric vasculature: normal anatomy, anatomic variants, and pathologic conditions. Radiographics, 22: 161–172.
51. Horton K.M., Fishman E.K.. Multidetector C.T. (2002) Angiography of pancreatic carcinoma: part I, evaluation of arterial involvement. AJR Am J Roentgenol., 178: 827–831.
52. Hosten N., Lemke A.J., Wiedenmann B. et al. (2000) Combined imaging techniques for pancreatic cancer. Lancet., 356: 909–910.
53. Hough T.J., Raptopoulos V., Siewert B. et al. (1999) Teardrop superior mesenteric vein: CT sign for unresectable carcinoma of the pancreas. AJR Am J Roentgenol., 173: 1509–1512.
54. Ichikawa T., Haradome H., Hachiya J. et al. (1997) Pancreatic ductal adenocarcinoma: preoperative assessment with helical CT versus dynamic MR imaging. Radiology, 202: 655–662.
55. Imbriaco M., Megibow A.J., Camera L. et al. (2002) Dual-phase versus single-phase helical CT to detect and assess resectability of pancreatic carcinoma. AJR Am J Roentgenol., 178: 1473–1479.
56. Ishida H., Konno K., Hamashima Y. et al. (1999) Assessment of resectability of pancreatic carcinoma by color Doppler sonography. Abdom Imaging, 24: 295–298.
57. Ishikawa O., Ohigashi H., Imaoka S. et al. (1992)Preoperative indications for extended pancreatectomy for locally advanced pancreas cancer involving the portal vein. Ann Surg., 215: 231–236.
58. Ito K., Blasbalg R., Hussain S.M. et al. (2000) Portal vein and its tributaries: evaluation with thin-section three-dimensional contrast-enhanced dynamic fat-suppressed MR imaging. Radiology, V. 215: 381–386.
59. Jadvar H., Fischman A.J. (2001) Evaluation of pancreatic carcinoma with FDG PET. Abdom Imaging, 26: 254–259.
60. John T.G., Greig J.D., Carter D.C. et al. (1995) Carcinoma of the pancreatic head and periampullary region. Tumor staging with laparoscopy and laparoscopic ultrasonography. Ann Surg., 221: 156–164.
61. John T.G., Wright A., Allan P.L. et al. (1999) Laparoscopy with laparoscopic ultrasonography in the TNM staging of pancreatic carcinoma. World J Surg., 23: 870–881.
62. Kahl S., Glasbrenner B., Zimmermann S., Malfertheiner P. (2002) Endoscopic ultrasound in pancreatic diseases. Dig Dis., 20: 120–126.
63. Kalra M.K., Maher M.M., Boland G.W. et al. (2003) Correlation of positron emission tomography and CT in evaluating pancreatic tumors: technical and clinical implications. AJR Am J Roentgenol., 181: 387–393.
64. Kaneko T., Nakao A., Inoue S. et al. (1994) Portal venous invasion by pancreatobiliary carcinoma: diagnosis with intraportal endovascular US. Radiology, 192: 681–686.
65. Kaneko T., Inoue S., Sugimoto H. et al. (2001) Intraoperative diagnosis of pancreatic cancer extension using IVUS . Hepatogastroenterology, 48: 944–948.
66. Kaneko T., Nakao A., Harada A. et al. (1994) Intraportal endovascular ultrasonography in pancreatic cancer — a new technique for the diagnosis of portal vein invasion: a preliminary report. Surgery, 115: 438–444.
67. Kaneko T., Nakao A., Inoue S. et al. (1995) Intraportal endovascular ultrasonography in the diagnosis of portal vein invasion by pancreatobiliary carcinoma. Ann Surg., 222: 711–718.
68. Kaneko T., Nakao A., Takagi H. (1998) Intraportal endovascular ultrasonography for pancreatic cancer. Semin Surg Oncol., 15: 47–51.
69. Kanematsu M., Shiratori Y., Hoshi H. et al. (2000)Pancreas and peripancreatic vessels: effect of imaging delay on gadolinium enhancement at dynamic gradient-recalled-echo MR imaging. Radiology, 215: 95–102.
70. Kobayash I.A., Yamaguchi T., Ishihara T. et al. (2005) Assessment of portal vein invasion in pancreatic cancer by fusion 3-dimensional ultrasonography. J Ultrasound Med., 24: 363–369.
71. Kopka L., Rogalla P., Hamm B. (2002) Multislice CT of the abdomen — current indications and future trends. Rofo., 174: 273–282.
72. Krishna N.B., LaBundy J.L., Saripalli S. et al. (2009) Diagnostic value of EUS-FNA in patients suspected of having pancreatic cancer with a focal lesion on CT scan/MRI but without obstructive jaundice. Pancreas., 38: 625–630.
73. Lemke A.J., Niehues S.M., Hosten N. et al. (2004) Retrospective digital image fusion of multidetector CT and 18F-FDG PET: clinical value in pancreatic lesions–a prospective study with 104 patients. J Nucl Med., 45: 1279–1286.
74. Lepanto L., Arzoumanian Y., Gianfelice D. et al. (2002) Helical CT with CT angiography in assessing periampullary neoplasms: identification of vascular invasion. Radiology, 222: 347–352.
75. Li D., Xie K., Wolff R., Abbruzzese J.L. (2004) Pancreatic cancer. Lancet, 363: 1049–1057.
76. Li H., Zeng M.S., Zhou K.R. et al. (2006) Pancreatic adenocarcinoma: signs of vascular invasion determined by multi-detector row CT. Br J Radiol., 79: 880–887.
77. Li H., Zeng M.S., Zhou K.R. et al. (2005) Pancreatic adenocarcinoma: the different CT criteria for peripancreatic major arterial and venous invasion. J Comput Assist Tomogr., 29: 170–175.
78. Lopez Hänninen E., Amthauer H., Hosten N. et al. (2002) Prospective evaluation of pancreatic tumors: accuracy of MR imaging with MR cholangiopancreatography and MR angiography. Radiology, 224: 34–41.
79. Loyer E.M., David C.L., Dubrow R.A. et al. (1996) Vascular involvement in pancreatic adenocarcinoma: reassessment by thin-section CT. Abdom Imaging, 21: 202–206.
80. Lu D.S., Reber H.A., Krasny R.M. et al. (1997) Local staging of pancreatic cancer: criteria for unresectability of major vessels as revealed by pancreatic-phase, thin-section helical CT. AJR Am J Roentgenol., 168: 1439–1443.
81. Lu D.S., Vedantham S., Krasny R.M. et al. (1996) Two-phase helical CT for pancreatic tumors: pancreatic versus hepatic phase enhancement of tumor, pancreas, and vascular structures. Radiology, 199: 697–701.
82. Maire F., Sauvanet A., Trivin F. et al. (2004) Staging of pancreatic head adenocarcinoma with spiral CT and endoscopic ultrasonography: an indirect evaluation of the usefulness of laparoscopy. Pancreatology, 4: 436–440.
83. Manninen H.I., Räsänen H. (2000) Intravascular ultrasound in interventional radiology. Eur Radiol., 10: 1754–1762.
84. McCarthy M.J., Evans J., Sagar G. et al. (1998) Prediction of resectability of pancreatic malignancy by computed tomography. Br J Surg., 85: 320–325.
85. McNulty N.J., Francis I.R., Platt J.F. et al. (2001) Multi-detector row helical CT of the pancreas: effect of contrast-enhanced multiphasic imaging on enhancement of the pancreas, peripancreatic vasculature, and pancreatic adenocarcinoma. Radiology, 220: 97–102.
86. Megibow A.J., Zhou X.H., Rotterdam H. et al. (1995) Pancreatic adenocarcinoma: CT versus MR imaging in the evaluation of resectability–report of the Radiology Diagnostic Oncology Group. Radiology, 195: 327–332.
87. Menack M.J., Spitz J.D., Arregui M.E. (2001) Staging of pancreatic and ampullary cancers for resectability using laparoscopy with laparoscopic ultrasound. Surg Endosc., 15: 1129–1134.
88. Merchant N.B., Conlon K.C. (1998) Laparoscopic evaluation in pancreatic cancer. Semin Surg Oncol. 15: 155–165.
89. Mertz H.R., Sechopoulos P., Delbeke D. et al. (2000) EUS, PET, and CT scanning for evaluation of pancreatic adenocarcinoma. Gastrointest Endosc., 52: 367–371.
90. Minnard E.A., Conlon K.C., Hoos A. et al. (1998)Laparoscopic ultrasound enhances standard laparoscopy in the staging of pancreatic cancer. Ann Surg., 228: 182–187.
91. Minniti S., Bruno C., Biasiutti C. et al. (2003) Sonography versus helical CT in identification and staging of pancreatic ductal adenocarcinoma. J Clin Ultrasound., 31: 175–182.
92. Morrin M.M., Kruskal J.B., Raptopoulos V. et al. (2001) State-of-the-art ultrasonography is as accurate as helical computed tomography and computed tomographic angiography for detecting unresectable periampullary cancer. J Ultrasound Med., 20: 481–490.
93. Murugiah M., Paterson-Brown S., Windsor J.A. et al. (1993) Early experience of laparoscopic ultrasonography in the management of pancreatic carcinoma. Surg Endosc., 7: 177–181.
94. Nakamoto Y., Higashi T., Sakahara H. et al. (2000) Delayed (18)F-fluoro-2-deoxy-D-glucose positron emission tomography scan for differentiation between malignant and benign lesions in the pancreas. Cancer, 89: 2547–2554.
95. Nakao A., Kaneko T. (1999) Intravascular ultrasonography for assessment of portal vein invasion by pancreatic carcinoma. World J Surg., 23: 892–895.
96. Nieveen van Dijkum E.J., Romijn M.G., Terwee C.B. et al. (2003) Laparoscopic staging and subsequent palliation in patients with peripancreatic carcinoma. Ann Surg., 237: 66–73.
97. Nino-Murcia M., Tamm E.P., Charnsangavej C. et al. (2003) Multidetector-row helical CT and advanced postprocessing techniques for the evaluation of pancreatic neoplasms. Abdom Imaging., 28: 366–377.
98. Phoa S.S., Reeders J.W., Stoker J., et al. (2000) CT criteria for venous invasion in patients with pancreatic head carcinoma. Br J Radiol., 73: 1159–1164.
99. Phoa S.S., Tilleman E.H., van Delden O.M. et al. (2005) Value of CT criteria in predicting survival in patients with potentially resectable pancreatic head carcinoma. J Surg Oncol., 91: 33–40.
100. Pietrabissa A., Caramella D., Di Candio G. et al. (1999) Laparoscopy and laparoscopic ultrasonography for staging pancreatic cancer: critical appraisal. World J Surg., 23: 998–1002.
101. Pisters P.W., Lee J.E., Vauthey J.N. et al. (2001) Laparoscopy in the staging of pancreatic cancer. Br J Surg., 88: 325–337.
102. Poen J.C., Ford J.M., Niederhuber J.E. (1999)Chemoradiotherapy in the management of localized tumors of the pancreas. Ann Surg Oncol., V. 6: 117–122.
103. Potter M.W., Shah S.A., McEnaney P., Chari R.S., Callery M.P. (2000) A critical appraisal of laparoscopic staging in hepatobiliary and pancreatic malignancy. Surg Oncol., 9: 103–110.
104. Rajput A., Stellato T.A., Faulhaber P.F. et al. (1998) The role of fluorodeoxyglucose and positron emission tomography in the evaluation of pancreatic disease. Surgery, 124: 793–797.
105. Ralls P.W., Wren S.M., Radin R. et al. (1997) Color flow sonography in evaluating the resectability of periampullary and pancreatic tumors. J Ultrasound Med., 16: 131–140.
106. Rau B., Hünerbein M., Schlag P.M. (2002) Is there additional information from laparoscopic ultrasound in tumor staging? Dig Surg., 19: 479–483.
107. Riker A., Libutti S.K., Bartlett D.L. (1997) Advances in the early detection, diagnosis, and staging of pancreatic cancer. Surg Oncol., 6: 157–169.
108. Rivadeneira D.E., Pochapin M., Grobmyer S.R.,et al. (2003) Comparison of linear array endoscopic ultrasound and helical computed tomography for the staging of periampullary malignancies. Ann Surg Oncol., 10: 890–897.
109. Roder J.D., Stein H.J., Siewert J.R. (1996) Carcinoma of the periampullary region: who benefits from portal vein resection? Am J Surg., 171: 170–174.
110. Romijn M.G., Stoker J., van Eijck C.H. et al. (2000) MRI with mangafodipir trisodium in the detection and staging of pancreatic cancer. J Magn Reson Imaging, 12: 261–268.
111. Rösch T., Braig C., Gain T. et al. (1992) XStaging of pancreatic and ampullary carcinoma by endoscopic ultrasonography. Comparison with conventional sonography, computed tomography, and angiography. Gastroenterology, 102: 188–199.
112. Rösch T., Dittler H.J., Strobel K. et al. (2000) Endoscopic ultrasound criteria for vascular invasion in the staging of cancer of the head of the pancreas: a blind reevaluation of videotapes. Gastrointest Endosc. 52: 469–477.
113. Rose D.M., Delbeke D., Beauchamp R.D. et al. (1999) 18Fluorodeoxyglucose-positron emission tomography in the management of patients with suspected pancreatic cancer.Ann Surg., 229: 729–737.
114. Rumstadt B., Schwab M., Schuster K. et al. (1997) The role of laparoscopy in the preoperative staging of pancreatic carcinoma. J Gastrointest Surg.,1: 245–250.
115. Saisho H., Yamaguchi T. (2004) Diagnostic imaging for pancreatic cancer: computed tomography, magnetic resonance imaging, and positron emission tomography. Pancreas., 28: 273–278.
116. Saldinger P.F., Reilly M., Reynolds K. et al. (2000) Is CT angiography sufficient for prediction of resectability of periampullary neoplasms? J Gastrointest Surg., 4: 233–237.
117. Sarmiento J.M., Sarr M.G. (2003) Staging strategies for pancreatic adenocarcinoma: what the surgeon really wants to know. Curr Gastroenterol Rep., 5: 117–124.
118. Scaglione M., Pinto A., Romano S. et al. (2005) Using multidetector row computed tomography to diagnose and stage pancreatic carcinoma: the problems and the possibilities. JOP., 6: 1–5.
119. Schima W., Függer R., Schober E. et al. (2002) Diagnosis and staging of pancreatic cancer: comparison of mangafodipir trisodium-enhanced MR imaging and contrast-enhanced helical hydro-CT. AJR Am J Roentgenol., 179: 717–724.
120. Schwarz M., Pauls S., Sokiranski R. et al. (2001) Is a preoperative multidiagnostic approach to predict surgical resectability of periampullary tumors still effective? Am J Surg., 182: 243–249.
121. Semelka R.C., Kelekis N.L., Molina P.L. et al. (1996) Pancreatic masses with inconclusive findings on spiral CT: is there a role for MRI? J Magn Reson Imaging., 6: 585–588.
122. Sendler A., Avril N., Helmberger H. et al. (2000) Preoperative evaluation of pancreatic masses with positron emission tomography using 18F-fluorodeoxyglucose: diagnostic limitations. World J Surg., 24: 1121–1129.
123. Sironi S., De Cobelli F., Zerbi A. et al. (1996) Pancreatic adenocarcinoma: assessment of vascular invasion with high-field MR imaging and a phased-array coil. AJR Am J Roentgenol., 167: 997–1001.
124. Snady H., Bruckner H., Siegel J. et al. (1994) Endoscopic ultrasonographic criteria of vascular invasion by potentially resectable pancreatic tumors. Gastrointest Endosc., 40: 326–333.
125. Snady H., Cooperman A., Siegel J. (1992) Endoscopic ultrasonography compared with computed tomography with ERCP in patients with obstructive jaundice or small peri-pancreatic mass. Gastrointest Endosc., 38: 27–34.
126. Soriano A., Castells A., Ayuso C. et al. (2004) Preoperative staging and tumor resectability assessment of pancreatic cancer: prospective study comparing endoscopic ultrasonography, helical computed tomography, magnetic resonance imaging, and angiography // Am J Gastroenterol., 99: 492–501.
127. Sperti C., Pasquali C., Decet G., et al. (2005) F-18-fluorodeoxyglucose positron emission tomography in differentiating malignant from benign pancreatic cysts: a prospective study. J Gastrointest Surg., 9: 22–82.
128. Squillaci E., Fanucci E., Sciuto F. et al. (2003) Vascular involvement in pancreatic neoplasm: a comparison between spiral CT and DSA. Dig Dis Sci., 48: 449–458.
129. Stein M., Schneider P.D., Ho H.S. et al. (2002) Percutaneous transhepatic portography with intravascular ultrasonography for evaluation of venous involvement of hepatobiliary and pancreatic tumors. J Vasc Interv Radiol., 13: 805–814.
130. Sugiyama M., Hagi H., Atomi Y. (1999) Reappraisal of intraoperative ultrasonography for pancreatobiliary carcinomas: assessment of malignant portal venous invasion. Surgery, 125: 160–165.
131. Sugiyama M., Hagi H., Atomi Y. et al. (1997) Diagnosis of portal venous invasion by pancreatobiliary carcinoma: value of endoscopic ultrasonography. Abdom Imaging., 22: 434–438.
132. Syrota A., Duquesnoy N., Paraf A. et al. (1982) The role of positron emission tomography in the detection of pancreatic disease. Radiology, 143: 249–253.
133. Takhar A.S., Palaniappan P., Dhingsa R. et al. (2004) Recent developments in diagnosis of pancreatic cancer. BMJ, 329: 668–673.
134. Tezel E., Kaneko T., Takeda S. et al. (2005) Intraportal endovascular ultrasound for portal vein resection in pancreatic carcinoma. Hepatogastroenterology, 52: 237–242.
135. Tierney W.M., Francis I.R., Eckhauser F. et al. (2001) The accuracy of EUS and helical CT in the assessment of vascular invasion by peripapillary malignancy. Gastrointest Endosc., 53: 182–188.
136. Tomiyama T., Ueno N., Tano S. et al. (1996) Assessment of arterial invasion in pancreatic cancer using color Doppler ultrasonography. Am J Gastroenterol., 91: 1410–1416.
137. Trede M., Rumstadt B., Wendl K. et al. (1997) Ultrafast magnetic resonance imaging improves the staging of pancreatic tumors. Ann Surg., 226: 393–405.
138. Ueno N., Tomiyama T., Tano S. et al. (1997) Color Doppler ultrasonography in the diagnosis of portal vein invasion in patients with pancreatic cancer. J Ultrasound Med., 16: 825–830.
139. Valls C., Andía E., Sanchez A. et al. (2002) Dual-phase helical CT of pancreatic adenocarcinoma: assessment of resectability before surgery. AJR Am J Roentgenol., 178: 821–826.
140. Vargas R., Nino-Murcia M., Trueblood W. et al. (2004) MDCT in Pancreatic adenocarcinoma: prediction of vascular invasion and resectability using a multiphasic technique with curved planar reformations. AJR Am J Roentgenol., 182: 419–425.
141. Vedantham S., Lu D.S., Reber H.A. et al. (1998) Small peripancreatic veins: improved assessment in pancreatic cancer patients using thin-section pancreatic phase helical CT. AJR Am J Roentgenol., 170: 377–383.
142. Vollmer C.M., Drebin J.A., Middleton W.D. et al. (2002) Tility of staging laparoscopy in subsets of peripancreatic and biliary malignancies. Ann Surg.,235: 1–7.
143. Wagner M., Redaelli C., Lietz M. et al. (2004) Curative resection is the single most important factor determining outcome in patients with pancreatic adenocarcinoma. Br J Surg., 91: 586–594.
144. Warshaw A.L., Fernández-del Castillo C. (1992) Pancreatic carcinoma. N Engl J Med., 326: 455–465.
145. Wren S.M., Ralls P.W., Stain S.C. et al. (1996)Assessment of resectability of pancreatic head and periampullary tumors by color flow Doppler sonography. Arch Surg., 131: 812–817.
146. Yamada Y., Mori H., Kiyosue H. et al. (2000) CT assessment of the inferior peripancreatic veins: clinical significance. AJR Am J Roentgenol., 174: 677–684.
147. Yasuda K., Mukai H., Nakajima M. et al. (1993) Staging of pancreatic carcinoma by endoscopic ultrasonography. Endoscopy, 25: 151–155.
148. Yeo C.J., Cameron J.L., Sohn T.A. et al. (1997) Six hundred fifty consecutive pancreaticoduodenectomies in the 1990s: pathology, complications, and outcomes. Ann Surg., 226: 248–257.
149. Yoshimi F., Hasegawa H., Koizumi S. et al. (1995) Application of three-dimensional spiral computed tomographic angiography to pancreatoduodenectomy for cancer. Br J Surg., 82: 116–117.
150. Yusoff I.F., Mendelson R.M., Edmunds S.E. et al. (2003) Preoperative assessment of pancreatic malignancy using endoscopic ultrasound. Abdom Imaging, 28: 556–562.
151. Zimny M., Bares R., Fass J., et al. (1997) Fluorine-18 fluorodeoxyglucose positron emission tomography in the differential diagnosis of pancreatic carcinoma: a report of 106 cases. Eur J Nucl Med., 24: 678–682.














Leave a comment