Порівняння виживаності хворих на неходжкінські дифузні В-великоклітинні лімфоми з клітин гермінального та негермінального центру, що визначені за імуногістохімічними алгоритмами Hans, Colomo і Muris. Досвід Національного інституту раку
Крячок І.А., Мартинчик А.В., Філоненко К.С., Грабовий О.М., Антонюк С.О., Титоренко І.Б., Алексик О.М., Степанішина Я.А.
Резюме. Досвід Національного інституту ракуДифузна В-великоклітинна лімфома (ДВКЛ) є клінічно, морфологічно та генетично гетерогенною групою захворювань. У зв’язку з тим, що ця гетерогенність має суттєвий вплив на клінічний перебіг та відповідь на терапію, залишається актуальним питання про універсальний метод для визначення прогнозу. З появою нових сучасних методів дослідження відбувається постійне удосконалення субкласифікації для виокремлення прогностично важливих груп пацієнтів. У статті наведено імуногістохімічні алгоритми Hans, Colomo і Muris для визначення підтипів ДВКЛ. Також проведено оцінку виживаності підгруп хворих на ДВКЛ за кожним із цих алгоритмів. Окремо проаналізовано виживаність пацієнтів групи низького та високого ризику (за міжнародним прогностичним індексом) за кожним з імуногістохімічних алгоритмів. Встановлено, що алгоритм Hans демонструє найбільшу прогностичну цінність для виокремлення хворих з гіршою виживаністю навіть для пацієнтів групи низького ризику за міжнародним прогностичним індексом.
Вступ
Дифузна В-великоклітинна лімфома (ДВКЛ) є найпоширенішим підваріантом неходжкінських лімфом і становить близько 30–40% усіх вперше діагностованих випадків неходжкінських лімфом [1].
ДВКЛ є клінічно, морфологічно та генетично гетерогенною групою захворювань. У зв’язку з тим, що ця гетерогенність має суттєвий вплив на клінічний перебіг та відповідь на терапію, залишається актуальним питання про універсальний метод для визначення прогнозу та оптимізації терапії. З появою нових сучасних методів дослідження відбувається постійне удосконалення субкласифікації для виявлення прогностично важливих груп пацієнтів.
A.A. Alizadeh та співавтори вперше ідентифікували нові молекулярні підтипи ДВКЛ [3]. Дослідники проаналізували зразки пухлини 42 хворих на ДВКЛ, що отримували антрациклінвмісну хіміотерапію. На основі визначення профілю експресії генів виділено два молекулярні підтипи ДВКЛ із різними ознаками експресії генів, що свідчили про різні етапи диференціювання пухлинних клітин. Екпресія генів одного підтипу була характерна для клітин гермінального центру (ДВКЛ з клітин гермінального центру), а експресія генів другого підтипу в нормі може бути викликана активацією В-лімфоцитів периферичної крові in vitro (ДВКЛ з клітин негермінального центру). П’ятирічна загальна виживаність для першої групи пацієнтів становила 76% і тільки 16% — для другого підтипу [2].
Висока вартість обладнання, необхідність проводити дослідження на свіжозамороженому матеріалі та складність методики визначення профілю експресії генів обмежують застосування цього методу у рутинній клінічній практиці для визначення прогнозу захворювання. Тому продовжується пошук імуногістохімічних алгоритмів для розподілення ДВКЛ на молекулярні підтипи.
Першим і найбільш розповсюдженим є алгоритм Christine P. Hans. Згідно з ним розподіл на молекулярні підтипи виконано на основі експресії таких маркерів, як CD10, bcl-6 та MUM1. Випадки були віднесені до групи ДВКЛ з клітин гермінального центру (GCB) за умови позитивної експресії CD10 або CD10 та bcl-6. При негативній експресії CD10 та bcl-6 випадок належав до групи ДВКЛ із клітин негермінального центру (non-GCB). За умови позитивної експресії bcl-6 та негативної експресії CD10 приналежність до групи визначали на основі результатів експресії MUM1: при негативній експресії MUM1 випадок відносили до групи GCB, при позитивній експресії MUM1 — до групи non-GCB [4].
Схематично описаний алгоритм представлено на рис. 1.
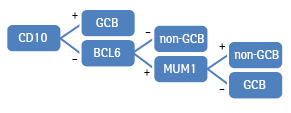
Згідно з алгоритмом Colomo, до фенотипу non-GCB належали випадки з позитивною експресією MUM1. Випадки з негативною експресією MUM1 і позитивною експресією CD10 — до GCB фенотипу. Випадки з негативною експресією MUM1 та CD10 і позитивною експресією також розцінювалися як група GCB. Випадки з негативною експресією усіх трьох маркерів вважалися такими, що неможливо класифікувати (not classified) [5].
Схематично цей алгоритм представлено на рис. 2.
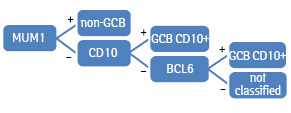
Відповідно до алгоритму Muris випадки з позитивною експресією CD10 класифікували як фенотип GCB. Випадки з негативною експресією CD10 належали до GCB або non-GCB залежно від експресії MUM1. Пацієнтів з негативною експресією розглядали як групу GCB. До тієї самої групи відносили випадки з позитивною експресією Bcl2 та позитивною експресією CD10 або негативною експресією MUM1 (за умови негативної експресії CD10); до групи non-GCB — випадки з негативною експресією CD10 та позитивною експресією MUM1 [6].
Схематично зазначений алгоритм представлено на рис. 3.
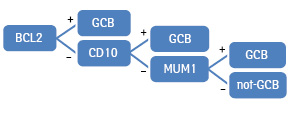
Метою нашого дослідження було проведення порівняння основних клінічних (вік, стать, стадія захворювання, приналежність до групи високого ризику за міжнародним прогностичним індексом — МПІ) та імуногістохімічних (експресія Bcl2, Bcl6, CD10, CD30, MUM1) характеристик пацієнтів із ДВКЛ із клітин гермінального та негермінального центру (підтип визначено за кожним алгоритмом), зіставлення прогностичної здатності імуногістохімічних алгоритмів (Hans, Colomo і Muris) та обґрунтування вибору алгоритму для подальшої роботи.
Об’єкт і методи дослідження
Проаналізовано дані 63 хворих із діагнозом неходжкінська ДВКЛ, що перебували під спостереженням та отримали лікування в Національному інституті раку з 2011 по 2015 р., для яких було можливо ретроспективно оцінити приналежність до підтипу ДВКЛ за всіма трьома алгоритмами (Hans, Colomo, Muris).
Статистичний аналіз
Безподійну виживаність (БПВ) обчислювали за методом Каплана — Мейєра від моменту встановлення діагнозу до реєстрації прогресування захворювання, рецидиву чи смерті пацієнта або дати останнього візиту під час спостереження. Різницю виживаності визначали за допомогою лог-рангового тесту. χ використовували для порівняння частоти якісних ознак між групами.
Результати
У табл. 1 наведено клінічні та імуногістохімічні характеристики і виживаність пацієнтів з різними молекулярними підтипами ДВКЛ, визначеними за алгоритмами Hans, Colomo, Muris.
Таблиця 1. Клінічні та імуногістохімічні характеристики та виживаність пацієнтів із різними молекулярними підтипами ДВКЛ, визначеними за алгоритмами Hans, Colomo, Muris
| Показник | Hans | р | Colomo | р | Muris | р | |||
| GCB | non-GCB | GCB | non-GCB | GCB | non-GCB | ||||
| Загальна кількість, % | 73,0 | 27,0 | 49,0 | 51,0 | 77,0 | 23,0 | |||
| Жінки, % | 33,8 | 88,9 | <0,001 | 58,0 | 65,0 | 0,720 | 55,1 | 85,7 | 0,062 |
| МПІ 3–4 | 29,0 | 22,6 | 0,811 | 29,0 | 22,6 | 0,720 | 24,5 | 30,8 | 0,921 |
| III–IV стадія, % | 39,1 | 70,6 | 0,055 | 34,1 | 39,0 | 0,819 | 40,0 | 71,4 | 0,085 |
| Ритуксимаб у 1-й лінії терапії | 46,0 | 50,0 | 0,992 | 51,6 | 40,6 | 0,538 | 49,0 | 38,5 | 0,720 |
| Bcl2+, % | 72,0 | 88,0 | 0,280 | 67,7 | 84,4 | 0,212 | 69,4 | 100,0 | 0,014 |
| Bcl6+, % | 89,7 | 29,4 | <0,001 | 89,5 | 51,4 | 0,015 | 81,3 | 35,7 | 0,011 |
| CD10+, % | 91,3 | 0 | <0,001 | 87,1 | 48,4 | 0,003 | 85,7 | 0 | <0,001 |
| CD30+, % | 11,0 | 30,0 | 0,478 | 15,4 | 20,0 | 0,859 | 15,0 | 25,0 | 0,937 |
| MUM1+, % | 32,6 | 88,2 | 0,014 | 0 | 93,8 | <0,001 | 55,2 | 100,0 | 0,002 |
| БПВ, % | 74,3 | 43,4 | 0,058 | 68,5 | 63,3 | 0,811 | 73,3 | 44,8 | 0,2 |
За алгоритмом Hans, пацієнти з ДВКЛ з клітин гермінального центру (GCB) становили 73,0%, а з негермінального центру (non-GCB) — 27,0%. Згідно з алгоритмом Colomo згадані показники становили відповідно 49,0 і 51,0%, а за алгоритмом Muris — 77,0 і 23,0%.
Аналіз виживаності за алгоритмом Hans
Середній вік хворих в групі GCB (50,2±2,5 року; 95% довірчий інтервал (ДІ) 45,2–55,2) не відрізнявся від середнього віку пацієнтів у групі non-GCB (52,6±3,7 року; 95% ДІ 44,8–60,4).
У групі GCB жінки становили 33,8% (95% ДІ 23,0–45,6%), у non-GCB — 88,9% (95% ДІ 69,2–99,2%). Кількість жінок в другій групі була статистично більшою порівняно з першою групою (встановлено різницю на рівні значущості p<0,001).
За кількістю хворих категорії високого ризику та кількістю пацієнтів із пізніми стадіями захворювання групи не відрізнялися (29% проти 22,6%, p=0,811; 39,1% проти 70,6%, p=0,055 відповідно). Кількість пацієнтів, що отримували ритуксимаб, також статистично не різнилася в обох групах (46,0% проти 50,0%, p=0,992).
Групи були зіставними за частотою позитивної експресії Bcl2 (72,0 і 88,0%, p=0,280) і CD30 (11,0 і 30,0%, p=0,478).
Частка хворих із позитивною експресією Bcl-6 у групі GCB становила 89,7% (95% ДІ 75,5–98,1%), а у non-GCB — 29,4% (95% ДІ 9,7–54,5%). Експресія цього маркера більш характерна для групи GCB (на рівні значущості p<0,001). Позитивна експресія CD10 також виявилася більш характерною для групи GCB: 91,3% (95% ДІ 81,2–97,7%) проти 0% (95% ДІ 0–10,6%); p<0,001.
Встановлено, що експресія MUM1 є більш притаманною пацієнтам групи non-GCB: у групі GCB зазначений показник становив 32,6% (95% ДІ 19,7–47,1%), а у групі non-GCB — 88,2% (95% ДІ 67,4–99,1%).
При порівнянні БПВ виявлено тенденцію до вищої виживаності пацієнтів у групі GCB: 16-місячна БПВ сягала 74,3% (95% ДІ 59,3–89,3) проти 43,4% (95% ДІ 16,7–70,2) у групі non-GCB (p=0,058) (рис. 4).
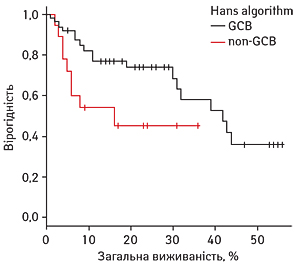
Медіани виживаності в групі GCB не досягнуто. Медіана БПВ у групі non-GCB становила 16 міс.
Аналіз виживаності за алгоритмом Colomo
Середній вік хворих у групі GCB (52,1±3,0 року; 95% ДІ 45,9–58,2) не відрізнявся від середнього віку пацієнтів в групі non-GCB (49,5±3,0 року; 95% ДІ 43,3–55,7). За статтю розподіл обох груп також не різнився (жінки становили 58,0% у першій групі та 65,0% — у другій; p=0,720).
За кількістю хворих категорії високого ризику групи не відрізнялися (29,0% проти 22,6%; p=0,720). За кількістю пацієнтів із пізніми стадіями групи розподілені рівномірно (34,1% проти 39%; p=0,819). Кількість хворих, що отримували ритуксимаб, також статистично не відрізнялася в обох групах (51,6% проти 40,6%; p=0,538). Групи були подібними за позитивною експресією Bcl2 (67,7 і 84,4%; p=0,212) та CD30 (15,4 і 20%; p=0,859).
Частка хворих із позитивною експресією Bcl-6 у групі GCB становила 89,5% (95% ДІ 70,8–99,2%), а у групі non-GCB — 51,49% (95% ДІ 32,5–71,0%). Експресія цього маркера більш характерна для групи GCB (p=0,015).
Позитивну експресію MUM1 частіше реєстрували в групі non-GCB порівняно з групою GCB: 93,8% (95% ДІ 82,4– 99,5%) проти 0% (95% ДІ 0,0–6,0%); p<0,001.
Позитивну експресію CD10 частіше фіксували в групі GCB: 87,1% (95% ДІ 72,6–96,7%) проти 48,4% (95% ДІ 30,6–66,4%); p=0,003.
При аналізі розподілу груп за алгоритмом Colomo 16-місячна БПВ не відрізнялася: у групі GCB показник становив 68,5% (95% ДІ 49,6–87,5%), а у групі non-GCB — 63,3% (95% ДІ 44,6–82,1); р>0,05. Медіани виживаності не досягнуто в жодній групі (рис. 5).
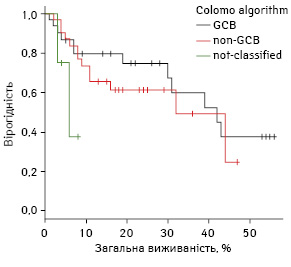
Аналіз виживаності за алгоритмом Muris
Середній вік хворих в групі GCB (50,4±2,3 року; 95% ДІ 45,7–55,0) не відрізнявся від середнього віку пацієнтів в групі non-GCB (52,7±4,5 року; 95% ДІ 42,8–62,3). За статтю розподіл обох груп також був подібний (жінки становили 55,1% в першій групі та 85,7% — у другій; p=0,062).
За кількістю хворих категорії високого ризику групи були зіставними (24,5% проти 30,8%; p=0,921). За кількістю пацієнтів із пізніми стадіями групи розподілені рівномірно (40% проти 71,4%; p=0,085). Кількість хворих, що отримували ритуксимаб, також статистично не відрізнялася в обох групах (49% проти 38,5%; p=0,720). Не виявлено різниці в експресії CD30 (15% проти 25%; p=0,937).
Позитивну експресію Bcl2 достовірно частіше відмічали в групі non-GCB: 100,0% (95% ДІ 87,3–100,0%) проти 69,4% (95% ДІ 55,5–81,7%); p=0,014. Позитивна експресія Bcl6 достовірно частіше визначалася у групі GCB: 81,3% (95% ДІ 65,5–93,0%) проти 35,7% (95% ДІ 11,9–64,2%); p=0,011.
Позитивну експресію MUM1 достовірно частіше фіксували в групі non-GCB: 100,0% (95% ДІ 87,3–100,0%) проти 55,2% (95% ДІ 36,3–73,3%); p=0,002.
Позитивну експресію CD10 частіше реєстрували в групі GCB: 85,7% (95% ДІ 74,3–94,2%) проти 0% (95% ДІ 0–12,7%); p<0,001.
При порівнянні виявлено тенденцію до вищої виживаності у групі GCB: 16-місячна БПВ становила 73,3% (95% ДІ 59,1–87,4) проти 44,8% у групі non-GCB (95% ДІ 14,2–5,3%); p=0,2 (рис. 6).
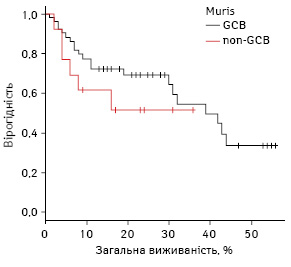
Для визначення прогностичної цінності описаних алгоритмів проаналізовано групу пацієнтів низького ризику з МПІ 0–2 (N=46) та високого ризику з МПІ 3–4 (N=17).
Розподіл на підтипи у цій когорті хворих, а також аналіз і порівняння показників БПВ між групами GCB та non-GCB представлено в табл. 2.
Таблиця 2. Виживаність пацієнтів низького та високого ризику групи non-GCB і GCB
| Hans’ | р | Colomo | р | Muris | р | ||||
| GCB | non-GCB | GCB | non-GCB | GCB | non-GCB | ||||
| МПІ 0–2 | |||||||||
| Хворі, % | 74,0 | 26,0 | 52,0 | 48,0 | 80,0 | 20,0 | |||
| БПВ, % | 85,7 | 49,4 | 0,029 | 84,7 | 73,6 | 0,905 | 82,0 | 61,0 | 0,217 |
| Медіана | − | 6 міс | − | − | − | − | − | − | − |
| МПІ 3–4 | |||||||||
| Хворі, % | 81,3 | 18,7 | 68,0 | 32,0 | 88,2 | 11,8 | |||
| БПВ, % | 76,7 | 55,4 | 0,705 | 74,8 | 62,6 | 0,702 | 74,0 | 62,0 | 0,316 |
| Медіана | − | – | − | − | − | − | − | − | − |
Отже, у групі пацієнтів низького ризику відмічається краща виживаність при фенотипі клітин із гермінального центру, що визначено за алгоритмом Hans.
Криві виживаності пацієнтів низького ризику групи GCB та non-GCB (визначені за алгоритмом Hans) представлено на рис. 7.
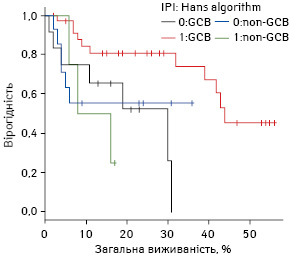
Висновки
Таким чином, позитивна експресія Bcl6 та CD10 є імуногістохімічним маркером ДВКЛ із клітин гермінального центру при розподілі на підтипи за всіма трьома алгоритмами. Позитивна експресія MUM1 є характерною для групи ДВКЛ з клітин негермінального центру також при застосуванні усіх трьох проаналізованих алгоритмів.
Медіана БПВ для групи non-GCB при використанні алгоритмів Hans та Muris становила 16 міс. Медіана виживаності не досягнута у пацієнтів групи GCB при застосуванні всіх трьох алгоритмів. Також при використанні алгоритмів Hans та Muris відмічалися тенденції до кращої БПВ в групі GCB (р=0,058).
Для пацієнтів усіх категорій ризику тенденцію до вищої виживаності пацієнтів у групі GCB відмічали при розподілі на групи за алгоритмами Hans та Muris.
Не було різниці у виживаності для груп при використанні алгоритму Colomo.
Серед пацієнтів низького ризику не було різниці у виживаності при використанні алгоритмів Colomo та Muris; не відмічалося різниці у виживаності серед хворих групи високого ризику при застосуванні всіх трьох алгоритмів.
Виявлено достовірну відмінність у виживаності пацієнтів групи GCB порівняно з групою non-GCB за умови застосування алгоритму Hans.
Таким чином, цей імуногістохімічний алгоритм дає можливість виділити пацієнтів із несприятливим прогнозом (non-GCB підтип) в групі пацієнтів низького ризику за МПІ.
Підсумовуючи вищесказане, можна дійти висновку, що алгоритм Hans має найбільшу прогностичну цінність для виокремлення несприятливої підгрупи пацієнтів із МПІ ≤2.
Список використаної літератури
1. Maria V.A.J., Victorino R.M.M. (1997) Development and validation of a clinical scale for the diagnosis of drug-induced hepatitis. Hepatology, 26: 664–669.
2. Gatter K.C., Warnke R.A. (2001) Diffuse large B-cell lymphoma. In: Jaffe ES, Harris NL, Stein H, Vardiman JW (ed). World Health Organization Classification of Tumours, Pathology and Genetics. IARC Press, Lyon, 171–174.
3. Alizadeh A.A., Eisen M.B., Davis R.E. et al. (2000) Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature, 403: 503–511.
4. Hans C.P., Weisenburger D.D., Greiner T.C. et al. (2004) Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood, 103(1): 275–282.
5. Colomo L., Lopez-Guillermo A., Perales M. et al. (2003) Clinical impact of the differentiation profile assessed by immunophenotyping in patients with diffuse large B-cell lymphoma. Blood, 101(1): 78–84.
6. Muris J.J., Meijer C.J., Vos W. et al. (2006) Immunohistochemical profiling based on Bcl-2, CD10 and MUM1 expression improves risk stratification in patients with primary nodal diffuse large B cell lymphoma. J Pathol., 208(5): 714–723.
Сравнение выживаемости больных неходжкинскими диффузными В-крупноклеточными лимфомами из клеток герминального и негерминального центра, определенными по иммуногистохимическим алгоритмам Hans, Colomo и Muris.
Опыт Национального института рака
Национальный институт рака, Киев
Резюме. Диффузная В-крупноклеточная лимфома (ДВКЛ) является клинически, морфологически и генетически гетерогенной группой заболеваний. В связи с тем, что данная гетерогенность существенно влияет на клиническое течение и ответ на терапию, остается актуальным вопрос об универсальном методе определения прогноза. С появлением современных методов исследования происходит постоянное усовершенствование субклассификации для выявления прогностически важных групп пациентов. В статье приведены иммуногистохимические алгоритмы Hans, Colomo и Muris для определения подтипов ДВКЛ. Также проведена оценка выживаемости подгрупп ДВКЛ, определенных по каждому алгоритму. Отдельно проанализирована выживаемость пациентов группы низкого и высокого риска (по международному прогностическому индексу) соответственно каждому алгоритму. Установлено, что алгоритм Hans демонстрирует наибольшую прогностическую ценность для определения пациентов с худшей выживаемостью даже в группе низкого риска по международному прогностическому индексу.
диффузная В-крупноклеточная лимфома, иммуногистохимические алгоритмы Hans, Colomo и Muris, виживаемость, группы риска.
Адреса:
Крячок Ірина Анатоліївна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку















Leave a comment