Профілактика ранньої антрациклін-індукованої кардіотоксичності поліхіміотерапії у хворих на рак грудної залози
Аскольський А.В.1, Сивак Л.А.1, Жарінов О.Й.2, Антомонов М.Ю.3, Шевчук Л.А.1
- 1Національний інститут раку, Київ
- 2Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
- 3ДУ «Інститут громадського здоров’я ім. О.М. Марзєєва НАМН України», Київ
Резюме. Відомо, що використання доксорубіцину в низьких кумулятивних дозах (240–450 мг/м2) асоціюється з ризиком пошкодження міокарда, порушень діастолічної та систолічної функцій лівого шлуночка. У рекомендаціях Європейського товариства медичної онкології (ESMO) допускається можливість індивідуалізованого застосування інгібіторів ангіотензинперетворювального ферменту (АПФ) і блокаторів β-адренорецепторів для профілактики кардіотоксичності доксорубіцину. Мета дослідження полягала в оцінці безпеки та ефективності стандартизованої низькодозової кардіопротекторної терапії інгібіторами АПФ і блокаторами β-адренорецепторів у хворих на рак грудної залози II і III стадії. У дослідження включено 100 пацієнток, яким показано застосування 6 циклів стандартної антрациклінової поліхіміотерапії (ПХТ) у рамках комплексного лікування за радикальною програмою. В основну групу увійшли 50 хворих, які отримали ПХТ за схемою FАC разом з використанням терапії супроводу (еналаприл 2,5 мг перорально двічі на добу та карведилол 6,25 мг перорально двічі на добу), в контрольну — 50 пацієнток, яким призначили таку саму схему ПХТ, але без терапії супроводу. До початку спеціального лікування, на етапах ПХТ і через 3 міс після останнього циклу у пацієнток обох груп здійснили комплексне обстеження серцево-судинної системи: вимірювання артеріального тиску, частоти серцевих скорочень, електро- і ехокардіографію. Встановлено, що застосування терапії супроводу безпечне та значуще знижує частоту виникнення специфічних ознак кардіотоксичності доксорубіцину в низьких кумулятивних дозах, таких як патологічне подовження інтервалу Q–Tc і діастолічна дисфункція лівого шлуночка 1-го типу.

Вступ
Дозозалежна антрациклін-індукована кардіоміопатія є поширеним і добре вивченим серцево-судинним ускладненням хіміотерапії [1]. Доксорубіцин входить до більшості стандартних протоколів хіміотерапії раку грудної залози (РГЗ) [2]. Ризик виникнення кардіотоксичних ускладнень особливо відчутно зростає при використанні доксорубіцину в кумулятивній дозі ≥450 мг/м2 [3]. Більшість пацієнток з РГЗ на ранніх стадіях у рамках комплексного лікування за радикальною програмою отримують не більше 300 мг/м2 доксорубіцину. Втім, навіть при застосуванні доксорубіцину в низьких кумулятивних дозах (240–450 мг/м2) в 1–3% хворих виникають порушення систолічної функції лівого шлуночка (ЛШ) із розвитком серцевої недостатності та інших клінічних проявів кардіотоксичності доксорубіцину [4]. Крім того, застосування доксорубіцину в низьких кумулятивних дозах нерідко (у 26–55% хворих) спричиняє порушення діастолічної функції ЛШ, що вважається раннім доклінічним маркером кардіотоксичності [5]. Так, продовжується пошук шляхів зменшення кардіотоксичності, що може підвищити ефективність хіміотерапії та якість життя пацієнтів. Перспективу з цього огляду можуть мати ліпосомальні форми доксорубіцину, дексразоксан, а також засоби з кардіопротекторними властивостями, такі як убіхінон (коензим Q10), антиоксиданти, інгібітори ангіотензинперетворювального ферменту (АПФ), блокатори β-адренорецепторів [6].
Важливе значення у формуванні антрациклінової кардіоміопатії відіграє, зокрема, тканинна ренін-ангіотензин-альдостеронова система у міокарді. В експерименті показано, що після введення доксорубіцину у серці підвищується вміст тканинного АПФ, а інгібітори АПФ здатні його знижувати [7, 8]. Призначення доксорубіцину супроводжується також підвищенням рівня реактивних оксигенових утворень (reactive oxygen species — ROS), продуктів перекисного окиснення ліпідів в тканинах зі зниженням рівня антиоксидантних систем. Доксорубіцин-індукований оксидативний стрес у серці значно вираженіший, ніж у печінці, нирках і селезінці. Натомість, блокатори β-адренорецепторів запобігають вивільненню вільних радикалів, порушенню функції мітохондрій, апоптозу в міокарді тварин, які отримували антрацикліни. Ці препарати також продемонструвати обнадійливі дані щодо запобігання кардіотоксичності доксорубіцину [7].
Мета дослідження полягала в оцінці безпеки та ефективності стандартизованої низькодозової кардіопротекторної терапії інгібіторами АПФ і блокаторами β-адренорецепторів у хворих на РГЗ II і III стадії.
Об’єкт і методи дослідження
Для досягнення поставленої мети в дослідження включили 118 жінок із вперше виявленим РГЗ II або ІІІ стадії, яким було показане комплексне лікування за радикальною програмою. Згідно з чинними європейськими стандартами Європейського товариства медичної онкології (European Society for Medical Oncology — ESMO), всім пацієнткам призначали стандартну неоад’ювантну та/або ад’ювантну поліхіміотерапію (ПХТ), променеву терапію, оперативне лікування, гормонотерапію при люмінальному типі РГЗ [9]. Загалом, кожна хвора отримала 6 циклів ПХТ за стандартною схемою FАС (циклофосфамід 500 мг/м2 у 1-й день циклу внутрішньовенно, доксорубіцин 50 мг/м2 у 1-й день циклу внутрішньовенно, 5-флуороурацил 500 мг/м2 у 1-й день циклу внутрішньовенно, інтервал між циклами — по 3 тиж). Таким чином, після завершення 6 циклів кумулятивна доза доксорубіцину у всіх пацієнток становила 300 мг/м2. Усім хворим виконували радикальне оперативне лікування (мастектомію або квадрантектомію, або секторальну резекцію з лімфаденектомією) і променеву терапію на гамма-терапевтичному апараті «THERATRON» (сумарна вогнищева доза 40–42 Гр).
Основні критерії невключення пацієнток в дослідження: ад’ювантна променева терапія на лінійному прискорювачі, наявність клінічно значущої кардіоваскулярної патології (стенокардії або інших клінічних форм ішемічної хвороби серця, артеріальної гіпертензії II–III ступеня, серцевої недостатності ІІ–ІІІ стадії, фракції викиду лівого шлуночка (ФВЛШ) <50%, гемодинамічно значущих вад серця, хронічних порушень серцевого ритму), протипоказання до призначення інгібіторів АПФ і блокаторів β-адренорецепторів (бронхіальна обструкція, брадикардія, симптомна гіпотензія тощо).
Усі хворі до першої процедури надали письмову згоду на участь у дослідженні і пройшли подвійну сліпу рандомізацію у співвідношенні 1:1 за методом «конвертів» (самостійно обирали один з двох конвертів, у якому зазначалася схема лікування). Рандомізація здійснювалася з урахуванням правої і лівої локалізації РГЗ, зважаючи на різний ушкоджувальний вплив променевої терапії в рамках комплексного лікування. Програма дослідження була схвалена комісією з біоетики Національного інституту раку.
Вісімнадцять пацієнток у процесі лікування вибули з дослідження через появу критеріїв виключення: 5 пацієнток пройшли менше або більше 6 циклів ПХТ за протоколом FAC, у 7 хворих змінено схему ПХТ із різних причин, 3 пацієнтки пройшли променеву терапію на лінійному прискорювачі, 3 пацієнтки не виконали всі процедури дослідження. Таким чином, у статистичному аналізі враховано результати обстеження та лікування 100 пацієнток. Вік хворих на момент включення в дослідження становив від 30 до 69 років, середній вік — 52,61±0,8 року.
В основну групу увійшли пацієнтки, які отримали хіміотерапевтичне лікування (неоад’ювантна, ад’ювантна ПХТ) за схемою FАC разом з інгібітором АПФ еналаприлом 2,5 мг перорально двічі на добу та блокатором β-адренорецепторів карведилолом 6,25 мг перорально двічі на добу (n=50), в контрольну — пацієнтки, яким призначили таку саму схему ПХТ, але без терапії супроводу (n=50). Досліджувані препарати застосовували щоденно протягом 3 тиж після кожного циклу ПХТ. Відтак, терапія супроводу завершувалася через 3 тиж після останнього циклу ПХТ. У періопераційний період, а також під час застосування променевої терапії зазначені лікарські засоби не призначали. Усі пацієнтки були поінформовані про можливі побічні ефекти еналаприлу і карведилолу, необхідність щоденного контролю артеріального тиску (АТ) і частоти серцевих скорочень (ЧСС).
Перед кожним циклом ПХТ усім пацієнткам виконували загальний аналіз крові, біохімічний аналіз крові, загальний аналіз сечі. З огляду на можливу мієло-, гепато- і нефротоксичність еналаприлу [8] реєстрували значення таких лабораторних показників, як: гемоглобін, абсолютна кількість нейтрофілів, тромбоцитів, загальний білірубін, аланінамінотрансфераза (АлАТ), аспартатамінотрансфераза (АсАТ), креатинін, глюкоза в крові, білок в сечі.
Електрокардіограму (ЕКГ) реєстрували з використанням діагностичного комплексу CARDIO (ТОВ «MIDA», Україна) до початку ПХТ, перед 2-м, 4-м, 6-м циклами і через 3 міс після завершення ПХТ. Здійснювали стандартні вимірювання тривалості інтервалів та амплітуди зубців ЕКГ. Коригований інтервал Q–T оцінювали за формулою Базетта:
Q–Tc = Q–T/√R–R.
Подовження інтервалу Q–T діагностували у випадку, якщо тривалість Q–Tс перевищувала 460 мс.
Трансторакальну ехокардіографію (ехоКГ) виконували до лікування, перед 6-м циклом ПХТ та через 3 міс спостереження за стандартною методикою на ультразвуковому сканері NEMIO XG («Toshiba Medical System Corporation», Японія). Визначали кінцево-діастолічний та кінцево-систолічний об’єм ЛШ, кінцево-діастолічний розмір ЛШ, об’єм лівого передсердя, діаметр аорти, розраховували ФВЛШ. Для оцінки діастолічної функції ЛШ використовували допплер-ехоКГ в імпульсному режимі. Вивчали структуру трансмітрального кровотоку із визначенням максимальної швидкості раннього (хвиля Е) і пізнього (хвиля А) діастолічного наповнення ЛШ та розраховували їх співвідношення (Е/А). Допплер-ехоКГ-дослідження передбачало також визначення періоду сповільнення піку раннього наповнення ЛШ (DT). Інтерпретацію показників та діагностику типів діастолічної дисфункції (ДД) ЛШ здійснювали за рекомендаціями робочої групи Європейського кардіологічного товариства [10].
Перед кожним циклом ПХТ, а також через 3 міс після ії завершення в рамках загальноклінічного обстеження всіх пацієнток опитували на предмет появи клінічних побічних ефектів еналаприлу і карведилолу, реєстрували рівні АТ і ЧСС. Виявлені кардіоваскулярні побічні ефекти ПХТ оцінювали за шкалою СTCAE 4.0 (Common Terminology Criteria for Adverse Events) [11].
Первинна статистична обробка кількісних показників включала розрахунок середнього арифметичного (M), похибки середньоарифметичного значення (m). Взаємозв’язок між кількісними змінними визначали за допомогою парного коефіцієнта кореляції Пірсона. Для рангових змiнних взаємозв’язок оцінювали за допомогою рангового коефiцiєнта кореляцiї Спiрмена (rs). Для номiнальних змiнних (шкали найменувань) взаємозв’язок розраховувався за таблицями спряженостi за допомогою критерію χ2 Пiрсона. Математичну обробку отриманих результатів виконували з використанням стандартного статистичного пакета Statistica 8.0.
Результати
В обох групах у всіх обстежуваних до хіміотерапевтичного лікування ЧСС знаходилася у межах норми, а її середні рівні в контрольній і основній групах значуще не відрізнялися (відповідно 68,1±0,5 і 66,9±0,71 уд./хв; p=0,12). У контрольній групі протягом ПХТ синусова тахікардія з’явилася у 8 (16%) пацієнток, серед них у 2 — після 2-го циклу, у 6 — після 5-го циклу, причому тахікардія зберігалася протягом наступних циклів хіміотерапії. Натомість, в основній групі протягом 6 циклів ПХТ не зареєстрували жодного випадку синусової тахікардії. У контрольній групі через 3 міс після останньої дози доксорубіцину синусова тахікардія зникла у 5 пацієнток, зберігалася у 3 хворих, а в основній групі у 2 пацієнток вперше зареєстрували підвищення ЧСС до 86 і 89 уд./хв, що, очевидно, пов’язано з передчасним завершенням терапії супроводу. Водночас на етапах ПХТ в основній групі була зареєстрована незначна брадикардія у 6 пацієнток (не менше 56 уд./хв), у контрольній — в 1 пацієнтки (57 уд./хв). Наголосимо, що у всіх випадках синусова тахікардія і брадикардія були безсимптомними, потреби в їх корекції не було. Середні значення ЧСС в основній групі на етапах ПХТ були достовірно нижчими порівняно з контрольною групою (табл. 1).
Таблиця 1. Середня ЧСС (уд./хв) в основній і контрольній групах на етапах ПХТ
| Термін обстеження | Основна група (n=50) | Контрольна група (n=50) | р |
| Перед 1-м циклом | 68,1±0,5 | 66,9±0,71 | 0,12 |
| Перед 2-м циклом | 69,2±0,7 | 64,2±0,4 | <0,01 |
| Перед 3-м циклом | 69,9±0,7 | 64,3±0,6 | <0,01 |
| Перед 4-м циклом | 70,1±0,8 | 64,4±0,5 | <0,01 |
| Перед 5-м циклом | 70,4±0,9 | 65,1±0,7 | <0,01 |
| Перед 6-м циклом | 71,6±0,9 | 64,3±0,3 | <0,01 |
| 3 міс після ПХТ | 72,4±0,9 | 67,1±0,7 | <0,01 |
Через 3 міс після введення останньої дози доксорубіцину в основній групі у всіх випадках брадикардія спонтанно зникла, а середня ЧСС у групі підвищилася (рис. 1).
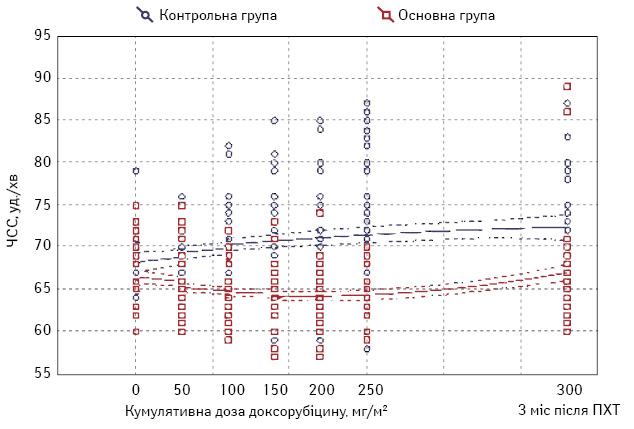
При вихідному обстеженні у всіх пацієнток обох груп зареєстровано нормальні значення систолічного і діастолічного АТ. В 11 (22%) хворих контрольної та лише в 1 (4%) пацієнтки основної групи на етапах ПХТ зареєстрували підвищення АТ ІІ ступеня. У контрольній групі цим пацієнткам додатково призначали еналаприл, що дозволило досягти цільових рівнів АТ. У пацієнтки з основної групи нормалізацію АТ забезпечили шляхом титрування еналаприлу до добової дози 10 мг. У жодному випадку артеріальна гіпертензія не призвела до відтермінування ПХТ. Середні рівні систолічного і діастолічного АТ в основній групі протягом періоду ПХТ були нижчими, ніж у контрольній (рис. 2).
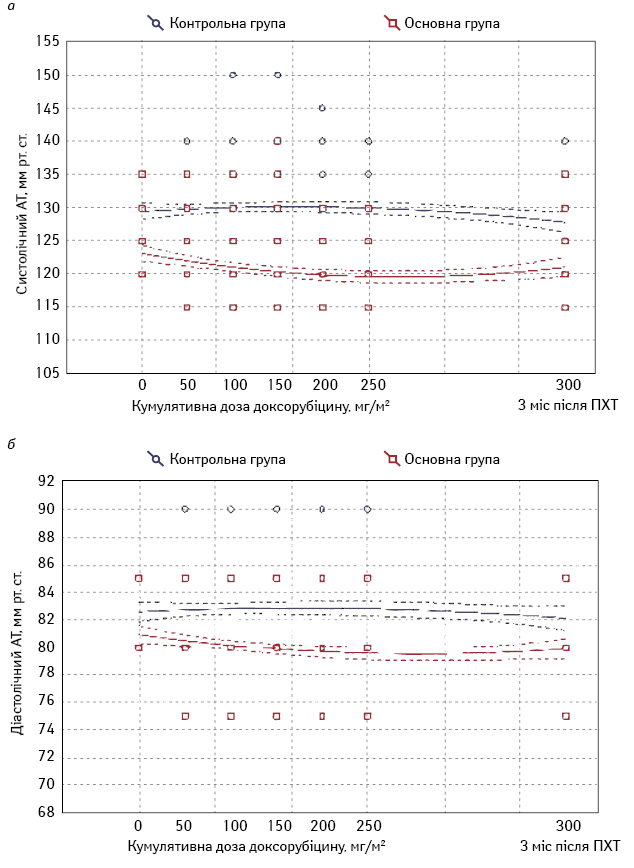
Перед другим циклом у 4 пацієнток з основної групи встановлено зниження рівня АТ до 110/70 мм рт. ст. і нижче, причому надалі рівень АТ у них залишався без динаміки протягом ПХТ. При контрольному обстеженні через 3 міс після ПХТ рівень АТ у цих пацієнтів повернувся до вихідного.
У пацієнток основної групи під час усього періоду спостереження не зареєстровано жодної специфічної скарги, яку можна було б інтерпретувати як побічну дію еналаприлу чи карведилолу. До початку лікування у 3 пацієнток основної та 2 контрольної групи виявлена анемія I ступеня; інші лабораторні показники у всіх пацієнток були в межах норми. Перед 2-м і наступними циклами у пацієнток обох груп зареєстровано анемію I ступеня, нейтропенію I ступеня, тромбоцитопенію I ступеня, підвищення АлАТ та/або АсАТ I ступеня, гіперглікемію I ступеня, але значущих відмінностей частоти виникнення вказаних змін в основній і контрольній групах не встановлено. Крім того, при дослідженні загального аналізу крові у пацієнток основної і контрольної груп не виявлено значущої відмінності рівнів гемоглобіну, абсолютної кількості нейтрофілів, тромбоцитів перед кожним циклом проведеної ПХТ.
При аналізі даних ЕКГ у період проведення ПХТ особливу увагу приділили вивченню змін тривалості інтервалу Q–Tc. До початку лікування у всіх пацієнток обох груп тривалість Q–Tc була в межах норми. У 13 (26%) пацієнток контрольної групи і у 5 (10%) основної на фоні ПХТ зареєстрували збільшення тривалості Q–Tс понад 460 мс. У контрольній групі у 10 пацієнток відмічено подовження інтервалу Q–Tc I ступеня, у 3 пацієнток — II ступеня, у хворих основної групи — тільки I ступеня. І в основній, і в контрольній групі збільшення тривалості інтервалу Q–Tc прямо залежало від підвищення кумулятивної дози доксорубіцину (рис. 3).
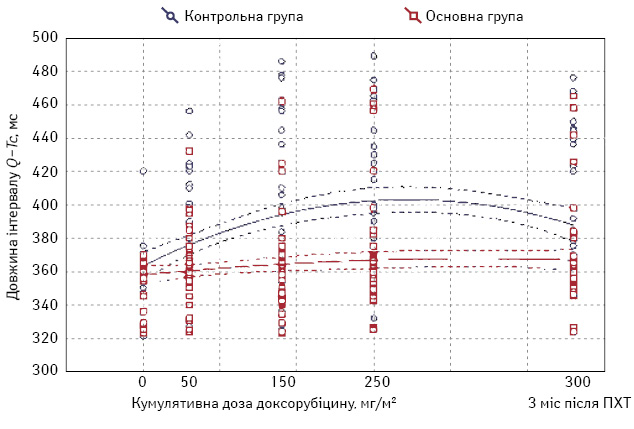
Через 3 міс після завершення хіміотерапії в контрольній групі відзначено зменшення тривалості інтервалу Q–Tc, яке, втім, не досягло початкового рівня (див. рис. 3). Середні значення тривалості інтервалу Q–Tc на етапах ПХТ, а також через 3 міс після закінчення лікування в основній групі були достовірно нижчими, ніж у контрольній (табл. 2).
Таблиця 2. Тривалість інтервалу Q–Tc (M±m, мс) на етапах ПХТ в основній і контрольній групах
| Термін обстеження | Контрольна група (n=50) | Основна група (n=50) | p |
| Перед 1-м циклом | 361±1,9 | 356±2,9 | 0,08 |
| Перед 2-м циклом | 378±4,3 | 364±4,8 | 0,05 |
| Перед 4-м циклом | 393±6,1 | 360±5,8 | <0,001 |
| Перед 6-м циклом | 401±6,9 | 368±6,2 | <0,001 |
| 3 міс після ПХТ | 387,9±5,2 | 366±5,3 | 0,02 |
За даними вихідного ехоКГ-дослідження, у всіх пацієнток систолічна і діастолічна функції ЛШ були збережені. У жодної пацієнтки основної групи ФВЛШ істотно не змінилася протягом усього періоду спостереження. В однієї хворої з контрольної групи відзначено зменшення ФВЛШ на 13% від вихідного значення через 3 міс після закінчення ПХТ, що відповідає I ступеню систолічної дисфункції за шкалою CTCAE 4.0. Перед 6-м циклом ПХТ значущих відмінностей середніх значень ФВЛШ в основній і контрольній групах не встановлено. Проте виявлено тенденцію до зниження ФВЛШ у контрольній групі через 3 міс після введення останньої дози доксорубіцину (табл. 3).
Таблиця 3. Середні значення ФВЛШ (%) в основній і контрольній групах на етапах ПХТ
| Термін обстеження | Основна група (n=50) | Контрольна група (n=50) | р |
| Перед 1-м циклом | 57,9±0,2 | 57,5±0,2 | 0,76 |
| Перед 6-м циклом | 56,8±0,2 | 55,9±0,3 | 0,11 |
| 3 міс після ПХТ | 56,9±0,3 | 55,1±0,2 | 0,07 |
На фоні ПХТ у пацієнтів обох груп відмічали зміни показників діастолічної функції ЛШ (час ізоволюмічного розслаблення, швидкість трансмітрального кровотоку, співвідношення Е/А). У контрольній групі зареєстровано 15 випадків виникнення ДД ЛШ 1-го типу, серед них у 9 пацієнток — перед 6-м циклом, ще у 6 — через 3 міс після завершення ПХТ. В основній групі виявлено 5 випадків розвитку ДД 1-го типу (у 3 пацієнток — перед 6-м циклом і ще в 3 — через 3 міс після завершення ПХТ). Слід зазначити, що зареєстрована ДД перед 6-м циклом ПХТ зберігалася у всіх пацієнток обох груп за даними допплер-ехоКГ через 3 міс після останньої дози доксорубіцину. В основній групі перед 6-м циклом ПХТ спостерігали тенденцію до зниження частоти виникнення ДД ЛШ 1-го типу порівняно з контрольною, а через 3 міс після ПХТ відмінність була статистично значущою (табл. 4).
Таблиця 4. Кількість випадків ДД ЛШ 1-го типу в основній і контрольній групах
| Кількість випадківвиникнення ДД ЛШ 1-го типу | Контрольна група | Основна група | p |
| Перед 6-м циклом | 9 | 3 | 0,07 |
| Через 3 міс після ПХТ | 15 | 5 | 0,01 |
Загалом при застосуванні терапії супроводу в основній групі фіксували значуще зниження частоти виникнення синусової тахікардії, артеріальної гіпертензії, патологічного подовження інтервалу Q–Tc, ДД ЛШ 1-го типу (табл. 5).
Таблиця 5. Серцево-судинні прояви кардіотоксичності ПХТ в основній і контрольній групах
| Порівнювані побічні ефекти ПХТ | Контрольна група |
Основна група |
р |
| Синусова тахікардія (протягом усього дослідження) | 8 | 2 | <0,05 |
| Артеріальна гіпертензія (протягом усього дослідження) | 11 | 1 | <0,05 |
| Патологічне подовження Q–Tc через 3 міс після ПХТ | 13 | 5 | <0,05 |
| ДД ЛШ 1-го типу через 3 міс після ПХТ | 15 | 5 | <0,05 |
Випадки синусової тахікардії й артеріальної гіпертензії не є специфічними клінічними ознаками кардіотоксичності доксорубіцину, на відміну від подовження інтервалу Q–Tc і порушення діастолічної функції ЛШ [4]. Відсутність терапії супроводу виявилася у нашому дослідженні фактором ризику виникнення патологічного подовження інтервалу Q–Tc (відношення шансів (OR)=3,15; довірчий інтервал (ДІ) 2,05–4,21; p=0,03) і розвитку ДД ЛШ 1-го типу (OR=3,85; ДІ 2,75–4,96; p=0,01).
Обговорення результатів
Низька кумулятивна доза доксорубіцину в обстежених пацієнтів не дає підстави виключати вплив антрациклінової кардіотоксичності на виявлені зміни ЧСС, АТ та ехоКГ-параметрів. Безумовно, потенціюючими факторами цього впливу можуть бути похилий вік і жіноча стать [12]. Втім, у нашому дослідженні лише 5 жінок на момент включення були віком старше 65 років (2 — в контрольній групі та 3 — в основній), а середній вік обстежених становив 52,6 року. Наголосимо, що в жінок ризик розвитку антрациклінової кардіотоксичності удвічі більший, ніж у чоловіків [13].
Важливим чинником виникнення проявів кардіотоксичності доксорубіцину могло бути також внутрішньовенне струминне введення препарату. Натомість пролонговані інфузії доксорубіцину за допомогою інфузоматів, інфузійних помп (48-годинні, 96-годинні) значно знижують антрациклінову кардіотоксичність [14].
Ще одним фактором, який спричиняє формування проявів кардіотоксичності, може бути одночасне застосування кількох засобів ПХТ. Щоправда, можлива кардіотоксичність 5-флуороурацилу частіше є гострою і оборотною [15]. Частота і ступінь ушкоджувальної дії на міокард прямо пропорційні дозі та тривалості інфузії. У нашому дослідженні стандартне введення 5-флуороурацилу (довенно крапельно протягом 30 хв) не супроводжувалося жодними кардіотоксичними ознаками. Алкілуючі цитостатики також нерідко чинять токсичну дію на міокард, що зумовлено гострим ушкоджувальним впливом токсичних метаболітів циклофосфаміду на клітинну мембрану ендотелію і міокарда. Але, на відміну від антрациклінів, ступінь кардіотоксичності алкілуючих агентів залежить не від кумулятивної, а від разової дози препарату, і прояви кардіотоксичності рідко є відтермінованими [16]. У схемі FAC разова доза циклофосфаміду є однією з мінімальних (становить 500 мг/м2), тому виявлені ознаки кардіотоксичності не пов’язані з його використанням.
За даними метааналізу, ризик смерті від серцево-судинних причин у пацієнток з раннім РГЗ може зростати також при застосуванні променевої терапії [17]. У всіх обстежених променева терапія була завершена через 2 міс після введення останньої дози доксорубіцину. Але кардіологічні ускладнення променевої терапії реєструють зазвичай не раніше ніж через 5–6 міс після ії закінчення [18]. Отже, проведена променева терапія не могла суттєво вплинути на стан серцево-судинної системи вже через 3 міс після завершення ПХТ.
У рекомендаціях ESMO вказується на можливість використання інгібіторів АПФ і блокаторів β-адренорецепторів з метою лікування і профілактики кардіотоксичності хіміотерапевтичного лікування [9]. Але дотепер не розроблено універсального алгоритму кардіопротекторної терапії супроводу, оскільки існує велика кількість чинників, які впливають на ризик її розвитку у конкретного хворого (вік, стать, супутні захворювання, схема ПХТ, променева терапія тощо).
У нашому дослідженні апробована терапія супроводу з включенням еналаприлу і карведилолу дозволила знизити ризик виникнення проявів кардіотоксичності хіміотерапії у молодих жінок з раннім РГЗ без фонової серцево-судинної патології. Значну увагу приділено оцінці безпеки комбінованого застосування інгібітору АПФ і блокатора β-адренорецепторів у вказаної категорії хворих. Наголосимо, що еналаприл у дозі 5 мг/добу не спричинив проявів мієлотоксичності. Частота патологічних змін у біохімічних аналізах крові та сечі в порівнюваних групах була зіставною і насамперед зумовленою різними видами токсичності схеми FAC. Варто також зауважити, що терапія супроводу не характеризувалася значущими змінами рівнів ЧСС і АТ. Отримані результати загалом узгоджуються з раніше відомими даними щодо ефективності та безпеки застосування інгібіторів АПФ і блокаторів β-адренорецепторів як кардіопротекторів у пацієнтів зі злоякісними захворюваннями, які отримують антрациклінову хіміотерапію [8, 19, 20].
Висновки
1. Отримані результати свідчать про безпеку профілактичного застосування еналаприлу в дозі 5 мг/добу і карведилолу в дозі 12,5 мг/добу як кардіопротекторів у хворих на РГЗ, які отримують антрациклінову ПХТ.
2. Використання розробленого алгоритму терапії супроводу дозволяє значуще знизити частоту виникнення кардіотоксичних проявів застосування низьких кумулятивних доз доксорубіцину, зокрема подовження інтервалу Q–Tc та ДД ЛШ 1-го типу.
Список використаної літератури
1. Ewer M.S., Ewer S.M. (2015) Cardiotoxicity of anticancer treatments. Nat. Rev. Cardiol., 12: 620.
2. Suter T.M., Ewer M.S. (2013) Cancer drugs and the heart: importance and management. Eur. Heart J., 34: 1102–1111.
3. Vejpongsa P., Yeh E.T. (2014) Prevention of anthracycline-induced cardiotoxicity: challenges and opportunities. J. Am. Coll. Cardiol., 64: 938–945.
4. Khouri M.G., Douglas P.S., Mackey J.R. et al. (2012) Cancer therapy-induced cardiac toxicity in early breast cancer: addressing the unresolved issues. Circulation, 126: 2749–2763.
5. Caram M., Leja M., Smerage J. et al. (2015) Diastolic dysfunction in patients treated with doxorubicin for early stage breast cancer. J. Clin. Oncol., 33: 59–64.
6. Truong J., Yan A.T., Cramarossa G., Chan K.K. (2014) Chemotherapy-induced cardiotoxicity: detection, prevention, and management. Can. J. Cardiol., 30: 869–878.
7. Sawyer D.B., Peng X., Chen B. et al. (2010) Mechanisms of anthracycline cardiac injury: can we identify strategies for cardioprotection? Prog. Cardiovasc. Dis., 53: 105–113.
8. Wzgarda А., Kleszcz R., Prokop M., Regulska K. (2017) Unknown face of known drugs — what else can we expect from angiotensin converting enzyme inhibitors? Eur. J. Pharmacol., 41: 73–78.
9. Senkus Е., Kyriakides S., Ohno S. et al. (2015) Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 26 (Suppl. 5): v8–v30.
10. Plana J., Galderisi M., Barac A. et al. (2014) Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur. Heart J. Cardiovasc. Imaging, 15: 1063–1093.
11. Trotti A., Colevas A., Setser A. et al. (2008) CTCAE v 4.0: development of a comprehensive grading system for the adverse effects of cancer treatment. Semin. Radiat. Oncol., 13(3): 176–181.
12. Armstrong G.T., Oeffinger K.C., Chen Y. et al. (2013) Modifiable risk factors and major cardiac events among adult survivors of childhood cancer. J. Clin. Oncol., 31: 3673–3680.
13. Ewer M.S., Yeh E.T. (2013) Anthracycline cardiotoxicity: clinical aspects, recognition, monitoring, treatment, and prevention. Cancer and the Heart. Shelton, CT, USA: People’s Medical Publishing House: 11–41.
14. Vejpongsa P., Yeh E.T. (2014) Prevention of anthracycline-induced cardiotoxicity: challenges and opportunities. J. Am. Coll. Cardiol., 64: 938–945.
15. Alter P., Herzum M., Soufi M. et al. (2006) Cardiotoxicity of 5-fluorouracil. Cardiovasc. Hematol. Agents. Med. Chem., 4 (1): 1–5.
16. Dow E., Schulman H., Agura E. (1993) Cyclophosphamide cardiac injury mimicking acute myocardial infarction. Bone Marrow Transplant., 12: 169–172.
17. McGale P., Darby S.C., Hall P. et al. (2011) Incidence of heart disease in 35,000 women treated with radiotherapy for breast cancer in Denmark and Sweden. Radiother. Oncol., 100: 167–175.
18. Darby S.C., Ewertz M., McGale P. et al. (2013) Risk of ischemic heart disease in women after radiotherapy for breast cancer. N. Engl. J. Med., 368: 987–998.
19. Dalen E.C., Caron H.N., Dickinson H.O. et al. (2011) Cardioprotective interventions for cancer patients receiving anthracyclines. Cochrane Database Syst. Rev., 6: CD003917.
20. Bosch X., Rovira M., Sitges M. et al. (2013) Enalapril and carvedilol for preventing chemotherapy-induced left ventricular systolic dysfunction in patients with malignant hemopathies. J. Am. Coll. Cardiol., 61: 2355–2362.
Профилактика ранней антрациклин-индуцированной кардиотоксичности полихимиотерапии у больных раком грудной железы
Национальный институт рака, Киев
Национальная медицинская академия последипломного образования им. П.Л. Шупика, Киев
ГУ «Институт общественного здоровья им. А.М. Марзеева НАМН Украины», Киев
Резюме. Известно, что использование доксорубицина в низких кумулятивных дозах (240–450 мг/м2) ассоциируется с риском повреждения миокарда, нарушением диастолической и систолической функции левого желудочка. В рекомендациях Европейского общества по клинической онкологии (ESMO) допускается возможность индивидуализированного применения ингибиторов ангиотензинпревращающего фермента (АПФ) и блокаторов β-адренорецепторов для профилактики кардиотоксичности доксорубицина. Цель исследования заключалась в оценке безопасности и эффективности стандартизированной низкодозовой кардиопротекторной терапии ингибиторами АПФ и блокаторами β-адренорецепторов у больных раком грудной железы II и III стадии. В исследование включено 100 пациенток, которым показано применение 6 циклов стандартной антрациклиновой полихимиотерапии (ПХТ) в рамках комплексного лечения по радикальной программе. В основную группу вошли 50 больных, получивших ПХТ по схеме FАC вместе с использованием терапии сопровождения (эналаприл 2,5 мг перорально дважды в сутки и карведилол 6,25 мг перорально дважды в сутки), в контрольную — 50 пациенток, которым назначили такую же схему ПХТ, но без терапии сопровождения. Перед началом специального лечения, на этапах ПХТ и через 3 мес после последнего цикла у пациенток обеих групп провели комплексное обследование сердечно-сосудистой системы: измерение артериального давления, частоты сердечных сокращений, электро- и эхокардиографию. Установлено, что применение терапии сопровождения является безопасным и значимо снижает частоту возникновения специфических признаков кардиотоксичности доксорубицина в низких кумулятивных дозах, таких как патологическое удлинение интервала Q–Tc и диастолическая дисфункция левого желудочка 1-го типа.
рак грудной железы, антрациклины, кардиотоксичность, профилактика, ингибиторы ангиотензинпревращающего фермента, блокаторы β-адренорецепторов.
Адреса:
Аскольський Антон В’ячеславович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: +38 (044) 257-93-64
E-mail: anton.askolsky@gmail.com














Leave a comment