Саркоми м’яких тканин кінцівок та тулуба високого ступеня ризику: дослідження оцінки неоад’ювантного лікування за допомогою критеріїв RECIST та відносної частки життєздатної пухлинної тканини
Остафійчук В.В., Коровін С.І., Палівець А.Ю., Кукушкіна М.М., Кротевич М.С., Бойчук С.І.
Резюме. 81 хворого на саркому м’яких тканин ІІb-ІІІ стадії залежно від схеми неоад’ювантного лікування розподілили на 2 групи. Групу 1 склали 40 пацієнтів, які отримали лікування в обсязі 2 курсів неоад’ювантної поліхіміотерапії (ПХТ) з наступним хірургічним втручанням. Група 2 — 41 хворий, у якого лікування розпочиналося із 2 курсів неоад’ювантної ПХТ та курсу променевої терапії (ПТ) (сумарна вогнищева доза 40–45 Гр) з наступним хірургічним лікуванням. Проведено оцінку відповіді пухлини на лікування за системою Response Evaluation Criteria in Solid Tumors (RECIST) 1.1. Визначено достовірно значиму різницю (p=0,04) об’єктивної відповіді пухлини на проведене лікування в групі 2, яка становила 19,4±6,2%, порівняно з групою 1, об’єктивна відповідь в якій сягала 5,0±3,4%. Наступним критерієм оцінки відповіді була відносна частка життєздатної пухлинної тканини (ВЧЖПТ). Виявлено статистично достовірну різницю (p=0,01) між групою 1, позитивний ефект ВЧЖПТ (III–VI ступеня) в якій становив 52,5±7,9%, та групою 2, середня ВЧЖПТ в якій становила 87,8±5,1%. Можна зробити висновок про перевагу комбінації ПХТ+ПТ в неоад’ювантному лікуванні хворих на саркому м’яких тканин.
Одержано 19.10.2017
Прийнято до друку 06.03.2018
Вступ
Саркоми м’яких тканин (СМТ) — група рідкісних пухлин, що охоплює близько 50 різних морфологічних підтипів, які можуть суттєво відрізнятися клінічною картиною захворювання, відповіддю на лікування та ризиком прогресування патологічного процесу [1, 2]. Питома вага СМТ становить 1% усіх злоякісних пухлин, показник захворюваності сягає 6 нових випадків на кожні 100 тис. населення [3, 4]. Пухлина може розвиватися в будь-якому віці та фактично на будь-якій ділянці людського тіла.
Наразі алгоритм застосування методів лікування хворих на СМТ остаточно не визначений [5]. Хірургічний метод є основним стандартом в лікуванні цієї патології, найвища ефективність досягається при виконанні резекції із негативними краями [6]. Променева терапія (ПТ) використовується для зниження ризику виникнення локального рецидиву захворювання. Вона може бути застосована в неоад’ювантному режимі для зменшення вогнища ураження, що сприяє радикальності хірургічного лікування [7]. Використання системної поліохіміотерапії (ПХТ) в ад’ювантному режимі із ПТ чи без неї вивчено в рандомізованих дослідженнях [8]. Така стратегія лікування підвищує 5-річну виживаність від 5 до 10% [9]. Усе частіше використовують неоад’ювантну ПХТ у лікуванні пацієнтів з локальними формами СМТ високого ступеня ризику. Існує низка переваг при застосуванні ПХТ у передопераційному режимі. Зокрема, з’являється можливість проведення менш агресивного хірургічного лікування при позитивній відповіді пухлини на передопераційну терапію. Необхідно зазначити, що проведення неоад’ювантної ПХТ може потенціювати ефект ПТ у зв’язку з її радіосенсибілізуючою дією. У статті представлено порівняльний аналіз ефективності двох схем неоад’ювантного лікування хворих на СМТ високого ступеня ризику шляхом оцінки відповіді пухлини за системою Response Evaluation Criteria in Solid Tumors (RECIST) 1.1. та визначення за допомогою гістологічного дослідження залишкової життєздатної пухлинної тканини.
Об’єкт і методи дослідження
У дослідження включено 81 хворого на СМТ кінцівок і тулуба IIb–III стадії, що проходили лікування в Національному інституті раку в період з 2010 по 2016 р.
Критеріями включення пацієнтів в групи, проаналізовані в дослідженні, були патогістологічно верифікована СМТ тулуба та кінцівок, хірургічне видалення пухлини R0–R1, відсутність клінічних ознак метастатичного ураження, вік старше 18 років, ECOG 0–1 бал.
У план обстеження хворих входили:
- комп’ютерна томографія органів черевної порожнини;
- комп’ютерна томографія органів грудної порожнини та малого таза;
- магнітно-резонансна томографія (МРТ) місця локалізації пухлини;
- товстоголкова або трепан-біопсія пухлини;
- лабораторні дослідження.
Хірургічний етап лікування включав радикальне і абластичне видалення пухлини, за можливості в фасціальному футлярі. Операцію виконували під загальною анестезією. Шви знімали на 12–14-ту добу на момент повного загоєння післяопераційної рани.
Залежно від застосованого алгоритму лікування пацієнтів розподілили на 2 групи.
До першої групи включено 40 пацієнтів. Хворі цієї групи отримували лікування за розробленою методикою:
а) неоад’ювантна системна ПХТ за протоколом СYVADIC — 2 курси з інтервалом 3 тиж:
– 1-й день:
- вінкристин — 1,4 мг/м, не більше 2 мг;
- доксорубіцин — 50 мг/м;
- дакарбазин — 400 мг/м;
- циклофосфамід — 0,5 г/м;
– 2-й день:
- дакарбазин — 400 мг/м;
– 3-й день:
- дакарбазин — 400 мг/м;
б) хірургічне втручання з видалення пухлини через 4 тиж після закінчення опромінення;
в) ад’ювантна системна ПХТ — 2 курси з інтервалом 3 тиж:
– 1-й день:
- вінкристин — 1,4 мг/м, не більше 2 мг;
- доксорубіцин — 20 мг/м;
- циклофосфамід — 0,5 г/м;
– 2-й день:
- доксорубіцин — 20 мг/м;
- циклофосфамід — 0,5 г/м;
– 3-й день:
- доксорубіцин — 20 мг/м;
- циклофосфамід — 0,5 г/м;
г) ад’ювантна ПТ на ділянку післяопераційного рубця в сумарній вогнищевій дозі (СВД) 50–55 Гр при разовій вогнищевій дозі (РВД) 2,2 Гр.
Хворим на СМТ високого ступеня ризику у 2-й групі (41 пацієнт) проводили лікування у такому режимі:
а) неоад’ювантна системна ПХТ за протоколом СYVADIC:
– 1-й день:
- вінкристин — 1,4 мг/м, не більше 2 мг;
- доксорубіцин — 50 мг/м;
- дакарбазин — 400 мг/м;
- циклофосфамід — 0,5 г/м;
– 2-й день:
- дакарбазин — 400 мг/м;
– 3-й день:
- дакарбазин — 400 мг/м;
б) доопераційна ПТ на ділянку пухлини до СВД 35 Гр при РВД 2,2 Гр;
в) хірургічне втручання з видалення пухлини через 4 тиж після закінчення опромінення;
г) ад’ювантна системна ПХТ: два курси з інтервалом 3 тиж:
– 1-й день:
- вінкристин — 1,4 мг/м, не більше 2 мг;
- доксорубіцин — 20 мг/м;
- циклофосфамід — 0,5 г/м;
– 2-й день:
- доксорубіцин — 20 мг/м;
- циклофосфамід — 0,5 г/м;
– 3-й день:
- доксорубіцин — 20 мг/м;
- циклофосфамід — 0,5 г/м;
д) ад’ювантна ПТ на ділянку післяопераційного рубця в СВД 25 Гр при РВД 2,2 Гр.
Порівняльний аналіз основних характеристик пацієнтів дослідних груп представлено в табл. 1.
| Характеристики | Група 1 (n=40) |
Група 2 (n=41) |
|
| Стать | Чоловіки | 20 (50,0%) | 16 (39,0%) |
| Жінки | 20 (50,0%) | 25 (61,0%) | |
| Вік | 16–30 років | 4 (10,0%) | 8 (19,5%) |
| 31–50 років | 15 (37,5%) | 13 (31,7%) | |
| >50 років | 21 (52,5%) | 20 (48,8%) | |
| Градація G | G3 | 37 (92,5%) | 37 (90,3%) |
| G4 | 4 (7,5%) | 4 (9,7%) | |
| Підтипи саркоми м’яких тканин | Ангіосаркома | 6 (15,0%) | 6 (14,6%) |
| Злоякісна мезенхімома | 2 (5,0%) | 9 (22,0%) | |
| Поліморфноклітинна саркома | 10 (25,0%) | 9 (22,0%) | |
| Лейоміосаркома | 0 | 3 (7,3%) | |
| Ліпосаркома | 5 (12,5%) | 5 (12,2%) | |
| Нейросаркома | 9 (22,5%) | 2 (4,9%) | |
| Рабдоміосаркома | 1 (2,5%) | 3 (7,3%) | |
| Некласифікована саркома | 2 (5,0%) | 0 | |
| Синовіальна саркома | 5 (12,5%) | 4 (9,7%) | |
| Нижні кінцівки | Стегно | 24 (60,0%) | 28 (68,3%) |
| Гомілка та стопа | 4 (10,0%) | 7 (17,1%) | |
| Тулуб | 4 (10,0%) | 0 | |
| Верхні кінцівки | Кисть та передпліччя | 1 (2,5%) | 4 (9,7%) |
| Плече | 7 (17,5%) | 2 (4,9%) | |
Оцінку об’єктивної відповіді на терапію проводили за системою RECIST 1.1 після неоад’ювантного лікування з обов’язковим визначення країв резекції пухлини та аналізом лікувального патоморфозу після неоад’ювантної терапії з визначенням відносної частки життєздатної пухлинної тканини (ВЧЖПТ).
За критеріями RECIST 1.1 (2009) оцінюються розміри вогнища ураження. Сума розмірів до лікування розглядається як базовий діаметр і порівнюється з сумою після лікування. Критерії ефекту терапії такі:
- повна регресія — зникнення всіх вогнищ ураження після проведеного лікування;
- часткова регресія — зменшення вимірюваних вогнищ на 30% та більше;
- стабілізація — зменшення вимірюваних вогнищ менше ніж на 30% та збільшення до 20%;
- прогресування — збільшення на 20% і більше вимірюваних вогнищ чи поява нових патологічних вогнищ.
Для кількісних критеріїв обліку загибелі пухлинної паренхіми, індукованої протипухлинною терапією, використовувалася схема — шкала оцінки лікувального патоморфозу за операційним матеріалом:
- 0 ступінь — ВЧЖПТ не менше 95% пухлинних клітин. Лікування неефективне, результат поганий;
- I ступінь — ВЧЖПТ від 75 до 95% пухлинних клітин. Лікування незадовільне, результат несуттєвий;
- II ступінь — ВЧЖПТ від 50 до 70% пухлинних клітин. Лікування низької ефективності, результат посередній;
- III ступінь — ВЧЖПТ від 25 до 50% пухлинних клітин. Лікування середньої ефективності, результат задовільний;
- IV ступінь — ВЧЖПТ від 10 до 25% пухлинних клітин. Лікування з ефектом вище середнього, результат хороший;
- V ступінь — ВЧЖПТ менше 10% пухлинних клітин. Лікування високої ефективності, результат дуже хороший;
- VI ступінь — відсутність збережених пухлинних клітин. Лікування максимально високої ефективності, результат відмінний.
Результати
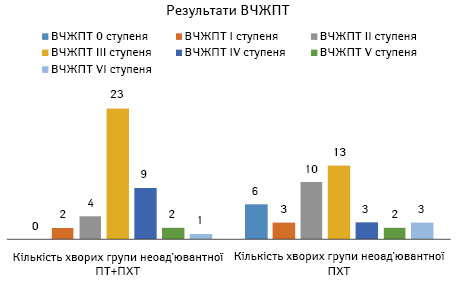
Безпосередні результати лікування, оцінку відповіді на неоад’ювантну терапію за системою RECIST 1.1 наведено в табл. 2, 3 та на рис. 1, 2.
| Відповідь пухлини на терапію | Група 1 (n=40) |
Група 2 (n=41) |
р | ||
| N | % | N | % | ||
| Пролонгація | 7 | 17,5 | 3 | 7,3 | 0,16 |
| Стабілізація | 31 | 77,5 | 30 | 73,2 | 0,65 |
| Часткова регресія | 2 | 5,0 | 7 | 17,0 | 0,08 |
| Повна регресія | 0 | 0,0 | 1 | 2,4 | 0,31 |
| Показник загальної частоти відповідей |
2 | 5,0* | 8 | 19,4* | 0,04 |
*Cума часткового та повного регресу пухлини.
| Група | ВЧЖПТ 0–II ступеня, N (%) |
ВЧЖПТ III–VI ступеня, N (%) |
Загальна кількість, N (%) |
| 1 (n=40) | 19 (47,5) | 21 (52,5) | 40 (100,0) |
| 2 (n=41) | 5 (12,2) | 36 (87,8) | 41 (100,0) |
| р | 0,01 | 0,01 |
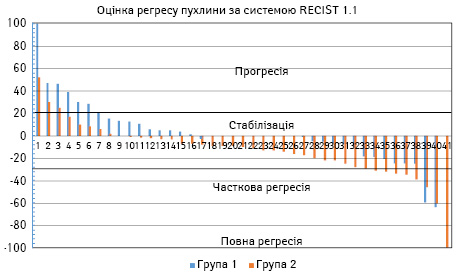
За даними оцінки виявлено достовірно значиму різницю (p=0,04) відповіді пухлини, що включала частковий та повний регрес пухлини на проведене лікування в групі 2, ефективність в якій становила 19,4±6,2%, порівняно з групою 1, середня відповідь в якій сягала 5,0±3,4%.
При вивченні відповіді пухлинної тканини на проведене неоад’ювантне лікування методом гістологічної оцінки ВЧЖПТ виявлено статистично достовірну різницю (p=0,01) між групою 1, позитивний ефект ВЧЖПТ (III–VI ступеня) в якій становив 52,5±7,9%, та групою 2, позитивна ВЧЖПТ в якій була 87,8±5,1 (див. табл. 1, 2 та рис. 1, 2).
Клінічний випадок
Пацієнт Ч., чоловік 40 років, поступив у червні 2016 р. у відділення онкоортопедії та пухлин шкіри і м’яких тканин Національного інституту раку зі скаргами на наявність пухлини в м’яких тканинах правого стегна. За словами хворого, утворення спостерігає протягом 4 років, пухлина значно збільшилася в розмірах, відмітив появу болю в зоні локалізації пухлини за 2 міс до звернення. Проведено трепан-біопсію (попередній гістологічний висновок — нейросаркома G3).
21.06.2016 р. виконано комп’ютерну томографію головного мозку, органів черевної, грудної порожнини та малого таза. Патології не виявлено.
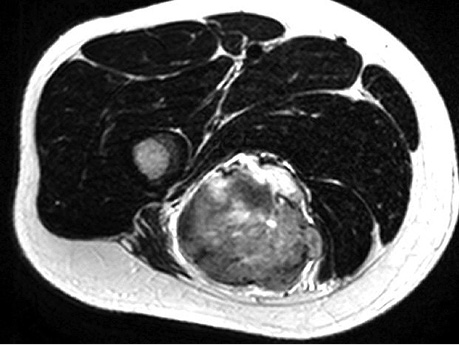
Результати МРТ м’яких тканин лівого стегна (23.06.2016 р.): у ділянці м’язів задньої групи правого стегна (головним чином в довгій голівці двоголового м’яза та меншою мірою в короткій голівці і великому привідному м’язі, а також частково в сідничному м’язі та квадратному м’язі стегна) візуалізується масивне, видовженої форми, солідне утворення розмірами 68×71×180 мм. Утворення розповсюджується по міжфасціальних просторах і залучає в себе сідничний нерв та судинний пучок, який його супроводжує. Стегнова кістка інтактна (рис. 3).
Хворому проведено 2 курси неоад’ювантної ПХТ за схемою CyVADIC. Контроль МРТ (02.09.2016 р.): у ділянці м’язів задньої групи правого стегна (головним чином у довгій голівці двоголового м’яза та меншою мірою в короткій голівці і великому привідному м’язі, а також частково в сідничному м’язі та квадратному м’язі стегна) візуалізується масивне, видовженої форми, солідне утворення розмірами 61×53×103 мм (рис. 4).
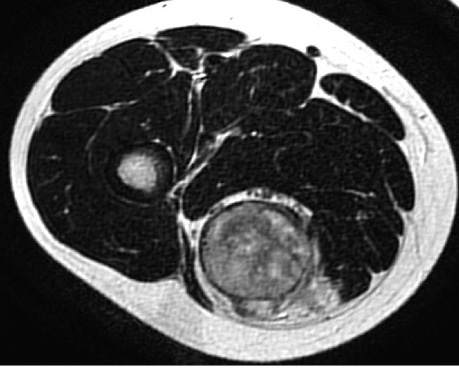
За системою оцінки RECIST 1.1 відповідь пухлини на лікування становила –31,97%, що відповідає частковій регресії. У подальшому проведено оперативне лікування в обсязі широкого висічення пухлини м’яких тканин правого стегна, краї резекції негативні (R0), оцінка ВЧЖПТ становила 50%.
Висновки
Порівняльний аналіз безпосередніх результатів лікування дозволив нам зробити такі висновки: застосування в неоад’ювантному режимі комбінації ПХТ та ПТ має переваги порівняно з використанням в неоад’ювантному режимі тільки ПХТ, що потребує додаткового дослідження віддалених результатів лікування хворих на СМТ, які одержали лікування за зазначеними схемами.
Список використаної літератури
1. Fletcher C.D.M., Bridge J.A., Hogendoorn P. et al. (2013) WHO classification of tumours of soft tissue and bone. Pathology and genetics of tumours of soft tissue and bone. Lyon: IARC Press.
2. Jo V.Y., Doyle L.A. (2016) Refinements in sarcoma classification in the current 2013 World Health Organization Classification of Tumours of Soft Tissue and Bone. Surg. Oncol. Clin. N. Am., 25: 621–643.
3. Miller K.D., Siegel R.L., Lin C.C. et al. (2016) Cancer treatment and survivorship statistics, 2016. CA Cancer J. Clin., 66: 271–289.
4. Siegel R.L., Miller K.D., Jemal A. (2016) Cancer statistics, 2016. CA Cancer J. Clin., 66: 7–30.
5. ESMO/European Sarcoma Network Working Group (2014) Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 25(Suppl. 3): iii102–iii112.
6. Cable M.G., Randall R.L. (2016) Extremity soft tissue sarcoma: tailoring resection to histologic subtype. Surg. Oncol. Clin. N. Am., 25: 677–695.
7. Larrier N.A., Czito B.G., Kirsch D.G. (2016) Radiation therapy for soft tissue sarcoma: indications and controversies for neoadjuvant therapy, adjuvant therapy, intraoperative radiation therapy, and brachytherapy. Surg. Oncol. Clin. N. Am., 25: 841–860.
8. Casali P.G. (2015) Adjuvant chemotherapy for soft tissue sarcoma. Am. Soc. Clin. Oncol. Educ. Book: e629–e633.
9. Pervaiz N., Colterjohn N., Farrokhyar F. et al. (2008) A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer, 113: 573–581.
Саркомы мягких тканей конечностей и туловища высокой степени риска: исследования оценки неоадъювантного лечения с помощью критериев RECIST и относительной доли жизнеспособной опухолевой ткани
Национальный институт рака, Киев
Резюме. 81 больного саркомой мягких тканей ІІb–ІІІ стадии в зависимости от схемы неоадъювантного лечения распределили на 2 группы. Группу 1 составили 40 пациентов, получивших лечение в объеме 2 курсов неоадъювантной полихимиотерапии (ПХТ) с последующим хирургическим вмешательством. Группа 2 — 41 больной, у которых лечение начинали с 2 курсов неоадъювантной ПХТ и курса лучевой терапии (ЛТ) (суммарная очаговая доза 40–45 Гр) с последующим хирургическим лечением. Проведена оценка ответа опухоли на лечение по системе Response Evaluation Criteria in Solid Tumors (RECIST) 1.1. Определена достоверно значимая разница (p=0,04) объективного ответа опухоли на проводимое лечение в группе 2, который составил 19,4±6,2%, по сравнению с группой 1, объективный ответ в которой достиг 5,0±3,4%. Следующим критерием оценки ответа была относительная доля жизнеспособной опухолевой ткани (ОДЖОТ). Выявлена статистически достоверная разница (p=0,01) между группой 1, положительный эффект ОДЖОТ (III–VI степени) в которой составил 52,5±7,9%, и группой 2, средняя ОДЖОТ в которой составила 87,8±5,1%. Можно сделать вывод о преимуществе комбинации ПХТ+ЛТ в неоадъювантном лечении больных саркомой мягких тканей.
саркома мягких тканей; неоадъювантное лечение; лучевая терапия; химиотерапия.
Остафійчук Василь Васильович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 257-99-46
E-mail: lugnik2007@gmail.com
Correspondence:
Ostafiichuk Vasyl
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
Tel.: (044) 257-99-46
E-mail: lugnik2007@gmail.com














Leave a comment