Роль неоад’ювантної та ад’ювантної хіміотерапії у лікуванні хворих на рак легені (огляд літератури)
Колеснік О.П., Шевченко А.І., Каджоян А.В., Кузьменко В.О., Кабаков А.О., Михайлов В.В.
Резюме. На сьогодні рак легені (РЛ) є лідером у структурі захворюваності та смертності від злоякісних новоутворень в усьому світі. Щороку у світі діагностують більш ніж 1,6 млн нових випадків захворювання на РЛ, а смертність від РЛ становить понад 1,2 млн людей. Прогнозується, що до 2035 р. смертність від РЛ сягне 3 млн осіб на рік. Лідером за захворюваністю є Центральна і Східна Європа (53,5 випадку на 100 тис. населення). У статті на підставі даних спеціалізованої наукової літератури проаналізовано сучасні підходи до неоад’ювантної (НАПХТ) та ад’ювантної поліхіміотерапії (АПХТ) при лікуванні хворих на недрібноклітинний РЛ. Проведення НАПХТ та АПХТ є важливим етапом лікування хворих на РЛ, оскільки дозволяє покращити загальну та безрецидивну виживаність пацієнтів. При проведенні НАПХТ вдається досягнути радикальної резекції R0 40,0% (пеметрексед/цисплатин), 29,0% (карбоплатин/паклітаксел) та 18,0% (цисплатин/вінбластин) відповідно. Профіль токсичності є невід’ємним компонентом у виборі схеми поліхіміотерапії. Краща переносимість схеми збільшує кількість проведених циклів хіміотерапії, що в свою чергу покращує показники виживаності та якості життя. Переносимість схеми цисплатин/віндезин становить 45,0–69,0%, карбоплатин/паклітаксел — 57% та пеметрексед/цисплатин — 81,0% відповідно.
Одержано 30.04.2018
Прийнято до друку 01.06.2018
На сьогодні рак легені (РЛ) є лідером у структурі захворюваності та смертності від злоякісних новоутворень в усьому світі. Щороку у світі діагностують більш ніж 1,6 млн нових випадків захворювання на РЛ, а смертність від РЛ становить понад 1,2 млн людей. Прогнозується, що до 2035 р. смертність від РЛ сягне 3 млн осіб на рік. Лідером за захворюваністю є Центральна і Східна Європа (53,5 випадку на 100 тис. населення) [1].
Згідно з даними Американської протиракової спільноти (American Cancer Society), 5-річна виживаність хворих на РЛ залежить від стадії захворювання. Так, при IA1 стадії недрібноклітинного раку легені (НДКРЛ) 5 років проживають 92,0% пацієнтів, IA2 — 83,0%, IA3 — 77,0%, при IIА стадії цей показник становить 60,0%, а при ІІB стадії — 53,0%. При III стадії спостерігається значне зниження загальної виживаності (ЗВ). Таким чином, при ІІІА стадії 5 років прожило 36,0% пацієнтів, ІІІB — 26,0%, IIIС — лише 13,0%. Низькими залишаються показники ЗВ при IV стадії РЛ (10,0% — IVА, <1,0% — при IVB стадії) [1].
Методами лікування РЛ є: хірургічний, хіміотерапія, променева, таргетна терапія та імунотерапія.
При НДКРЛ I–II стадії основним методом лікування є хірургічне втручання. Операцією вибору є лобектомія та пульмонектомія, залежно від розповсюдженості захворювання. Виконання атипової резекції можливе лише у хворих із супутньою патологією, що не дає змоги виконати операції більшого обсягу, та тільки після ретельного вивчення стану лімфатичних вузлів. Однак після хірургічного лікування у частини пацієнтів виникає прогресування захворювання. Так, 60,0% хворих з I–III стадіями НДКРЛ після хірургічного лікування мають рецидив онкологічної патології [2].
Саме тому проведення додаткового лікування є актуальним [3]. Застосування ад’ювантної (АПХТ) та неоад’ювантної поліхіміотерапії (НАПХТ) покращує ЗВ пацієнтів із НДКРЛ, яким проведено хірургічне лікування [4, 5].
На рис. 1–3 показано метааналіз досліджень ефективності НАПХТ у хворих на НДКРЛ [5]. Як видно з даних представлених рисунків, відмічається статистично значуще підвищення виживаності хворих, яким проведено додаткове передопераційне хіміотерапевтичне лікування.
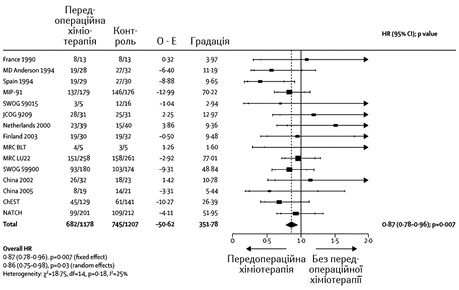
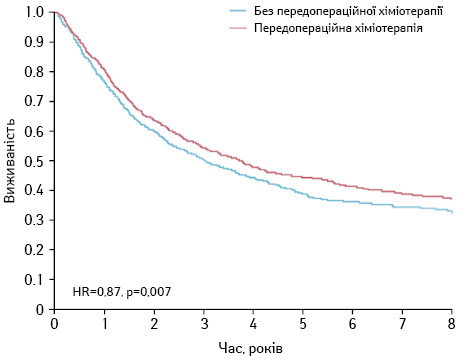
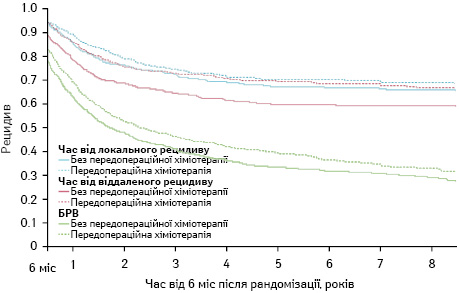
Згідно зі стандартами NCCN 2018 р. (рис. 4), НАПХТ слід призначати при II або IIIA (T3, N1) стадії захворювання. Найбільш ефективним такий вид лікування є у пацієнтів з N2 «позитивними» лімфатичними вузлами [6, 7]. За даними W. Song та співавторів (2010 р.), проведення НАПХТ дозволяє поліпшити резектабельність і виживаність пацієнтів із НДКРЛ [8].

Однак невирішеним залишається питання вибору найефективніших схем НАПХТ. Наразі чіткої відповіді на це запитання немає.
Вважається, що одним із найважливіших показників ефективності НАПХТ є кількість об’єктивних відповідей пухлини. Так, G. Bepler та співавтори у своєму дослідженні, опублікованому у 2009 р., показали, що при терапії комбінацією пеметрексед/цисплатин об’єктивна відповідь пухлини на лікування відзначена у 35,0% хворих із I–III стадіями НДКРЛ, стабілізацію захворювання зафіксовано у 59,0% пацієнтів, прогресування — у 6,0% [9]. У схожому дослідженні V. Noronha та співавторів (2018 р.) при застосуванні пеметрекседу у монорежимі кількість об’єктивних відповідей (повна і часткова відповіді) становила при НАПХТ 36,4%, прогресування захворювання відзначалося у 12,5% пацієнтів. При цьому R0-резекцію вдалося виконати у 40,0% пацієнтів [7]. В аналогічному дослідженні D. De Candis та співавторів (2003 р.) при проведенні хіміотерапії у неоад’ювантному режимі за схемою карбоплатин/паклітаксел визначили, що радикальну операцію вдалося виконати у 29,0% пацієнтів [10]. За даними D. Johnson та співавторів (1991 р.), при використанні схеми цисплатин/вінбластин операція була виконана у 18,0% хворих, причому R0-резекція досягнута у 10,0% прооперованих [11].
Важливим є вплив НАПХТ на виживаність пацієнтів на ранніх стадіях НДКРЛ (IВ, IIА стадії). Безрецидивна виживаність (БРВ) хворих на НДКЛР II стадії після проведення НАПХТ пеметрекседом з подальшим хірургічним лікуванням становила 38 міс (95,0% CI 28,1–47,9 міс) і при IIIA стадії 21,0 міс (95,0% CI 13,7–28,3 міс). Дворічна БРВ сягала 70,5 і 45,9% відповідно [3].
В аналогічному дослідженні G. Bepler і співавторів (2009 р.) однорічна ЗВ пацієнтів, які отримали лікування пеметрекседом з подальшим хірургічним втручанням, становила 84,6%, дворічна — 71,0%, БРВ відповідно — 67,5 і 51,3% [9]. При використанні схеми карбоплатин/паклітаксел медіана виживаності сягала 15,0 міс, одно- і дворічна виживаність становила 51,0 і 22,0% відповідно [10]. У дослідженні M. Davidov та співавторів (2011 р.) при використанні схеми гемцитабін/цисплатин у неоад’ювантному режимі однорічна виживаність досягала 74,4%, однак прогресування захворювання при використанні цієї схеми відмічено у 30,0% пацієнтів [12].
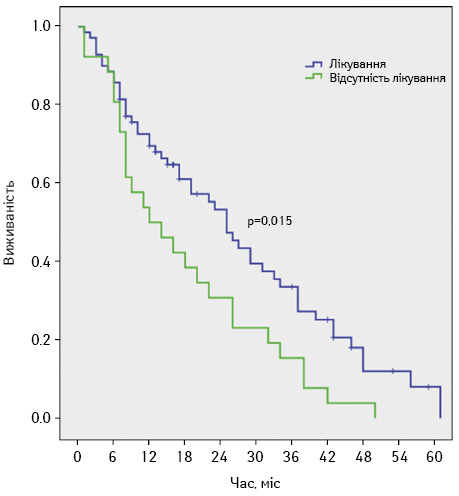
У дослідженні [7] V. Noronha та співавторів (2018 р.) вивчали ефективність НАПХТ при використанні схеми пеметрексед/цисплатин порівняно з відсутністю лікування у хворих на РЛ з N2-позитивним статусом. Медіана БРВ становила 15,0 міс у пацієнтів, які отримували НАПХТ, проти 8,0 міс у пацієнтів, які не одержували терапії. Медіана ЗВ: 25,0 проти 12,0 міс (рис. 5) [7].
Невід’ємною частиною лікування пацієнтів із НДКРЛ є проведення післяопераційної хіміотерапії. АПХТ доцільна навіть на ранніх стадіях РЛ, що доведено у багатьох рандомізованих дослідженнях [13–15]. Так, в дослідженні JBR.10, в якому брали участь 482 пацієнти, проводили АПХТ за схемою цисплатин/вінорельбін. Встановлено абсолютну перевагу ЗВ та БРВ пацієнтів після АПХТ порівняно з хворими, які не отримували додаткового післяопераційного лікування. Так, ЗВ пацієнтів у групі АПХТ становила 69,0%, тоді як у пацієнтів без АПХТ 5-річна ЗВ сягала 54,0%. Медіана ЗВ — 94,0 міс проти 73,0 міс (р=0,01) відповідно. У схожому багатоцентровому дослідженні CALGB9633, в яке залучено 344 пацієнти з НДКРЛ ІВ стадії, хворим проводилася АПХТ за схемою карбоплатин/паклітаксел. У пацієнтів відмічалося статистично значуще покращення 4-річної ЗВ (71,0% проти 59,0%) при проведенні АПХТ [15].
Отримані дані свідчать про високу ефективність та задовільну переносимість цього АПХТ у пацієнтів з НДКРЛ.
Незважаючи на поліпшення виживаності, що спостерігається після проведення НАПХТ та АПХТ, не можна ігнорувати і токсичність такого виду лікування. Згідно з аналізом LACE щонайменше 33,0% хворих не проходять необхідну кількість курсів НАПХТ та АПХТ в зв’язку з токсичністю III і IV ступеня, яка виникає у 66,0% пацієнтів. У деяких дослідженнях частота гематологічних небажаних явищ сягала позначки 85,0%.
Доведено, що ефективність НАПХТ та АПХТ залежить від кількості курсів проведеного лікування, що в свою чергу корелює з токсичністю лікування.
Як видно із таблиці, при використанні схеми пеметрексед/цисплатин у дослідженні NCT00349089 «TREAT» (2013 р.) процент небажаних явищ становив 10,0%. Так, за даними G. Bepler та співавторів (2009 р.), НАПХТ з використанням пеметрекседу вдалося в повному обсязі провести у 81,0% пацієнтів [9]. При використанні інших схем хіміотерапії, як показано у таблиці, процент небажаних явищ становив від 17,5 до 73,0%.
| Дослідження | Рік публікації | Загальна кількість пацієнтів | Стадія захворювання | Режим хіміотерапії | Кількість циклів | Нейтропенія III/IV ступеня, % | ЗВ |
| ALPI | 2003 | 1209 | I, II, IIIA | Цисплатин/віндезин | 3 | 28,0 | p=0,589 |
| IALT | 2004 | 1867 | I, II, III | Цисплатин | 3/4 | 17,5 | p<0,03 |
| BLT | 2004 | 381 | I, II, III | Цисплатин | 3 | 40,0 | p=0,90 |
| JBR 10 | 2005 | 482 | IB, II | Цисплатин/вінорельбін | 4 | 73,0 | p=0,04 |
| ANTA | 2006 | 840 | IB, II, IIIA | Цисплатин/вінорельбін | 4 | 85,0 | p=0,017 |
| CALG8 9633 | 2008 | 344 | IB | Карбоплатин/паклітаксел | 4 | 35,0 | p=0,12 |
| NCT00349089 (TREAT) | 2013 | 132 | IB, IIA, IIB і T3N1 | Пеметрексед/цисплатин | 4 | 10,0 | p<0,001 |
Водночас при застосуванні пеметрекседу відмічається досить низька токсичність. Найбільш частими негативними проявами поліхіміотерапії є нейтропенія — 63,4% (13,4% III–IV ступеня), слабкість — 43,9%, нудота/блювання — 57,3%, підвищення рівня трансаміназ — 22,0% [3].
ВИСНОВКИ
1. Проведення НАПХТ та АПХТ є важливим етапом лікування хворих на РЛ, що дозволяє поліпшити ЗВ та БРВ пацієнтів із НДКРЛ.
2. При проведенні НАПХТ за різними схемами вдається досягнути радикальної резекції R0 40,0% (пеметрексед/цисплатин), 29,0% (карбоплатин/паклітаксел) та 18,0% (цисплатин/вінбластин) відповідно.
3. Профіль токсичності є невід’ємним компонентом у виборі схеми поліхіміотерапії. Краща переносимість лікування збільшує кількість проведених циклів хіміотерапії, що в свою чергу покращує показники виживаності та якості життя. Переносимість схеми цисплатин/віндезин становила від 45,0 до 69,0%, при схемі карбоплатин/паклітаксел — 57,0% та пеметрексед/цисплатин — 81,0% відповідно.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Fedorenko Z.P., Mykhailovych Yu.I., Gulak L.O. et al. (2015) Rak v Ukraini, 2015–2016 [Cancer in Ukraine, 2015–2016]. Biuleten Natsionalnoho kantser-reiestru Ukrainy, 18 [in Ukrainian].
2. Mountain C.F. (1997) Revisions in the International System for Staging Lung Cancer. Chest, 111: 1710–1717.
3. Zhang L., Wei Ou, Qianwen L. et al. (2014) Pemetrexed plus carboplatin as adjuvant chemotherapy in patients with curative resected non-squamous non-small cell lung cancer. Thoracic Cancer, 5: 50–56.
4. Pignon J., Tribodet H., Scagliotti G. et al. (2008) Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J. Clin. Oncol., 26: 3552–3559.
5. NSCLC Meta-analysis Collaborative Group (2014) Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data. Lancet, 383 (9928):1561–1571.
6. Vansteenkiste J., De Ruysscher D., Eberhardt W. et al. (2013) Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 24 (6): 89–98.
7. Noronha V., Zanwar S., Joshi A. et al. (2018) Original article practice patterns and outcomes for pemetrexed plus platinum doublet as neoadjuvant chemotherapy in adenocarcinomas of lung: looking beyond the usual paradigm. Clin. Oncol., 30: 23–29.
8. Song W., Zhou N., Wang W. et al. (2010) Survival benefit of neoadjuvant chemotherapy in non-small cell lung cancer: an updatedmeta-analysis of 13 randomized control trials. J. Thorac. Oncol., 5: 510–516.
9. Bepler G., Sommers K., Cantor A. (2008) Clinical efficacy and predictive molecular markers of neoadjuvant gemcitabine and pemetrexed in resectable non-small-cell lung cancer. J. Thorac Oncol., 3(10): 1112–1118.
10. De Candis D., Stani S., Bidoli P. et al. (2003) Induction chemotherapy with carboplatin/paclitaxel followed by surgery or standard radiotherapy and concurrent daily low-dose cisplatin for locally advanced non-small cell lung cancer (NSCLC). J. Clin. Oncol., 26(3): 265–269.
11. Johnson D., Strupp J., Greco F. et al. (1991) Neoadjuvant cisplatin plus vinblastine chemotherapy in locally advanced non-small cell lung cancer. Cancer, 68(6): 1216–1220.
12. Davidov M., Polotzky B., Marenich A. et al. (2011) Gemcitabine combined with cisplatin as neoadjuvant chemotherapy in stage IB-IIIA non-small cell lung cancer. Anticancer Drugs, 22(6): 569–575.
13. Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group (1995) BMJ, 311(7010): 899–909.
14. Winton T., Livingston R., Johnson D. et al. (2005) Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. N. Engl. J. Med., 352(25): 2589–2597.
15. Strauss G., Wang X., Maddaus M. et al. (2011) Adjuvant chemotherapy (AC) in stage IB non-small cell lung cancer (NSCLC): Long-term follow-up of Cancer and Leukemia Group B (CALGB) 9633. J. Clin. Oncol., 29(15): 7015–7015.
Роль неоадъювантной и адъювантной химиотерапии в лечении больных раком легкого (обзор литературы)
Запорожский государственный медицинский университет
Резюме. На сегодня рак легкого (РЛ) является лидером в структуре заболеваемости и смертности от злокачественных новообразований во всем мире. Ежегодно в мире диагностируют более 1,6 млн новых случаев заболевания РЛ, а смертность от РЛ составляет более 1,2 млн человек. Прогнозируется, что к 2035 г. смертность от РЛ достигнет 3 млн человек в год. Лидером по заболеваемости является Центральная и Восточная Европа (53,5 случая на 100 тыс. населения). В статье на основании данных специализированной научной литературы проанализированы современные подходы к неоадъювантной (НАПХТ) и адъювантной полихимиотерапии (АПХТ) в лечении больных немелкоклеточным РЛ. Проведение НАПХТ и АПХТ является важным этапом лечения больных РЛ, так как позволяет улучшить общую и безрецидивную выживаемость пациентов. При проведении НАПХТ удается достичь радикальной резекции R0 40,0% (пеметрексед/цисплатин), 29,0% (карбоплатин/паклитаксел) и 18,0% (цисплатин/винбластин) соответственно. Профиль токсичности является неотъемлемым компонентом при выборе схемы полихимиотерапии. Лучшая переносимость схемы увеличивает количество проведенных циклов химиотерапии, что в свою очередь улучшает показатели выживаемости и качества жизни. Переносимость схемы цисплатин/виндезин составляла 45,0–69,0%, при схеме карбоплатин/паклитаксел — 57% и пеметрексед/цисплатин — 81,0% соответственно.
немелкоклеточный рак легкого; неоадъювантная химиотерапия; адъювантная химиотерапия.
Колеснік Олексій Петрович
69091, Запоріжжя, вул. Нижньодніпровська, 4/238
Запорізький державний медичний університет
Тел.: (097) 315-31-78
Факс: (0612) 96-34-96
E-mail: oleksiikolesnik@gmail.com
Correspondence:
Kolesnik Oleksiy
4/238 Nyzhnodniprovska str., Zaporizhzhia 69091
Zaporizhzhia State Medical University
Tel.: (097) 315-31-78
Fax: (0612) 96-34-96
E-mail: oleksiikolesnik@gmail.com














Leave a comment