Результати застосування високодозової поліхіміотерапії з аутологічною трансплантацією гемопоетичних стовбурових клітин в лікуванні ембріональних пухлин ЦНС у дітей (досвід одного центру)
Приходько І.О., Климнюк Г.І., Шайда Е.В., Павлик С.В. , Іжовський О.Й., Стежка М.О., Велимчаниця М.В.
Резюме. Пухлини центральної нервової системи (ЦНС) залишаються одними з найбільш розповсюджених злоякісних новоутворень у дітей, займаючи за частотою друге місце після гострих лейкозів та третє — після гострих лейкозів і лімфом в Україні. Сучасні протоколи лікування пухлин ЦНС у дітей віком до 4 років включають оперативне втручання і курси інтенсивної поліхіміотерапії (ПХТ), у дітей старше 4 років — операцію, променеву терапію (локальну і краніоспінальну) і підтримувальну ПХТ за схемою ломустин/цисплатин/вінкристин. Але незважаючи на це, за результатами, отриманими робочою групою за протоколом HIT-2000, діти до 3 років мають низьку 5-річну загальну виживаність (ЗВ) — 12–28% порівняно зі старшою віковою групою — 55–73%. З метою підвищення ЗВ цієї групи пацієнтів впроваджено використання високодозової хіміотерапії (ВДХТ) з аутологічною трансплантацією гемопоетичних стовбурових клітин (ауто-ТГСК), що дозволяє досягти високих концентрацій хіміопрепаратів у ЦНС і сприяє підвищенню ефективності лікування. Висока ефективність ауто-ТГСК встановлена в лікуванні супратенторіальних примітивних нейроектодермальних пухлин у першій лінії терапії або в поєднанні з променевою терапією: ЗВ — 40%, виживаність без прогресування — 24%, що може бути методом вибору в групі пацієнтів з первинно дисемінованими і рецидивами гермінативно-клітинних пухлин ЦНС, які характеризуються несприятливим прогнозом — 5–30%. У відділенні дитячої онкології Національного інституту раку у 13 хворих з ембріональними пухлинами ЦНС проведено ВДХТ з ауто-ТГСК в період 2011–2017 рр. Наразі 7 хворих перебувають у ремісії, 3 пацієнти продовжують лікування (1 пацієнт — з приводу раннього рецидиву захворювання, 2 — одержують II елемент ВДХТ з ауто-ТГСК), 2 пацієнти померли від прогресування захворювання, 1 пацієнт помер від ускладнень, що виникли під час II елементу ВДХТ. ЗВ хворих становить 76,9%. Таким чином, проведення ВДХТ з ауто-ТГСК є важливим етапом в комплексному лікуванні певної категорії хворих із пухлинами ЦНС та потребує подальшого вивчення, що дозволить значно підвищити їх ЗВ.
Одержано 03.04.2018
Прийнято до друку 03.05.2018
Пухлини центральної нервової системи (ЦНС) залишаються одними з найбільш розповсюджених злоякісних новоутворень у дітей, займаючи за частотою друге місце після гострих лейкозів [1, 2] та третє — після гострих лейкозів і лімфом в Україні [3].
Відповідно до класифікації Всесвітньої організації охорони здоров’я (ВООЗ) 2016 р. і за епідеміологічними даними центрального реєстру пухлин головного мозку в США (CBTRUS 2009–2013) розрізнюють такі морфологічні варіанти ембріональних пухлин ЦНС у дітей (1%): медулобластому, ембріональну пухлину з множинними розетками (ЕТМR), медулоепітеліому, нейробластому, гангліонейробластому, атипову тератоїд-рабдоїдну пухлину (АТРП) [1].
Клінічну стратифікацію за групами ризику представлено в табл. 1.
| Фактор ризику | Стандартний ризик | Високий ризик |
| Об’єм залишкової пухлини | <1,5 см2 | >1,5 см2 |
| М-форма | М0 | М+ (М1, М2, М3, М4) |
| Вік | >3 років | <3 років |
Тактика лікування та прогноз захворювання залежать від:
- віку пацієнта;
- поширеності процесу (метастази);
- можливості радикального оперативного лікування (обсяг резекції пухлини);
- гістологічного варіанта пухлини (при медулобластомі, гермінативно-клітинних пухлинах);
- молекулярно-біологічних властивостей пухлини (найбільш досліджені при медулобластомі).
Так, наприклад, за результатами провідних світових груп (SIOP, UKCCSG, HIT-2000) з лікування пухлин ЦНС у дітей, визначення біологічного варіанта медулобластоми відіграє важливу прогностичну роль: за даними німецьких дослідників виявлено, що 5-річна загальна виживаність (ЗВ) у пацієнтів молодшого віку з десмопластичною медулобластомою достовірно вища, ніж при класичній медулобластомі, — 95 та 41% відповідно [4]. За даними англійської групи, яка порівнює результати лікування класичної та анапластичної/великоклітинної медулобластоми в двох дослідницьких протоколах ОР/UKCCSG, отримана достовірна різниця 5-річної ЗВ — 73 і 57% відповідно [5]. За даними італійських авторів, 5-річна безрецидивна виживаність у групі з класичною медулобластомою становила 78,1%, десмопластичною — 82,4%, анапластичною/великоклітинною — 44,4% [6].
Ембріональні пухлини, медулобластоми, гермінативно-клітинні пухлини ЦНС відрізняються високою хіміочутливістю, тому системна поліхіміотерапія (ПХТ) відіграє значну роль у лікуванні хворих з цими новоутвореннями (табл. 2).
Сучасні протоколи лікування пухлин ЦНС у дітей віком до 4 років включають оперативне втручання і курси інтенсивної ПХТ, у дітей старше 4 років — операцію, променеву терапію (локальну і краніоспінальну) і підтримувальну ПХТ за схемою ломустин/цисплатин/вінкристин [8, 9].
Незалежно від цього, за результатами, отриманими робочою групою за протоколом HIT-2000, діти віком до 3 років мають низьку 5-річну ЗВ — 12–28% порівняно зі старшою вікової групою — 55–73% [10–12].
| Пухлини | Частота, % | Хіміочутливість |
| Супратенторіальні астроцитоми:
низькодиференційовані високодиференційовані |
15–2510–15 | +\–+\– |
| Ембріональні пухлини:
медулобластоми інші супратенторіальні ПНЕП |
10–200,5–2 | ++ |
| Астроцитоми мозочка | 10–20 | +\– |
| Гліоми стовбура мозку | 10–20 | – |
| Епендимоми | 5–10 | +\– |
| Краніофарингеоми | 6–9 | – |
| Гермінативно-клітинні пухлини ЦНС | 2–3 | + |
| Інші | 10–12 | +\– |
Тут і далі: ПНЕП — примітивні нейроектодермальні пухлини.
З метою підвищення ефективності лікування впроваджено застосування високодозової хіміотерапії (ВДХТ) з аутологічною трансплантацією гемопоетичних стовбурових клітин (ауто-ТГСК), що дозволяє досягти високих концентрацій хіміопрепаратів у ЦНС.
Ауто-ТГСК може бути ефективна у пацієнтів групи високого ризику [13, 14], а також у пацієнтів з рецидивами захворювання після попереднього хіміопроменевого лікування [15].
Іншими пацієнтами — кандидатами для ВДХТ з ауто-ТГСК є діти молодшої вікової групи (від 0 до 4 років), у яких неможливе призначення променевої терапії у високих дозах, оскільки процес мієлінізації головного мозку повністю завершується після 3-річного віку, а також у зв’язку з розвитком тяжких віддалених наслідків опромінення (виражена затримка нейропсихологічного розвитку, росту, ендокринні порушення) [16].
Висока ефективність ауто-ТГСК встановлена в лікуванні пацієнтів із супратенторіальними ПНЕП в першій лінії терапії або в поєднанні з променевою терапією: ЗВ — 40%, виживаність без прогресування — 24% [17], що може бути методом вибору в групі пацієнтів з первинно дисемінованими і рецидивами гермінативно-клітинних пухлин ЦНС, які характеризуються несприятливим прогнозом — 5–30% [18].
Однак при використанні ауто-ТГСК у пацієнтів з рецидивом медулобластоми безрецидивна виживаність коливається від 25 до 61,5%, у пацієнтів з cупратенторіальними ПНЕП — 39% [19], при АТРП — 38–53% [14, 20], що, ймовірно, пов’язано з різними критеріями включення пацієнтів у дослідження, режимами кондиціонування, попередньою терапією. Факторами, що негативно впливають на результати, є відсутність попереднього краніоспінального опромінення, наявність локального рецидиву або прогресування захворювання на момент виконання ауто-ТГСК, а також додаткове використання променевої терапії після ауто-ТГСК [21, 22]. Водночас ауто-ТГСК відносно рідко використовуються в лікуванні гермінативно-клітинних пухлин центральної локалізації з огляду на те, що ці пухлини чутливі до застосування стандартної хіміотерапії і променевої терапії [23].
Незважаючи на значні успіхи, в першу чергу пов’язані зі зниженням за останні 10 років токсичності ВДХТ з ауто-ТГСК, смертність від побічних ефектів терапії залишається значущою проблемою, за даними окремих досліджень, досягає 10–19% [24].
Мета роботи — проаналізувати результати застосування ВДХТ з ауто-ТГСК у дітей з ембріональними пухлинами ЦНС залежно від факторів ризику і токсичності терапії в рамках проспективного нерандомізованого дослідження.
Об’єкт і методи дослідження
У відділенні дитячої онкології Національного інституту раку 13 хворим проведено ВДХТ з ауто-ТГСК в період 2011–2017 рр.
Критерії, за якими пацієнти підлягали ВДХТ з ауто-ТГСК:
- хіміочутливість (зменшення розмірів резидуальної пухлини та/або метастазів після індукційної ПХТ);
- наявність одного чи декількох несприятливих факторів: вік пацієнта <4 років, агресивні ембріональні пухлини ЦНС, такі як АТРП, ПНЕП, пінеобластома пінеальної ділянки (ПБПД), рецидив захворювання після проведеного стандартизованого лікування, М+ стадія захворювання.
Більшість хворих мали два або більше несприятливих факторів ризику.
Основну групу дослідження сформували пацієнти з медулобластомою, що становить 77% усіх хворих і відповідає епідеміологічним даним літератури (рис. 1).
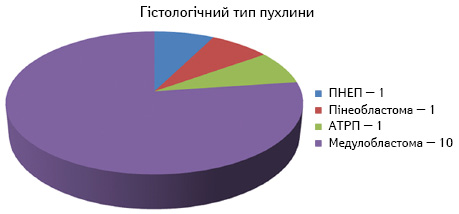
Вік хворих на момент встановлення діагнозу становив від 8 міс до 9 років, медіана віку — 2 роки 4 міс, на час проведення трансплантації вік пацієнтів становив від 1 року 6 міс до 10 років, медіана — 3 роки 6 міс. Діти до 4 років — 62% (n=8). Співвідношення хлопчиків до дівчаток 6:7.
Стадія на момент встановлення діагнозу: М0 — 23% (n=3), М1 — 31% (n=4), М2 — 31% (n=4), М3 — 15% (n=2).
Рецидив захворювання після проведеного лікування — 23% хворих (n=3).
При встановленні діагнозу пацієнти мали неврологічні симптоми, спричинені основним захворюванням: хиткість ходи — 54% (n=7), геміпарез або зниження м’язового тонусу — 54% (n=7), порушення мовлення — 15% (n=2), окорухові порушення — 23% (n=3).
Усі пацієнти після хірургічного лікування чи без його проведення отримали протокольне лікування з урахуванням гістологічного варіанта пухлини, стадії захворювання і віку.
Хворі з медулобластомою, ПНЕП, ПБПД отримали хіміотерапію за протоколом МЕТ-НІТ-2008, НІТ-2000, один пацієнт — згідно з клінічним протоколом АТРТ-ZNS-2004, два пацієнти з рецидивом захворювання після стандартного лікування отримали перед ВДХТ з ауто-ТГСК — ПХТ другої лінії (протокол HIT-REZ-2005), один хворий до виникнення рецидиву отримував нестандартизоване лікування (темозоломід 150 мг/м2 5 днів з перервою 28 днів — 3 курси).
Обсяг проведеного оперативного втручання: у 6 пацієнтів — тотальне видалення пухлини, у 4 — субтотальне видалення пухлини, у 3 хворих оперативне лікування не застосовували, у 3 пацієнтів виконано повторне хірургічне лікування при виявленні рецидиву захворювання.
Променеву терапію 3 пацієнти отримали до ВДХТ з ауто-ТГСК і 3 пацієнти після її проведення (46% усіх хворих), у 7 пацієнтів променеву терапію не застосовували в лікуванні з урахуванням віку (<4 років) на момент завершення терапії.
Перед ВДХТ з ауто-ТГСК у всіх пацієнтів проведено колекцію стовбурових клітин периферичної крові (СКПК).
Підготовка пацієнтів перед аферезом СКПК включала стимуляцію кровотворення за допомогою гранулоцитарних колонієстимулюючих факторів у дозі 10 мкг/кг/добу за 2 введення протягом 5–7 діб. На 4–5-й день оцінювали кількість CD34+ клітин у периферичній крові методом проточної цитометрії.
Аферез СКПК проводили за один або два наступні дні при кількості СD34+ клітин у периферичній крові >15/мкл та залежно від їх кількості, отриманої після першого сеансу. Мінімальна кількість СКПК, необхідна для проведення ВДХТ, становить 2,2–3,0•106/кг. Колекцію СКПК проведено за два етапи у 62% (n=8) пацієнтів, у 15% (n=2) — за три.
Одну ауто-ТГСК отримали 7 (55%) хворих, тандемну ВДХТ — 6 (45%).
Режими кондиціонування та дози, використані при проведенні ВДХТ, наведено в табл. 3.
| Кількість пацієнтів, n | Режими кондиціонування та дози | |
| І елемент | ІІ елемент | |
| 3 | Мелфалан 40 мг/м2 (день –4, –3)/ топотекан 2 мг/м2 (день –6, –3) |
– |
| 2 | Топотекан 2 мг/м2 (день –7, –3)/ циклофосфамід 60 мг/кг внутрішньовенно (день –5, –3) |
– |
| 2 | Карбоплатин 500 мг/м2 (день –7, –4)/ етопозид 250 мг/м2 (день –7, –4) |
– |
| 6 | Топотекан 2 мг/м2 (день –7, –3)/ циклофосфамід 60 мг/кг внутрішньовенно (день –5, –3) |
Карбоплатин 500 мг/м2 (день –7, –4)/ етопозид 250 мг/м2 (день –7, –4) |
Після завершення режиму кондиціонування всім пацієнтам в «0» день проводили реінфузію заздалегідь заготовлених аутологічних стовбурових клітин. Кількість використаних стовбурових клітин становила від 2,9•106/кг до 16,0•106/кг.
Критерії відновлення кровотворення, які наведені в положенні, прийнятому EBMT (European Bone Marrow Transplantation Group) і CIBMTR (Center for International Blood and Marrow Research), такі:
- абсолютна кількість лейкоцитів 1,0•109/л і більше протягом трьох наступних днів за умови відсутності стимуляції кровотворення;
- збереження абсолютної кількості тромбоцитів 20,0•109/л і більше протягом трьох наступних днів при відсутності замісних трансфузій гемокомпонентів.
Досягнення енграфту у хворих представлено в табл. 4.
| Вид кровотворення | Одна ВДХТ з ауто-ТГСК | Тандемна ВДХТ з ауто-ТГСК | |
| І елемент | ІІ елемент | ||
| Лейкоцитарний | +10 — +18 дні | +8 — +14 дні | +7 — +14 дні |
| Тромбоцитарний | +9 — +35 дні | +8 — +14 дні | +9 — +13 дні |
В 1 пацієнта відмічалося нестійке досягнення тромбоцитарного енграфту.
Оцінку токсичності ВДХТ с ауто-ТГСК здійснювали за допомогою стандартних міжнародних критеріїв Common Terminology Criteria for Adverse Events (CTCAE) Version 4.0 Published: May 28, 2009, та об’єктивних показників за органами і системами.
Лейкоцитопенія IV ступеня тяжкості, тромбоцитопенія IV ступеня тяжкості, нейтропенія визначалася у всіх 13 хворих. Анемію тяжкого ступеня зафіксували у 6 хворих. У 2 хворих визначався мукозит III–IV ступеня з токсичним ураженням кишечнику, що ускладнився ентероколітом.
Один хворий помер від ускладнень: гіпоплазія кісткового мозку, панцитопенія IV ступеня, токсичне ураження кишечнику (нейтропенічний ентероколіт), дерматит II ступеня, тромбоз гілок верхньої та нижньої мезентеріальної артерії з некрозом дуоденума та лівої половини ободової кишки, геморагічний синдром, тяжкий змішаний сепсис, дисеміноване внутрішньосудинне згортання крові на фоні сепсису, поліорганна недостатність (печінкова, ниркова, легенево-серцева).
Результати та їх обговорення
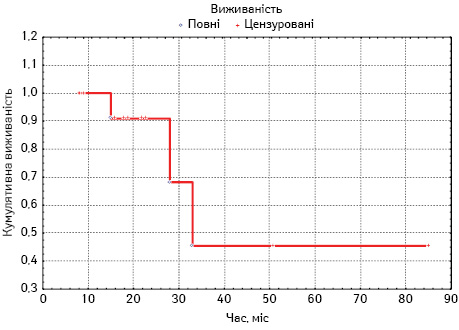
Наразі 7 хворих перебувають в ремісії, 3 пацієнти продовжують лікування (1 пацієнт з приводу раннього рецидиву захворювання, 2 — одержують II елемент ВДХТ з ауто-ТГСК), 2 пацієнти померли від прогресування захворювання, 1 пацієнт помер від ускладнень, що виникли під час II елементу ВДХТ.
ЗВ хворих становить 76,9% (рис. 2).
Висновки
1. ВДХТ з ауто-ТГСК активно використовується в лікуванні дітей з ембріональними пухлинами ЦНС групи високого ризику, асоційованими з прогностично несприятливими факторами, та є ефективним методом терапії, що сприяє підвищенню виживаності в цій групі пацієнтів. ЗВ хворих становила 76,9%.
2. Найбільш тяжкими ускладненнями, які виникають при ВДХТ, є інфекційні ураження, постцитостатичні мукозити слизової оболонки шлунково-кишкового тракту.
Список використаної та рекомендованої літератури
1. Louis D.N., Ohgaki H., Wiestler O.D. et al. (2016) WHO Classification of Tumours of the Central Nervous System. Lyon, France: International Agency for Research on Cancer. 408 p.
2. Siegel R.L., Miller K.D., Jemal A. (2016) Cancer statistics, 2016. CA Cancer J. Clin., 66(1): 7–30.
3. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2014) Рак в Україні, 2014–2015. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 17. Київ: 104–108.
4. Rutkowski S., Bode U., Deinlein F., Holger O. (2005) Treatment of early childhood medulloblastoma by postoperative chemotherapy alone. New Engl. J. Med., 352(10): 978–986.
5. McManamy C.S., Lamont J.M., Taylor R.E. et al. (2003) Morphophenotypic variation predicts clinical behavior in childhood non-desmoplastic medulloblastomas. J. Neuropathol. Exp. Neurol., 62: 627–632.
6. Maura M., Massimino M., Antonelli M. et al. (2013) Histological variants of medulloblastoma are the powerful clinical prognostic indicators. Pedaitr. Blood Cancer, 60: 210–216.
7. Pizzo P., Poplack D. (2015) Principles and Practice of Pediatric Oncology, 7-th ed. Wolters Kluwer, 1320 p.
8. Burki T.K. (2016) Postoperative radiotherapy for paediatric medulloblastoma. Lancet Oncol., 17(9): 381.
9. Kann B.H., Park H.S., Lester-Coll N.H. et al. (2016) Postoperative radiotherapy patterns of care and survival implications for medulloblastoma in young children. JAMA Oncol., 2(12): 1574–1581.
10. Mynarek M., Pizer B., Dufour C. et al. (2016) Evaluation of age-dependent treatment strategies for children and young adults with pineoblastoma: analysis of pooled European Society for Paediatric Oncology (SIOP-E) and US Head Start data. Neurooncol., Dec 23: 234.
11. von Bueren A.O., Kortmann R.D., von Hoff K., Rutkowski S. et al. (2016) Treatment of children and adolescents with metastatic medulloblastoma and prognostic relevance of clinical and biologic parameters. J. Clin. Oncol., 34(34): 4151–4160.
12. Sabel M., Fleischhack G., Tippelt S. et al. and SIOP-E Brain Tumour Group (2016) Relapse patterns and outcome after relapse in standard risk medulloblastoma: a report from the HIT-SIOPPNET4 study. J. Neurooncol., 129(3): 515–524.
13. Alsultan A., Alharbi M., Al-Dandan S. et al. (2015) High-dose chemotherapy with autologous stem cell rescue in Saudi children less than 3 years of age with embryonal brain tumors. J. Pediatr. Hematol. Oncol., 37(3): 204–208.
14. Sung K.W., Lim D.H., Y i E.S. et al. (2016) Tandem high-dose chemotherapy and autologous stem cell transplantation for atypical teratoid/rhabdoid tumor. Cancer Res. Treat., 48(4): 1408–1419.
15. von Bueren A.O., Friedrich C., von Hoff K., Rutkowski S. et al. (2015) Metastatic medulloblastoma in adults: outcome of patients treated according to the HIT2000 protocol. Eur. J. Cancer, 51(16): 2434–2443.
16. Guichardet K., Kieffer V., Lyard G. (2015) Neurocognitive outcome in childhood brain tumor survivors. Bull. Cancer, 102(7–8): 636–641.
17. Friedrich C., von Bueren A.O., von Hoff K. et al. (2013) Treatment of young children with CNS-primitive neuroecto-dermal tumors/pineoblastomas in the prospective multicenter trial HIT 2000 using different chemotherapy regimens and radiotherapy. Neuro Oncol., 15(2): 224–234.
18. Gilligan T. (2016) Decision making in a data-poor environment: management of brain metastases from testicular and extragonadal germ cell tumors. J. Clin. Oncol., 34 (4): 303–306.
19. Fangusaro J.R., Jubran R.F., Allen J. et al. (2008) Brainstem primitive neuroectodermal tumors (bstPNET): results of treatment with intensive induction chemotherapy followed by consolidative chemotherapy with autologous hematopoietic cell rescue. Pediatr. Blood Cancer, 50(3): 715–717.
20. Park E.S., Sung K.W., Baek H.J. et al. (2012) Tandem high-dose chemotherapy and autologous stem cell transplantation in young children with atypical teratoid/rhabdoid tumor of the central nervous system. J. Korean Med. Sci., 27(2): 135–140.
21. Graham M.L., Herndon J.E., Casey J.R. et al. (1997) High-dose chemotherapy with autologous stem-cell rescue in patients with recurrent and high-risk pediatric brain tumors. J. Clin. Onc., 15: 1814–1823.
22. Ridola V., Grill J., Doz F. et al. (2007) High-dose chemotherapy with autologous stem cell rescue followed by posterior fossa irradiation for local medulloblastoma recurrence or progression after conventional chemotherapy. Cancer, 110(1): 156–163.
23. Plant A.S., Chi S.N., Frazie L. (2016) Pediatric malignant germ cell tumors: A comparison of the neuro-oncology and solid tumor experience. Pediatr. Blood Cancer, 63(12): 2086–2095.
24. Dhall G., Grodman H., Ji L. et al. (2008) Outcome of children less than three years old at diagnosis with non-metastatic medulloblastoma treated with chemotherapy on the «Head Start» I and II protocols. Pediatr. Blood Cancer, 50(6): 1169–1175.
25. Al-Halabi H., Nantel A., Klekner A. et al. (2011) Preponderance of sonic hedgehog pathway activation characterizes adult medulloblastoma. Acta Neuropathol., 121: 229–239.
26. Benesch M., Bartelheim K., Fleischhack G. et al. (2014) High-dose chemotherapy (HDCT) with auto-SCT in children with atypical teratoid/rhabdoid tumors (AT/RT): a report from the European Rhabdoid Registry (EU-RHAB), 49(3): 370–375.
27. Bergthold G., Kababri E.l., Varlet P. et al. (2014) High-dose busulfan-thiotepa with autologous stem cell transplantation followed by posterior fossa irradiation in young children with classical or incompletely resected medulloblastoma, 61(5): 907–912.
28. Blaney S., Kocak M., Gajjar A. et al. (2012) Pilot study of systemic and intrathecal mafosfamide followed by conformal radiation for infants with intracranial central nervous system tumors: a pediatric brain tumor consortium study (PBTC-001). J. Neurooncol., 109(3): 565–571.
29. Bleyer W., Poplack D., Simon R. et al. (1978) ‘Concentration x time’ methotrexate via a subcutaneous reservoir: a less toxic regimen for intraventricular chemotherapy of central nervous system neoplasms. Blood, 51: 835–842.
30. Bouffet E., Baranzelli M.C., Patte C. et al. (2000) On behalf of the Societe Francaise d’Oncologie Pediatrique. High dose etoposide and thiotepa for refractory and recurrent malignant intracranial germ cell tumours (CNS-GCT). 9th International Symposium on Pediatric Neuro-Oncology, San Francisco, CA: 11–14.
31. Bouffet E., Raquin M., Doz F. et al. (2000) Radiotherapy followed by high dose busulfan and thiotepa: a prospective assessment of high dose chemotherapy in children with diffuse pontine gliomas. Cancer, 88: 685–692.
32. Broniscer A., Nicolaides T.P., Dunkel I.J. et al. (2004) High-dose chemotherapy with autologous stem cell rescue in the treatment of patients with recurrent non-cerebellar primitive neuroectodermal tumors. Pediatr. Blood Cancer, 42: 261–267.
33. Brown H.G., Kepner J.L., Perlman E.J. et al. (2000) «Large cell/anaplastic» medulloblastomas: a Pediatric Oncology Group Study. J. Neuropathol. Exp. Neurol., 59: 857–865.
34. Brown R.J., Rahim H., Wong K.E. et al. (2013) Infectious complications in the first year following autologous hematopoietic progenitor cell rescue for children with brain tumors. Pediatr. Blood Cancer, 60(12): 2012–2017.
35. Butturini A.M., Jacob M., Aguajo J. et al. (2009) High-dose chemotherapy and autologous hematopoietic progenitor cell rescue in children with recurrent medulloblastoma and supratentorial primitive neuroectodermal tumors: the impact of prior radiotherapy on outcome. Cancer, 115(13): 2956–2963.
36. Choi Y.B., Yi E.S., Kang J.M. et al. (2016) Infectious complications during tandem high-dose chemotherapy and autologous stem cell transplantation for children with high-risk or recurrent solid tumors. PLoS One, 11(9): е0162178.
37. Danielsson A., Nemes S., Tisell M. et al. (2015) MethPed: a DNA methylation classifier tool for the identification of pediatric brain tumor subtypes. Clin. Epigenetics, 7: 62.
38. Drabko K., Wisniewska-Slusarz H., Wojcik B. et al. (2005) Megachemotherapy followed by autologous haematopoietic stem cell rescue in children with high risk CNS tumors. Med. Wieku Rozwoj, 9(3 Pt 2): 439–447.
39. Dufour C., Beaugrand A., Pizer B. et al. (2012) Metastatic medulloblastoma in childhood: Chang’s Classification Revisited. Int. J. Surg. Oncol.: 245385.
40. Dunkel I.J., Boyett J.M., Yates A. et al. (1998) High-dose carboplatin, thiotepa, and etoposide with autologous stem-cell rescue for patients with recurrent medulloblastoma. J. Clin. Onc., 16: 222–228.
41. Dunkel I.J., Gardner S.L., Garvin J.H. et al. (2010) High-dose carboplatin, thiotepa, and etoposide with previously irradiated recurrent medulloblastoma. Neurooncol., 12 (3): 297–303.
42. Dunkel I.J., Garvin J.H., Goldman S. et al. (1998) High dose chemotherapy with autologous bone marrow rescue for children with diffuse pontine brain stem tumors. J. Neurooncol., 37: 67–73.
43. Finlay J.L. (1996) The role of high-dose chemotherapy and stem cell rescue in the treatment of malignant brain tumors. Bone Marrow Transplant., 18: S1–S5.
44. Gajjar A., Chintagumpala M., Ashley D. et al. (2006) Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. The Lancet Oncol., 7 (10): 813–820.
45. Gardner S.L., Asgharzadeh S., Green A. et al. (2008) Intensive induction chemotherapy followed by high dose chemotherapy with autologous hematopoietic progenitor cell rescue in young children newly diagnosed with central nervous system atypical teratoid rhabdoid tumors. Pediatr. Blood Cancer, 51(2): 235–240.
46. Gilheeney S.W., Khakoo Y., Souweidane M. et al. (2010) Thiotepa/topotecan/carboplatin with autologous stem cell rescue in recurrent/refractory/poor prognosis pediatric malignancies of the central nervous system. Pediatr. Blood Cancer, 54(4): 591–595.
47. Lee S.H., Son M.H., Sung K.W. et al. (2014) Toxicity of tandem high-dose chemotherapy and autologous stem cell transplantation using carboplatin-thiotepa-etoposide and cyclophosphamide-melphalan regimens for malignant brain tumors in children and young adults. J. Neurooncol., 120(3): 507–513.
48. Lym R.L., Ostrom Q.T., Kruchko C. et al. (2015) Completeness and concordancy of WHO grade assignment for brain and central nervous system tumors in the United States, 2004–2011. J. Neurooncol., 123(1): 43–51.
49. Nazemi K.J., Shen V., Finlay J.L. et al. (2016) High incidence of veno-occlusive disease with myeloablative chemotherapy following craniospinal irradiation in children with newly diagnosed high-risk CNS embryonal tumors: a report from the Children’s Oncology Group (CCG-99702). Pediatr. Blood Cancer, 63(9): 1563–1570.
50. Panosyan E.H., Ikeda A.K., Chang V.Y. et al. (2011) High-dose chemotherapy with autologous hematopoietic stem-cell rescue for pediatric brain tumor patients: a single institution experience from UCLA. J. Transplant., 740673.
51. Tulla M., Berthold F., Graf N., Rutkowski S. et al. (2015) Incidence, trends, and survival of children with embryonal tumors. Pediatrics, 136(3): 623–632.
52. van Zanten S.E. et members of the SIOPE DIPG Network (2017) Development of the SIOPE DIPG network, registry and imaging repository: a collaborative effort to optimize research into a rare and lethal disease.J. Neurooncol., Jan 21.
53. Vázquez Meraz J.E., Mendoza-García E., Jiménez-Hernández E. (2016) Corrigendum to «Stem Cell Mobilization with G-CSF versus Cyclophosphamide plus G-CSF in Mexican Children». Stem Cells Int., 3914030.
Результаты применения высокодозной полихимиотерапии с аутологичной трансплантацией гемопоэтических стволовых клеток в лечении эмбриональных опухолей ЦНС у детей (опыт одного центра)
Национальный институт рака, Киев
Резюме. Опухоли центральной нервной системы (ЦНС) остаются одними из самых распространенных злокачественных новообразований у детей, занимая по частоте второе место после острых лейкозов и третье — после острых лейкозов и лимфом в Украине. Современные протоколы лечения опухолей ЦНС у детей в возрасте до 4 лет включают оперативное вмешательство и курсы интенсивной полихимиотерапии (ПХТ), у детей старше 4 лет — операцию, лучевую терапию (локальную и краниоспинальную) и поддерживающую ПХТ по схеме ломустин/цисплатин/винкристин. Но несмотря на это, по результатам, полученным рабочей группой по протоколу HIT-2000, дети в возрасте до 3 лет имеют низкую 5-летнюю общую выживаемость (ОВ) — 12–28% по сравнению с старшей возрастной группой — 55–73%. С целью повышения ОВ в этой группе пациентов введено использование высокодозной химиотерапии (ВДХТ) с аутологической трансплантацией гемопоэтических стволовых клеток (ауто-ТГСК), что позволяет достичь высоких концентраций химиопрепаратов в ЦНС и способствует повышению эффективности лечения. Высокая эффективность ауто-ТГСК установлена в лечении супратенториальных примитивных нейроэктодермальных опухолей в первой линии терапии или в сочетании с лучевой терапией: ОВ — 40%, выживаемость без прогрессирования — 24%, что может быть методом выбора в группе пациентов с первично диссеминированными и рецидивирующими герминативно-клеточными опухолями ЦНС, которые характеризуются неблагоприятным прогнозом — 5–30%. В отделении детской онкологии Национального института рака у 13 больных с эмбриональными опухолями ЦНС проведена ВДХТ с ауто-ТГСК в период 2011–2017 гг. В настоящее время 7 больных находятся в ремиссии, 3 пациента продолжают лечение (1 пациент — по поводу раннего рецидива заболевания, 2 — получают II элемент ВДХТ с ауто-ТГСК), 2 пациента умерли от прогрессирования заболевания, 1 пациент умер от осложнений, возникших во время II элемента ВДХТ. ОВ больных составляет 76,9%. Таким образом, проведение ВДХТ с ауто-ТГСК является важным этапом в комплексном лечении определенной категории больных с опухолями ЦНС и требует дальнейшего изучения, что позволит значительно повысить их ОВ.
Ключевые слова: опухоли ЦНС; медуллобластома; ПНЭО; применение ВДХТ с ауто-ТГСК; дети.
Results of application of high-dose polychemotherapy with autologous transplantation of hematopoietic stem cells in the treatment of embryonic CNS tumors in children (experience of one center)
National Cancer Institute, Kyiv
Summary. The central nervous system (CNS) tumors remain among the most common malignant neoplasms in children, with the second highest frequency after acute leukemia and the third after acute leukemia and lymphoma in Ukraine. Modern protocols for the treatment of CNS tumors in children under 4 years of age include surgical treatment and courses of intensive polychemotherapy (PCT), in children over 4 years of age — surgery, radiation therapy (local and craniospinal) and PCT supportive by the scheme CCNU/cisplatin/VCR. But despite this, according to the results of the working group of the HIT-2000 protocol, children under 3 years of age have a lower overall survival rate of 5 years of 12–28% compared with the older age group of 55–73%. In order to increase the overall survival of this group of patients, the use of high-dose chemotherapy (НDCT) with autologous transplantation of hematopoietic stem cells (auto-THSC) has been introduced, which allows achieving high concentrations of chemotherapy in the CNS and contributes to the improvement of treatment efficacy. The high efficiency of auto-THSC is established in the treatment of supratentorial primitive neuroectodermal tumors in the first line of therapy or in combination with radiotherapy: overall survival — 40%, survival without progression — 24%, which may be a method of choice in a group of patients with primary disseminated and recurrent hemorrhagic CNS tumors, which are characterized by an unfavorable prognosis, range from 5–30%. In the Department of children’s oncology of the National Cancer Institute 13 patients with CNS tumors have been conducted НDCT with auto-THSC in the period from 2011 to 2017. At present, 7 patients are in remission, 3 patients continue treatment (1 patient for the early relapse of the disease, 2 — the II element of the HDCT with auto-THSC), 2 patients died from the progression of the disease, 1 patient died of complications that arose during the second element of the HDCT. The overall survival rate of patients is 76.9%. Thus, as can be seen from the data presented, conduction of HDCT with auto-THSC is an important stage in the complex treatment in a certain category of patients with CNS tumors and needs further study, which will allow them to significantly increase their overall survival.
Key words: central nervous system tumors; medulloblastoma; PNET; use of HDCT with auto-THSC; children.
Приходько Ірина Олександрівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 259-01-85
E-mail: irinaprihodko2014@gmail.com
Prikhodko Iryna
33/43 Lomonosova street, Kyiv 03022.
National Cancer Institute
Tel.: (044) 259-01-85
E-mail: irinaprihodko2014@gmail.com














Leave a comment