Порівняльна характеристика якості життя хворих на місцево-поширені форми раку грудної залози після проведення поліхіміотерапії в системному та внутрішньолімфатичному режимах
Думанський Ю.В. 1, Бондар О.В.2, Ткаченко О.І.2, Столярчук Є.А.3, Єрмаков В.Ю.3
- 1Донецький національний медичний університет, Лиман
- 2Одеський національний медичний університет
- 3Центр реконструктивної та відновної медицини «Університетська клініка» Одеського національного медичного університету
Резюме. Протягом останніх років рак грудної залози (РГЗ) є найбільш розповсюдженою онкологічною патологією та найчастішою причиною втрати працездатності серед жінок розвинених країн. Пошук найбільш ефективних шляхів взаємодії між пацієнтом і лікарем створює передумови для необхідного аналізу процесу лікування з об’єктивної та суб’єктивної позиції. Тому важливим показником, який необхідно брати до уваги, є якість життя (ЯЖ) пацієнта. Мета дослідження. Порівняти показники комплексної оцінки ЯЖ пацієнток із несприятливими місцево-поширеними (МП) формами РГЗ до початку та після проведення внутрішньовенної системної поліхіміотерапії (СПХТ) та селективної ендолімфатичної поліхіміотерапії (ЕЛПХТ) в неоад’ювантному режимі. Об’єкт і методи. Дослідження проведено на основі вибіркового аналізу карт стаціонарних хворих 112 пацієнток з МП РГЗ T4A-DN0-3M0, які отримували комплексне протипухлинне лікування на базі Донецького обласного протипухлинного центру та Університетської клініки Одеського національного медичного університету в період 2000–2017 рр. та яким було запропоновано пройти анкетування на різних етапах передопераційного лікування. До першої (контрольної) групи увійшли 65 (58%) пацієнток із неоперабельними формами МП РГЗ, яким в неоад’ювантному режимі була проведена СПХТ. До другої (досліджуваної) групи увійшли 47 (42%) пацієнток з неоперабельними формами МП РГЗ, яким в якості неоад’ювантного курсу виконано ЕЛПХТ. Результати. За інтегральними показниками ЯЖ та якості здоров’я між пацієнтками контрольної та досліджуваної груп не відзначалося статистично достовірної відмінності. При детальному аналізі показників симптоматичних шкал розбіжність між групами не перевищувала критичних значень. За результатами проведеного дослідження серед пацієнток, які отримували ЕЛПХТ в неоад’ювантному режимі, суб’єктивні оцінки застосованого лікування в абсолютних цифрах мають кращі референтні значення без статистичної переваги. Висновок. Дослідження інтегративного показника ЯЖ та його дискретних елементів є ергономічним та економічним засобом евристичної оцінки стану здоров’я пацієнток для подальшої розробки більш раціональних та зручних способів вирішення нагальних питань сучасної онкології шляхом підвищення комплаєнсу та пошуку компромісу між лікарем та пацієнтом.
Одержано 04.09.2018
Прийнято до друку 26.09.2018
Вступ
Упродовж останніх десятиліть минулого століття та на початку нинішнього канцер-реєстри більшості країн світу невпинно фіксують рак грудної залози (РГЗ) як найбільш розповсюджений онкологічний процес та одну з найчастіших причин втрати працездатності та смертності серед жіночого населення світу [1]. У рамках етіологічного пошуку для цієї патології сформовано досить широкий спектр чинників, жоден з яких не має статистично значимої переваги над іншими, тому в кожній конкретній ситуації необхідний індивідуальний підхід до діагностики. З іншого боку, патогенетично та морфологічно сам РГЗ є досить умовною назвою для неоднорідного набору новоутворень, відмінних за генотипічними та фенотипічними властивостями [2]. За даними ВОЗ, в епідеміологічному ракурсі чітко спостерігаються тенденції найбільшої його розповсюдженості серед населення розвинутих країн, що з різним відсотком імовірності пов’язується з культурними, традиційними та соціальними особливостями Західного світу [3]. Усе це пояснює збільшення витрат на підтримання та покращення діагностично-лікувальних заходів з боку державних та приватних страхових установ і справедливість зростаючого клінічного та академічного інтересу до проблем розуміння ключових аспектів боротьби з РГЗ [4, 5].
Зважений підхід до кожного окремого захворювання диктує розглядати його крізь індивідуальну призму для оптимального вибору відповідної терапії. У цьому ключі досить перспективно в онкологічній практиці виглядає таргетна терапія в максимально широкому значенні цього поняття: від векторних та моноклональних біоінженерних розробок до прямого механічного адресного доправлення необхідних речовин до проблемної ділянки шляхом збагачення аферентного судинного русла діючими компонентами медикаментозного засобу. Найбільш відповідним для такого методу з очевидних причин є місцево-поширені (МП) форми пухлин, а в контексті наведеної статті — РГЗ [6, 7]. Незважаючи на зростаючий інтерес професіоналів та аматорів до проблеми прицільного лікування цього онкологічного захворювання, широкий спектр засобів терапії свідчить про відсутність статистично вивіреної для кожного окремого випадку тактики лікування. Локальною проблемою нашої країни є багаточинникова стагнація в напрямку проведення необхідних досліджень та накопичення відповідної інформації [8, 9].
Проблема пошуку адекватного шляху доставки хіміопрепаратів та складу самої панелі медикаментів для селективного комплексного лікування при МП РГЗ є актуальним питанням, зважаючи на незадовільну ефективність системної поліхіміотерапії (СПХТ).
Регіонарні методи поліхіміотерапії (ПХТ) (внутрішньоартеріальні, внутрішньовенні, ендолімфатичні) є одним з сучасних хірургічних шляхів вирішення питання селективного підходу до лікування пацієнтів зі злоякісними новоутвореннями. Лімфотропна терапія будується на уявленні про адитивність конструкції лімфатичної системи певного регіону з чітким напрямком руху лімфи від периферії до регіонарних центрів. Складний та гістотоксичний метод внутрішньотканинної ін’єкції з подальшим пасивним дренуванням за принципом дифузії вимагає комбінації з паралельним внутрішньовенним введенням та унеможливлює повторні сеанси хіміотерапії. Тому новим та прогресивним етапом еволюції методу став маневр мікрохірургічної високоточної катетеризації декількох магістральних лімфатичних судин з інтраопераційним насиченням аферентного русла цільової ділянки. Теоретична ефективність і надійність ендолімфатичної інфузії роблять методику перспективною в контексті подальшого вивчення [10, 11]. На меті маються загальні для всіх таргетних методів результати: підвищення місцевого впливу та зменшення системної токсичної реакції.
Мета дослідження — порівняти показники комплексної оцінки якості життя (ЯЖ) пацієнток із несприятливими МП формами РГЗ до початку та після проведення внутрішньовенної СПХТ та селективної ендолімфатичної поліхіміотерапії (ЕЛПХТ) в неоад’ювантному режимі.
Об’єкт і методи дослідження
Дослідження проведено на основі вибіркового аналізу карт стаціонарних хворих 112 пацієнток із МП РГЗ T4A-DN0-3M0, які отримували комплексне протипухлинне лікування на базі Донецького обласного протипухлинного центру та Університетської клініки Одеського національного медичного університету в період 2000–2017 рр. та яким було запропоновано пройти анкетування на різних етапах передопераційного лікування. Перед залученням пацієнтки до протоколу дослідження попередньо була отримана її письмова добровільна згода на участь згідно з WMA Declaration of Helsinki — Ethical Principles for Medical Research Involving Human Subjects (2013) відповідної форми.
Вибірка була стандартизована за віковими, гендерними, соціальними та клінічними параметрами. Віковий діапазон: 46,3±12,4 року. Серед пацієнток 85 (76%) були працездатного віку. До 1-ї (контрольної) групи увійшли 65 (58%) пацієнток з неоперабельними формами МП РГЗ, яким в неоад’ювантному режимі проведено СПХТ. До 2-ї (досліджуваної) групи залучено 47 (42%) пацієнток з неоперабельними формами МП РГЗ, яким в якості неоад’ювантного курсу виконано ЕЛПХТ. Кількість курсів проведеної передопераційної ПХТ становила максимум 4. За кінцеву мету встановлено досягнення пухлиною резектабельного стану. За фактом констатації цього результату пацієнтки долучалися до програми планування оперативного втручання, а подальше опитування на етапі ПХТ проводилося серед решти хворих.
Вивчення ЯЖ хворих проводилося в рамках Міжнародного протоколу Європейської організації дослідження і лікування раку (European Organization for the Research and Treatment of Cancer) за допомогою анкети для опитування EORTC QLQ-C30, які були апробовані в численних іноземних дослідженнях і відповідають критеріям надійності, обґрунтованості та результативності.
Анкета має протокольну форму та включає 30 стандартних запитань: запитання загального характеру (ЯЖ та якість здоров’я — ЯЗ), шкали функціонального стану (фізичного, емоційного, рольового, соціального та когнітивного) та шкали ключових симптомів. На відміну від запропонованого авторами способу оцінки, застосовано лінійну аналогову шкалу з діапазоном від 1 до 100 балів. Для функціональних шкал найгірший показник відповідав оцінці 0 балів, найкращий — 100 балів. У симптоматичних шкалах найслабший прояв був оцінений в 0 балів, найсильніший — 100 балів.
Анкетування пацієнток здійснювалося протягом 1 тиж перед початком ПХТ та через 10–14 днів після проведення кожного курсу ПХТ (таблиця). У зазначених контрольних точках відбувалися найбільш репрезентативні зміни функціональних і симптоматичних шкал. Анкетування проводилося серед 100% пацієнток перед початком лікування та припинялося після закінчення терапії з будь-якої причини або за власним бажанням хворої.
| Протокол CAF | Циклофосфамід: з 2-го по 4-й день — 400 мг/м Доксорубіцин: у 1-й день внутрішньовенно — 50 мг/м 5-Флуороурацил: з 2-го по 4-й день — 500 мг/м |
| Протокол CAМF | Циклофосфамід: з 2-го по 4-й день — 400 мг/м Доксорубіцин: у 1-й день внутрішньовенно — 30 мг/м Метотрексат: у 1-й і 5-й дні — по 30 мг/м 5-Флуороурацил: з 2-го по 4-й день — 500 мг/м |
ПХТ за протоколом CAF при внутрішньовенному введенні обрана основною робочою схемою для усіх 65 пацієнток 1-ї групи. Комбінацію CAМF застосовували у 2-й групі з регіонарним введенням циклофосфаміду, 5-флуороурацилу та метотрексату та внутрішньовенним — доксорубіцину. Обробку даних проводили за допомогою стандартних статистичних функцій програми MS Excel. При порівнянні показників ЯЖ у групах дослідження використано непараметричний показник — коефіцієнт χ Пірсона, для дослідження динаміки — показники вивчення динамічних рядів. Статистичні параметри порівняння: розрахункове значення ступеня свободи = 1 (при р<0,05 χ =3,841; при р<0,01 χ=6,635).
Результати
Оцінка загального стану пацієнток на усіх етапах формується головним чином за рахунок об’єктивних (наявність пухлинного новоутворення; інтоксикаційний синдром, астенічний синдром; локальні та системні прояви лізису пухлини, приєднання вторинної інфекції скомпрометованих тканин) та суб’єктивних (психологічний та емоційний дискомфорт від фізичного стану, соціальна дезадаптація через онкологічну стигматизацію та непрацездатність) факторів. Після аналізу показника ЯЖ закономірно не виявлено статистично значимих відмінностей: у контрольній групі середнє значення становило 54±11,3 бала, у досліджуваній — 57±4,1 бала (при р=0,67 χ=0,182).
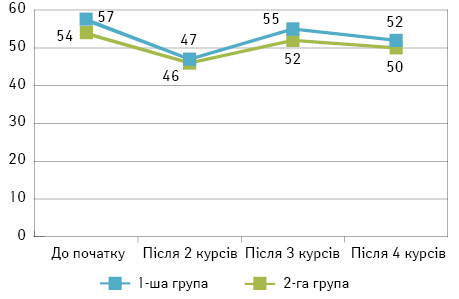
Після завершення першого та другого курсів хіміотерапії показник ЯЖ мав поетапну негативну динаміку як у 1-й (на 7,4 та 8,0% відповідно з остаточним результатом 46±4,3 бала), так і у 2-й (на 5,3 та 13,0% відповідно з остаточним результатом 47±3,1 бала) групах, зберігаючи пропорційну статистичну близькість результатів. Варто зауважити, що через виражений інтоксикаційний синдром та психологічний дискомфорт від участі в дослідженні 3 (4,6%) пацієнтки 1-ї та 2 (4,3%) — 2-ї групи відмовилися від подальшої оцінки ЯЖ та продовжили лікування у звичайному режимі. Така динаміка показників, на думку авторів, пов’язана з недостатньо встановленим комплаєнсом з пацієнтками та неповним поясненням суті лікування: персистенція синдрому інтоксикації, дисонанс очікуваних та фактичних змін у габаритах пухлини, панічний страх невдачі лікування та відсутність покращення самопочуття інтерпретувалися більшістю пацієнток як негативний результат. Кінцевої мети вдалося досягнути у 16 (25%) пацієнток 1-ї групи та 13 (28%) — 2-ї. Після завершення третього курсу хіміотерапії референтні значення параметра ЯЖ здобули позитивну динаміку, підвищившись на 13% (52±2,3 бала) у контрольній та на 18% (55±4,9 бала) — у досліджуваній групі, внаслідок покращення загального стану, звикання до систематичних хвилеподібних симптомів інтоксикації від ПХТ, покращення локального статусу пухлини та досягнення кінцевого результату у більшості пацієнток. Втім статистично показники в обох групах залишилися невідмінними (при р=0,671 χ=0,181). Резектабельного стану пухлини досягнуто у 30 (46%) жінок 1-ї групи та у 21 (45%) — 2-ї. Після завершення 4 курсів ПХТ показники знизилися на 2–4 бали в обох групах (50±4,4 та 52±2,3 бала відповідно), що інтерпретувалося як результат фізичного та морального виснаження пацієнток, відсутності такої самої динаміки клінічних симптомів, як у інших хворих, зневіри у позитивний результат і невдоволення від симптомів ятрогенної інтоксикації. Статистичної різниці на користь тієї чи іншої методики за фактом проведення 4 курсів ПХТ не з’явилося (χ=0,08 при р=0,778). Клінічний ефект одержано у 17 (26%) жінок контрольної групи та 11 (23%) — досліджуваної. На жаль, резектабельного стану МП РГЗ не досягли у 2 (3%) пацієнток 1-ї та 2 (4%) — 2-ї групи; їм була запропонована система професійної допомоги та підтримки онкохворих та симптоматична терапія в умовах онкологічного диспансеру (рис. 1).
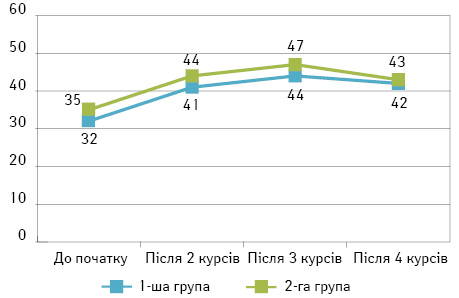
За іншим показником загального характеру — ЯЗ (рис. 2) — спостерігалася схожа динаміка. До проведення ПХТ у пацієнток 1-ї та 2-ї груп були отримані такі результати: середня оцінка власного здоров’я у 1-й групі становила 32±4,1 бала, а у 2-й — 35±3,7 бала, що не мало статистичної різниці (χ=0,202, р=0,654). Зі слів пацієнток, така низька оцінка зумовлена впливом «депресивного» стану через «невиліковне» захворювання та песимістичних прогнозів щодо результатів майбутнього лікування, сформованих через самодезінформацію пацієнток під час спілкування одне з одним та вивчення неперевірених джерел. На жаль, умови та формат експерименту не дозволили провести більш чисте дослідження з інформаційною ізоляцією пацієнток та роз’ясненням щодо стану їх здоров’я і технічних можливостей лікування цієї патології. Надалі після кожного курсу хіміотерапії між показниками груп формувалася стійка різниця у 3,3 та 2 бали відповідно, незначна за коефіцієнтом Пірсона (χ<3,841), та з коливаннями всередині групи 5±1%. У фазу неоад’ювантної терапії три пацієнтки не мають змоги оцінити кінцевий результат, проте за допомогою роз’яснювальної роботи лікарем можна правильно інтерпретувати тенденції загального стану організму та локальні параметри (розмір та розпад пухлини).
У структурі анкети EORTC QLQ-C30 конкретні запитання симптоматичної шкали йдуть першими, далі розміщені більш загальні шкали функціонального, когнітивного, емоційного, психологічного та соціального станів, у кінці стоять два інтегральних показники — ЯЖ та ЯЗ, даючи можливість пацієнтам рухатися від вирішення більш простих завдань до відповіді на глобальні питання.
Під час аналізу показників за шкалами загального стану та фізичного здоров’я спостерігалися такі зміни: статистично недостовірна різниця до початку проведення хіміотерапії (63±6,4 та 81±5,4 бала у 1-й групі, 65±4,3 та 83±9,6 бала у 2-й; χ відповідно 0,087 та 0,136) з подальшою негативною динамікою в межах 5 балів після 2 курсів хіміотерапії та майже без змін надалі при подальшому лікуванні.
Найменші зміни у відповідь на хіміотерапію спостерігалися для показника когнітивного стану: графічна модель динаміки в обох групах наближалася до прямої з амплітудою коливань ±5 балів із середнім значенням 81 та 83 відповідно.
Найбільша варіативність закономірно виявилася у результатах за шкалами психологічно-емоційного стану та соціальної адаптації. Як і очікувалося, показники емоційного фону виявилися надзвичайно лабільними і в динаміці не простежувалося системи; безумовно, цей параметр є найбільш суб’єктивним та найменш надійним для дискретної оцінки, проте, як уже зазначалося, необхідним для комплексного підходу. У ході аналізу психологічного стану жінок в обох групах до та під час проведення ПХТ виявлено коливання широкої амплітуди, які не були пов’язані із зовнішніми чинниками, що є серйозним наслідком недостатньої професійної психотерапевтичної допомоги хворим.
З іншого боку, шкала соціальної адаптації продемонструвала неухильну позитивну динаміку для обох груп, хоча, знову ж таки, без статистичних розбіжностей та з міжгруповими розходженнями до 5 балів. Все ж, на думку авторів, саме цей параметр є ключовим у складі показника ЯЖ, адже саме соціальна адаптація та самовизначення є кінцевою метою комплексного лікування та проміжною для кожного з його етапів.
До початку хіміотерапії пацієнтки обох груп вважали себе однаково низько соціально адаптованими (47±3,7 бала у 1-й групі та 49±3,9 бала — у 2-й). Після двох курсів ПХТ в обох групах показники покращилися: на 25,5% у контрольних хворих, становлячи 59±7,2 бала, та на 16% у досліджуваній когорті з 49±4,3 бала. Надалі позитивна динаміка зберігалася: у 1-й групі +8,5% (64±5,0 бала) після третього курсу та ще +12,5% (72±5,2 бала) — після четвертого; у 2-й — +11% (65±4,7 бала) на третьому етапі дослідження, +7,5% (72±3,1 бала) — на четвертому. При цьому об’єктивно у хворих дійсно відмічалася виражена редукція локальних симптомів в обох когортах пацієнток.
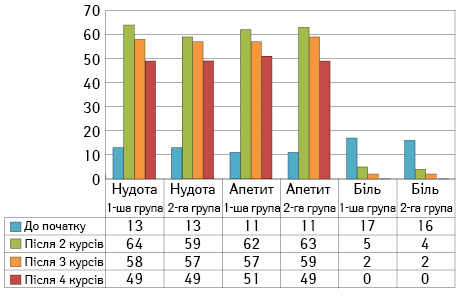
Під час аналізу панелі симптоматичних шкал для публікації взято лише показники з високими референтними значеннями, статистично значимими розбіжностями та патогенетичним зв’язком з проведеним втручанням: біль, нудота та втрата апетиту — як параметри, що характеризують локальні та системні зміни в організмі (рис. 3).
Синдром інтоксикації є основним побічним ефектом хіміотерапевтичного лікування. Варто зазначити, що об’єктивно симптоми інтоксикації персистують в середньому 5±1 день після СПХТ та 4±1 день після ЕЛПХТ. Також важливо те, що інтоксикаційний синдром породжується як наявністю самої пухлини, так і лікувальними заходами. Доцільно детально пояснити цей факт пацієнтам перед проведенням хіміотерапії та навчити їх відстежувати динаміку нових симптомів для правильної інтерпретації власного стану.
Пошук нових препаратів та їх раціональна комбінація сприяють редукції симптомів ятрогенного отруєння організму незалежно від шляху введення препаратів, тому показники безсоння, апатії, депресії та загальної втоми не зазнають суттєвих змін. Проте, як видно з рис. 3, нудота та втрата апетиту відзначаються багатьма пацієнтками із синдромом лізису пухлини ще до початку проведення лікування, що в середньому дає низьку оцінку (13±1,4 та 11±0,9 бала відповідно у 1-й групі, 13±1,9 та 11±1,1 — у 2-й). На подальших етапах ці симптоми відзначалися в типові терміни усіма хворими та були оцінені відповідно: 64±4,3 і 62±1,3 бала у 1-й групі та 59±4,1 і 63±2,0 бала у 2-й на другому етапі, 58±5,3 i 57±1,1 та 57±3,2 i 59±1,7 бала відповідно на третьому; 49±5,7 i 51±1,3 та 49±4,0 і 49±2,1 бала відповідно на четвертому. При аналізі не виявлено достовірної різниці між параметрами на жодному з етапів. Окремо необхідно розглянути параметр больового синдрому. На відміну від інших, він є індикатором локальних змін. Між досліджуваною та контрольною групами достовірних відмінностей не простежено.
Обговорення
Сучасна медицина перебуває у незбалансованому конфліктному середовищі ідей минулого та теперішнього. Сформовані на початку минулого століття патерни мислення та реалізації підходів до роботи з пацієнтами мали риси глибокої персоналізації та необґрунтовано радикальних дій, тому зараз проходять поетапні процеси перегляду та порівняння [1, 2]. З появою поняття доказовості (evidence-based medicine) та початком формування міжнародних інформаційних баз у світовій медичній спільноті доходять висновку щодо ірраціональності як багатьох класичних методів лікування, так і прийнятих методів оцінки досягнених результатів [3]. Проте, незважаючи на постійний прогрес медицини, нові досягнення в розвитку загальних та спеціальних її напрямків, а також невпинну і пильну увагу суспільства до проблем медицини, статистичні дані у масштабі десятиліть не демонструють переконливих якісних змін у динаміці захворюваності та смертності [4, 5]. Раціональний підхід до організації роботи постулює, що досягнення абсолютного результату є стратегічно помилковим курсом, а грамотна програма розвитку передбачає перш за все правильний вибір мети та правильне формулювання завдання перед дисципліною в особі кожного окремого її учасника. Тому наприкінці минулого століття медицина повністю змінила концепцію свого підходу до пацієнта, перетворивши його з об’єкта на суб’єкт лікувального процесу. Мета досягнення максимального клінічного ефекту ціною обмеження комфорту більше не могла бути самометою, а новий зважений образ медицини став орієнтованим на пацієнта (patient oriented), на його потреби, інтереси та переживання [6]. Сумарний вектор впливу на людину в системі охорони здоров’я змінив напрям з кількісних інтенсивних та екстенсивних статистичних показників загальної виживаності, тривалості безрецидивного періоду та інвалідизації на компромісні якісні показники комфорту та здоров’я. У такому контексті постає питання необхідності розробки та використання заходів оцінки не тільки кількісної, а й якісної складової комплексного висновку щодо результатів терапії. Тому важливим показником, який необхідно брати до уваги, є ЯЖ пацієнта [7, 8].
У першоджерелі Index Medicus (1977) ЯЖ визначається як фізичне, емоційне, фінансове і духовне благополуччя людини [9]. За рішенням Американського товариства клінічної онкології (ASCO), ЯЖ за своєю значимістю для оцінки результатів протипухлинної терапії важливіший за рівень безрецидивної виживаності [10].
Головним плюсом показника ЯЖ є його інтегративна здатність: ідеальний індекс ЯЖ є об’єктивною оцінкою суб’єктивних даних. У перспективі він надасть можливість об’єднувати та координувати низку непараметричних адитивних характеристик, таких як загальний стан організму, емоційні, когнітивні, психологічні та соціальні аспекти, тобто реалізує стратегічну мету оцінювати стан організму пацієнта до та після лікування з погляду самого пацієнта, після чого стане можливою більш ефективна раціоналізація подальшої лікувальної тактики. Основним недоліком показника ЯЖ є ідемпотентність його синтетичної природи та відсутність іманентних параметрів, що створює передумови для апроксимативності будь-якої математичної функції для його моделювання та кількісно-якісного перерахунку.
Сучасні анкети комплексної оцінки ЯЖ віддзеркалюють вказані позитивні та негативні аспекти, проте все ж дають змогу «порівнювати те, що можна порівняти». Широке запровадження стандартизованих форм опитувань в якості рутинного онкологічного дослідження та регулярне проведення масштабних метааналізів дозволить акумулювати та структурувати матеріал для подальшого створення більш досконалих науково-методичних матеріалів.
Використання опитувальників EORTC QLQ-C30 як однієї з найбільш розповсюджених форм у рамках нашого дослідження здебільшого продиктовано зазначеними міркуваннями. У перспективі систематизація даних кожного окремого лікувального підрозділу створить можливість сформувати вісь академічного та клінічного досвіду у визначеному напрямку та розробити ефективну систему вертикальних і горизонтальних зворотних зв’язків на локальному, регіональному, державному та міжнародному рівнях. Враховуючи різницю у структурі моделей організації охорони здоров’я між країнами Східної та Західної Європи, а також відмінності в практиці дослідження показників ЯЖ у рамках розширеного індивідуального підходу до лікування пацієнтів, перспективним є створення національних інформаційних баз із дискретних питань із подальшим різнобічним порівнянням та визначенням найбільш конкурентоспроможних варіантів у контексті еволюції методів та їх штучного відбору.
Дослідження ЯЖ як показника не є конкурентом класичним методам оцінки якості лікування та не може розглядатися як альтернатива екстенсивним та інтенсивним статистичним параметрам. Проте паралельне вивчення об’єктивного та суб’єктивного результату терапії дозволяє використовувати другий як камертон адекватної ефективності програми допомоги пацієнтові та полегшує процес розуміння між лікарем та хворим, дозволяючи останньому активно брати участь у власному лікуванні. Дослідження кореляційних зв’язків між клінічним, морфологічним, лабораторним та інструментальним наслідками втручання та комплексним показником ЯЖ пацієнта проводитимуться у майбутньому.
Висновок
Дослідження інтегративного показника ЯЖ та його дискретних елементів є ергономічним та економічним засобом евристичної оцінки стану здоров’я пацієнток для подальшої розробки найбільш раціональних та зручних способів вирішення нагальних питань сучасної онкології шляхом підвищення комплаєнсу та пошуку компромісу між лікарем і пацієнтом.
Список використаної та рекомендованої літератури
- Wang Minghao, Hou Lingmi, Chen Maoshan et al. (2017) Neoadjuvant chemotherapy creates surgery opportunities for inoperable locally advanced breast cancer. Sci. Rep., 7: 44673. doi: 10.1038/srep44673
- Bodai B.I., Tuso Ph. (2015) Breast cancer survivorship: a comprehensive review of long-term medical issues and lifestyle recommendations. Perm. J., 19(2): 48–79. doi: 10.7812/TPP/14-241
- Arnaout A., Boileau J.-F., Brackstone M. (2014) Surgical considerations in locally advanced breast cancerpatients receiving neoadjuvant chemotherapy. Curr. Opin. Support Palliat. Care, 8 (1): 39–45. doi: 10.1097/SPC.0000000000000031
- Mittendorf Elizabeth A., Buchholz Thomas A., Tucker Susan L. et al. (2013) Impact of chemotherapy sequencing on local-regional failure risk in breast cancer patients undergoing breast conserving therapy. Ann. Surg., 257(2): 173–179. doi: 10.1097/SLA.0b013e3182805c4a
- Go A.S., Mozaffarian D., Roger V.L. et al.; American Heart Association Statistics Committee and Stroke Statistics Subcommittee (2013) Heart disease and stroke statistics-2013 update: a report from the American Heart Association. Circulation, 127(1): e6–e245. doi: http://dx.doi.org/10.1161/CIR.0b013e31828124ad
- Shockney L.D. (2013) Perspectives on surveillance and survivorship: when to make the transition. J. Natl. Compr. Canc. Netw., 11(10): 1298–1302.
- Ganz P.A., Earle C.C., Goodwin P.J. (2012) Journal of Clinical Oncology update on progress in cancer survivorship care and research. J. Clin. Oncol., 30(30): 3655–3656. doi: http://dx.doi.org/10.1200/JCO.2012.45.3886
- Lenihan D.J., Cardinale D.M. (2012) Late cardiac effects of cancer treatment. J. Clin. Oncol., 30(30): 3657–64. doi: http://dx.doi.org/10.1200/JCO.2012.45.2938
- Lustberg M.B., Reinbolt R.E., Shapiro C.L. (2012) Bone health in adult cancer survivorship. J. Clin. Oncol., 30(30): 3665–3674. doi: http://dx.doi. org/10.1200/JCO.2012.42.2097
- Wood M.E., Vogel V., Ng A. et al. (2012) Second malignant neoplasms: assessment and strategies for risk reduction. J. Clin. Oncol., 30(30): 3734–3745. doi: http://dx.doi.org/10.1200/JCO.2012.41.8681
- Paskett E.D., Dean J.A., Oliveri J.M., Harrop J.P. (2012) Cancer-related lymphedema risk factors, diagnosis, treatment, and impact: a review. J. Clin. Oncol., 30(30): 3726–3733. doi: http://dx.doi.org/10.1200/JCO.2012.41.8574
- Canto J.G., Kiefe C.I. (2014) Age-specific analysis of breast cancer versus heart disease mortality in women. Am. J. Cardiol., 113(2): 410–411. doi: http://dx.doi.org/10.1016/j.amjcard.2013.08.055 NCCN guidelines for patients: caring for adolescents and young adults [Internet] Fort Washington, PA: National Comprehensive Cancer Network; 2013.
- Fayers P., Aaronson N., Bjordal K. et al. (2001) EORTC QLQ-C30 scoring manual. 2nd edn. EORTC Publications, Brussels.
- Howard-Anderson J., Ganz P.A., Bower J.E., Stanton A.L. (2012) Quality of life, fertility concerns, and behavioral health outcomes in younger breast cancer survivors: a systematic review. NCI: J. Natl Cancer Inst., 104(5): 386–405. doi: https://doi.org/10.1093/jnci/djr541
- De Santis C., Ma J., Bryan L., Jemal A. (2014) Breast cancer statistics. CA: A Cancer J. Clin., 64 (1): 52–62. doi: https://doi.org/10.3322/caac.21203
- Liu L., Fiorentino L., Rissling M. et al. (2013) Decreased health-related quality of life in women with breast cancer is associated with poor sleep. Behavioral Sleep Medicine, 11(3): 189–206. doi: https://doi.org/10.1080/15402002.2012.660589
- Sharma N., Purkayastha A. (2017) Factors affecting quality of life in breast cancer patients: a descriptive and cross-sectional study with review of literature. J. Mid-life Health, 8(2): 75–83. doi: 10.4103/jmh.JMH_15_17
- Eom C.S., Shin D.W., Kim S.Y. et al. (2013) Impact of perceived social support on the mental health and health-related quality of life in cancer patients: Results from a nationwide, multicenter survey in South Korea. Psychooncology, 22 (6): 1283–1290. DOI: 10.1002/pon.3133
- Gray J.M., Rasanayagam Sh., Engel C., Rizzo J. (2017) State of the evidence 2017: an update on the connection between breast cancer and the environment. Environ Health, 16: 94. doi: 10.1186/s12940-017-0287-4
- Anampa J., Makower D., Sparano J.A. (2015) Progress in adjuvant chemotherapy for breast cancer: an overview. BMC Med., 13: 195. doi: 10.1186/s12916-015-0439-8
Сравнительная характеристика качества жизни больных местно-распространенными формами рака грудной железы после проведения полихимиотерапии в системном и внутрилимфатическом режимах
Донецкий национальный медицинский университет, Лиман
Одесский национальный медицинский университет
Центр реконструктивной и восстановительной медицины «Университетская клиника» Одесского национального медицинского университета
Резюме. В последние годы рак грудной железы (РГЖ) является наиболее распространенной онкологической патологией и наиболее частой причиной потери работоспособности среди женщин развитых стран. Поиск наиболее эффективных путей взаимодействия между пациентом и врачом создает предпосылки для необходимого анализа процесса лечения с объективной и субъективной позиции. Поэтому важным показателем, который необходимо принимать во внимание, является качество жизни (КЖ) пациента. Цель исследования. Сравнить показатели комплексной оценки КЖ пациенток с неблагоприятными местно-распространенными (МР) формами РГЖ до начала и после внутривенной системной полихимиотерапии (СПХТ) и селективной эндолимфатической полихимиотерапии (ЭЛПХТ) в неоадъювантном режиме. Объект и методы. Исследование проведено на основе выборочного анализа карт стационарных больных 112 пациенток с МР РГЖ T4A-DN0-3M0, получавших комплексное противоопухолевое лечение на базе Донецкого областного противоопухолевого центра и Университетской клиники Одесского национального медицинского университета в период 2000–2017 гг. и которым было предложено пройти анкетирование на различных этапах предоперационного лечения. В 1-ю (контрольную) группу вошли 65 (58%) пациенток с неоперабельными формами МР РГЖ, которым в неоадъювантном режиме проведена СПХТ. Во 2-ю (исследуемую) группу вошли 47 (42%) пациенток с неоперабельными формами МР РГЖ, которым в качестве неоадъювантного курса выполнена ЭЛПХТ. Результаты. По интегральным показателям КЖ и качества здоровья между пациентками контрольной и исследуемой групп не отмечалось статистически достоверного различия. При детальном анализе показателей симптоматических шкал расхождение между группами не превышало критических значений. По результатам проведенного исследования среди пациенток, получавших ЭЛПХТ в неоадъювантном режиме, субъективные оценки лечения в абсолютных цифрах имеют лучшие референтные значения без статистического преимущества. Вывод. Исследование интегративного показателя КЖ и его дискретных элементов является эргономичным и экономичным средством эвристической оценки состояния здоровья пациенток для дальнейшей разработки более рациональных и удобных способов решения насущных вопросов современной онкологии путем повышения комплаенса и поиска компромисса между врачом и пациентом.
местно-распространенный рак грудной железы; комплексное лечение; эндолимфатическая полихимиотерапия; системная полихимиотерапия; качество жизни.
Адреса:
Бондар Олександр Вадимович
65009, Одеса, вул. Тіниста, 8
Центр реконструктивної та відновної медицини
«Університетська клініка»
Одеського національного медичного університету
E-mail: ovbondar0708@gmail.com
Correspondence:
Bondar Oleksandr
8 Tinysta str., Odessa 65009
Department of General Practice and Medical Rehabilitation
«University Clinic» of Odesa National Medical University
E-mail: ovbondar0708@gmail.com














Leave a comment