Жирова тканина та її роль у мікрооточенні клітин аденокарциноми колоректального раку
Бурлака А.А.1, Вовк А.В.2, Звірич В.В.1, Бурлака А.П.2, Ганусевич І.І.2, Вірко С.В.3, Колеснік О.О.1
- 1Національний інститут раку, Київ
- 2Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 3Інститут фізики напівпровідників ім. В.Є. Лашкарьова НАН України, Київ
Резюме. Актуальність. За останні десять років наше розуміння механізмів впливу жирової тканини (ЖТ) на пухлинне прогресування значно розширилося, однак до цього часу не розкрито механізми взаємодії адипоцитів із клітинами раку прямої кишки (РПК) за умов проведення променевої та хіміопроменевої терапії. Об’єкт і методи. Проведено проспективне рандомізоване одноцентрове дослідження. У дослідженні брали участь 110 хворих на місцево-поширений рак прямої кишки (мпРПК; ymrT3-4aN0-2M0-1, CRM-positive) з надмірною масою тіла в період з січня 2016 р. до грудня 2018 р. Пацієнтів рандомізували у співвідношенні 1:1 на основну групу (група А; n=57; променева терапія сумарною вогнищевою дозою 50,4 Гр (1,8 Гр х 28) та поліхіміотерапія на основі оксаліплатину) та групу порівняння (група Б; n=53; променева терапія сумарною вогнищевою дозою 50,4 Гр (1,8 Гр х 28) та монохіміотерапія на основі фторпіримідинів). Результати та їх обговорення. Зареєстровані рівні швидкості генерування супероксидних радикалів у ЖТ, яка контактувала з пухлиною, становили 0,58±0,15 (група А) та 0,70±0,12 нмоль/г тканини·хв (група Б) (р<0,001). У крові цих хворих виявлено зростання рівня вільних жирних кислот: у групі А до значень 2,05±0,15 ммоль/л, а в групі Б цей показник становив 2,48±0,20 ммоль/л при нормі 0,57±0,11 ммоль/л. Рівні 8-‐оксогуаніну в прилеглій до пухлини ЖТ хворих досліджуваних груп не мали статистично значущої відмінності — 0,80±0,08 та 0,84±0,13 відповідно для груп А та Б (р=0,052). Висновки. Прилегла до пухлини ЖТ являє собою енергетичне депо, здатне виступати в ролі промотора пухлинного прогресування, забезпечуючи пухлину мпРПК енергетичним субстратом — вільними жирними кислотами. Застосування оксаліплатину знижувало рівень окисно-індукованих точкових мутацій у ДНК адипоцитів ЖТ.
Одержано 16.01.2019
Прийнято до друку 18.02.2019
DOI: 10.32471/clinicaloncology.2663-466X.38.22179
Вступ
У низці клінічних досліджень продемонстровано прямий вплив ожиріння на епідеміологію колоректального раку (КРР), прогресування хвороби та безпосередній вплив жирової тканини (ЖТ) на розвиток злоякісних новоутворень, а також «виживання» останніх. Адипоцит — основна структурна одиниця ЖТ, що забезпечує значний ресурс ліпідів, цитокінів та адипокінів. Продемонстровано, що присутність останніх забезпечує регуляцію сигнальних каскадів метаболізму та поширення злоякісних клітин, в тому числі клітин аденокарцином КРР.
Адипоцити можуть модифікувати пухлинне мікрооточення, що стимулює/прискорює пухлинний метаболізм і формує агресивний фенотип пухлини КРР шляхом паракринної секреції та наявності значних рівнів вільних жирних кислот (ВЖК). Клітини злоякісних новоутворень мають здатність прискорювати швидкість проліферації, останнє неможливо без модифікації енергетичного обміну та ініціювання de novo-ліпідогенезу [1]. ВЖК використовуються для накопичення ЖТ та побудови мембран, що є основою у виживанні злоякісних клітин. Більшість проведених досліджень демонструють, що ліпіди забезпечують виживання клітин аденокарциноми, поки їх власний de novo-ліпідогенез перебуває в стані пригнічення [2]. Таким чином, стає зрозумілим, що клітини аденокарцином здійснюють проліферацію, не виконуючи синтезу власної енергії, а використовуючи енергію багатого на жирні кислоти мікрооточення [3]. ВЖК як готове джерело енергії стає ключовим елементом у формуванні агресивного фенотипу раку прямої кишки (РПК). Варто пам’ятати, що ліпіди здатні підсилювати ефект Варбурга у клітинах пухлини [4].
За останні десять років наше розуміння механізмів впливу ЖТ на пухлинне прогресування значно розширилося, однак до цього часу не розкрито механізми взаємодії адипоцитів з клітинами РПК за умов проведення променевої та хіміопроменевої терапії.
Об’єкт і методи дослідження
Проведено проспективне рандомізоване одноцентрове дослідження, у якому брали участь 110 хворих на місцево-поширений рак прямої кишки (мпРПК; ymrT3-4aN0-2M0-1, CRM-positive) з надмірною масою тіла (передожиріння), які перебували на лікуванні в клініці Національного інституту раку в період з січня 2016 р. до грудня 2018 р. Пацієнтів рандомізували у співвідношенні 1:1 на основну групу (група А; n=57; променева терапія сумарною вогнищевою дозою 50,4 Гр (1,8 Гр × 28) та поліхіміотерапія на основі оксаліплатину) та групу порівняння (група Б; n=53; променева терапія сумарною вогнищевою дозою 50,4 Гр (1,8 Гр × 28) та монохіміотерапія на основі фторпіримідинів). Характеристику хворих наведено в табл. 1.
Таблиця 1. Характеристика груп хворих
| Показники | Група А (n=57) | Група Б (n=53) | р |
| Вік | 61,4±2,3 | 64,2±1,9 | 0,16 |
| Індекс маси тіла | 31,5±2,3 | 29,2±3,8 | 0,84 |
| Стать (чоловіки/жінки), n | 37/21 | 24/28 | 0,45 |
| Наявність віддалених метастазів, n | 14 | 5 | 0,19 |
| CRM-positive | 20 | 12 | 0,32 |
| EMVI-positive | 9 | 3 | 0,44 |
| TRG ≥3 | 10 | 4 | 0,25 |
| pN+ | 28 | 14 | 0,21 |
| Рівень раково-ембріонального антигену | 27,4±5,6 | 12,2±3,1 | 0,18 |
| Стан хворого (шкала ASA): | |||
| І–ІІ | 47 | 39 | 0,65 |
| ІІІ | 10 | 14 | 0,67 |
CRM — circumferential resection margin (циркулярний край резекції); EMVI — extramural venous invasio (екстрамуральна венозна інвазія); TRG — tumor regression grade (ступінь регресії пухлини).
У кожному клінічному випадку застосовано мультидисциплінарний розбір, участь в якому брали хірурги, онкологи, хіміотерапевти і радіологи. У всіх випадках діагноз підтверджено цито-/гістологічно на матеріалі біопсії первинної пухлини під час колоноскопії з метою оцінки резектабельності первинної пухлини, виявлення метастатичного ураження в регіонарних лімфатичних вузлах, а також можливих віддалених метастазів. Рутинно використовували магнітно-резонансну томографію малого таза та черевної порожнини із внутрішньовенним контрастуванням та комп’ютерну томографію грудної порожнини, черевної порожнини та малого таза з внутрішньовенним контрастуванням відповідно до міжнародних протоколів [5]. Позитронно-емісійну томографію використовували тільки при плануванні мультивісцеральних резекцій та у клінічно складних випадках з метою проведення диференційної діагностики на наявність метастатичного ураження інших органів/сайтів.
Хірургічна техніка передбачала виконання стандартизованих підходів у видаленні РПК (тотальної мезоректальної ексцизії та D3-лімфодисекції), більшість інтервенцій було виконано лапароскопічно.
Забір зразків ЖТ виконували впродовж 20 хв з моменту видалення макропрепарату за участю хірурга та морфолога на відстані 1–5 см від пухлини. Зразки формували за допомогою спеціальної прес-форми, заморожуючи в рідкому азоті, після чого проводили реєстрацію спектрів електронного парамагнітного резонансу (ЕПР) у парамагнітно чистому кварцовому Д’юарі. Рівні супероксидних радикалів (CР), генерованих мітохондріями адипоцитів ЖТ, та рівні вмісту NO визначали методом ЕПР із застосуванням технології Spin Traps. Стан міжклітинного матриксу оцінювали за активністю матриксних металопротеїназ (ММП)-2 та -9, які реєстрували методом зимографії в поліакриламідному гелі. Після відмивання гелю активні форми ММП-2 та -9 візуалізувалися у вигляді знебарвлених смужок на синьому тлі, локалізація яких визначалася за стандартами молекулярної маси («Sigma») і відповідала молекулярній масі кожного із ферментів (72 та 92 кДа відповідно). Оцінку протеолітичної активності проводили шляхом вимірювання площі зони лізису, використовуючи для порівняння стандартний набір ММП-2 і -9 («Sigma»). За умовну одиницю (у.о.) прийнято активність 1 мкг ферменту в 1 г вихідного контрольного зразка. Результати оцінювали за допомогою стандартної програми TotalLab 1.01.
Рівні окиснення гуаніну ДНК (маркер 8-оксогуанін — 8-oxoG) в ЖТ та рівень ВЖК у крові досліджували спектрофотометрично.
Отримані результати піддавали статистичному аналізу за допомогою SPSS 20.0 (IBM, Армонк, штат Нью-Йорк, США). Статистичні тести були двосторонніми при р<0,05 і вважалися статистично значущими.
Результати та їх обговорення
У ЖТ СР та їх похідні (ROS) продукуються мітохондріями та NOX імунокомпетентних клітин. За фізіологічних умов існує рівновага між процесом генерування СР та їх елімінацією антиоксидантами. За патологічних станів, зокрема при злоякісному рості, спостерігається підвищення рівнів ROS як в самій пухлині, так і в навколишніх тканинах, що впливає на сигнальні регуляторні шляхи пухлинних клітин.
Результати досліджень ЖТ наведено в табл. 2. Проаналізовано рівні швидкості генерування СР в ЖТ, яка була відпрепарована на відстані 1 см від макроскопічно видимого краю пухлин мпРПК. За фізіологічних умов швидкість генерування CP в ЖТ становить 0,18±0,03 нмоль/г тканини•хв [6]. Зареєстровані рівні швидкості генерування СР в ЖТ, яка контактувала з пухлиною, сягали 0,58±0,15 (група А) та 0,70±0,12 нмоль/г тканини•хв (група Б) (р<0,001). У крові цих хворих виявлено зростання рівня ВЖК: у групі А до значень 2,05±0,15 ммоль/л, а в групі Б цей показник становив 2,48±0,20 ммоль/л при нормі 0,57±0,11 ммоль/л. Тобто пошкоджувальний вплив на навколишні тканини, зокрема променевої терапії та препарату платини, є меншим у порівнянні зі схемою на основі променевої терапії з фторпіримідинами. Зростання рівнів СР і, відповідно, ROS може викликати перекисне окиснення ліпідів та утворення 4-гідроксиноненалю та малонового діальдегіду. Останні здатні стимулювати активність циклооксигенази-2, що в свою чергу каталізує синтез простагландинів та індукує ангіогенез у пухлинах РПК [7]. Жирні кислоти, рівень яких зростає в ЖТ, у пухлині, метаболізуючи, продукують електрони, енергія яких в електронтранспортному ланцюзі (EТЛ) мітохондрій пухлинних клітин перетворюється в АТФ та СР, оскільки мітохондрії адипоцитів є дисфункціональними (див. табл. 2).
Таблиця 2. Результати дослідження ЖТ
| Показники | Норма (сер. зн.±СП) | Група А (сер. зн.±СП) | Група Б (сер. зн.±СП) | t | р |
| Швидкість генерування CP, нмоль/г тканини•хв | 0,18±0,03 | 0,58±0,15 | 0,70±0,12 | 4,43 | 0,00 |
| Вміст NO, нмоль/г тканини | 1,16±0,20 | 0,51±0,11 | 0,38±0,08 | –7,24 | 0,00 |
| Вміст 8-oxoG, нмоль/г тканини | 0,21±0,03 | 0,8±0,08 | 0,84±0,13 | 1,96 | 0,052 |
| Вміст ВЖК, ммоль/л | 0,57±0,11 | 2,05±0,15 | 2,48±0,20 | 2,36 | 0,045 |
Окисне пошкодження ДНК також є наслідком нерегульованого зростання рівнів СР та ROS та їхньої дії на клітини людини. Найбільш часто продуктом такого патологічного впливу СР на молекулу ДНК є утворення 8-oxoG, рівні якого починають перевищувати норму вже на ранніх стадіях захворювання [8]. 8-oxoG здатний накопичуватися як в ядерній, так і мітохондріальній ДНК, саме тому останній вважається високоінформативним маркером розвитку злоякісних новоутворень та їх прогресування.
За даними власних досліджень, рівні 8-oxoG в прилеглій до пухлини ЖТ хворих досліджуваних груп не мали статистично значущої відмінності — 0,80±0,08 та 0,84±0,13 відповідно для груп А та Б (р=0,052), що може бути пояснене тим, що хіміотерапевтичні препарати, які використовувалися в схемах лікування, спричинюють генотоксичну дію. А препарати платини можуть, крім цього, ініціювати генерування СР.
Оксид азоту (NO) являє собою плейотропну регуляторну сигнальну молекулу, що відіграє критичну роль у різноманітних біологічних процесах, зокрема вазодилатації, нейротрансмісії та імунній відповіді [9]. NO синтезується із L-аргініну NO-синтазами (NOS) [10]. Підвищена експресія індуцибельної NOS (iNOS) у клітинах пухлини може прямо пропорційно корелювати із виживаністю хворих на РПК та з іншими злоякісними новоутвореннями епітеліального походження [11]. Визначено активність iNOS у прилеглій до пухлини ЖТ відповідно до вищеописаної методики. У нормі рівень вмісту NO становить 1,16±0,20 нмоль/г тканини. Безпосередня оцінка рівня NO становила 0,51±0,11 та 0,38±0,08 нмоль/г тканини відповідно для груп А та Б (р<0,001), що свідчить про порушення в прилеглій до пухлини ЖТ біодоступності NO.
Виявлено зміни у функціонуванні ЕТЛ мітохондрій клітин ЖТ у хворих на мпРПК за умов застосування різних схем лікування. У спектрах ЕПР ЖТ реєструють інтенсивні сигнали ЕПР з g=2,03, що відображають утворення та зростання рівнів комплексів NO з FeS-білками в комплексі І (ЕТЛ) мітохондрій адипоцитів ЖТ хворих групи А (рис. 1, спектр ЕПР 3, g=2,03), рівень яких становив 0,27±0,14 відн. од. У нормі цей показник становить 0,08±0,05 відн. од. У мітохондріях адипоцитів ЖТ хворих групи Б, які отримували замість оксаліплатину фторпіримідини, рівень комплексів NOFeS-білків в ЕТЛ був значно вищим (0,36±0,09 відн. од.), що свідчить про те, що променева та хіміотерапія на основі фторпіримідинів формує гіпоксичне мікрооточення, яке є більш сприятливим для пухлини. Рівень комплексів NOFeS-білками в ЕТЛ мітохондрій адипоцитів корелює зі ступенем диференціювання РПК (r=0,79; p<0,05). Слід також зазначити, що рівень активності ММП-2 у ЖТ був значно нижчим у хворих групи А, це свідчить про те, що оксаліплатин менше впливає на редокс-стан ЖТ і, відповідно, ремоделювання міжклітинного матриксу.
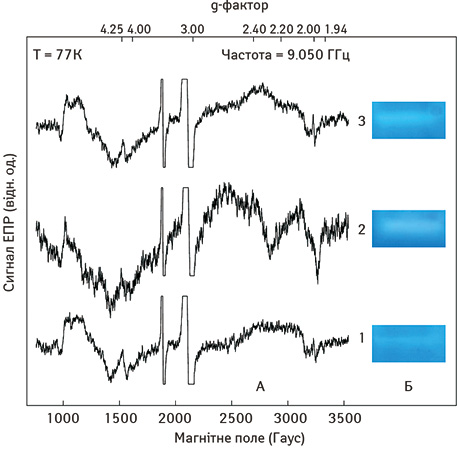
Відбувається ремоделювання міжклітинного матриксу в тканинах, що включає деградацію та реорганізацію його структур за участю специфічних ферментів — ММП. ММП становлять родину Zn- та Cu-залежних ендопептидаз із загальним функціональним доменом та механізмом активації.
Наразі відомо більше ніж 20 типів ММП, які на основі клітинної локалізації, субстратної специфічності, функціональної активності поділяються на п’ять класів: желатинази, колагенази, стромелізини, мембранозв’язані ММП та група недостатньо вивчених ММП [12].
Підвищений рівень представників підгрупи желатиназ (ММП-2 та -9) свідчить про наявність процесу пошкодження матриксу тканин. Чинниками, які активують неактивні форми ММП (про-ММП), є інтенсифікація генерування СР мітохондріями ендотеліоцитів та NOX імунокомпетентних клітин в ЖТ, які, реагуючи з NO, утворюють ONOO¯, що і призводить до порушення біодоступності NO в ЖТ [13]. Як вже зазначалося раніше, у досліджуваних хворих назалежно від способу лікування виявлено зниження вмісту NO в ЖТ, яка контактувала з пухлиною (див. табл. 2).
На рис. 2 представлено результати дослідження активності желатиназ (ММП-2 і -9) у ЖТ хворих на мпРПК. Виявлено, що активність ММП-2 становила 3,51±1,06 та 5,72±1,13 (р<0,001) відповідно для груп А та Б, а активність ММП-9 — 6,82±1,03 та 8,06±1,36 для основної і контрольної групи відповідно (р<0,001). Отримані результати свідчать про те, що в ЖТ хворих групи А, які отримували оксаліплатин та капецитабін, рівень деградації міжклітинного матриксу є нижчим у порівнянні з хворими групи Б, яким призначали фторпіримідини.
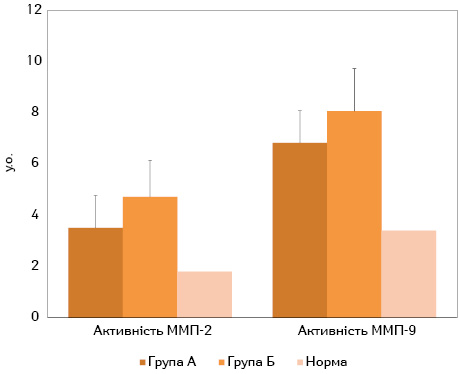
Редокс-молекули здатні індукувати ліполіз у клітинах аденокарциноми, внаслідок чого генерується гліцерол, який має здатність включатися у гліколітичний метаболічний шлях [14]. Такі патологічні зміни нормального метаболізму можуть активувати швидший ріст і, відповідно, більш злоякісний метастатичний фенотип пухлин, в тому числі РПК [15]. Подібні зміни супроводжуються трансформацією мікрооточення здорових клітин, відбувається інфільтрація пухлиноасоційованих клітин імунної системи, які запускають процес хронічного запалення та посилюють окисний стрес. Аналіз власних даних демонструє активацію de novo-ліпідогенезу у більшості досліджуваних пацієнтів із РПК, що запускається високими рівнями СР і, як наслідок, активацією ММП. Останнє, в свою чергу, демонструє, що адипоцити прилеглої до пухлини ЖТ у хворих на РПК є «додатковим» джерелом енергії, яка залучається у метаболічні процеси аденокарциноми РПК, що призводить до їхнього швидшого росту та формування метастазів.
Крім того, виявлена достовірна відмінність у досліджуваних молекулярних маркерах демонструє перспективність застосування модифікованої схеми передопераційного курсу хіміопроменевої терапії на фоні оксаліплатину та капецитабіну (XELOX). Вважаємо, що такий підхід може сприяти зниженню відсотка віддаленого метастазування та локальних рецидивів.
Висновки
- Прилегла до пухлини ЖТ являє собою енергетичне депо, здатне виступати в ролі промотора пухлинного прогресування, забезпечуючи пухлину мпРПК енергетичним субстратом — ВЖК.
- У крові хворих, які отримували оксаліплатинвмісну хіміотерапію, рівень ВЖК у 3,6 раза перевищував значення в контрольній групі, тоді як застосування фторпіримідинів призводило до зростання цього показника в 4,4 раза (р<0,05).
- Виявлено високі рівні швидкості генерування СР в прилеглій до пухлини ЖТ (0,58 та 0,7 нмоль/г тканини•хв) відповідно для груп А та Б, які є достовірно нижчими при застосуванні оксаліплатину (р<0,001).
- Застосування оксаліплатину знижувало рівень окисно-індукованих точкових мутацій у ДНК адипоцитів ЖТ.
- Встановлено, що рівень активності ММП-2 при використанні оксаліплатину в схемах поліхіміотерапії в режимі XELOX достовірно знижує ступінь ремоделювання міжклітинного матриксу.
Список використаної літератури
- Currie E., Schulze A., Zechner R. et al. (2013) Cellular fatty acid metabolism and cancer. Cell. Metab., 18: 153–161.
- Daniels V.W., Smans K., Royaux I. et al. (2014) Cancer cells differentially activate and thrive on de novo lipid synthesis pathways in a low-lipid environment. PLoS One, 9: e106913.
- Martinez-Outschoorn U.E., Sotgia F., Lisanti M.P. (2012) Power surge: supporting cells «fuel» cancer cell mitochondria. Cell. Metab., 15: 4–5.
- Manzi L., Costantini L., Molinari R., Merendino N. (2015) Effect of dietary omega-3 polyunsaturated fatty acid DHA on glycolytic enzymes and Warburg phenotypes in cancer. Biomed. Res. Int., 2015: 137097.
- National Comprehensive Cancer Network. Rectal Cancer (Version 3.2018). https://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf
- Chouchani E.T., Kazak L., Spiegelman B.M. (2017) Mitochondrial reactive oxygen species and adipose tissue thermogenesis: Bridging physiology and mechanisms. J. Biol. Chem., 292(41): 16810–16816.
- Tomida C., Nagano H., Yamagishi N. et al. (2017) Regorafenib induces adaptive resistance of colorectal cancer cells via inhibition of vascular endothelial growth factor receptor. J. Med. Invest., 64(3.4): 262–265. doi: 10.2152/jmi.64.262
- Viel A., Bruselles A., Meccia E. et al. (2017) A specific mutational signature associated with DNA 8-oxoguanine persistence in MUTYH-defective colorectal cancer. EBio Medicine, 20: 39–49. doi: 10.1016/j.ebiom.2017.04.022
- Nathan C., Xie Q.W. (1994) Nitric oxide synthases: roles, tolls, and controls. Cell., 78: 915–918.
- Forstermann U., Kleinert H. (1995) Nitric oxide synthase: expression and expressional control of the three isoforms. Naunyn Schmiedebergs Arch. Pharmacol., 352: 351–364.
- de Oliveira G.A., Cheng R.Y.S., Ridnour L.A. et al. (2017) Inducible nitric oxide synthase in the carcinogenesis of gastrointestinal cancers. Antioxid. Redox Signal, 26(18): 1059–1077.
- Said A.H., Raufman J.P., Xie G. (2014) The role of matrix metalloproteinases in colorectal cancer. Cancers (Basel), 6(1): 366-75. doi:10.3390/cancers6010366
- Tauro M., Lynch C.C. (2018) Cutting to the Chase: how matrix metalloproteinase-2 activity controls breast-cancer-to-bone metastasis. Cancers (Basel), 10(6): 185. doi:10.3390/cancers10060185
- Wang C., Li P., Xuan J. et al. (2017) Cholesterol enhances colorectal cancer progression via ROS elevation and MAPK signaling pathway activation. Cell. Physiol. Biochem., 42(2): 729–742. doi: 10.1159/000477890
- Tabuso M., Homer-Vanniasinkam S., Adya R., Arasaradnam R.P. (2017) Role of tissue microenvironment resident adipocytes in colon cancer. World J. Gastroenterol., 23(32): 5829–5835. doi: 10.3748/wjg.v23.i32.5829
Жировая ткань и ее роль в микроокружении клеток аденокарциномы колоректального рака
Национальный институт рака, Киев
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев
Институт физики полупроводников им. В.Е. Лашкарева НАН Украины, Киев
Резюме. Актуальность. За последние десять лет наше понимание механизмов влияния жировой ткани (ЖТ) на опухолевое прогрессирование значительно расширилось, однако до сих пор не раскрыты механизмы взаимодействия адипоцитов с клетками рака прямой кишки (РПК) в условиях проведения лучевой и химиолучевой терапии. Объект и методы. Проведено проспективное рандомизированное одноцентровое исследование. В исследовании принимали участие 110 больных местно-распространенным раком прямой кишки (мпРПК; ymrT3–4aN0–2M0–1, CRM-positive) с избыточной массой тела в период с января 2016 до декабря 2018 г. Пациентов в соотношении 1:1 рандомизировали в основную группу (группа А; n=57; лучевая терапия суммарной очаговой дозой 50,4 Гр (1,8 Гр × 28) и полихимиотерапия на основе оксалиплатина) и группу сравнения (группа Б; n=53; лучевая терапия суммарной очаговой дозой 50,4 Гр (1,8 Гр × 28) и монохимиотерапия на основе фторпиримидинов). Результаты и их обсуждение. Зарегистрированные уровни скорости генерирования супероксидных радикалов в ЖТ, которая контактировала с опухолью, составляли 0,58±0,15 (группа А) и 0,70±0,12 нмоль/г ткани·мин (группа Б) (р<0,001). В крови этих больных выявлено повышение уровня свободных жирных кислот: в группе А до значений 2,05±0,15 ммоль/л, а в группе Б этот показатель составил 2,48±0,20 ммоль/л при норме 0,57±0,11 ммоль/л. Уровни 8-оксогуанина в прилегающей к опухоли ЖТ больных исследуемых групп не имели статистически значимого различия — 0,80±0,08 и 0,84±0,13 соответственно для групп А и Б (р=0,052). Выводы. Прилегающая к опухоли ЖТ представляет собой энергетическое депо, способное выступать в роли промотора опухолевого прогрессирования, обеспечивая опухоль мпРПК энергетическим субстратом — свободными жирными кислотами. Применение оксалиплатина снижало уровень окислительно-индуцированных точечных мутаций в ДНК адипоцитов ЖТ.
адипоциты; жировая ткань; рак прямой кишки; колоректальный рак.
Бурлака Антон Анатолійович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: nir.burlaka@gmail.com
Correspondence:
Burlaka Anton
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail: nir.burlaka@gmail.com














Leave a comment