Проблема локального контролю в лікуванні хворих на рак прямої кишки
Щепотін І.Б., Колеснік О.О., Приймак В.В., Безносенко А.П., Кикоть В.В., Дорожинський В.І., Діденко В.М., Коломієць А.П., Балабушко С.Б.
Оптимальний локальний контроль — важливий показник у лікуванні хворих на рак прямої кишки (РПК). Методом вибору в хірургічному лікуванні РПК є техніка тотальної мезоректумектомії (ТМЕ), яка супроводжується невеликою кількістю локальних рецидивів. Наступним після ТМЕ найбільш важливим прогностичним фактором виникнення локальних рецидивів пухлини є латеральна границя резекції (CRM). Одним із найбільш ефективних методів, що дозволяють поліпшити безрецидивну виживаність цієї категорії хворих, є променева терапія. Розглядаються різні режими променевої терапії (передопераційна та післяопераційна). Наведено дані рандомізованого дослідження хворих на РПК II–III стадії із застосуванням неоад’ювантної променевої терапії 30 Гр (15х2 Гр) порівняно із променевою терапією 20 Гр (4х5 Гр). Комбіноване лікування з використанням неоад’ювантної променевої терапії 30 Гр дозволяє збільшити кількість виконуваних сфінктерзберігаючих операцій та зменшити кількість локальних рецидивів.
Актуальність
Незважаючи на певний прогрес за останні роки в лікуванні раку прямої кишки (РПК), локальні рецидиви після радикальних операцій залишаються актуальною проблемою, а оптимальна тактика для запобігання їх виникненню – темою постійних дискусій.
У 30% пацієнтів, які радикально проліковані з приводу РПК, розвивається локальний рецидив. Ключовою подією стало введення Біллом Хілдом (Richard J. Heald) у 1982 р. тотальної мезоректумектомії (ТМЕ). Після цього частота локальних рецидивів знизилась до <10% [13] та <6% у разі доповнення ТМЕ неоад’ювантною променевою терапією (НПТ) з/без хіміотерапії [16]. За даними дослідників від 20 до 50% хворих мають тільки локальні рецидиви без віддалених метастазів. Без подальшого хірургічного лікування 5-річна виживаність цих хворих становить <4% та медіана виживаності ≈8 міс [12, 15, 19, 27].
Мета цього дослідження — вивчення і узагальнення даних літератури з цього питання і оцінка власних результатів комбінованого лікування хворих на РПК.
Прогностичні фактори локального рецидиву РПК
Багато факторів впливають на ризик виникнення рецидиву. Ризик зростає з підвищенням стадії захворювання та у разі несприятливих морфологічних властивостей первинної пухлини, а саме периневральної та судинної інвазії, ступеня диференціювання. Локальні рецидиви частіше виникають при первинних пухлинах, які розташовані в дистальній ділянці прямої кишки, при наявності перфорації чи кишкової непрохідності, а також пухлини, фіксованої до сусідніх органів та структур [14, 17, 19, 27]. За результатами лікування 2315 хворих на РПК подальшими важливими факторами ризику виникнення рецидиву є відсутність НПТ, R1 (мікроскопічно позитивні краї резекції) та R2 (макроскопічно позитивні краї резекції) резекції прямої кишки та клініки з невеликою кількістю обігу операцій в обсязі ТМЕ [24]. Незаперечний факт важливості латерального чи циркулярного краю резекції. За даними M. Davis та співавторів немає ніякої різниці в частоті виникнення рецидиву РПК після сфінктерозберігаючих операцій порівняно з черевно-промежинною екстирпацією, але при умові дистального краю резекції не менше 1 см та мікроскопічно негативного циркулярного краю резекції. При мобілізації до тазового дна в обсязі ТМЕ і видалення низько розташованих пухлин «en block» з оточуючими леваторами частота R1 циркулярного краю резекції становила 0%, а локальні рецидиви — 5% [9, 22]. Існують різні рівні підготовки та досвіду виконання ТМЕ серед хірургів, внаслідок чого в літературі висвітлено широкий спектр локальних рецидивів у різних клініках. Так, вже більше 10 років тому опубліковані дані Канадського дослідження, в якому порівнювалась частота локальних рецидивів РПК після резекції прямої кишки у групі хірургів — колопроктологів та у групі загальних хірургів — 13 та 34% відповідно [21].
Значення НПТ у профілактиці локального рецидиву РПК
За останні 20 років проведено декілька великих багатоцентрових рандомізованих досліджень щодо вивчення впливу НПТ на частоту локорегіонарних рецидивів, частоту віддалених метастазів, тривалість безрецидивного періоду. Однак велика кількість різноманітних методик променевої терапії, різниця в дозах і схемах лікування, об’ємах опромінення, а також інтервалах між закінченням опромінення і оперативним втручанням приводять до значної розбіжності в результатах та ускладнюють їх інтерпретацію [1, 6, 8, 11, 18, 20, 23, 26].
Велику увагу заслуговують результати ретроспективного дослідження, проведеного в США E.T. Castaldo та співавторами [7]. За основу було взято дані датабази SEER Національного інституту раку США. Хворі на РПК І–ІІІ стадії (10 971 особа) були розподілені на дві групи. У 1-й було 7211 пацієнтів із РПК І стадії, які отримували лише хірургічне лікування. У 2-й групі було 3760 пацієнтів із РПК ІІ–ІІІ стадії, які отримували НПТ. Під час післяопераційного морфологічного дослідження «downstaging» (до операції стадія захворювання була ІІ–ІІІ, після операції стадія була 0–І) виявили у 792 (21%) пацієнтів. Показники 5-річної виживаності у групі хворих, у яких відповідь на променеву терапію розцінювалась як регресія чи повна регресія, виявилися вищими на 16% (р<0,001) порівняно з групою хворих, у яких не було позитивної відповіді на НПТ, та становили 94%, що відповідає результатам виживаності у 1-й групі пацієнтів з І стадією захворювання (97%). Інші дані цього дослідження свідчать про необхідність точного доопераційного стадіювання та перспективи проведення адекватної променевої терапії у хворих на резектабельний РПК [10].
У спільному дослідженні групи голландських клінік проаналізовані результати лікування 1417 пацієнтів із неметастатичним РПК з метою оцінки факторів, що впливають на ризик виникнення локальних рецидивів, їх локалізацію, значення повного видалення мезоректума та НПТ у профілактиці їх виникнення. Було сформовано дві групи хворих. У 1-й групі 713 пацієнтів отримували НПТ у сумарній дозі 25 Гр (по 5 Гр 5 сеансів) з подальшим хірургічним втручанням в обсязі ТМЕ. У 2-й групі 704 хворим було проведене тільки хірургічне лікування в обсязі ТМЕ. Наступним етапом проаналізовано частоту та локалізацію локальних рецидивів в обох групах. Рецидиви були розділені за анатомічним принципом — пресакральні, передні, латеральні, промежинні та у зоні анастомозу. За 7-літній період спостереження виявлено 114 рецидивів раку. Мінімальний період спостереження становив 1,5 року, максимальний — 9,8 року. У групі комбінованого лікування частота локальних рецидивів становила 4,6%, у групі хірургічного лікування — 11%. При цьому час до виникнення рецидиву пухлини у групі комбінованого лікування — 2,6 року порівняно з 1,5 року в іншій групі. Віддалені метастази на момент виявлення локального рецидиву визначались у 55% пацієнтів, які отримували передопераційну променеву терапію і у 41% пацієнтів, які пройшли хірургічне лікування виключно.
Основними факторами ризику розвитку рецидиву були низька локалізація пухлини, висока стадія захворювання та R1-резекція. Найчастіше рецидиви раку в обох досліджуваних групах локалізувалися у пресакральній ділянці. Найбільш ефективною НПТ була у профілактиці передніх рецидивів: 5-річні показники в 1-й групі становили 0,7 та 1,9% — у 2-й групі. Ефективність променевої терапії також підтверджена зменшенням кількості рецидивів у ділянці анастомозу: 5-річні показники в 1-й групі становили 0,7 та 2,7% — у 2-й групі. Відзначимо, що незважаючи на наявність пухлинних клітин по циркулярному краю резекції, тільки у 46 із 267 таких пацієнтів виникли місцеві рецидиви, що становило 17,2%. Напевно, залучення краю резекції є далеко не єдиним механізмом виникнення рецидиву РПК.
Дистальний край резекції <2 см був, вірогідно, пов’язаний із підвищеним ризиком розвитку рецидиву, але в основному в групі хворих із наявністю ураження лімфовузлів параректальної клітковини – 19% при N0 порівняно з 94,3% при N+ у групі хірургічного лікування і 11,8% при N0 порівняно з 35,8% при N+ у групі НПТ. Загальний ризик виникнення рецидиву в групі хворих, які отримували комбіноване лікування, був досить низький, за винятком випадків, коли дистальний край резекції був <5 мм. Висновки цього дослідження: необхідність проведення НПТ абсолютно усім хворим на РПК, незалежно від типу хірургічного втручання та використання техніки ТМЕ. Оскільки переважна більшість локальних рецидивів виникла у групі з розповсюдженими (Т3-4N + M0) стадіями захворювання, то автори зробили припущення про необхідність розширення показань для проведення тривалих курсів передопераційної променевої або хіміопроменевої терапії замість стандартної по 5 Гр 5 сеансів. Також у поля опромінення обов’язково мають бути включені лімфатичні вузли латеральної групи, тому що їх ураження відзначається у 10–20% випадків за даними різних авторів, зокрема М. Kusters (2010).
Об’єкт і методи дослідження
У клініці Національного інституту раку з січня 2008 р. по серпень 2010 р. проведено рандомізоване дослідження щодо вивчення ефективності комбінованого лікування хворих на резектабельний РПК із застосуванням НПТ 30 Гр (дрібними фракціями) з відстроченим оперативним лікуванням порівняно із застосуванням НПТ 20 Гр (крупними фракціями) та негайним оперативним лікуванням. Рандомізація 1:1.
У всіх хворих був морфологічно підтверджений РПК T2-4N0-1M0. Усім пацієнтам проводили повне клінічне, лабораторне, морфологічне, ендоскопічне (ректороманоскопія, фіброколоноскопія), рентгенологічне (іригоскопія, проктографія, комп’ютерна томографія, магнітно-резонансна томографія), трансректальне УЗД.
У 1-й групі хворих дистанційна НПТ проводилась на апараті «Рокус», який генерує енергію тормозного випромінення 15–18 Мев. Опромінення проводили з двох зустрічно-направлених полів, переднім та заднім, розмірами 12х14 см. До зони опромінення була включена первинна пухлина, параректальна клітковина, незмінені ділянки товстої кишки проксимальніше та дистальніше пухлини на 3–5 см. Опромінення проводили протягом 4 діб, разовою дозою 5 Гр, сумарною дозою 20 Гр із подальшим хірургічним втручанням через 24–48 год.
У 2-й групі хворих дистанційну НПТ проводили на аналогічному апараті «Рокус», з ідентичними полями, розмірами та зонами опромінення. Опромінення проводили протягом 17 діб, разовою дозою 1,8 Гр, сумарною дозою 30 Гр із подальшим хірургічним втручанням через 3 тиж.
Ефективність променевої терапії оцінювали залежно від міжнародних критеріїв REGIST з урахуванням даних об’єктивного дослідження. Оперативні втручання виконували в обсязі проктектомії, низької передньої резекції, передньої резекції, екстирпації прямої кишки із застосуванням техніки ТМЕ.
Результати Дослідження
У дослідження були включені 205 хворих на РПК. До 1-ї групи увійшли 98, до 2-ї — 107 пацієнтів.
Проведено аналіз результатів лікування хворих двох груп. За своїм складом групи були репрезентативними. У більшості пацієнтів обох груп діагностовано рак дистальних відділів прямої кишки (у 1-й групі — 77,6%, у 2-й — 72%) з інфільтрацією пухлини всієї товщі кишкової стінки — Т3-4 (у 1-й групі — 99%, у 2-й групі — 85,1%).
Дані щодо розподілу хворих за факторами клінічного прогнозу наведено в табл. 1.
| Показник | 1-ша група | 2-га група | Усього | |
|---|---|---|---|---|
| (n=98) | (n=107) | (n=205) | ||
|
Стать: жіноча чоловіча |
44 (44,8) |
58 (54,2) |
102 (49,8) |
|
| 54 (55,2) | 49 (45,8) | 103 (50,2) | ||
| Середній вік (min/max), років | 56,1 (31–76) | 60,6 (39–80) | 58,3 (31–80) | |
| Стадія II | Т2-4N0M0 | 74 (75,5) | 88 (82,2) | 162 (79,0) |
| Стадія III | T2-4N1-2M0 | 24 (24,5) | 19 (17,8) | 43 (21,0) |
Локалізація пухлинного процесу у прямій кишці наведена в табл. 2.
| Група | Локалізація пухлини | ||
|---|---|---|---|
| В/а відділ | С/а відділ | Н/а відділ | |
| 1-ша | 22 (22,4) | 25 (25,5) | 51 (52,1) |
| 2-га | 30 – 28,0% | 37 (34,4) | 40 (37,6) |
| Усього | 52 (25,4) | 62 (30,2) | 91 (44,4) |
Об’єктивний ефект НПТ оцінювався безпосередньо перед оперативним втручанням за рахунок зниження показника Т, часткова та повна регресії пухлини спостерігалась у 41% хворих 2-ї групи. За рахунок цього кількість пацієнтів, яким планувалась і була виконана черевно-промежинна екстирпація прямої кишки скоротилась у 2,7 раза (р<0,005) і відповідно становила 8 (7,5%) хворих, на противагу 34 (34,7%) хворих у групі крупнофракційного опромінення. У 1-й групі кількість осіб, яким була виконана сфінктерзберігаюча операція становила 64 (65,3%), у 2-й — 99 (92,5%).
У 1-й групі з 98 хворих у 8 (8,2%) виконана проктектомія, 31 (31,6%) хворому — низька передня резекція, 15 (15,3%) — передня резекція, черевно-анальна резекція — 10 (10,2%) хворим та екстирпація прямої кишки — 34 (34,7%) пацієнтам. У 2-й групі (107 осіб) проктектомія була виконана 26 (24,3%) хворим, низька передня резекція — 43 (40,2%), передня резекція — 29 (27,1%) хворим, 1(0,9%) хворому виконана черевно-анальна резекція та екстирпація прямої кишки — 8 (7,5%) пацієнтам. За даними післяопераційного морфологічного дослідження повна морфологічна регресія пухлини прямої кишки зареєстрована у 7 випадках у 2-й групі, у 1-й групі аналогічного результату не спостерігалося.
Загалом статистично вірогідної різниці в показниках післяопераційних ускладнень не відзначено (7,5 та 8,8%). Отримані нами результати зіставні з даними інших дослідників, які вказують на відсутність ризику виникнення періоперативних ускладнень після НПТ [25].
У процесі спостереження локальні рецидиви виявлено у 13 (13,2%) хворих 1-ї групи та у 5 (4,7%) — 2-ї групи. Усі рецидиви виникли у пацієнтів із факторами ризику (параметром Т3-4N1).
При вивченні віддалених результатів з’ясувалося, що показник загальної 3-річної виживаності у групі хворих, які отримували крупнофракційне опромінення, становив 69,8%, тоді як у групі з дрібнофракційним опроміненням — 80,5% (рис. 1).
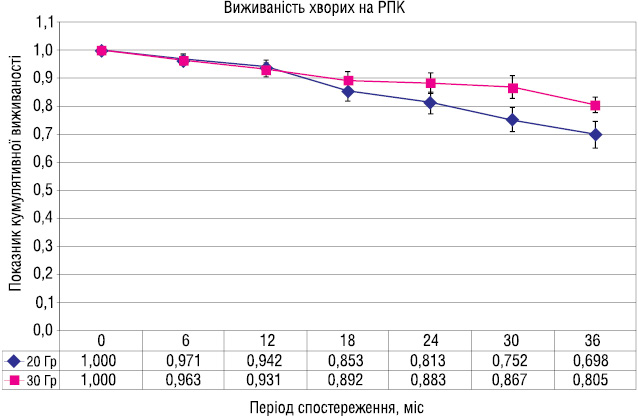
При досліджені безрецидивної виживаності в обох групах за той же період 3-річна безрецидивна виживаність була вищою у 2-й групі, ніж у 1-й і становила відповідно 70,1 та 57,1% (рис. 2).
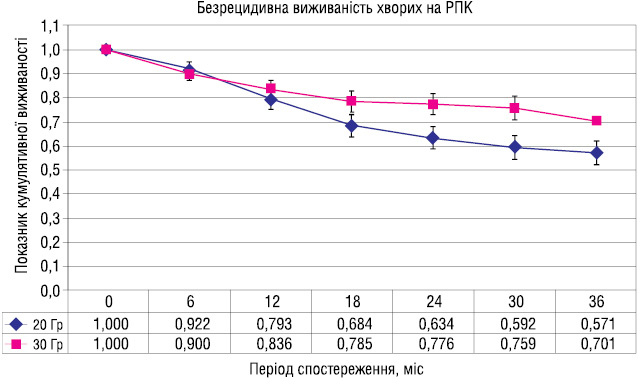
При порівнянні загальної виживаності хворих на РПК залежно від стадії та видів променевої терапії, достовірного підвищення цього показника не виявлено (рис. 3, 4).
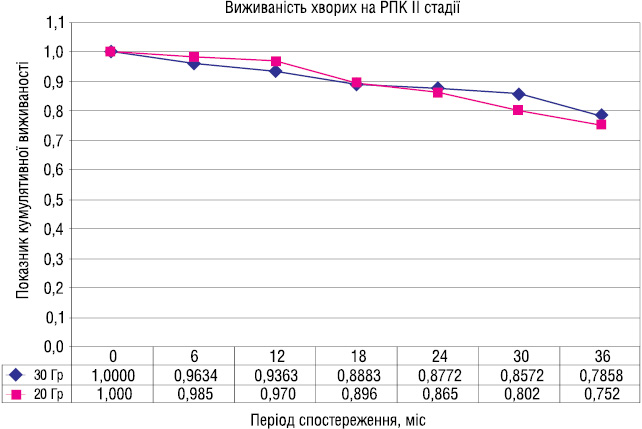
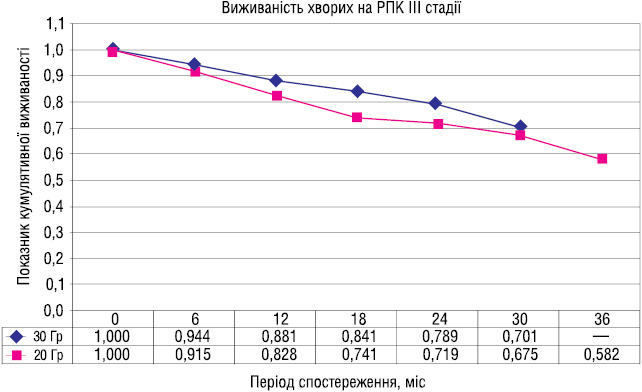
ВИСНОВКИ
Оптимальний локальний контроль є важливим показником у лікуванні РПК. Комбіноване лікування хворих на резектабельний РПК із НПТ (дрібними фракціями) — ефективний метод, який надає можливість збільшити кількість сфінктерзберігаючих операцій і покращити якість життя хворих. Результати доводять, що дрібнофракційна НПТ в сумарній дозі 30 Гр підвищує 3-річну безрецидивну та загальну виживаність хворих на РПК ІІ–ІІІ стадії.
Література
1. Барсуков Ю.А., Николаев А.В., Тамразов Р.И. и др. (2002) Сравнительный анализ хирургического и комбинированного лечения больных операбельным раком прямой кишки (результаты рандомизированного исследования). Практ. онкология, 3(2): 105–113.
2. Бердов Б.А., Невольских А.А., Ерыгин Д.В. и др. (2008) Использование радиотерапии в современном лечении резектабельного рака прямой кишки. Вопр. онкологии, 54(3): 350–353.
3. Дворниченко В.В., Афанасьев С.Г., Шелехов А.В. и др. (2009) Лучевая терапия в комбинированном лечении рака прямой кишки. Сибир. онколог. журн., 31(1): 72–77.
4. Тюряева Е.И. (2008) Химиолучевое лечение рака прямой кишки. Практ. онкология, 9(1): 31–38.
5. Шалимов С.А., Колесник Е.А., Гриневич Ю.А. (2005) Современные направления в лечении колоректального рака. Киев, 112 с.
6. Bécouarn Y., Guillo S., Artru P. et al. (2008) Systematic review: value of perioperative chemotherapy in the management of resectable rectal adenocarcinoma (brief report). Bull. Cancer., 95(7): 717–734.
7. Castaldo E.T., Parikh A.A., Pinson C.W. et al. (2009)Improvement of survival with response to neoadjuvant radiation therapy for rectal cancer. Arch Surg., 144(2): 129–134.
8. Cervantes A., Rosello S., Rodriguez-Braun E. et al. (2008) Progress in the multidisciplinary treatment of gastrointestinal cancer and impact on clinical practice: perioperative management of rectal cancer. Ann. Oncol., 19(7): vil266–vil272.
9. Davies M., Harries D., Hirst G. et al. (2009) Local recurrence after abdomino-perineal resection. Colorectal. Dis., 11: 39–43.
10. Dunst J., Reese T., Hoelscher T. et al. (2003) Preoperative chemotherapy with capecitabine in locally advanced rectal cancers — a phase-II-study. EJC, 1(5): 86. Abstr. 282.
11. Fazio V.W., Zutshi M., Remzi F.H. et al. (2007) A randomized multicenter trial to compare long-term functional outcome, quality of life, and complications of surgical procedures for low rectal cancer. Ann. Surg., 246(3): 481–490.
12. Glimelius B., Pahlman L., Cervantes A. (2010) Rectal cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 21(Suppl. 5): v82–v86.
13. Heald R.J., Moran B.J., Ryall R.D. et al. (1998) Rectal cancer: the Basingstoke experience of total mesorectal excision, 1978–1997. Arch. Surg., 133: 894–899.
14. Howard J.H., Gonzalez Q., Arnoletti J.P. et al. (2008) Prognostic factors and preoperative radiation therapy associated with sphincter preservation in patients with resectable rectal cancer. Am. J. Surg., 195(2): 239–243.
15. Huguier M., Houry S., Barrier A. (2001) Local recurrence of cancer of rectum. Am. J. Surgery, 182 (5): 437–439.
16. Kapiteijn E., Putter H., van de Velde C.J.; Cooperative investigators of the Dutch ColoRectal Cancer Group (2002) Impact of the introduction and training of total mesorectal excision on recurrence and survival in rectal cancer in The Netherlands. Br. J. Surg., 89(9): 1142–1149.
17. Keighley M.R.B., Williams N.S. (2001) Surgery of the anus, rectum and colon, 2nd ed. WB Saunders, London.
18. Marijnen C.A., Nagtegaal I.D., Kapiteijn E. et al. (2003) Cooperative investigators of the Dutch Colerectal Cancer Group. Radiotherapy does not compensate for positive resection margins in rectal cancer patients: report of a multicenter randomized trial. Int. J. Radiat. Oncol. Biol. Phys., 55(5): 1311–1320.
19. Moriya Y. (2006) Treatment Strategy for Locally Recurrent Rectal Cancer. Jpn. J. Clin. Oncol., 36(3): 127–131.
20. Penopoulos V., Handolias M., Avgerinos A. et al. (2008) A short course of preoperative radiotherapy improves prognosis of operable rectal carcinoma: a case control study. Hepatogastroenterology, 55(85): 1280–1287.
21. Porter G.A., Soskolne C.L., Yakimets W.W. et al. (1998) Surgeon-related factors and outcome in rectal cancer. Ann. Surg., 227: 157–167.
22. Rutkowski A., Bujko K., Nowacki M.P. et al. (2008) Distal Bowel Surgical Margin Shorter than 1 cm After Preoperative Radiation for Rectal Cancer: Is It Safe? Ann. Surg. Oncol., 3: 2014–2019.
23. Suh W.W., Blackstock A.W., Herman J. et al. (2008) ACR Appropriateness Criteria on resectable rectal cancer: expert panel on radiation oncology — rectal/anal cancer. Int. J. Radiat. Oncol. Biol. Phys., 70(5): 1427–1430.
24. Syk E., Glimelius B., Nilsson P.J. (2010) Factors Influencing Local Failure in Rectal Cancer: Analysis of 2315 Patients From a Population-Based Series. Diseases of the Colon & Rectum, 53(5): 744–752.
26. Ulrich A., Weitz J., Slodczyk M. et al. (2009) Neoadjuvant Treatment Does Not Influence Perioperative Outcome in Rectal Cancer Surgery. Int. J. Radiat. Oncol. Biol. Phys., 20: 1230–1238.
27. van Cutsem E., Dicato M., Haustermans K. et al. (2008) The diagnosis and management of rectal cancer: expert discussion and recommendations derived from the 9th World Congress on Gastrointestinal Cancer, Barcelona, 2007. Ann. Oncol., 19(Suppl. 6): vi1–8.
28. Velenik V. (2009) Locally recurrent rectal cancer: treatment options. Radiol. Oncol., 43(3): 144–151.














Leave a comment