Можливості променевих методів у діагностиці злоякісних пухлин яєчника
Лаврик Г.В., Головко Т.С., Шевчук Л.А., Бакай О.А.
Резюме. Мета. Підвищити ефективність променевої діагностики та оптимізувати моніторинг лікування хворих зі злоякісними новоутвореннями яєчника шляхом застосування інноваційних методик та визначення їх ефективності. Об’єкт і методи. Матеріали дослідження базуються на проведенні комплексного променевого обстеження 60 хворих на рак яєчника (РЯ) та аналізі його безпосередніх результатів у рамках фрагмента науково-дослідної роботи періоду 2017–2018 рр. Усім пацієнткам проведено ультразвукове дослідження (УЗД) органів малого таза, черевної порожнини та заочеревинного простору (всього 176 досліджень); 30 хворим — магнітно-резонансну томографію (МРТ) органів малого таза для уточнення розповсюдження пухлинного процесу: як базові дослідження, для планування лікування та його оцінки (всього 57 досліджень). Стадіювання РЯ проводили відповідно до класифікації FIGO (2013 р.) Морфологічну верифікацію проведено усім пацієнткам — підтверджено аденокарциному різного ступеня диференціювання. Групу порівняння сформували 20 пацієнток, у яких виявлено доброякісні новоутворення яєчника. Результати. Визначено та уточнено візуальні найбільш значущі ультразвукові та магнітно-резонансні ознаки РЯ, що характеризують активність злоякісного процесу. Визначено інформативність (чутливість, специфічність і точність) УЗД, МРТ, МРТ + дифузійно-зважених зображень для виявлення новоутворення в яєчнику. Розроблено алгоритм променевого обстеження жінок при підозрі на злоякісні новоутворення яєчника з метою своєчасної діагностики, моніторингу лікування. Висновки. Застосування комплексу променевих методів дослідження дозволило підвищити ефективність діагностики злоякісних новоутворень яєчника, визначити пріоритетність та доцільність їх використання у лікуванні, діагностичному моніторингу, виявленні рецидиву.
Одержано 24.01.2019
Прийнято до друку 28.02.2019
DOI: doi.org/10.32471/clinicaloncology.2663-466X.38.22233
Вступ
Серед злоякісних пухлин малого таза рак яєчника (РЯ) посідає третє місце з тенденцією до підвищення захворюваності та смертності, особливо серед жінок репродуктивного віку [1].
За даними Міжнародного агентства з вивчення раку (International Agency for Research on Cancer — IARC), щороку в світі реєструють близько 500 тис. нових випадків РЯ, від якого помирають більше 140 тис. жінок. За даними Національного канцер-реєстру України, у 2016 р. захворюваність на РЯ в Україні становила 15,1%, а смертність — 8,7 випадку на 100 тис. жіночого населення [2].
Показники смертності від РЯ, у тому числі протягом першого року після встановлення діагнозу, є високими. За даними популяційних канцер-реєстрів країн Європи, виживаність хворих протягом одного року становить 63%, трьох років — 41%, п’яти років — 35%. Щороку від РЯ помирають більше жінок, ніж від раку шийки матки та ендометрія разом. Такі невтішні дані пояснюються агресивними біологічними властивостями пухлин, раннім метастазуванням та схильністю до рецидивування [3, 4].
Здебільшого найчастіше (66–88%) пухлину яєчника діагностують на III–IV стадії захворювання за високої імовірності її поширення за межі органа й метастазування [5, 6].
Проблема важлива в науковому і практичному аспектах через відсутність специфічної симптоматики, агресивність пухлини, схильність до раннього метастазування та рецидивування, що диктує необхідність визначення факторів ризику виникнення захворювання, розробки діагностичного алгоритму, диференційованого персоніфікованого підходу до методів лікування.
Ефективність лікування значною мірою залежить від якості діагностики. Правильно проведена диференційна діагностика новоутворення, визначення поширення злоякісного процесу є важливою інформацією для вибору адекватної тактики лікування [7, 8].
Методи променевої діагностики є ключовими поряд із аналізом пухлинних маркерів та правильною інтерпретацією базових досліджень, контролем відповіді на лікування та визначенням можливості виконання операції [9, 10].
Сучасний етап розвитку медицини характеризується широким впровадженням у клінічну практику більш складних методів променевої діагностики (комп’ютерної томографії (КТ), МРТ), які не тільки істотно полегшують та об’єктивізують візуалізацію патологічного процесу, але й змінюють, у низці випадків, уявлення про особливості захворювання. Як правило, для встановлення точного діагнозу застосовують комплекс діагностичних процедур з метою одержання необхідної інформації в повному обсязі [11–13].
Ультразвукове дослідження (УЗД) залишається методом першої лінії у виявленні та уточнювальній діагностиці РЯ завдяки доступності апаратури, неінвазивності, простоті виконання, відсутності променевого навантаження, повній і достовірній інформації для встановлення діагнозу.
Найбільш поширеним способом УЗД при РЯ є В-режим. Для підвищення специфічності сірошкальних досліджень у диференційній діагностиці між доброякісними та злоякісними новоутвореннями яєчника запропоновано різні оціночні системи, які враховують особливості оваріальних новоутворень: ехогенність, структуру, товщину стінки, наявність перетинок, внутрішній вміст та ін. [14–16].
Незважаючи на те що УЗД має високу чутливість (90–96%) та точність (98–99%) у визначенні злоякісних новоутворень яєчника, позитивний прогностичний показник цього методу щодо РЯ не перевищує 7–10%. Але покращити специфічність УЗД можливо шляхом поєднання сірошкального дослідження з іншими методиками, які додають інформації про наявність/відсутність кровоносних судин у тканині пухлини та швидкість кровотоку в них — в якості маркера неоангіогенезу [17].
Застосування різних методик та вдале їх поєднання при структурних змінах в яєчниках дозволяє досягти значного підвищення чутливості у виявленні пухлин, але показники специфічності залишаються у досить широкому діапазоні (у межах 39–89%) через складність інтерпретації зображень [18, 19].
Добре зарекомендував себе інноваційний метод ультразвукової діагностики — еластографія, за допомогою якої оцінюють пружні властивості тканин (еластичність) [20]. В основу методу покладено принцип пальпації, під дією тиску відбувається деформація (зміщення) тканин, що надає інформацію про їх еластичність. Тиск створюється за допомогою ультразвукової хвилі та невеликої механічної компресії, яку виконує оператор. Отримані дані аналізуються ультразвуковим приладом, будується діаграма (еластограма), яка відображає ступінь жорсткості тканин різним спектром кольорів. Новоутворення в яєчнику спричиняють зміни структури органа в цілому та зміну його еластичності, внаслідок чого знижується здатність тканини деформуватися при компресії. Тканина яєчника разом із пухлиною стають жорсткими (поняття, обернене еластичності), що є характерним для патологічного процесу. Будь-які новоутворення з високою жорсткістю асоціюються з підвищеним ризиком наявності злоякісної пухлини [21–24].
Описані поєднані ультразвукові методики трансвагінального дослідження з одночасним контрастуванням (введення фізіологічного розчину NaCl) просвіту прямої кишки покращують зображення об’ємного процесу, можливість виявлення поширення ураження у регіонарних (параректальному та паравезикальному просторах) зонах, залучення в пухлинний процес прилеглих органів (стінок сечового міхура та прямої кишки) [25].
Результати роботи міжнародних експертних груп з визначення методу вибору для виявлення об’ємних процесів у яєчниках підтверджують переваги МРТ [26, 27].
В останнє десятиріччя в клінічну практику впроваджуються сучасні функціональні методики МРТ: дифузійні, перфузійні, спектроскопічні, котрі в поєднанні з традиційною МРТ визначають можливості метаболічного аналізу виявленого новоутворення, детальної оцінки васкуляризації, визначення швидкості дифузії молекул води, що дозволяє отримати додаткову інформацію для диференційної діагностики новоутворень яєчника. Дифузійно-зважена послідовність забезпечує чіткий візуальний контраст на основі молекулярної дифузії та демонструє високу інтенсивність первинної пухлини та імплантаційних перитонеальних метастазів (МТС) [28–30].
Вивчення in vivo динаміки коефіцієнта дифузії та рівнів перфузії відкриває якісно нові можливості оцінки змін у структурі пухлини під впливом специфічного протипухлинного лікування та перспективного застосування їх як незалежних предикторів чи показників ефективності терапії [31–33].
Достовірне зменшення обмеження дифузії вже після першого курсу поліхіміотерапії (ПХТ), за відсутності достовірних змін у групі резистентних пухлин, може бути позитивним ефектом лікування [34].
Порівнянням діагностичної ефективності КТ і МРТ та отриманих результатів диференційної діагностики доведено, що обидва методи можна вважати ефективними в діагностиці, однак, за результатам проведеного дослідження, МРТ із дифузійно-зваженими зображеннями (ДЗЗ) має вищі показники (порівняно з КТ) діагностичної ефективності: точність — 89,77%, чутливість — 93,1% та специфічність — 83,3% [35].
Наразі спіральну комп’ютерну томографію (СКТ) застосовують не стільки для раннього виявлення та диференційної діагностики новоутворень яєчника, скільки для оцінки поширення пухлини та виявлення віддалених МТС, оскільки метод має високу проникну здатність, високу чутливість для оцінки паренхіматозних та порожнистих органів. Передбачається застосування довенного болюсного підсилення з урахуванням фазності контрастування [36].
СКТ має суттєві переваги у визначенні розміру пухлини (різниця при зіставленні з макропрепаратом ±1,5 см); вивченні співвідношення з нервово-судинними магістралями; дослідженні складних анатомічних зон; можливостях подальшої комп’ютерної обробки зображення [37].
Вдале поєднання різних променевих методик не тільки додає цінності кожній із них і нівелює недоліки, а в цілому забезпечує точне встановлення діагнозу.
Визначення рівня СА 125 у сироватці крові застосовується в діагностиці РЯ для раннього виявлення рецидиву та оцінки ефективності лікування [15, 32, 33]. Однак разове визначення рівня СА 125 у пацієнток із РЯ не забезпечує достатньої чутливості та специфічності (70–75 та 71–76% відповідно) для диференційної діагностики [38, 39].
Рівень маркера СА 125 понад 35–65 од./мл у пацієнток протягом періоду лікування (неоад’ювантна ПХТ, виконання циторедуктивної операції, динамічне спостереження після проведеного лікування) може розцінюватися як прогностичний фактор прогресування злоякісного процесу [40]. Зниження рівня маркера більш як на 50% (порівняно з вихідним) після першого курсу неоад’ювантної ПХТ може асоціюватися із більш сприятливим прогнозом у хворих на РЯ як позитивний прогностичний критерій високої хіміочутливості [41, 42].
НЕ4 (human epididymis protein 4) — білок, ідентифікований в 1991 р. в епітелії епідидиміса людини. Натепер виконана достатня кількість досліджень з вивчення діагностичної значущості НЕ4 у хворих на РЯ. За чутливістю перевищує СА 125, особливо у жінок молодого віку [43]. Окрім того, доведено, що НЕ4 підвищується переважно тільки у пацієнток зі злоякісними новоутвореннями яєчника [44].
Результати метааналізу досліджень (за 2008–2013 рр.) продемонстрували, що чутливість та специфічність НЕ4 були неоднаковими — 65,0 та 85,0% на ранніх стадіях РЯ — та вирівнювалися на пізніх стадіях — відповідно 88,0 та 86,0% [45].
Комбінація НЕ4 з СА 125 давала найкращу чутливість (76%) і специфічність (95%) в диференційній діагностиці злоякісних та доброякісних процесів у яєчниках та, на думку авторів, є більш точним предиктором злоякісного перебігу при наявності у жінки новоутворення малого таза [46].
Для підвищення діагностичної значущості комбінації СА 125 та НЕ4 для диференційної діагностики РЯ та доброякісних новоутворень яєчника у 2009 р. R. Moore та співавтори [47] розробили алгоритм оцінки ризику наявності РЯ у жінок з новоутворенням малого таза — ROMA (Risk of Ovarian Malignancy Algorithm). Цей алгоритм включає три показники: концентрацію сироватки СА 125 та НЕ4 і менопаузальний статус жінки. Численні дослідження підтверджують діагностичну ефективність ROMA [48, 49].
Діагностика РЯ залишається складним завданням для радіології, оскільки не втрачають актуальності питання виявлення пухлини, встановлення її поширення, оцінки ефективності застосованого лікування та подальшого діагностичного моніторингу, спрямованого на раннє визначення рецидиву.
Мета роботи: покращити ефективність променевої діагностики та оптимізувати моніторинг лікування хворих зі злоякісними новоутвореннями яєчника шляхом застосування інноваційних методик та визначення їх ефективності.
Об’єкт і методи дослідження
Матеріали дослідження базуються на проведенні комплексного променевого обстеження 60 хворих на РЯ та аналізі його безпосередніх результатів у рамках науково-дослідної роботи за період 2017–2018 рр. Вік пацієнток — від 22 до 84 років, у середньому — 49,5±12,5 року. Усім пацієнткам проведено УЗД органів малого таза, черевної порожнини та заочеревинного простору (176 досліджень). Стадіювання РЯ проводили відповідно до класифікації FIGO (2013 р.) [50]. Морфологічну верифікацію виконано усім пацієнткам — підтверджено аденокарциному різного ступеня диференціювання.
Групу порівняння сформували 20 пацієнток, у яких виявлено доброякісні новоутворення яєчника (фолікулярні, параоваріальні кісти, кісти жовтого тіла).
УЗД органів малого таза проводили за стандартною методикою на діагностичних приладах, застосовуючи широкосмугові датчики із частотною характеристикою L12–7,5, C6 і С5–2 МГц та використовуючи методики енергетичного допплерівського картування, кольорового допплерівського картування (КДК). Вивчення гемодинамічних показників пухлинного кровотоку проводили із застосуванням спектральної допплерографії. Методики поєднували в трансабдомінальному та трансвагінальному доступі. Окрім того, була застосована соноеластографія для оцінки жорсткості новоутворення яєчника (25 досліджень).
30 хворим на РЯ проведено МРТ органів малого таза для уточнення розповсюдження пухлинного процесу: як базові дослідження, для планування та моніторингу, для оцінки ефективності після 1-го та 3-го курсів (57 досліджень).
КТ проводили для виявлення розповсюдження пухлини за межі таза, наявності чи виключення МТС в легенях, печінці та можливих інших локалізацій (97 досліджень).
Окрім того, вивчали скарги пацієнтів, норму чи порушення менструальної та репродуктивної функцій, анамнез хвороби та життя, дані загального фізикального обстеження, результати гінекологічного ректовагінального обстеження (встановлення наявності та локалізації патологічного процесу, форма, розміри матки та придатків, їх консистенція, рухомість, наявність больових відчуттів при пальпації, анатомо-топографічні зв’язки органів малого таза тощо), дані лапароскопії, кольпоскопії, фіброгастродуоденоскопії, колоноскопії.
Результати та їх обговорення
Характер скарг пацієнток у групах представлено в табл. 1.
| Скарги | Групи пацієнток, n (%) | Усього (N=80) | |
| Основна група (N=60) | Контрольна група (N=20) | ||
| Біль в животі | 33 (55) | 4 (20) | 37 |
| Ациклічність менструального циклу | 25 (41,6) | 4 (20) | 29 |
| Збільшення живота | 9 (15) | 0 (0) | 9 |
| Міжциклічні кров’яні виділення | 6 (10) | 0 (0) | 6 |
| Скарг немає | 12 (20) | 12 (60) | 24 |
У більшості хворих на РЯ основними скаргами були біль в животі (55%) та порушення менструального циклу (41,6%), виявлені при опитуванні і в пацієнток контрольної групи — по 20% відповідно.
При зборі анамнезу майже у 70% пацієнток виявлено супутні гінекологічні захворювання — фіброміому матки, гіперпластичні процеси в ендометрії, з приводу яких пацієнтки лікувались у лікаря-гінеколога (табл. 2).
| Захворювання | Кількість обстежених пацієнток, n (%)(N=80) |
| Гіперпластичні процеси ендометрія (поліпи) | 12 (15,0) |
| Міома матки | 37 (46,2) |
| Ендометріоз тіла матки | 4 (5,0) |
| Поєднання міоми матки і аденоміозу | 17 (21,2) |
У табл. 3 наведено порівняльну характеристику онкомаркерів, їх чутливість залежно від стадії злоякісного процесу.
| Маркер | Показники до початку лікування (операція, ПХТ), % | Показники після завершення лікування (операція, ПХТ), % | ||
| Стадії злоякісного процесу | Регрес | Прогресування | ||
| I–II | III–IV | |||
| СА 125 | 10–25 | 56–70 | 35–68 | 55—89 |
| НЕ4 | 61,1–92,3 | 80–90 | 45–89 | 88—99 |
| СА 125 + НЕ4 (ROMA) | 63,9–95,8 | 86–97 | 50–94 | 80—97 |
Як видно з даних табл. 3, саме поєднання та комплексна оцінка онкомаркерів є показовими на ранніх стадіях РЯ, під час проведення хіміотерапевтичного лікування та після завершення комбінованої терапії з метою визначення ранніх ознак прогресії захворювання.
У цій звітній роботі ми комплексно оцінювали результати ультразвукових методик, визначали параметри новоутворення яєчника для оцінки подальшого лікування.
Розміри новоутворень яєчника були в межах 37–300 мм, у середньому — 108,8±61,2 мм, об’єм утворення — 30–875 см. Ми не виявили прямої залежності між розміром новоутворення та стадією злоякісного процесу (табл. 4).
| Класифікація | Кількість хворих, n (%) | |
| Стадія за FIGO | TNM | |
| ІА | T1aN0M0 | 9 (15,0) |
| ІІА | T2аN0M0 | 8 (13,3) |
| ІІВ | T2аN0M0 | 9 (15,0) |
| ІІІА | T3аN0M0 | 8 (13,3) |
| ІІІВ | T3bN0M0 | 8 (13,3) |
| T3bN1M0 | 9 (15,0) | |
| ІV | T4N0M1 | 9 (15,0) |
| Усього, n (%) | 60 (100,0) | |
При оцінці ехоструктури всі пухлини яєчника було розділено (залежно від типу будови) на три типи: кістозний — 35% спостережень, кістозно-солідний — 40%, з наявністю пристінкового (100%) компонента та солідної будови новоутворення — 25% васкуляризованого (100%) тканинного компонента. Для кістозного типу була характерною наявність багатокамерного (83,3%) округлого новоутворення з чіткими краями, анехогенної структури з поодинокими чи множинними перетинками різної товщини з нерівномірним, хаотичним їх потовщенням (рис. 1, а).
При кістозно-солідному типі (40% спостережень) визначалися новоутворення округлої форми, з чіткими краями, рівними контурами, анехогенної структури, з перетинками (100% спостережень) та наявністю ехогенних включень по внутрішньому контуру псевдокапсули та на перетинках. Солідний компонент (40% випадків) мав правильну округлу форму з чітким рівним контуром. У 60% спостережень — неправильну форму, чіткі нерівні контури, гіперехогенну структуру (рис. 1, б).
При солідному типі будови (25% спостережень) визначалося новоутворення округлої (92,9%) чи неправильної форми, з чітким нерівним контуром, горбистим краєм, зниженої ехогенності, з множинними рідинними (31,1%) включеннями округлої форми (рис. 1, в). Наявність лінійних, різноспрямованих включень (перетинок) різної товщини в структурі пухлини свідчила про злоякісний характер, на відміну від рідинного вмісту при доброякісних новоутвореннях. Ця ознака розцінюється як один з основних діагностичних критеріїв.
Проведений нами аналіз типів ехоструктури РЯ дозволив виділити ехографічні типи пухлини, які є найбільш характерними для злоякісного процесу.
Так, достовірне переважання гіпер-, гіпо-, анехогенної структури новоутворення з наявністю таких самих гіпер-, гіпо-, анехогенних включень є ще одним діагностичним критерієм злоякісності пухлини. У наших дослідженнях їх виявлено у 51 (85%) пацієнтки.
Наведено розподіл пацієнток залежно від характеру пухлинного процесу, локалізації, клінічної симптоматики та віку (пре- чи постменопаузальний період) (табл. 5).
| Характеристика | Кількість пацієнток (N=80, 100%) | |
| n | % | |
Вік:
|
– 42 38 |
– 52,5 47,5 |
Локалізація новоутворення:
|
– 43 37 |
– 53,8 46,2 |
Тип будови:
|
– 28 32 20 |
– 35 40 25 |
| Багатокамерність | 50 (+) | 62,5 |
| Тканинний компонент | 60 (+) | 75 |
| Неоваскуляризація | 60 (+) | 75 |
| Присутність клінічних симптомів | 56 (+) | 70 |
| Асцит | 36 | 45 |
У 52,5% випадків новоутворення в яєчниках виявляли у жінок пременопаузального періоду, у 47,5% — постменопаузального. У 32 (53,3%) пацієнток пухлини яєчника спостерігалися протягом тривалого часу до встановлення діагнозу, мали стійкий характер росту та типову локалізацію.
При злоякісному процесі у 37 (46,2%) пацієнток новоутворення мали білатеральний характер (див. рис. 1, б). Об’ємний процес характеризувався відсутністю нормальної анатомії яєчників, наявністю в їх проекції різного характеру (кістозного, кістозно-солідного, солідного) новоутворень, що формували єдиний конгломерат з тілом матки та матковими трубами, розповсюджувався за межі порожнини малого таза та відзначався наявністю вільної рідини в порожнині малого таза, черевній, плевральних порожнинах та перикарді.
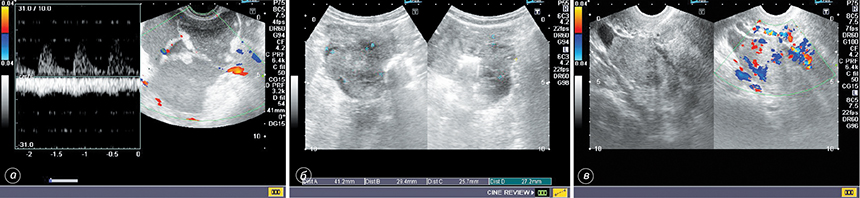
Застосування допплерографії дозволило досягти суттєвого підвищення точності диференційної діагностики злоякісних новоутворень яєчника. Так, у 60 (75%) спостереженнях виявлено атиповий кровотік, що характеризувався високою систолічною швидкістю (Vmax) ≥19 см/с та низьким індексом резистентності (RI) ≤0,4 в дрібних судинах стінок пухлини та в папілярних розростаннях, що притаманно злоякісному процесу. На допплерограмах атиповість судинної сітки — у вигляді різноспрямованого потоку, змішаних відтінків при картуванні, при аналізі кривої кровотоку — більше відповідає артеріальному типу (рис. 2). Показники кровотоку в наших дослідженнях було зареєстровано у 93,3% пацієнток із РЯ.
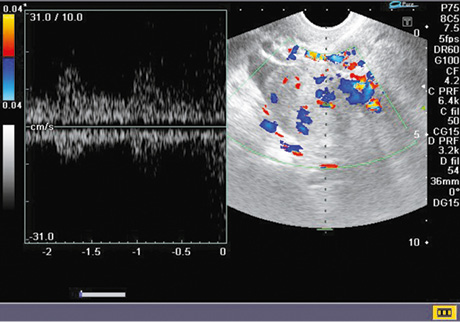
Після нерадикальних операцій особливої уваги заслуговують кістозні утворення в яєчниках. Основне завдання в цьому випадку — проведення диференційної діагностики між функціональними кістами, доброякісними пухлинами та злоякісними новоутвореннями. Однозначних ультразвукових критеріїв не існує. Але при комплексній оцінці необхідно враховувати, що малі розміри, неоднорідний вміст, тонкі стінки та відсутність папілярних вегетацій більш характерні для доброякісних утворень, водночас відносно великі розміри, товсті стінки, нерівномірна товщина стінки та перегородок, наявність розростань та власного сформованого кровотоку — для злоякісних пухлин. Певною мірою інформативною є спектрометрія — для злоякісних пухлин властива висока Vmax ≥19 см/с та низький RI ≤0,4 у судинах стінок та папілярних розростань.
Застосування інноваційної методики соноеластографії дозволило диференціювати ультразвукові ознаки злоякісного процесу (рис. 3, 4). Так, визначення еластичності утворення, типу жорсткості пристінкового компонента кістозного процесу дозволило досягти суттєвого підвищення точності диференційної діагностики злоякісних новоутворень яєчника.
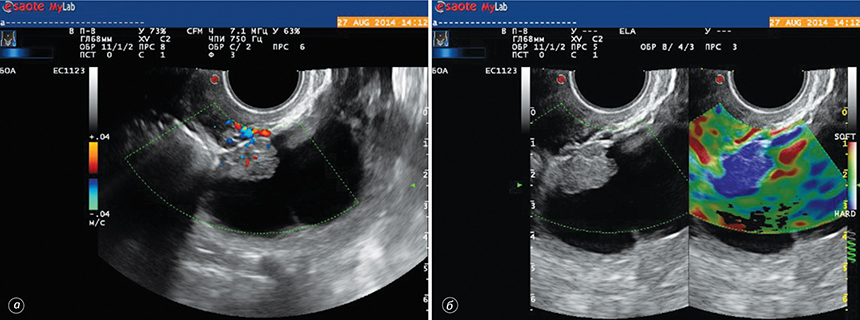
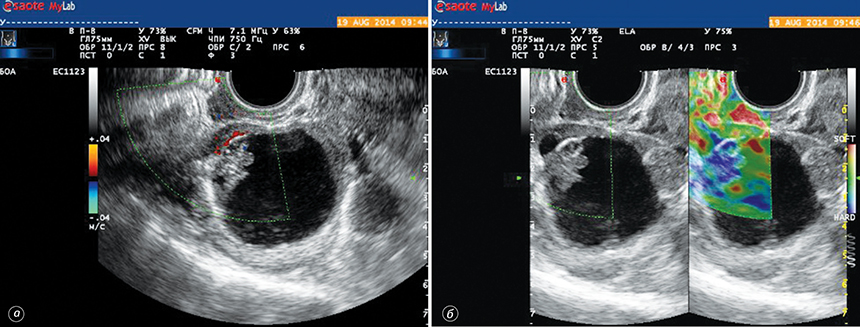
На основі проведених досліджень та отриманих результатів розроблено діагностичну тактику при визначенні злоякісних новоутворень яєчника (табл. 6).
| Характеристика | Ехосеміотика, притаманна доброякісним новоутворенням | Ехосеміотика, притаманна злоякісним новоутворенням |
| Вік пацієнток | Репродуктивний | Постменопауза |
| Дані УЗД | Новоутворення | Новоутворення |
| Розміри новоутворення | Невеликі (в межах 4–8 см) | Понад 8 см |
| Динамікановоутворення | Стабільність/зменшення | Збільшення з часом, приєднання додаткових ознак, характерних для злоякісного новоутворення |
| Характеристика новоутворення | Кістозний тип, контур гладкий, вміст однорідний гомогенний, відсутність пристінкових включень, аваскулярність | Кістозний, кістозно-солідний, солідний тип новоутворення, нерівний горбистий контур, пристінковий солідний компонент, неоваскуляризація |
| Рухливість | Рухливий | Фіксований |
| Сторона ураження | Частіше однобічне ураження | Частіше двобічне ураження |
| Клінічна симптоматика | Безсимптомність | Є клінічні прояви |
| Асцит | Немає | Наявний |
| Тактика лікування | Спостереження, повторне обстеження через 4–6 тиж | Хірургічне лікування, ПХТ |
Дані табл. 6 демонструють ультразвукові ознаки доброякісних новоутворень яєчника: переважання новоутворень невеликого розміру, в основному кістозного типу, з рівним контуром, однорідним гомогенним вмістом, відсутністю пристінкових включень, аваскулярними, переважно однобічної локалізації. Дані динамічних спостережень свідчать про стабільність чи зменшення розмірів, безсимптомність клінічного перебігу, відсутність асциту.
Ультразвуковими критеріями злоякісного новоутворення є: новоутворення кістозної, кістозно-солідної чи солідної будови, з нерівним горбистим контуром, наявним пристінковим солідним компонентом з вираженою неоваскуляризацією. У більшості випадків визначено фіксований характер новоутворення, наявність клінічної симптоматики та асциту.
Зображення малого таза при МР-дослідженнях у жінок репродуктивного віку при доброякісних новоутвореннях мали вигляд гомогенної строми зі збереженням її зональності та наявності в одному/обох яєчниках округлої форми додаткового утворення, строма яєчників була гомогенною на Т1-зважених зображеннях (ЗЗ), а на Т2-ЗЗ простежувалося зональне диференціювання у вигляді наявності центральної зони вищого сигналу і периферичної зони нижчого сигналу. У жінок менопаузального віку диференціювання в стромі яєчників було втрачене, структура мала гомогенний характер на Т2-ЗЗ, гіпоінтенсивний порівняно з міометрієм. При КТ строма яєчників накопичувала контрастний препарат з такою ж самою інтенсивністю, як і міометрій.
Для злоякісних пухлин яєчника основними достовірними прогностичними МР-ознаками були: великі розміри новоутворень, наявність потовщених перетинок, папілярних розростань, нечіткі нерівні контури стінки (рис. 5). При аналізі МР-семіотики РЯ виявлено такі закономірності: для пухлин з високим ступенем диференціювання була характерна кістозна або кістозна-солідна структура, тоді як новоутворення помірного і низького ступеня диференціювання мали переважний солідний компонент. Двобічне ураження яєчників частіше відмічалося у хворих із низькодиференційованими пухлинами. Наявність перетинок товщиною >3 мм частіше відмічена в низькодиференційованих пухлинах.
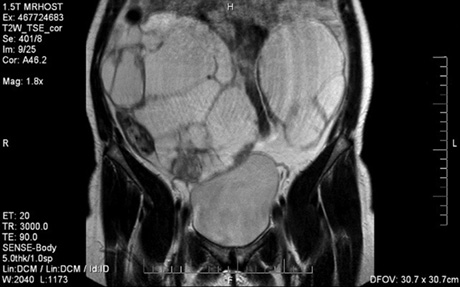
Структура РЯ була неоднорідною, з наявністю на Т2-ЗЗ гіперінтенсивної центральної зони і периферичної зони ізо- або гіпоінтенсивного сигналу та ізоінтенсивних внутрішніх перетинок товщиною понад 3 мм. У злоякісних утвореннях папілярні розростання виявляли як по внутрішньому, так і по зовнішньому контуру капсули. Тканинний компонент у 85% випадків був неоднорідним за рахунок наявності ділянок крововиливу та некрозу (рис. 6).
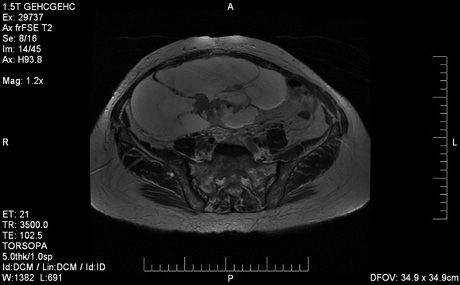
Солідний компонент у 78,1% спостережень характеризувався підвищеним накопиченням контрастного препарату. Кореляції між характером контрастного посилення і ступенем гістологічного диференціювання пухлини не виявлено (рис. 7).
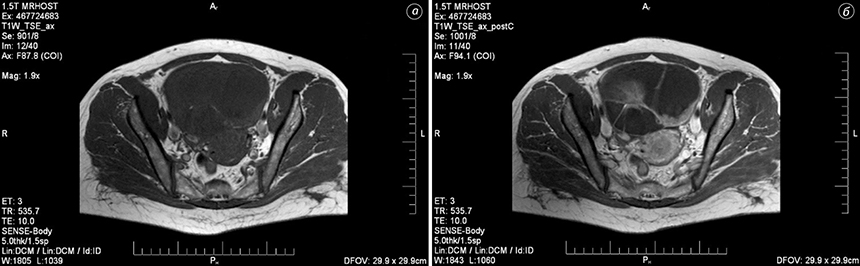
Для злоякісних новоутворень характерні: висока інтенсивність сигналу і низькі значення вимірюваного коефіцієнта дифузії, які відображають обмежену кількість молекул води в утворенні, зменшення обсягу позаклітинного простору. Відповідно, застосування ДЗЗ покращувало виявлення злоякісних новоутворень. Для злоякісних новоутворень яєчника характерним було поширення процесу на очеревину у вигляді перитонеальних імплантів з наявністю асциту (рис. 8).
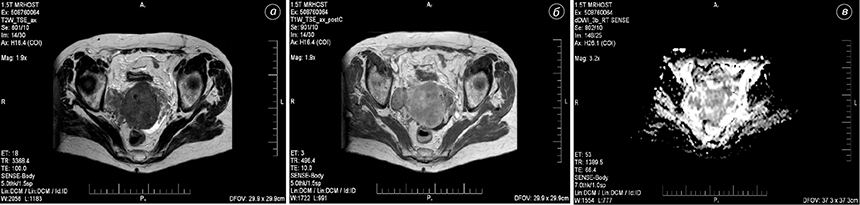
У результаті проведених досліджень уточнено ультразвукові та магнітно-резонансні ознаки РЯ: зміна структури яєчника (96,8%), нерівні контури (66,9%), нечіткі межі (74,5%), неоднорідна структура (89,0%), кістозний (56,6%) чи кістозно-солідний (87,9%) тип, наявність новоутворення з атиповим внутрішньопухлинним кровотоком (51,2%), висока жорсткість (60,0%), посилене (75,0%) накопичення контрасту, ознаки обмеження (85,5%) дифузії.
Уточнено інформативність різних променевих методів для виявлення новоутворення в яєчнику. Для РЯ чутливість, специфічність і точність становлять: при УЗД — 81,0; 84,0 та 82,0% відповідно, при МРТ — 90,5%, 89,6 та 89,7% відповідно, при МРТ з ДЗЗ — 94,5%, 93,6 та 94,7% відповідно (табл. 7).
| Метод | Кількість обстежень, n | Діагностична ефективність, % | ||
| Чутливість | Специфічність | Точність | ||
| УЗД | 176 | 81,0 | 84,0 | 82,0 |
| МРТ | 30 | 90,5 | 89,6 | 89,7 |
| МРТ + ДЗЗ | 27 | 94,5 | 93,6 | 94,7 |
Проведені дослідження продемонстрували, що ультразвукове зображення РЯ відрізняється значним поліморфізмом ехографічної картини. Основна частина висновку формується за результатами сірошкального режиму, а в якості додаткових методик долучаються результати картування, спектрографії та еластографії. Найбільш важливими ознаками слід вважати: збільшення розміру яєчника, наявність множинних включень, тканинного та рідинного компонентів у структурі новоутворення із зонами локальних папілярних розростань та перетинок, підсиленої васкуляризації з хаотично спрямованим кровотоком підвищеної швидкості. Виявлення жорсткої пухлини в яєчнику за даними еластографії доповнює результати щодо її злоякісного характеру.
Застосування МРТ із дифузійно-зваженою послідовністю підвищує діагностичну цінність методу, є інформативним доповненням до традиційних послідовностей для виявлення та характеристики новоутворення в яєчнику. Її використання дозволяє в низці випадків уникнути введення вартісних контрастних препаратів і не пов’язане з істотними тимчасовими або технічними затратами, підвищуючи діагностичну ефективність методу.
На підставі аналізу отриманих даних доцільним можна вважати застосування такого алгоритму променевого обстеження жінок при підозрі на новоутворення яєчника: в якості первинного методу дослідження рекомендується проводити УЗД, перевагу треба віддавати трансвагінальній методиці; виявлені прості однокамерні кістозні утворення з однорідною внутрішньою ехоструктурою потребують спостереження в динаміці протягом 2–3 менструальних циклів, оскільки з найбільшою вірогідністю є функціональними кістами; при виявленні інших новоутворень яєчника обстеження доцільно доповнювати МРТ. Включення в комплексне магнітно-резонансне дослідження ДЗЗ дозволяє з високою вірогідністю не тільки виявляти злоякісні новоутворення, а й визначати поширення пухлинного процесу, що покращує можливості подальшого лікування хворих.
У подальшому, за результатами проведених досліджень, для визначення та уточнення найбільш специфічних променевих ознак планується провести порівняльний аналіз комплексного застосування методик УЗД, СКТ та МРТ та оцінити суттєві переваги кожного методу, нівелювати недоліки, що унеможливить вірогідність діагностичної помилки.
Список використаної літератури
- Urmancheeva А.F., Tjuljandin S.A., Moisejenko V.M. (2008) Practical oncogynecology. Selected lectures. Centre TOMM, St. Petersburg, 368–375.
- Querleu D., Planchamp F., Chiva L. et al. (2016) European Society of Gynaecologic Oncology Quality Indicators for advanced ovarian cancer surgery. Int. J. Gynecol. Cancer, 26 (7): 1354–1363.
- Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2018) Рак в Україні, 2016–2017. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 19: 136 с.
- Cancer Incidence in Five Continents (2007) IARC; IX: 897 p. http://www.iarc.fr/en/publications/pdfs-online/epi/sp160/index.php.
- Антонеева И.И., Генинг Т.П., Абакумова Т.В. и др. (2012) Алгоритм диагностики прогрессирующих форм рака яичников. Медицинский альманах, 4: 29–31.
- Takur A., Mishra V., Jain S.K. (2011) Feed forward artificial neural network: tool for early detection of ovarian cancer. Sci. Pharm., 79 (3): 493–505. doi: 10.3797/scipharm.1105-11.
- Виллерт А.Б., Коломиец Л.А., Родичева Н.С. и др. (2014) Особенности рака яичников у больных с мутацией BRCA1 5382insC. Сиб. онкол. журн., 6: 19–26.
- Молчанов С.В., Коломиец Л.А. (2015) Диссеминированный рак яичников: современный подход к лекарственной терапии. Сиб. онкол. журн., 6: 68–75.
- Солопова А.Е., Чащин А.А., Солопова А.Г., Макацария А.Д. (2016) Неоадъювантная терапия рака яичников. Cовременные возможности и критерии отбора. Акушерство, гинекология и репродукція, 10 (2): 44–54.
- Fagö-Olsen C.L., Ottesen B., Kehlet H., Antonsen S.L. et al. (2014) Does neoadjuvant chemotherapy impair long-term survival for ovarian cancer patients? A nationwide Danish study. Gynecol. Oncol., 132: 292–298.
- Мартынова Н.В., Нуднов Н.В., Головина И.А. и др. (2005) Определение диагностической эффективности современных методов визуализации. Медицинская визуализация, 1: 140–144.
- Медведев М.В., Зыкин Б.П., Хохолин В.Л. (1997) Дифференциальная ультразвуковая диагностика в гинекологии. Видар, Москва, 184 с.
- Wang W., Ding J., Zhu X. et al. (2015) Magnetic resonance imaging characteristics of ovarian clear cell carcinoma. PLoS One, 10 (7): e0132406. doi: 10.1371/journal.pone.0132406.
- Тюляндин С.А., Носов Д.А., Переводчикова И.Н. (2010) Минимальные клинические рекомендации европейского общества медицинской онкологии (ESMO). Издательская группа РОНЦ им. Н.Н. Блохина РАМН, Москва, 436 с.
- Cухих Г.Т., Адамян Л.В. (2010) Новые технологии в диагностике и лечении гинекологических заболеваний. МЕДИ-Экспо, Москва, 304 с.
- Rehn M., Lohmann K., Rempen A. (1996) Transvaginal ultrasonography of pelvic masses: evaluation of B-mode technique and Doppler ultrasonography. Am. J. Obstet. Gynecol., 175: 97–104.
- Kalmantis K., Rodolakis A., Daskalakis G., Antsaklis A. (2013) Characterization of ovarian tumors and staging ovarian cancer with 3-dimensional power Doppler angiography: correlation with pathologic findings. Int. J. Gynecol. Cancer, 23(3): 469–474.
- Iyer V.R., Lee S. (2010) MRI, CT, and PET/CT for ovarian cancer detection and adnexal lesion characterization. Am. J. Roentgenol., 194: 311–321. doi: 10.2214/AJR.09.3522.
- Medeiros L.R., Rosa D.D., da Rosa M.I., Bozzetti M.C. (2009) Accuracy of ultrasonography with color Doppler in ovarian tumor: a systematic quantitative review. Int. J. Gynecol. Cancer, 19(2): 230–236. doi: 10.1111/ IGC.0b013e31819c136.
- Kaouther D., Olivier A. (2014) Elastography assessment of the cervix during cervical maturation. Tunisie Medicale, 92(7): 448–451.
- Медведев В.Е., Яцишин В.М. (2011) Предварительные результаты применения режима эластографии. Актуальные проблемы ультразвуковой диагностики, 23–27 мая 2011 г., Судак: материалы науч.-практ. конф. с междунар. участием; Киев: 54–55.
- Дикан І.М., Литвиненко С.В., Баранник Е.А. та ін. (2009) Метод дистанційної акустичної пальпації. Повідомлення 2. Параметри просторово локалізованих імпульсних зсувних деформацій у м’яких тканинах на прикладі фантомів м’яких тканин in vitro. Променева діагностика, променева терапія, 3–4: 42–46.
- Garra B.S. (2011) Elastography: current status, future prospects, and making it work for you. Ultrasound Q., 27: 177–186.
- Sarvazyan A.P., Rudenko O.V., Swanson S.D. et al. (1998) Shear wave elasticity imaging: a new ultrasonic technology of medical diagnostic. Ultrasound Med. Biol., 24(9): 1419–1435.
- Sokalska A., Timmerman D., Testa A.C. et al. (2009) Diagnostic accuracy of transvaginal ultrasound examination for assigning a specific diagnosis to adnexal masses. Ultrasound Obstet. Gynecol., 34(4): 462–470.
- Forstner R., Thomassin-Naggara I., Cunha T.M. et al. (2017) ESUR recommendations for MR imaging of the sonographically indeterminate adnexal mass: an update. Eur. Radiol., 27(6): 2248-2257. doi: 10.1007/s00330-016-4600-3.
- Ledermann J.A., Raja F.A., Fotopoulou C. et al. (2013) Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice Guidelines. Ann. Oncol., 24(6): 24–32.
- Chilla B., Hauser N., Singer G. et al. (2011) Indeterminate adnexal masses at ultrasound: effect of MRI imaging findings on diagnostic thinking and therapeutic decisions. Eur. Radiol., 21(6): 1301–1310. doi: 10.1007/s00330–010–2018-x.
- Foti P.V., Attina G., Spadola S. et al. (2016) MR-imaging of ovarian masses: classification and differential diagnosis. Insights Imaging, 7(1): 21–41. doi: 10.1007/s13244–015–0455–4.
- Cui Y.F., Li W.H., Zhu M.J. et al. (2012) Clinical application and research of diffusion weighted MR imaging in complex ovarian tumors. J. China Clinic. Medical Imaging, 23: 856–859.
- Yuan X., Guo L., Du W. et al. (2017) Diagnostic accuracy of DWI in patients with ovarian cancer: A meta-analysis. Medicine (Baltimore); 96(19): 6659. doi: 10.1097/MD.0000000000006659.
- Li W., Chu C., Cui Y. et al. (2012) Diffusion-weighted MRI: A useful technique to discriminate benign versus malignant ovarian surface epithelial tumors with solid and cystic components. Abdom Imaging, 37 (5): 897–903. doi: 10.1007/s00261–011–9814-x.
- Kim H.J., Lee S.Y., Shin Y.R. et al. (2016) The value of diffusion-weighted imaging in the differential diagnosis of ovarian lesions: a meta-analysis. PLoS One, 11(2): 0149465. doi: 10.1371/journal.pone.0149465.
- Kyriazi S., Collins D.J., Morgan V.A. et al. (2010) Diffusion-weighted imaging of peritoneal disease for non invasive staging of advanced ovarian cancer. Radiographics, 30(5): 1269–1285. doi: 10.1148/rg.305105073.
- Fan X., Zhang H., Meng S. et al. (2015) Role of diffusion-weighted magnetic resonance imaging in differentiating malignancies from benign ovarian tumors. Int. J. Clin. Exp. Med., 8(11): 19928–19937.
- Iyer V.R., Lee S.I. (2010) MRI, CT, and PET/CT for ovarian cancer detection and adnexal lesion characterization. Am. J. Roentgenol., 194 (2): 311–321. doi: 10.2214/ajr.09.3522.
- Tsili A., Tsampoulas C., Argyropoulou M. et al. (2008) Comparative evaluation of multidetector CT and MR imaging in the differentiation of adnexal masses. Eur. Radiol., 18(5): 1049–1057. doi: 10.1007/s00330–007–0842–4.
- Maggino Т., Gadducci A. (2000) Serum markers as prognostic factors in epithelial ovarian cancer: an overview. Eur. J. Gynecol. Oncol., 21(1): 64–69.
- Meyer T., Rustin G.J. (2000) Role of tumour markers in monitoring epithelial ovarian cancer. Br. J. Cancer, 82(9): 1535–1538.
- Nagele F., Petru E., Medl M. (1995) Preoperative CA 125: an independent prognostic factor in patients with stage I epithelial ovarian cancer. Obstet. Gynecol., 86(2): 259–264.
- Riedinger J.M., Bonnetain F., Basuyau J.P. (2007) Change in CA125 levels after the first cycle of induction chemotherapy is an independent predictor of epithelial ovarian tumor outcome. Ann. Oncol., 18(5): 881–885.
- Liu P.Y., Alberts D.S., Monk B.J. et al. (2007) An early signal of CA‑125 progression for ovarian cancer patients receiving maintenance treatment after complete clinical response to primary therapy. J. Clin. Oncol., 25(24): 3615–3620.
- Molina R., Escudero J.M., Augé J.M. et al. (2011) HE4 a novel tumor marker for ovarian cancer: comparison with CA 125 and ROMA algorithm in patients with gynecological diseases. Tumour Biol., 32(6): 1087–1095.
- Hertlein L., Stieber P., Kirschenhofer A. et al. (2012) Human epididymis protein 4 (HE4) in benign and malignant diseases. Clin. Chem. Lab. Med., 50(12): 2181–2188.
- Macedo A.C., da Rosa M.I., Lumertz S., Medeiros L.R. (2014) Accuracy of serum human epididymis protein 4 in ovarian cancer diagnosis: a systematic review and meta-analysis. Int. J. Gynecol. Cancer, 24(7): 1222–1231.
- Moore R.G., Brown A.K., Miller M.C. et al. (2007) The use of multiple novel tumor biomarkers for the detection of ovarian carcinoma in patients with a pelvic mass. Gynecol. Oncol., 108(2): 402–408.
- Moore R.G., McMeekin D.S., Brown A.K. et al. (2009) A novel multiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patients with a pelvic mass. Gynecol. Oncol., 112(1): 40–46.
- Li J., Chen H., Mariani A. et al. (2013) HE4 (WFDC2) Promotes tumor growth in endometrial cancer cell lines. Int. J. Mol. Sci., 14(3): 6026–6043.
- Ortiz-Muñoz B., Aznar-Oroval E., García García A. et al. (2014) HE4, Ca125 and ROMA algorithm for differential diagnosis between benign gynaecological diseases and ovarian cancer. Tumour Biol., 35(7): 7249–7258.
- Prat J. (2015) FIGO’s staging classification for cancer of the ovary, fallopian tube, and peritoneum: abridged republication. J. Gynecol. Oncol., 26(2): 87–89. doi: 10.3802/jgo.2015.26.2.87.
Возможности лучевых методов в диагностике злокачественных образований яичника
Национальный институт рака, Киев
Резюме. Цель. Повысить эффективность лучевой диагностики и оптимизировать мониторинг лечения больных со злокачественными образованиями яичника путем использования инновационных методик и определения их эффективности. Объект и методы. Материалы исследования базируются на проведении комплексного лучевого обследования 60 пациенток с раком яичника (РЯ) и анализе его непосредственных результатов в рамках фрагмента научно-исследовательской работы за период 2017–2018 гг. Всем пациенткам проведено ультразвуковое исследование (УЗИ) органов малого таза, брюшной полости и забрюшинного пространства (всего 176 исследований); 30 больным — магнитно-резонансную томографию (МРТ) органов малого таза для уточнения распространения опухолевого процесса: как базовое исследование, для планирования лечения и его оценки (всего 57 исследований). Стадирование РЯ проводили соответственно классификации FIGO (2013 г.). Морфологическая верификация проведена всем пациенткам — подтверждена аденокарцинома разной степени дифференцировки. Группу сравнения сформировали 20 пациенток с доброкачественными образованиями яичника. Результаты. Определены и уточнены визуальные наиболее значимые ультразвуковые и магнитно-резонансные признаки РЯ, характеризующие активность злокачественного процесса. Определена информативность (чувствительность, специфичность и точность) УЗИ, МРТ, МРТ + диффузионно-взвешенных исследований для диагностики новообразований яичника. Разработан алгоритм лучевого обследования женщин при подозрении на злокачественные образования яичника с целью своевременной диагностики, мониторинга лечения. Выводы. Применение комплекса лучевых методов исследования позволило повысить эффективность диагностики злокачественных образований яичника, определить приоритетность и необходимость их использования в лечении, диагностическом мониторинге, выявлении рецидивов.
ультразвуковая диагностика; компьютерная томография; магнитно-резонансная томография; рак яичника.
Адреса:
Шевчук Леся Анатоліївна
03022, Київ, вул. Ломоносова, 33/43
Тел.: (044) 257-21-06
E-mail: merezhivo@ukr.net
Correspondence:
Shevchuk Lesya
33/43 Lomonosova str., Kyiv 03022
Tel.: (044) 257-21-06
E-mail: merezhivo@ukr.net














Leave a comment