Прогностичне значення біомаркера окисного пошкодження ДНК (8-гідрокси-2’-дезоксигуанозину) для визначення ефективності використання неоад’ювантної хіміопроменевої терапії у хворих на місцево-поширений рак прямої кишки
Звірич В.В., Бурлака А.А., Колеснік О.О., Михайлович Ю.Й.
Резюме. Вступ. Загалом частота місцево-поширеного раку прямої кишки (МПРПК) становить 5–22% усіх випадків раку прямої кишки, що більш ніж у 30% хворих унеможливлює виконання сфінктерозберігаючих операцій. Перспективним напрямом потенційного підвищення ефективності комбінованого лікування МПРПК є модифікація режиму неоад’ювантної хіміотерапії — заміна монотерапії фторпіримідинами на поліхіміотерапію за схемою CAPOX на основі оксаліплатину. 8-гідрокси-2’-дезоксигуанозин (8-oxo-dGuo) є одним з найбільш поширених продуктів окислювально-модифікованих пошкоджень ДНК і є маркером окисного процесу. За відсутності репарації наявний у ДНК 8-oxo-dGuo здатний спричиняти зупинку клітинного циклу та апоптоз. 8-oxo-dGuo може акумулюватися як в ядерній, так і в мітохондріальній ДНК, саме тому він вважається високоінформативним маркером розвитку злоякісних новоутворень та одним з важливих критеріїв відповіді пухлини на системне лікування. Матеріали та методи. Хворих з діагнозом дистального МПРПК з урахуванням методики неоад’ювантної хіміопроменевої терапії (НХПТ) рандомізували у співвідношенні 1:1. Основна група (n=57) отримувала променеву терапію сумарною вогнищевою дозою (СВД) 50,4 Гр, разовою вогнищевою дозою (РВД) 1,8 Гр, кількість сеансів — 28. Одночасно з проведенням ПТ хворі отримували поліхіміотерапію (ПХТ) за схемою CAPOX (2 цикли). Група порівняння (n=53) отримувала променеву терапію — СВД 50,4 Гр, РВД 1,8 Гр, кількість сеансів — 28 та монохіміотерапію препаратом капецитабіну (2 цикли). Рівень 8-oxo-dGuо визначали в периферичній крові до та після НХПТ. Результати. Середнє значення рівня 8-oxo-dGuо після проведення НХПТ було достовірно вищим за фізіологічну норму, яка становить у середньому 0,23±0,04 нмоль/мл•хв. Отримані дані також засвідчили відсутність достовірної різниці між досліджуваними групами за рівнем окисного пошкодження ДНК (основна — 3,07±0,08 нмоль/мл•хв, порівняння — 2,94±0,06 нмоль/мл•хв). Однак середній рівень 8-oxo-dGuо в крові хворих після завершення НХПТ становив 1,96±0,04 нмоль/мл•хв та 2,72±0,04 нмоль/мл•хв відповідно для основної та групи порівняння (р<0,001). Проведений статистичний аналіз встановив, що дослідження рівня 8-oxo-dGuо, а саме його зниження, при застосуванні НХПТ на основі схеми CAPOX може бути незалежним чинником визначення ефективності застосування хіміопроменевої терапії у комбінованому лікуванні хворих на МПРПК (R2=0,465; 95% ДІ 0,004–0,016, р<0,0001). Висновки. Оцінка рівнів 8-oxo-dGuо у нейтрофілах периферичної крові хворих МПРПК може бути використана як маркер прогнозу ефективності використання НХПТ у хворих на МПРПК.
Одержано 25.06.2019
Прийнято до друку 22.07.2019
DOI: 10.32471/clinicaloncology.2663-466X.39.22590
Вступ
Рак прямої кишки (РПК) є соціальним тягарем як у багатьох державах світу, так і в Україні, оскільки посідає перше місце в структурі онкологічної захворюваності та смертності дорослого населення. Із 64,3% вперше виявлених хворих, у яких діагностували I–II стадію захворювання, не прожили року з моменту встановлення діагнозу майже третина з них — 29,3%. 45% з них потребують комбінованого лікування [1]. За такої частоти виявлення РПК результати лікування все ще залишаються незадовільними [2].
Місцево-поширений рак прямої кишки (МПРПК) становить 5–22% серед інших форм РПК. У більш ніж 30% хворих на МПРПК складність локального процесу унеможливлює виконання сфінктерозберігаючого хірургічного втручання. Дотепер лікувальна тактика МПРПК, на відміну від такої при локалізованих формах, не є стандартизованою та, як наслідок, відсутні чітко регламентовані міжнародні настанови щодо комплексного лікування [3].
Першу спробу вирішення цієї проблеми було здійснено міжнародною онкологічною спільнотою у 2013 р. у вигляді Консенсусу, важливим рішенням якого, підтриманим 100% експертів, було твердження про необхідність проведення неоад’ювантної хіміопроменевої терапії (НХПТ), оскільки це достовірно поліпшує віддалені результати лікування, а в багатьох випадках дає можливість досягти «зниження стадії» — переходу місцево-поширеної форми в локалізовану [4, 5].
На сьогодні перспективним напрямом, з погляду патоморфологічної відповіді пухлини прямої кишки на НХПТ, є пошук предикторів, на підставі яких можна було б спрогнозувати ефективність застосованої НХПТ.
Одним з таких предикторів прогнозу є 8-гідрокси-2’-дезоксигуанозин (8-oxo-dGuo). Відомо, що в клітинах живих організмів у результаті процесів метаболізму постійно утворюються активні форми кисню (АФК) й азоту (АФА), у низьких концентраціях вони виконують фізіологічні, у тому числі сигнально-регуляторні функції. Під дією факторів навколишнього середовища (іонізуюче й неіонізуючі випромінювання, токсини, ксенобіотики та ін.) АФК/АФА можуть утворюватися в кількостях, що перевищують захисні можливості антиоксидантних і репараційних систем організму (окислювальний стрес), що призводить до пошкодження біомакромолекул. Відкрито більше 30 продуктів окисної модифікації азотистих основ нуклеїнових кислот, серед яких найбільш поширеним і краще за інші вивченим є 8-oxo-dGuo. Утворення 8-oxo-dGuo (і продуктів його модифікації) є найбільш поширеним видом окисно-модифікованих пошкоджень у ДНК. Він вважається одним з основних біомаркерів окисного стресу [6–8]. Наявний у ДНК 8-oxo-dGuo, за відсутності репарації, здатний спричинювати зупинку клітинного циклу та апоптоз [9]. Більшість досліджень вказують на роль окислювального стресу в патогенезі раку товстої кишки. У повідомленнях Chang et al. є свідчення того, що вміст 8-oxo-dGuo у сироватці крові може бути чутливим біомаркером при колоректальній аденокарциномі [10].
Супероксидні радикали (СР), окислюючи ДНК, створюють цілий ряд окиснених основ та нуклеотидів у ДНК. Подібні пошкодження стають причиною мутацій та ініціації процесів канцерогенезу у здорових людей чи прогресування захворювання при раку товстої кишки. 8-oxo-dGuo є найбільш часто реєстрованою формою окиснених основ у ДНК чи в ядерному пулі та несе небезпеку у зв’язку з властивістю утворювати пари з аденіном та/чи цитозином у молекулі ДНК [11]. 8-oxo-dGuo здатний акумулюватися як в ядерній, так і в мітохондріальній ДНК, саме тому останній вважається високоінформативним предиктором розвитку злоякісних новоутворень та одним з важливих маркерів відповіді пухлини на системне лікування [12]. Нашою метою було дослідження рівнів молекулярного 8-oxo-dGuo у ДНК нейтрофілів крові та визначення можливості його використання у прогнозуванні патоморфологічної відповіді пухлини на НХПТ у хворих на МПРПК.
Матеріали та методи
У клініці Національного інституту раку проведено проспективне рандомізоване одноцентрове дослідження [13]. Хворих з діагнозом МПРПК з урахуванням методики НХПТ рандомізували у співвідношенні 1:1. Основна група (n=57) отримувала променеву терапію (ПТ): сумарна вогнищева доза (СВД) — 50,4 Гр, разова вогнищева доза (РВД) — 1,8 Гр, кількість сеансів — 28. Одночасно з проведенням ПТ, хворі отримували поліхіміотерапію (ПХТ) за схемою CAPOX (2 цикли). Пацієнти з групи порівняння (n=53) отримували ПТ: СВД — 50,4 Гр, РВД — 1,8 Гр, кількість сеансів — 28 та монохіміотерапію (МХТ) препаратом капецитабіну (2 цикли). Рівень 8-oxo-dGuо визначали в периферичній крові до та після НХПТ.
Аналіз рівнів та швидкості накопичення маркерів окисних пошкоджень гуаніну ДНК — 8-oxo-dGuо у ДНК нейтрофільних гранулоцитів крові хворих на МПРПК здійснювали за 1 добу до початку НХПТ та за 1 добу до виконання хірургічного втручання [13]. Для цього з ліктьової вени у центрифужну пробірку з 1 мл трилону Б набирали 5 мл крові. Із крові виділяли нейтрофіли відповідно до методики, описаної в роботі H.T. Lee [14].
Оцінку і лікування проводили через 8 тиж після завершення НХПТ за даними МРТ (шкали RECIST, mrTRG). Після виконання хірургічного втручання здійснювали оцінку лікувального патоморфозу за критеріями Коледжу американських патоморфологів (Сollege of American Pathologists — САР), 2013, із додатковим визначенням співвідношення сполучної та пухлинної тканини патогістологічним методом (забарвлення за Masson’s Trichrome).
Методи статистичної обробки. Отримані результати опрацьовувалися за допомогою статистичної програми Statistical Package for the Social Sciences (SPSS) 20.0 (IBM, Армонк, штат Нью-Йорк, США). Т-тест було застосовано для оцінки різниці концентрацій у крові 8-oxo-dGuо між групами хворих на МПРПК. Концентрації в 8-oxo-dGuо порівнювали з допомогою Oneway ANOVA. Статистичні тести були двосторонніми, при р<0,05, вважалися статистично значимими.
Результати та їх обговорення
Основною причиною розвитку РПК прийнято вважати мутаційний процес в генах, що контролюють клітинний цикл (проліферацію, диференціацію, адгезію та апоптоз) [15]. Окисне пошкодження ядерної та мітохондріальної ДНК, гіперметилювання промоторів генів є основними подіями на всіх етапах канцерогенезу, а тривалий вплив на слизову оболонку кишки CР ініціює хронічний запальний процес і дисплазію. До пошкоджень, спричинених СР, відносять окисно-індуковані мутації в геномі й нестабільність його функціонування і, як наслідок, втрату контролю над проліферацією клітин [16]. Необхідно зазначити, що визначення рівнів 8-oxo-dGuо у ДНК нейтрофілів крові може дати можливість неінвазивно оцінити ступінь окиснення ДНК та редокс-стан організму [17].
Окисне пошкодження ДНК також є наслідком нерегульованого зростання рівнів СР та їх дії на клітини людини. Найбільш часто продуктом такого патологічного впливу СР на молекулу ДНК є утворення 8-oxo-dGuо, рівні якого починають перевищувати норму ще на ранніх стадіях захворювання, і саме тому 8-oxo-dGuо вважається високоінформативним маркером розвитку злоякісних новоутворень та їх прогресування [18].
Для з’ясування ступеня регресу пухлини, як результат застосування НХПТ, проведено аналіз результатів магнітно-резонансної томографії (МРТ) до та після хіміопроменевого лікування за класифікацією mrTRG та за критеріями RECIST 1.1 (рис. 1).
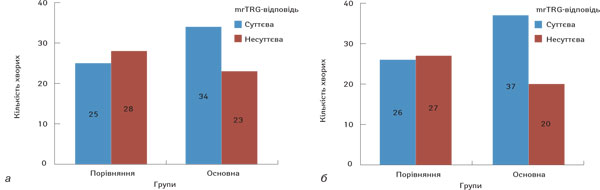
Привертає увагу те, що в обох групах відбулася суттєва відповідь на НХПТ, у групі порівняння вона становила 47,2%, в основній групі — 59,7% за шкалою mrTRG і 49,1 та 64,9% за критеріями RECIST 1.1 відповідно. Однак різниця виявилася недостовірною (р=0,190).
З метою пошуку прогностичних маркерів відповіді пухлини на НХПТ нами було проаналізовано рівні 8-oxo-dGuо у ДНК нейтрофільних гранулоцитів крові в досліджуваних групах хворих на МПРПК до початку проведення НХПТ та за 1 добу перед виконанням хірургічного лікування. Фізіологічний рівень 8-oxo-dGuо становить 0,23±0,04 нмоль/мл×хв [19]. За результатами одержаних даних, рівень 8-oxo-dGuо до операції в усіх хворих обох груп був достовірно вищим за фізіологічний і становив в основній групі 3,07±0,08 нмоль/мл×хв, у групі порівняння — 2,94±0,06 нмоль/мл×хв, однак достовірної різниці між досліджуваними групами за оцінкою рівнів окисного пошкодження ДНК виявлено не було (р>0,05) (рис. 2).
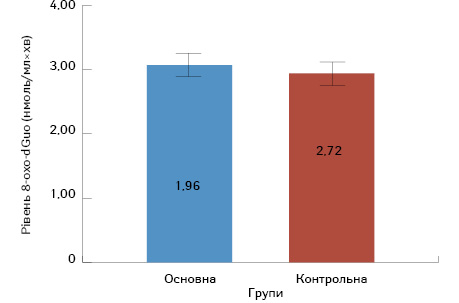
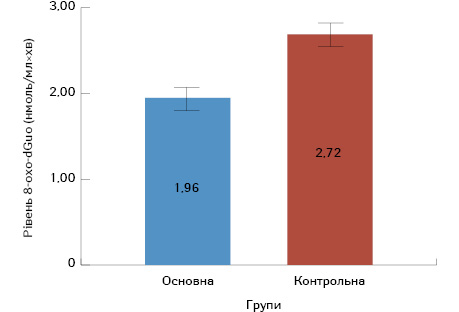
Після завершення НХПТ середній рівень 8-oxo-dGuо у крові хворих на МПРПК почав знижуватися і становив в основній групі 1,96±0,04 нмоль/мл×хв, у групі порівняння — 2,72±0,04 нмоль/мл×хв (р<0,001).
За вищенаведеними результатами дослідження встановлено, що оцінка рівнів 8-oxo-dGuо у крові хворих на МПРПК, залежно від застосованих схем хіміотерапії, саме оксаліплатинвмісна хіміотерапія сприяє статистично достовірному зниженню рівня досліджуваного маркера (R2=0,465; 95% ДІ 0,004–0,016, р<0,0001). Виявлено позитивний корелятивний зв’язок між показниками 8-oxo-dGuо та рівнями швидкості генерування супероксидних радикал-аніонів нейтрофільними гранулоцитами крові у хворих на МПРПК, що вказує на окисно-ініційовану природу виникнення цих пошкоджень (таблиця).
Методом лінійної регресії встановлено стійкий взаємозв’язок між рівнем 8-oxo-dGuо в крові хворих на МПРПК та відповіддю пухлини на проведене лікування (шкала mrTRG) в основній групі (рис. 4).
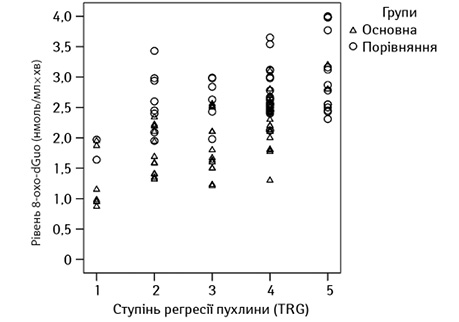
Таким чином, рівень досліджуваного маркера 8-oxo-dGuо може бути незалежним предиктором ефективності застосування НХПТ у хворих на МПРПК.
Отже, хіміотерапевтичні засоби, механізм дії яких передбачає пошкодження ДНК злоякісних клітин, сьогодні залишаються основними інструментами в численних схемах терапії раку. Протипухлинні препарати, що пошкоджують ДНК, розділяють на групи за механізмом дії та типом індукованого пошкодження. Алкілуючі агенти безпосередньо модифікують ДНК і часто індукують значні рівні точкових мутацій. Протипухлинні хіміотерапевтичні препарати на основі платини також індукують об’ємні пошкодження ДНК за рахунок прямого і опосередкованого впливів, ініціюючи генерування СР у мітохондріях клітин пухлин і тому є ефективними при лікуванні широкого спектру злоякісних новоутворень, у тому числі й колоректального раку. Індукція окисних пошкоджень ДНК за допомогою променевої терапії також є ефективним методом індукування клітинної смерті, оскільки вони вважаються найбільш токсичною формою пошкодження ДНК. Застосування НХПТ призводить до зростання швидкості генерування СР клітинними та позаклітинними джерелами, які можуть безпосередньо індукувати широкий спектр пошкоджень ДНК, включаючи окислення основ, фрагментацію і розриви ланцюгів ДНК клітин аденокарциноми МПРПК, що і було продемонстровано власними результатами.
Висновки
Результати нашого дослідження дають можливість вважати, що індукція окисних пошкоджень ДНК за допомогою НХПТ з використанням оксаліплатину є ефективним методом ініціації клітинної смерті пухлин. Тому оцінка рівнів 8-oxo-dGuо у нейтрофільних гранулоцитах крові може бути використана в якості маркера прогнозу ефективності НХПТ у хворих на МПРПК.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- Melnitchouk, N., Shabat, G., Lu, P., Lyu, H., Scully, R., Leung, K., …Bleday, R. (2018). Colorectal сancer in Ukraine: regional disparities and national trends in incidence, management, and mortality. Journal of global oncology, 4, 1–8. doi: 10.1200/JGO.18.00145.
- Dayal, S., Battersby, N., & Cecil, T. (2017). Evolution of surgical treatment for rectal cancer: a review. Journal of Gastrointestinal Surgery, 21(7), 1166–1173. doi: 10.1007/s11605-017-3427-9.
- Rullier, E., Denost, Q., Vendrely, V., Rullier, A., & Laurent, C. (2013). Low rectal cancer: classification and standardization of surgery. Diseases of the Colon & Rectum, 56(5), 560–567. doi: 10.1097/DCR.0b013e31827c4a8c.
- Xynos, E., Tekkis, P., Gouvas, N., Vini, L., Chrysou, E., Tzardi, M., …Souglakos, J. (2016). Clinical practice guidelines for the surgical treatment of rectal cancer: a consensus statement of the Hellenic Society of Medical Oncologists (HeSMO). Annals of Gastroenterology, 29(2),103–126. doi: 10.20524/aog.2016.0003.
- Díaz Beveridge, R., Akhoundova, D., Bruixola, G., & Aparicio, J. (2017). Controversies in the multimodality management of locally advanced rectal cancer. Medical Oncology, 34(6),102. doi: 10.1007/s12032-017-0964-8.
- Smith, J.J., & Garcia-Aguilar, J. (2015). Advances and challenges in treatment of locally advanced rectal cancer. Journal of Clinical Oncology, 33(16),1797–1808. doi: 10.1200/JCO.2014.60.1054.
- Tahara, Y. K., Auld, D., Ji, D., Beharry, A. A., Kietrys, A. M., Wilson, D. L., …Kool, E. T. (2018). Potent and Selective Inhibitors of 8-Oxoguanine DNA Glycosylase. Journal of the American Chemical Society, 140(6), 2105–2114. doi: 10.1021/jacs.7b09316.
- Martinez-Balibrea, E., Martínez-Cardús, A., Ginés, A., Ruiz de Porras, V., Moutinho, C., Layos, L., …Abad, A. (2015). Tumor-RelatedMolecular mechanisms of oxaliplatin resistance. Molecular Cancer Therapeutics, 14(8),1767–1776. doi: 10.1158/1535-7163.MCT-14-0636.
- Звірич, В. В., Бурлака, А. А., & Колеснік, О. О. (2018). Аналіз безпосередніх результатів застосування режиму XELOX при передопераційному хіміопроменевому лікуванні пацієнтів з місцево-поширеним раком прямої кишки. Онкология, 20(2), 114–117.
- Lee, H. T., Lin, C. S., Lee, C. S., Tsai, C. Y., & Wei, Y. H. (2014). Increased 8-hydroxy-2’-deoxyguanosine in plasma and decreased mRNA expression of human 8-oxoguanine DNA glycosylase 1, anti-oxidant enzymes, mitochondrial biogenesis-related proteins and glycolytic enzymes in leucocytes in patients with systemic lupus erythematosus. Clinical & Experimental Immunology, 176(1), 66–77. doi: 10.1111/cei.12256.
- Kasai, H. (1997). Analysis of a form of oxidative DNA damage, 8-hydroxy-2’-deoxyguanosine, as a marker of cellular oxidative stress during carcinogenesis. Mutation Research, 387, 147–163. doi: 10.1016/s1383-5742(97)00035-5.
- Evans, M. D., Mistry, V., Singh, R., Gackowski, D., Rozalski, R., Siomek-Gorecka, A., …Cooke, M. S. (2016). Nucleotide excision repair of oxidised genomic DNA is not a source of urinary 8-oxo-7,8-dihydro-2’-deoxyguanosine. Free Radical Biology and Medicine, 99, 385–391. doi: 10.1016/j.freeradbiomed.2016.08.018.
- Hyun, J. W., Jung, Y. C., Kim, H. S., Choi, E. Y., Kim, J. E., Yoon, B. H., …Chung, M.H. (2003). 8-Hydroxydeoxyguanosine causes death of human leukemia cells deficient in 8-oxoguanine glycosylase 1 activity by inducing apoptosis. Molecular Cancer Research, 1(4), 290–299. Retrieved from http://mcr.aacrjournals.org/content/1/4/290.long/.
- Hu, C. W., Cooke, M. S., Tsai, Y. H., & Chao, M. R. (2015). 8-Oxo-7,8-dihydroguanine and 8-oxo-7,8-dihydro-2’-deoxyguanosine concentrations in various human body fluids: implications for their measurement and interpretation. Archives of Toxicology, 89(2), 201–210. doi: 10.1007/s00204-014-1255-1.
- Kwiatkowski, P., Wierzbicki, P., Kmieć, A., & Godlewski, J. (2012). DNA microarray-based gene expression profiling in diagnosis, assessing prognosis and predicting response to therapy in colorectal cancer. Postępy Higieny i Medycyny Doświadczalnej, 66, 330–338. Retrieved from http://www.phmd.pl/api/files/view/28883.pdf/.
- Moloney, J. N., & Cotter, T. G. (2018). ROS signalling in the biology of cancer. Seminars in Cell and Developmental Biology, 80, 50–64. doi: 10.1016/j.semcdb.2017.05.023.
- Nakabeppu, Y. (2014). Cellular levels of 8-oxoguanine in either DNA or the nucleotide pool play pivotal roles in carcinogenesis and survival of cancer cells. International Journal of Molecular Sciences, 15(7), 12543–12557. doi: 10.3390/ijms150712543.
- Viel, A., Bruselles, A., Meccia, E., Fornasarig, M., Quaia, M., Canzonieri, V., … Bignami, M. (2017). A Specific Mutational Signature Associated with DNA 8-Oxoguanine Persistence inMUTYH-defective Colorectal Cancer. EBioMedicine, 20, 39–49. doi: 10.1016/j.ebiom.2017.04.022.
- Sliwinska, A., Kwiatkowski, D., Czarny, P., Toma, M., Wigner, P., Drzewoski, J., … Sliwinski, T. (2016). The levels of 7,8-dihydrodeoxyguanosine (8-oxoG) and 8-oxoguanine DNA glycosylase 1 (OGG1) — A potential diagnostic biomarkers of Alzheimer’s disease. Journal of the Neurological Sciences, 368, 155–159. doi: 10.1016/j.jns.2016.07.008.
Прогностическое значение биомаркера окислительного повреждения ДНК (8-гидрокси-2’-дезоксигуанозина) для определения эффективности использования неоадъювантной химиолучевой терапии у больных местно-распространенным раком прямой кишки
Национальный институт рака, Киев
Резюме. Введение. В общем частота местно-распространенного рака прямой кишки (МРРПК) составляет 5–22% всех случаев рака прямой кишки, что более чем у 30% больных делает невозможным выполнение сфинктеросохраняющих операций. Перспективным направлением потенциального повышения эффективности комбинированного лечения МРРПК является модификация режима неоадъювантной химиотерапии — замена монотерапии фторпиримидинами на полихимиотерапию CAPOX на основе оксалиплатина. 8-гидрокси-2’-дезоксигуанозина (8-oxo-dGuo) является одним из наиболее распространенных продуктов окислительно-модифицированных повреждений в ДНК, а также является маркером окислительного процесса. Находящийся в ДНК 8-oxo-dGuo, в отсутствие репарации, способен вызвать остановку клеточного цикла и апоптоз. 8-oxo-dGuo способен аккумулироваться как в ядерной, так и в митохондриальной ДНК, поэтому он считается высокоинформативным маркером развития злокачественных новообразований и одним из важных маркеров ответа опухоли на системное лечение. Материалы и методы. Больных с диагнозом МРРПК с учетом методики неоадъювантной химиолучевой терапии (НХЛТ) рандомизировали в соотношении 1:1. Основная группа (n=57) получала лучевую терапию суммарной очаговой дозой (СОД) 50,4 Гр, разовой очаговой дозой (РОД) — 1,8 Гр, количество сеансов — 28. Одновременно с проведением лучевой терапии больные получали полихимотерапию по схеме CAPOX (2 цикла). Участники контрольной группы сравнения (n=53) получали лучевую терапию: СОД — 50,4 Гр, РОД — 1,8 Гр. Количество сеансов — 28 и монохимиотерапию препаратом капецитабина (2 цикла). Уровень 8-oxo-dGuо определяли в периферической крови до и после НХЛТ. Результаты. Среднее значение уровня 8-oxo-dGuо после проведения НХЛТ было достоверно выше физиологической нормы, что составляет в среднем 0,23±0,04 нмоль/мл•мин. Полученные данные также показали отсутствие достоверной разницы между исследуемыми группами по уровню окислительного повреждения ДНК (основная — 3,07±0,08 нмоль/мл•мин, сравнения — 2,94±0,06 нмоль/мл•мин). Однако средний уровень 8-oxo-dGuо в крови больных после завершения НХЛТ составил 1,96±0,04 нмоль/мл•мин и 2,72±0,04 нмоль/мл•мин соответственно для основной и группы сравнения (р<0,001). Проведенный статистический анализ установил, что исследование уровня 8-oxo-dGuо, а именно его снижение, при применении НХЛТ на основании схемы CAPOX может быть независимым фактором определения эффективности применения химиолучевой терапии в комбинированном лечении больных МРРПК (R2=0,465; 95% ДИ 0,004–0,016, р<0,0001). Выводы. Оценка уровней 8-oxo-dGuо в нейтрофилах периферической крови больных МРРПК может быть использована в качестве маркера прогноза эффективности использования НХЛТ у больных МРРПК.
местно-распространенный рак прямой кишки; 8-гидрокси-2’-дезоксигуанозин; неоадъювантная химиолучевая терапия.
Звірич Віталій Васильович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: zvirvit@ukr.net
Correspondence:
Zvirych Vitaliy
33/43 Lomonosova Str., Kyiv 03022
National Cancer Institute
E-mail: zvirvit@ukr.net














Leave a comment