Імунотерапія дрібноклітинного раку легені: клінічне спостереження
Москаленко Ю.В., Терновенко О.А., Костюченко В.В., Привалова А.О., Біловол Д.О., Симонов О.В.
Резюме. Вступ. Наведено клінічне спостереження, в якому описано повну відповідь на хіміотерапію та імунотерапію PD-L-блокатором атезолізумабом у хворого з метастатичним дрібноклітинним раком легені. Тривалість ремісії — 20 міс. Мета. Повідомлення про успішний випадок лікування пацієнта із занедбаним дрібноклітинним раком легені. Матеріали та методи. Аналіз окремих джерел наукової літератури стосовно основних принципів хіміотерапії, імунотерапії та променевої терапії дрібноклітинного раку легені. Опис клінічного спостереження. Використано променевий, лабораторний, гістологічний, імуногістохімічний методи дослідження. Результати. Дрібноклітинний рак легені демонструє високу чутливість до хіміотерапії та променевої терапії, але ці методи лікування не здатні забезпечити стійкий ефект і значно подовжити медіану виживаності пацієнтів. Висновки. Поєднання хіміотерапевтичних засобів із PD-L-блокаторами може забезпечити тривале підтримувальне лікування і підвищення показника загальної виживаності пацієнтів з дрібноклітинним раком легені.
Одержано 08.05.2019
Прийнято до друку 23.09.2019
DOI: 10.32471/clinicaloncology.2663-466X.38.22880
Актуальність
Дрібноклітинний рак легені (ДРЛ) належить до найагресивніших форм раку легенів. Його частка в структурі злоякісних новоутворень дихальної системи становить близько 15%. Особливістю ДРЛ є схильність до раннього та швидкого метастазування. Хворіють переважно чоловіки вікової групи 40–60 років, які є теперішніми або колишніми курцями. Зазвичай пухлина починає ріст за типом центрального раку легені, але дуже швидко з’являються метастази в лімфатичних вузлах середостінні та віддалених органах (печінці, головному мозку, кістках скелету). Без спеціального протипухлинного лікування медіана виживаності становить від 2 до 4 міс [1].
Важливим прогностичним фактором для ДРЛ є стадія захворювання. Хворі з локалізованою формою мають кращі перспективи, у той час як для пацієнтів з поширеним процесом медіана виживаності становить від 6 до 12 міс при використанні сучасних методів лікування. Довгострокову виживаність без ознак захворювання відмічають при цій формі вкрай рідко [2].
Стандартні варіанти лікування у пацієнтів з поширеною формою ДРЛ включають комбіновану хіміотерапію та променеву терапію. Хіміотерапія зазвичай виконується двома препаратами — етопозидом і препаратом платини. Застосування цисплатину пов’язане зі значними токсичними проявами і вимагає гідратації перед або після інфузії препарату. Карбоплатин також активний щодо ДРЛ, його доза регулюється залежно від кліренсу креатиніну. Він асоціюється з меншими гематологічними токсичними ефектами. Різні дози і варіанти введення цих препаратів у пацієнтів з поширеною формою ДРЛ мають приблизно однаковий рівень відповіді — від 50 до 80%. Повної відповіді на лікування вдається досягти у 0–30% пацієнтів [3]. До такого типу лікування залишаються чутливими метастази в головному мозку та в інших віддалених органах. Схеми з використанням іринотекану та цисплатину або іринотекану та етопозиду забезпечують еквівалентну клінічну користь, але мають різний ступінь токсичності [4, 5]. Доведено, що пероральне застосування топотекану в комбінації з цисплатином не демонструє кращі результати порівняно зі схемою, що включає цисплатин і етопозид [6]. Паклітаксел у комбінації з етопозидом і цисплатином також не змінює показника загальної виживаності [7].
Пацієнтів з поширеною формою ДРЛ, які отримали хіміотерапію з досягненням гарної відповіді, розглядають у якості претендентів на проведення опромінення головного мозку. У рандомізованому дослідженні 286 пацієнтів, яким проводили 4–6 циклів хіміотерапії з подальшим опроміненням головного мозку, порівнювали з групою хворих, яким опромінення не проводилося. Ризик появи метастазів у головному мозку протягом 1 року становив 14,6% у групі з опроміненням головного мозку та 40,4% — у групі без опромінення [8].
Топотекан є стандартом хіміотерапії при рецидиві ДРЛ. Крім того, у якості препаратів другої лінії можливе використання іринотекану, таксанів, вінорельбіну, паклітакселу і гемцитабіну. Схема із застосуванням кількох препаратів зазвичай ефективніша, ніж монотерапія [9].
На жаль, класична хіміотерапія та променева терапія не здатні забезбечити довгострокові ефекти лікування та суттєво покращити показники виживаності пацієнтів. Лікарськими засобами з низьким рівнем токсичності могли б стати PD-L-блокатори, які дуже вдало зарекомендували себе у терапії недрібноклітинного раку легені. Ефект від препаратів напряму залежить від рівня експресії PD-L-рецепторів на пухлинних клітинах. І хоча рандомізовані клінічні дослідження лише тривають, ми хотіли б поділитися досвідом використання препарату атезолізумаб на прикладі клінічного спостереження.
Клінічне спостереження
Пацієнт К., 53 роки, перебуває на лікуванні в Сумському обласному клінічному диспансері з грудня 2017 р. Після проведення інструментальних і лабораторних методів дослідження встановлено діагноз: злоякісне новоутворення нижньої частки лівої легені, група II, стадія IV (Т2bN2M1), метастази в головний мозок, підшлункову залозу, лімфовузли середостіння, перикардіальний випіт.
Згідно з даними комп’ютерної томографії (КТ) на момент встановлення діагнозу хворий мав пухлину лівої легені розміром 57×47 мм, метастаз у головному мозку 12×10 мм, біфуркаційний лімфатичний вузол 23×18 мм, нижні та верхні паратрахеальні лімфатичні вузли у вигляді конгломерату 54×51 мм, метастаз у підшлунковій залозі 17×14 мм, а також перикардіальний випіт. З метою отримання морфологічного підтвердження діагнозу було проведено діагностичну бронхоскопію. У пацієнта запідозрили наявність ДРЛ, тому для уточнення діагнозу виконано імуногістохімічне дослідження. Згідно з висновком, в досліджуваному матеріалі визначалися елементи недиференційованої злоякісної дрібноклітинної пухлини, отриманий фенотип котрої характерний для дрібноклітинної карциноми легені. Також перед початком лікування визначався PD-L-статус пухлини. Після проведеного дослідження встановлено, що тканина легенів має розростання дрібних мономорфних клітин із зернистою цитоплазмою, які формують скупчення та пухлинні комплекси. Імуногістохімічна реакція з антитілами проти рецептора PD-L1 демонструє позитивну цитоплазматичну та мембранну реакцію у 75% пухлинних клітин (рис. 1).
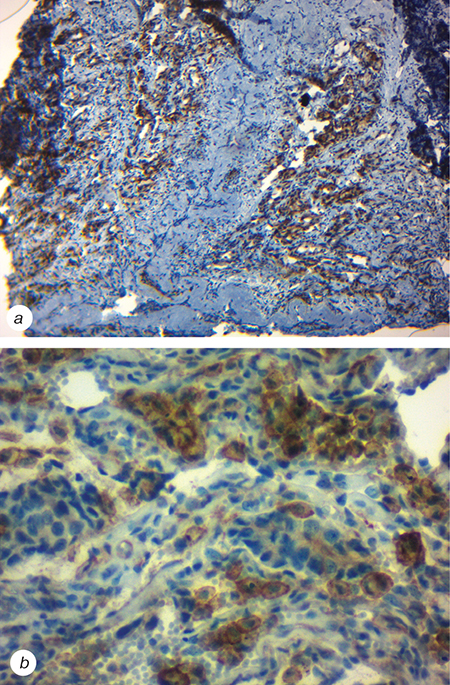
Пацієнту призначено 4 курси хіміотерапії за схемою етопозид 186 мг + карбоплатин 690 мг. Доза розраховувалася відповідно до площі тіла пацієнта та кліренсу креатиніну. Етопозид вводили в 1-й, 2-й та 3-й день циклу, а карбоплатин — лише в 1-й день циклу. У комбінації з хіміопрепаратами хворий отримував інфузії препарату атезолізумаб у дозуванні 1200 мг в/в краплинно в перший день циклу. Введення препаратів відбувалося кожні 3 тиж.
КТ проводилася кожні 6 тиж з метою моніторингу динаміки захворювання. Отже, після 2 циклів поліхіміотерапії (ПХТ) та імунотерапії у пацієнта зник метастатичний осередок у головному мозку та перикардіальний випіт. Розмір пухлини та інших віддалених метастазів зменшився приблизно вдвічі.
По закінченню 4 курсів ПХТ та імунотерапії зник метастаз у підшлунковій залозі. У хворого спостерігалася часткова відповідь на лікування (сума діаметрів пухлинних вогнищ зменшилася на 76,2%). З метою мінімізації ризику повторної появи метастазів у головному мозку було призначено його профілактичне опромінення в сумарній дозі 30 Гр. Променева терапія проводилася конкурентно з інфузіями атезолізумабу, який продовжували вводити кожні 3 тиж.
Через 6 циклів від початку лікування розміри пухлини становили 6×6 мм, а лімфатичних вузлів середостіння — 15×10 та 10×9 мм. Інші метастази зникли. Імунотерапія продовжувалася у тому ж режимі.
Після проведення 8 курсів імунотерапії у пацієнта зникли метастази в підшлунковій залозі та головному мозку, а також пухлина лівої легені, біфуркаційні та паратрахеальні лімфатичні вузли. Було зареєстровано повну відповідь на лікування. Для досягнення цього ефекту знадобилося 6 міс терапії. Протягом усього періоду пацієнт напрочуд добре переносив лікування. Серед небажаних явищ спостерігалася лише анемія 1-го ступеня та загальна слабкість, які швидко минули після закінчення введення етопозиду та карбоплатину. Динаміку перебігу захворювання зображено на рис. 2.
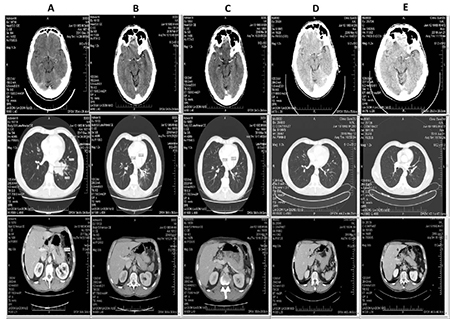
Наразі пацієнт продовжує отримувати інфузії препарату атезолізумаб у дозуванні 1200 мг кожні 3 тиж. Він дотримується активного способу життя, працює. Медіана виживаності цього хворого становить уже 20 міс, що значно перевищує середньостатистичні показники.
Висновки
ДРЛ показує високу чутливість до хіміотерапії та променевої терапії, але ці методи лікування не здатні забезпечити стійкий ефект і значно подовжити медіану виживаності пацієнтів. Тривале використання класичної хіміотерапії пов’язане з ризиками розвитку токсичних гематологічних та негематологічних ефектів. Саме тому поєднання хіміотерапевтичних засобів із PD-L-блокаторами може забезпечити тривале підтримувальне лікування і підвищення показника загальної виживаності хворих на ДРЛ.
Список використаної літератури
- Бахмутский, Н.Г., Порханов, В.А., & Бодня, В.Н. (2017) Мелкоклеточный рак легкого. Медицинский вестник Юга России, 8(4), 6–13. doi: 10.21886/2219-8075-2017-8-4-6-13.
- Aynaci, O., Canyilmaz, E., & Serdar, L.K. (2016) Survival and prognostic factors in limited stage small cell lung cancer: A retrospective study from northeast Turkey. Cancer Res., 12(1), 238–243. doi:10.4103/0973-1482.151446.
- Okamoto, H., Watanabe, K., & Kunikane, H. (2007) Randomised phase III trial of carboplatin extensive disease small-cell lung cancer: JCOG 9702. Br. J. Cancer, 97(2), 162–169.
- Schmittel, A., Sebastian, M., & Fischer von Weikersthal, L. (2011) A German multicenter, randomized phase III trial comparing irinotecan-carboplatin with etoposide-carboplatin as first-line therapy for extensivedisease small-cell lung cancer. Ann. Oncol., 22(8), 1798–1804. doi: 10.1093/annonc/mdq652.
- Zatloucal, P., Cardenal, F., & Szczesna, A. (2010) A multicenter international randomized phase III study comparing cisplatin in combination with irinotecan or etoposide in previously untreated small-cell lung cancer patients with extensive disease. Ann. Oncol., 21(9), 1810–1816. doi: 10.1093/annonc/mdq036.
- Guo, S., Liang, Y., & Zhou, Q. (2011) Complement and correction for meta-analysis of patients with extensive-stage small cell lung cancer managed with irinotecan/cisplatin versus etoposide/ cisplatin as first-line chemotherapy. J. Th orac. Oncol., 6(2), 406–408. doi: 10.1097/JTO.0b013e3182061d8c.
- Niell, H.B., Herndon, J.E., & Miller, A.A. (2005) Randomized phase III intergroup trial of etoposide and cisplatin with or without paclitaxel and granulocyte colony-stimulating factor in patients wit extensive-stage small-cell lung cancer: Cancer and Leukemia Group B Trial 9732. J. Clin. Oncol., 23(16), 3752–3759. doi: 10.1200/JCO.2005.09.071.
- Shivnani, A.T. (2007) Prophylactic cranial irradiation in smallcell lung cancer. N. Engl. J. Med., 357(19), 30–34. doi: 10.1056/NEJMc072691.
- Rocha-Lima, C.M., Herndon, J.E., Lee, M.E. (2007) Phase II trial of irinotecan/gemcitabine as second-line therapy for relapsed and refractory small-cell lung cancer: Cancer and Leukemia Group B Study 39902. Ann. Oncol., 18(2), 331–337. doi: 10.1093/annonc/mdl375.
Иммунотерапия мелкоклеточного рака легкого: клиническое наблюдение
Сумской государственный университет, Украина
Резюме. Введение. Представлено клиническое наблюдение, в котором описан полный ответ на химиотерапию и иммунотерапию PD-L-блокатором атезолизумабом у больного с метастатическим мелкоклеточным раком легкого. Продолжительность ремиссии — 20 мес. Цель. Сообщение об успешном случае лечения пациента с запущенным мелкоклеточным раком легкого. Материалы и методы. Анализ отдельных источников научной литературы по основным принципам химиотерапии, иммунотерапии и лучевой терапии мелкоклеточного рака легких. Описание клинического наблюдения. Использованы лучевой, лабораторный, гистологический, иммуногистохимический методы исследования. Результаты. Мелкоклеточный рак легкого демонстрирует высокую чувствительность к химиотерапии и лучевой терапии, но эти методы лечения не способны обеспечить устойчивый эффект и значительно улучшить медиану выживаемости пациентов. Выводы. Сочетание химиотерапии с PD-L-блокаторами может обеспечить длительное поддерживающее лечение и повышение показателя общей выживаемости пациентов с мелкоклеточным раком легких.
мелкоклеточный рак легких, атезолизумаб, PD-L-блокаторы
Адреса:
Москаленко Юлія Василівна
40000, Суми, вул. Римського-Корсакова, 2
Сумський державний університет
E-mail: yl.moskalenko@med.sumdu.edu.ua
Correspondence:
Moskalenko Yuliy
2 Rymskogo-Korsakova str., Sumy 40000
Sumy State University
E-mail: yl.moskalenko@med.sumdu.edu.ua














Leave a comment