Роль таргетної терапії у лікуванні хворих на рак легені з позитивними EGFR-мутаціями (огляд літератури)
Колеснік О.П., Шевченко А.І., Каджоян А.В., Кузьменко В.О., Кабаков А.О., Михайлов В.В.
Резюме. Важливою проблемою в онкології є лікування хворих на недрібноклітинний рак легені (НДКРЛ) III–IV стадії. Актуальність питання пов’язана з тим, що більш ніж половина пацієнтів із НДКРЛ мають IIIB (22,0%) або IV стадію захворювання (32,0%). Основною метою лікування хворих із задавненим НДКРЛ, крім підвищення виживаності, є поліпшення якості життя. Терапія задавненого раку легені на початку XX сторіччя стартувала із незадовільних результатів, у більшості досліджень медіана виживаності становила від 4,0 до 6,0 міс, а загальна виживаність — від 10,0 до 15,0%. Але з 2000-х років почалася ера таргетної терапії, і в останнє десятиліття вона зайняла одне з основних місць у наукових дослідженнях. А вже на цей момент, в 2018 р., згідно з даними NCCN 2018 та ESMO 2017, визначення драйверних мутацій є першим кроком у виборі оптимальної тактики лікування пацієнтів із задавненим раком легені. Однією з найрозповсюдженіших мутацій у світі (насамперед у Північній Америці та Азії) у хворих на рак легені є EGFR-мутація. У хворих з наявністю EGFR-мутацій відповідь на лікування інгібіторами тирозинкінази становить 70,0-100,0%, а при їх відсутності — 0,0-30,0%. На сьогодні виділяють три генерації інгібіторів тирозинкінази EGFR: перша — ерлотиніб та гефітиніб, друга — афатініб, третя — осимертиніб.
Одержано 00.00.2018
Прийнято до друку 00.00.2018
З 1985 р. і до сьогодні рак легені (РЛ) є лідером у структурі захворюваності та смертності від злоякісних новоутворень в усьому світі. Щороку у світі діагностують більш ніж 1,6 млн нових випадків захворювання на РЛ (12,0% усіх вперше виявлених злоякісних новоутворень), серед них 1,2 млн — у чоловіків, 440 тис. — у жінок. Так, за даними 2012 р., у світі від РЛ померли більше 1,6 млн людей. Прогнозується, що до 2035 р. смертність від РЛ становитиме 3,0 млн осіб на рік. Лідером із захворюваності на РЛ є Центральна і Східна Європа (53,5 випадку на 100 тис. населення).
Важливою проблемою в онкології є лікування хворих на недрібноклітинний рак легені (НДКРЛ) III–IV стадії. Актуальність питання пов’язана з тим, що більш ніж половина хворих на НДКРЛ мають IIIB (22,0%) або IV стадію захворювання (32,0%). При III стадії спостерігається значне зниження загальної виживаності, при ІІІА стадії 5 років прожили 36,0% пацієнтів, ІІІB — 26,0%, IIIС — усього лише 13,0%. Низькими залишаються показники загальної однорічної виживаності при IV стадії РЛ (10,0% — при IVА і <1,0% — при IVB) [1, 2]. Терапія задавненого РЛ на початку XX сторіччя стартувала із незадовільних результатів, у більшості досліджень медіана виживаності становила від 4 до 6 міс, а загальна виживаність — від 10,0 до 15,0% [3]. З 1970-х років проведено низку досліджень, у яких було показано перевагу застосування поліхіміотерапії при задавненому НДКРЛ перед найкращою симптоматичною терапією [4–6]. Наступним кроком у розвитку стратегій лікування при РЛ стало дослідження ефективності рослинних алкалоїдів (вінбластин, етопозид та віндезин) у комбінації з препаратами платини, проведене у 80-х роках ХХ сторіччя. У більшості досліджень доведено перевагу комбінації платини і вінкалоїдів перед монотерапією препаратами платини в строках безрецидивної та загальної виживаності. На початку 90-х років ХХ сторіччя стали доступними для лікування препарати хіміотерапії третього покоління — паклітаксел, доцетаксел, гемцитабін, вінорельбін. У 2002 р. проведено дослідження ECOG c метою порівняння ефективності різних «дублетів» платини. Згідно з отриманими даними жодна з комбінацій не продемонструвала статистично значущої переваги в термінах безрецидивної та загальної виживаності [7]. Важливою метою лікування хворих із задавненим НДКРЛ, крім підвищення виживаності, є поліпшення якості життя [8].
З 2000-х років почалася ера таргетної терапії і в останнє десятиліття вона зайняла домінуюче місце в наукових дослідженнях.
А вже на цей момент, в 2018 р., згідно з даними NCCN 2018 та ESMO 2017 визначення драйверних мутацій є першим кроком у виборі оптимальної тактики лікування хворих із задавненим РЛ (рис. 1).

Перш за все це пов’язано із значною розповсюдженістю різноманітних мутацій. Так, O. Calvayrac та співавтори у 2017 р. вивчали поширеність мутацій у Європі, Азії та Північній Америці у пацієнтів із РЛ. На рис. 2 відображено результати їх дослідження.
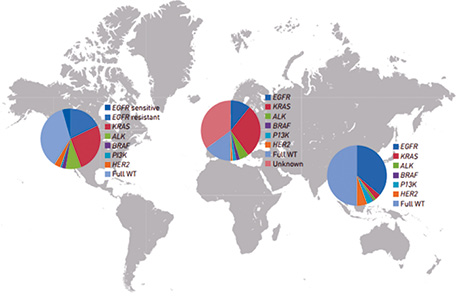
Як видно з наведеної карти, однією з найрозповсюдженіших мутацій в світі (насамперед у Північній Америці та Азії) у хворих на РЛ є EGFR-мутація [9].
У зв’язку з цим науковці всього світу почали шукати способи лікування хворих на НДКРЛ залежно від генних мутацій. У табл. 1 відображено еволюцію вивчення використання таргетних препаратів у лікуванні пацієнтів із НДКРЛ, затверджених Управлінням з контролю якості харчових продуктів і лікарських засобів (Food and Drug Administration — FDA). Впровадження цієї групи препаратів дозволило значно поліпшити показники як загальної, так і безрецидивної виживаності [10].
| Препарат | Група | Рік | Показання |
| Бевацизумаб | Анти-VEFG моноклональні антитіла | 2006 | У комбінації з карбоплатином та паклітакселом для метастатичного неплоскоклітинного НДКРЛ |
| Ерлотиніб | Перша генерація EGFR інгібіторів тирозинкінази | 2013 | EGFR-мутації (делеція екзона 19 або L858R) метастатичний НДКРЛ |
| Афатініб | Друга генерація EGFR інгібіторів тирозинкінази | 2013 | EGFR-мутації (делеція екзона 19 або L858R) метастатичний НДКРЛ |
| Рамуцирумаб | Анти-VEFG2 моноклональні антитіла | 2014 | У комбінації з доцетакселом у лікуванні пацієнтів із метастатичним НДКРЛ, які прогресували під час або після хіміотерапії на основі платини |
| Цертиніб | Друга генерація ALK/ROS1 інгібіторів тирозинкінази | 2014 | ALK-асоційований метастатичний НДКРЛ, який прогресував або резистентний до кризотинібу |
| Нецитимумаб | Друга генерація EGFR інгібіторів тирозинкінази | 2015 | У комбінації з гемцитабіном і цисплатином як перша лінія терапії метастатичного плоскоклітинного НДКРЛ |
| Гефітиніб | Перша генерація EGF інгібіторів тирозинкінази | 2015 | EGFR-мутації (делеція екзона 19 або L858R) метастатичний НДКРЛ |
| Осимертиніб | Третя генерація EGFR інгібіторів тирозинкінази | 2015 | EGFR T790M+ метастатичний НДКРЛ, який прогресував під час або після лікування EGFR інгібіторами тирозинкінази |
| Кризотиніб | Перша генерація ALK/ROS1 інгібіторів тирозинкінази | 2011 2016 |
ALK-асоційований метастатичний НДКРЛ ROS1-асоційований метастатичний НДКРЛ |
| Алектиніб | Друга генерація ALK інгібіторів тирозинкінази | 2015 2017 |
ALK-асоційований метастатичний НДКРЛ, який прогресував або резистентний до кризотинібу Перша лінія лікування ALK-асоційованого метастатичного НДКРЛ |
| Бригатиніб | Друга генерація ALK інгібіторів тирозинкінази | 2017 | ALK-асоційований метастатичний НДКРЛ, який прогресував або резистентний до кризотинібу |
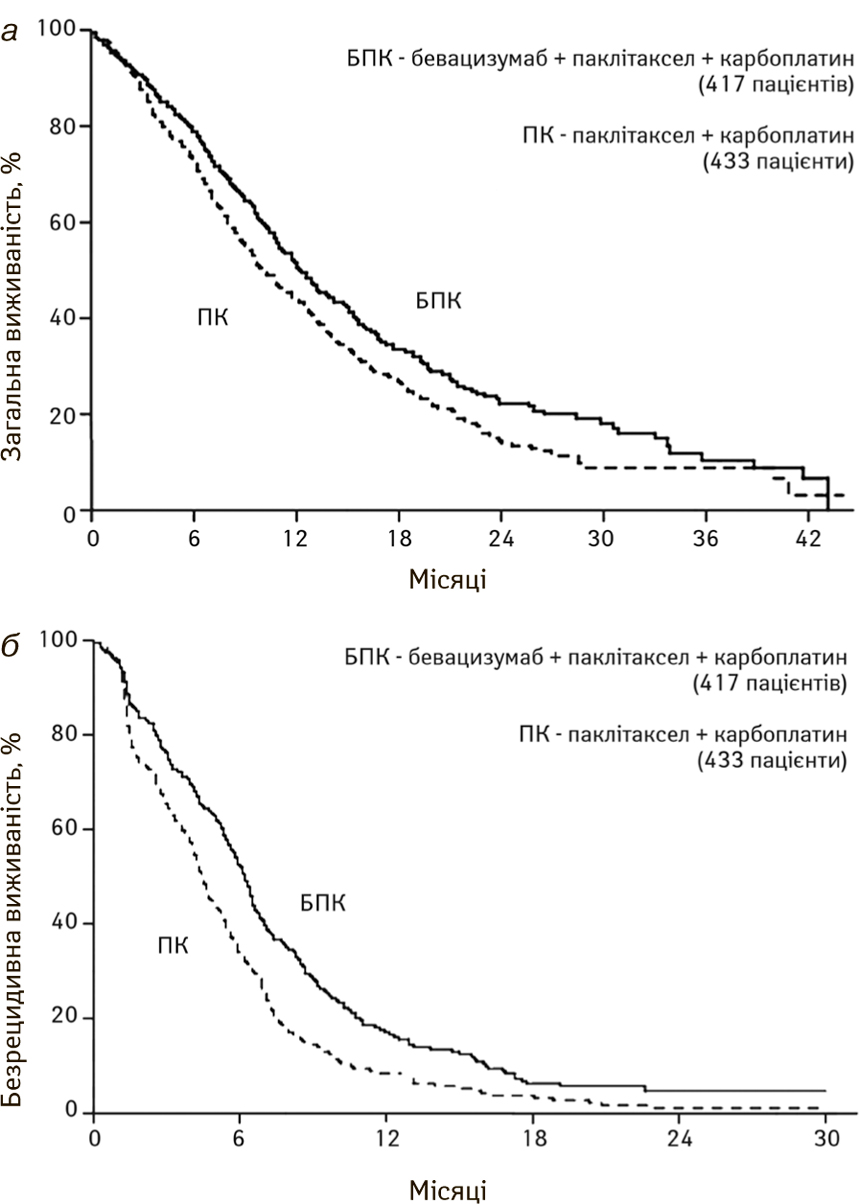
Як видно з наведеної табл. 2, першим таргетним препаратом, затвердженим для лікування хворих на НДКРЛ, був бевацизумаб. Так, у дослідженні А. Sandler і співавторів (2006) при застосуванні бевацизумабу в комбінації з платиновмісним дублетом (паклітаксел, карбоплатин) вдалося досягти вражаючих на той момент цифр загальної виживаності [11] (рис. 3).
Процес розвитку пухлини легені супроводжується активацією певних генів та рецепторів. EGFR, або рецептор епідермального фактора росту, — це рецептор, розташований на мембрані клітини. Активація цього рецептора запускає низку реакцій, які блокують апоптоз, підвищують активність ракової клітини і стимулюють пухлинну прогресію [12].
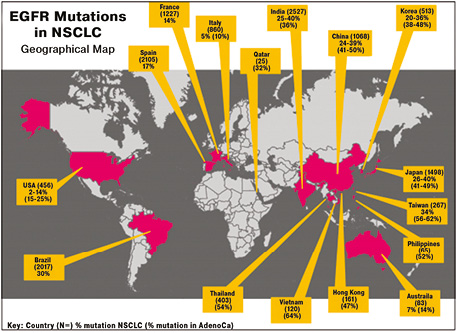
В «Індійському журналі раку» у 2013 р. опубліковано яскраву ілюстрацію (рис. 4), на якій зображено розповсюдження саме EGFR-мутацій у світі, та визначено країни, в яких ця мутація є найпоширенішою серед усіх випадків захворювання на НДКРЛ. Лідерами за цією мутацією є Індія, Китай, Австралія, Бразилія, США, Японія, Корея, Тайланд, В’єтнам, Філіппіни, а у Європі — Іспанія, Франція, Італія [13].
Ген EGFR знаходиться у 7-й хромосомі (7р11.2). Найбільш досліджені мутації гена — G719S, L858R, L861Q та в екзонах 19 і 21. Серед всіх мутацій найбільше клінічне значення мають мутації екзонів 18 (G719A/C), 21 (L858R і L861Q) та делеція екзона 19.
Мутації EGFR пов’язані з певними клінічними характеристиками пацієнтів:
- мутації частіше виникають у жінок, ніж у чоловіків (42,0% проти 14,0%);
- мутації частіше виникають у пацієнтів, які ніколи не палили (<100 сигарет), — 51,0% проти 10,0%;
- мутації частіше виникають у пацієнтів з аденокарциномою порівняно з іншими типами РЛ (40,0% проти 3,0%);
- мутації частіше виникають в азійської популяції [12].
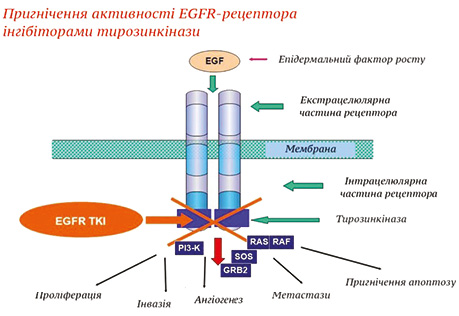
У хворих на НДКРЛ визначення мутації гена EGFR є обов’язковою процедурою для вибору оптимальної тактики терапії, тому що відповідь на протипухлинне таргетне лікування у пацієнтів з EGFR-мутаціями набагато краща, ніж при проведенні стандартної хіміотерапії. Інгібітори тирозинкінази є стандартною терапією першої лінії у пацієнтів із НДКРЛ з наявними мутаціями EGFR [14–16]. Блокуючи фосфорилювання рецепторної тирозинкінази, зазначені препарати пригнічують проліферацію, інвазію, ангіогенез, метастазування пухлини, а також апоптоз (рис. 5).
У хворих з наявністю EGFR-мутацій відповідь на лікування інгібіторами тирозинкінази становить 70,0–100,0,0%, а при відсутності мутацій — 0–30,0%.
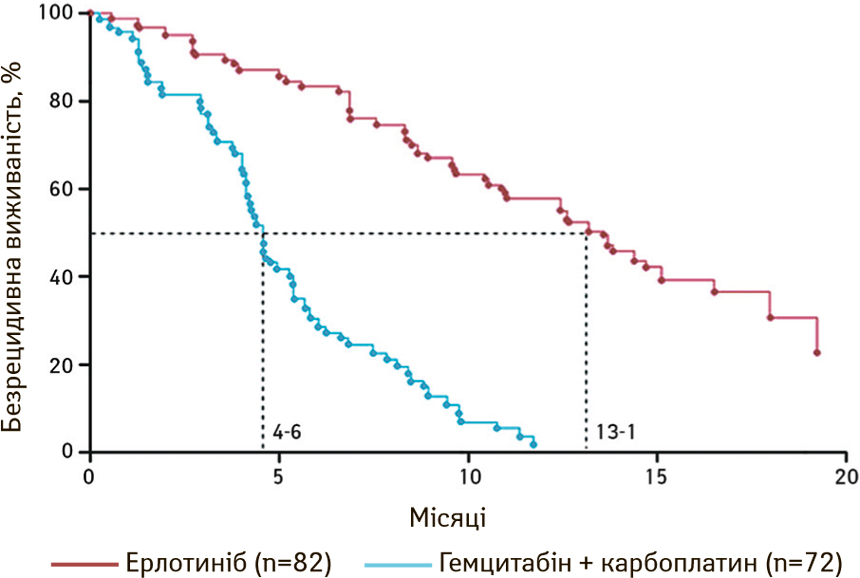
Інгібітором тирозинкінази першого покоління у лікуванні хворих на НДКРЛ з EGFR-мутацією є ерлотиніб [17]. Так, у багатоцентровому відкритому рандомізованому дослідженні III фази C. Zhou та співавтори (2011) порівнювали ефективність ерлотинібу в якості першої лінії терапії проти хіміотерапії (гемцитабін + карбоплатин) у пацієнтів із НДКРЛ з EGFR-мутацією. Безрецидивна виживаність була значно вищою у хворих, які лікувалися ерлотинібом, — 13,1 міс, ніж у пацієнтів, які отримували хіміотерапію, — 4,6 міс (рис. 6). Хіміотерапія була пов’язана з більшою токсичністю III або IV ступеня (нейтропенія, тромбоцитопенія), ніж лікування ерлотинібом, для якого було характерним лише підвищення концентрації трансаміназ та висипання на шкірі [18].
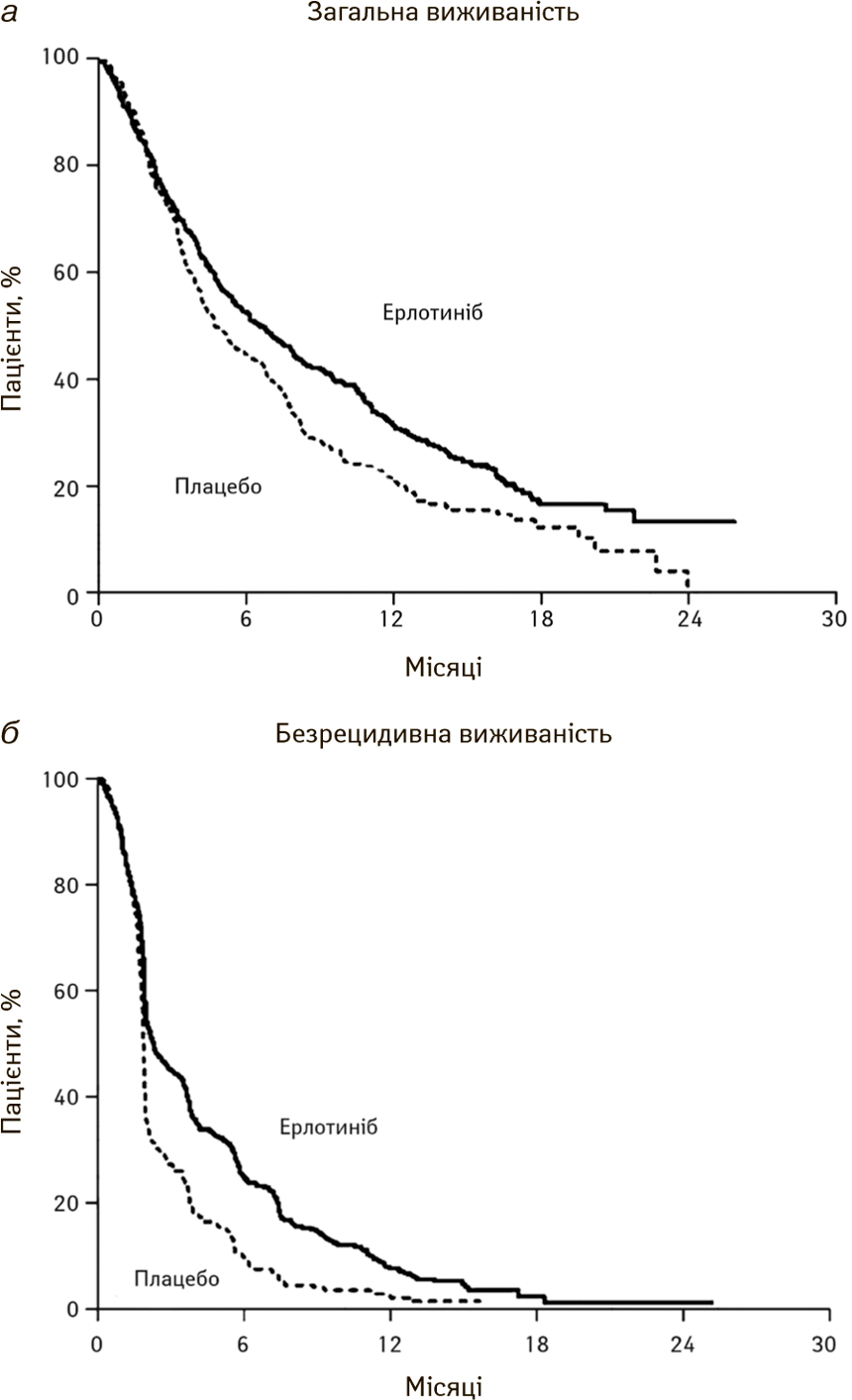
Також ерлотиніб може подовжувати виживаність у пацієнтів із НДКРЛ після лікування першою або другою лінією хіміотерапії. Співробітники Національного інституту раку Канади F.A. Shepherd і співавтори (2005) у дослідженні визначили підвищення як загальної, так і безрецидивної виживаності у пацієнтів, які приймали ерлотиніб (рис. 7). При цьому медіана загальної виживаності становила 6,7 міс у групі ерлотинібу і 4,7 міс — в групі плацебо відповідно, а середня тривалість відповіді була 7,9 міс в групі ерлотинібу та 3,7 міс — в групі плацебо [19].
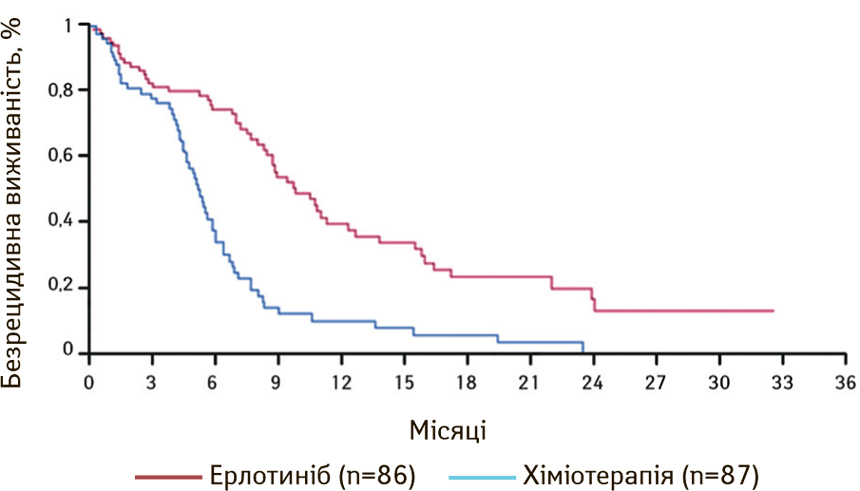
Ще в одному дослідженні ІІІ фази EURTAC (2012) вивчали ефективність ерлотинібу в якості першої лінії терапії у пацієнтів із НДКРЛ з EGFR-мутаціями: делецією 19-го екзона і мутацією в 21-му екзоні L585R. З 2007 по 2011 р. у дослідження було включено 174 пацієнти. Із них 86 хворих отримували ерлотиніб, а 87 — стандартну хіміотерапію (цисплатин/доцетаксел та гемцитабін/цисплатин). Медіана безрецидивної виживаності становила 9,7 міс у групі ерлотинібу і 5,2 міс — у групі стандартної хіміотерапії (рис. 8). Дослідження продемонструвало, що ерлотиніб можливо використовувати в осіб європейської популяції за наявності мутацій гена EGFR [20].
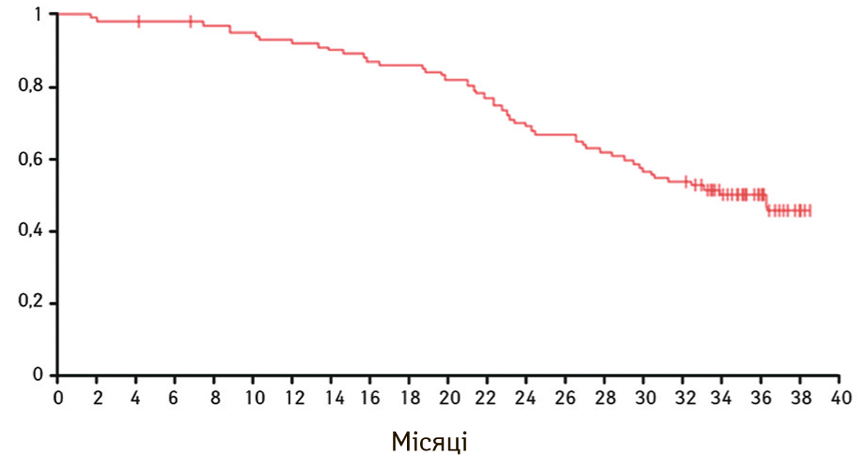
Вивчали також вплив ерлотинібу на загальну виживаність. Так, у відкритому дослідженні II фази JO22903 показник медіани загальної виживаності становив 36,3 міс [21] (рис. 9).
Гефітиніб — ще один інгібітор тирозинкінази, який використовується в якості терапії першої лінії хворих на НДКРЛ. Причому ефективність гефітинібу була доведена тільки у пацієнтів з наявністю EGFR-мутацій. Так, у дослідженні IPASS, проведеному у Східній Азії, 609 пацієнтів отримували гефітиніб і 608 — карбоплатин + паклітаксел. Однорічна безрецидивна виживаність становила 24,9 і 6,7%, частота відповіді — 43,0% проти 32,2% відповідно. Безрецидивну та загальну виживаність наведено на табл. 2 [22].
| Статус EGFR | Схема лікування | Безрецидивна виживаність | Загальна виживаність |
| EGFR+ | Гефітиніб | 9,5 | 22,0 |
| EGFR+ | Карбоплатин/паклітаксел | 6,3 | 22,0 |
| EGFR– | Гефітиніб | 1,5 | 11,2 |
| EGFR– | Карбоплатин/паклітаксел | 6,5 | 12,7 |
За даними табл. 2 видно, що у хворих з EGFR-негативною мутацією хіміотерапія була більш ефективною. Також виявлено значно нижчий профіль токсичності при прийомі гефітинібу порівняно з хіміотерапією.
У ще одному дослідженні IV фази J.Y. Douillard та співавтори (2014) вивчали ефективність ефітинібу у пацієнтів європеоїдної раси з IIIB–IV стадіями неплоскоклітинного РЛ, в якому взяли участь 1060 пацієнтів, у 859 з яких був відомий EGFR-статус. Досліджували такі мутації, як L858R (31,1%), делеція 19-го екзона (65,1%) і T790M. Відповідь на лікування була відзначена у 69,8% пацієнтів, медіана безрецидивної виживаності становила 9,7 міс, а медіана загальної виживаності — 19,2 міс (рис. 10) [23].
Окрім вищевказаних досліджень, ефективність гефітинібу вивчали також у інших роботах, наведених у табл. 3.
| Дослідження | Фаза дослідження | Мутація | Вид лікування (кількість пацієнтів) |
Об’єктивна швидкість відповіді, % | Медіана безрецидивної виживаності/час до прогресії | Медіана загальної виживаності |
| First-Signal (2009) [24] | Фаза III | EGFR+ | Гефітиніб Гемцитабін + цисплатин |
84,637,5 | 8,46,7 | 30,6 26,5 |
| NEJSG002 (2010) [25] | Фаза III | EGFR+ | Гефітиніб (115) Карбоплатин + паклітаксел (115) |
73,730,7 | 10,85,4 | 30,5 23,6 |
| WJTOG3405 (2010) [26] | Фаза III | EGFR+ | Гефітиніб (88) Цисплатин + доцетаксел (89) |
62,132,2 | 9,26,3 | 30,9 — |
Тож ерлотиніб та гефітиніб є інгібіторами тирозинкінази першого покоління, які використовуються в якості першої лінії терапії у пацієнтів із НДКРЛ з наявністю EGFR-мутацій.
Препаратом другого покоління для лікування пацієнтів із НДКРЛ з EGFR-мутаціями є афатініб.
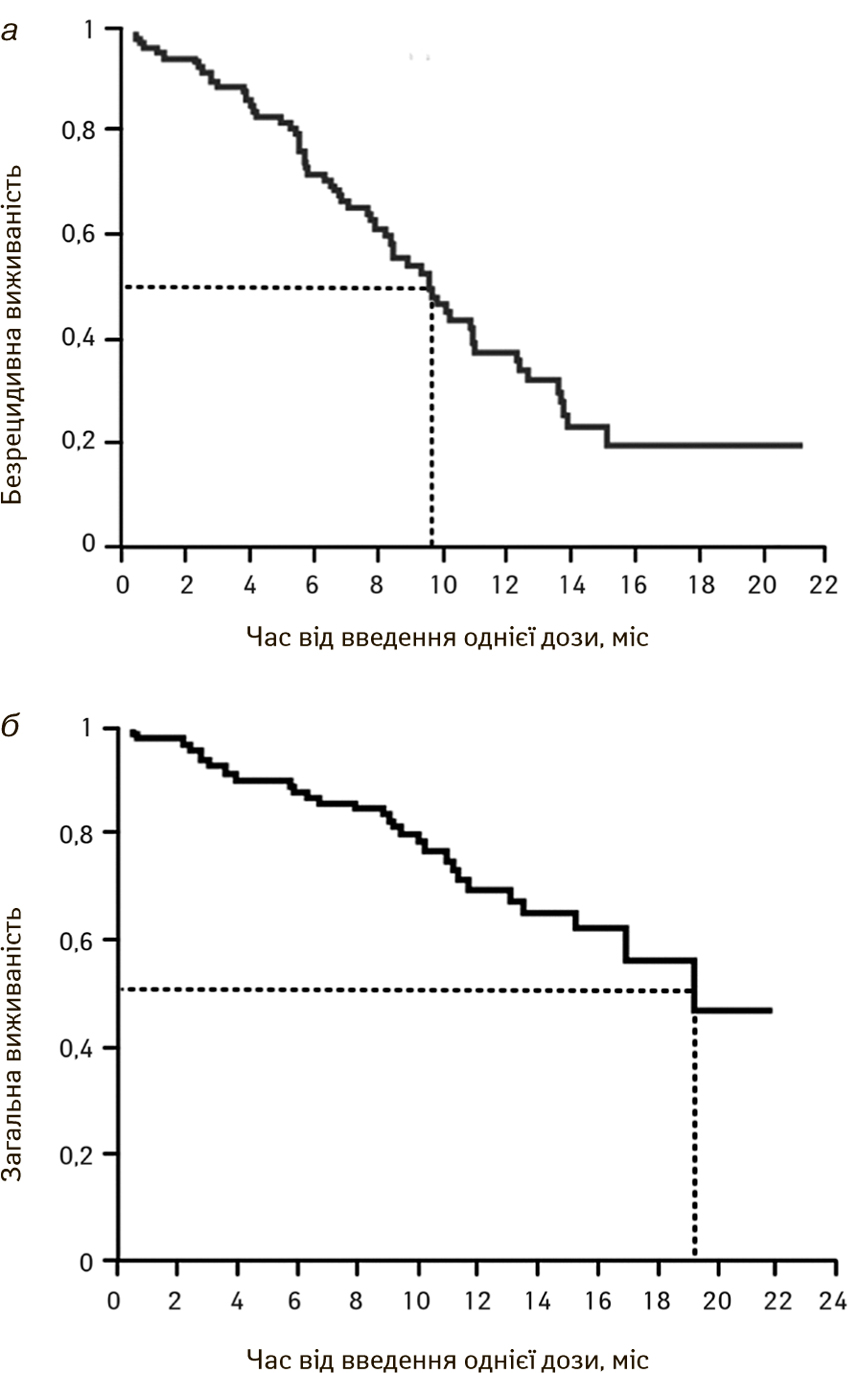
Вища ефективність цього препарату порівняно з плацебо була доведена у дослідженні LUX-Lung 1, в якому взяли участь 585 пацієнтів, 390 з яких лікувалися афатінібом, а 195 — плацебо відповідно. Медіана безрецидивної виживаності була вищою в групі афатінібу — 3,3 міс, ніж в групі плацебо — 1,1 міс (рис. 11) [27].
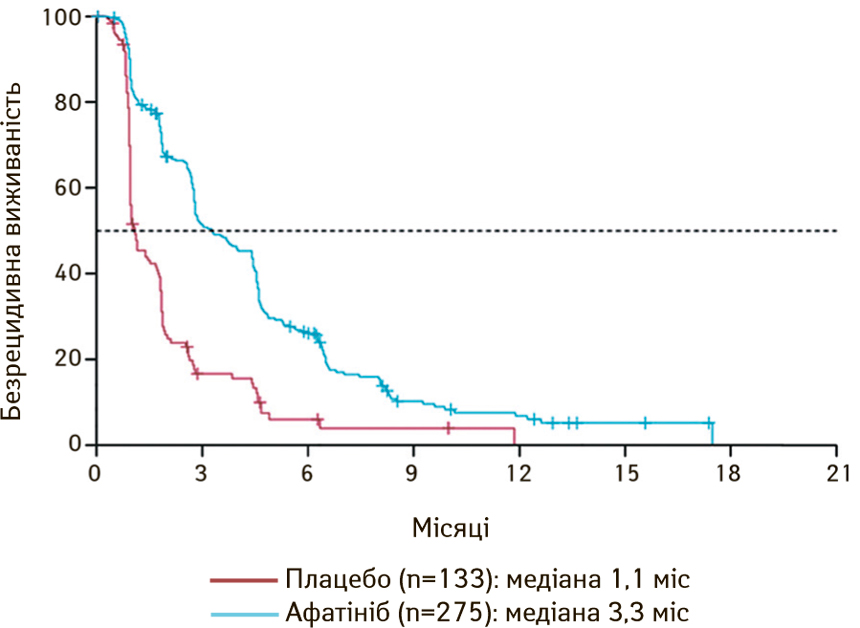
Також ефективність афатінібу вивчали у двох рандомізованих дослідженнях III фази LUX-Lung 3 та LUX-Lung 6, в яких проводилося порівняння ефективності афатінібу у хворих з IIIB–IV стадіями НДКРЛ (аденокарцинома) [28]. LUX-Lung 3 — афатініб порівнювали зі схемою пеметрексед/цисплатин, при цьому медіана загальної виживаності становила 28,2 міс у групі афатінібу і 28,2 міс — у групі пеметрекседу/цисплатину. LUX-Lung 6 — афатініб проти гемцитабіну/цисплатину, при цьому медіана загальної виживаності становила 23,1 міс в групі афатінібу і 23,5 міс — в групі гемцитабіну/цисплатину. Однак при аналізі виживаності залежно від різних мутацій в гені EGFR відзначено відмінність у цьому показнику при делеції 19-го екзона. У LUX-Lung 3 дослідженні медіана загальної виживаності становила 33,3 міс проти 21,1 міс, а в LUX-Lung 6 — 31,4 і 18,4 міс відповідно [28]. Водночас не відзначено відмінності у виживаності хворих з Leu858Arg-positiv EGFR пухлинами (рис. 12).
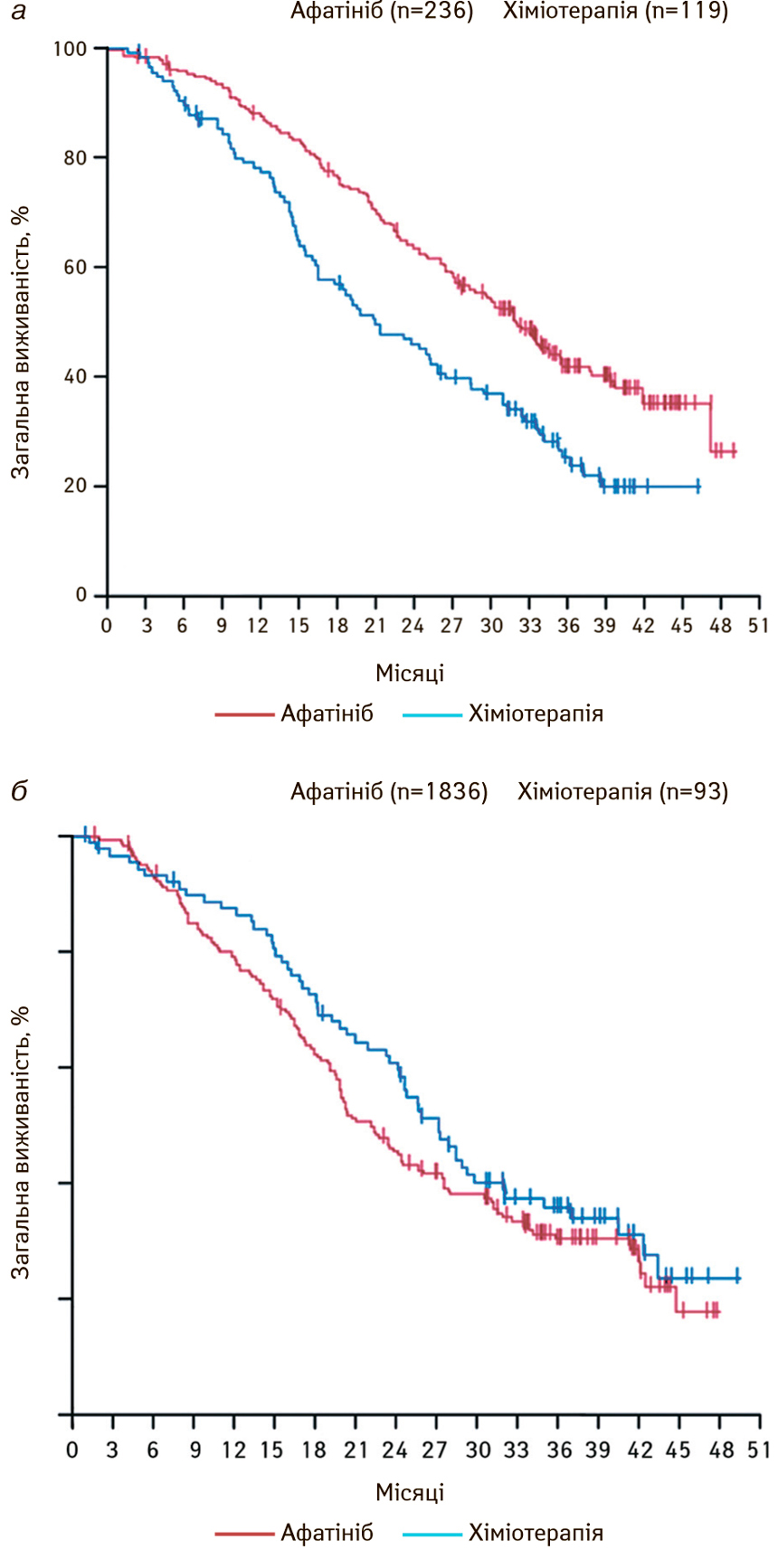
Афатініб порівнювали з гефітинібом в якості першої лінії терапії у пацієнтів із НДКРЛ з EGFR-мутаціями у дослідженні LUX-Lung 7 2016 р. Медіана безрецидивної виживаності сягала 11,0 міс у групі афатінібу проти 10,9 міс з гефітинібом, тобто суттєвої різниці не виявлено [29] (рис. 13).
Отже, афатініб, препарат другого покоління інгібіторів тирозинкінази, також може застосовуватися як терапія першої лінії у пацієнтів із НДКРЛ з наявністю EGFR-мутацій.
До препаратів третьої генерації інгібіторів тирозинкінази EGFR належить осимертиніб. Препарат добре проникає через гематоенцефалічний бар’єр, зв’язується з резистентними Т790М і зі звичайними рецепторами (делеція екзона 19 і L858R). Саме з наявністю мутацій T790M пов’язана резистентність до терапії ерлотинібом і гефітинібом [30].
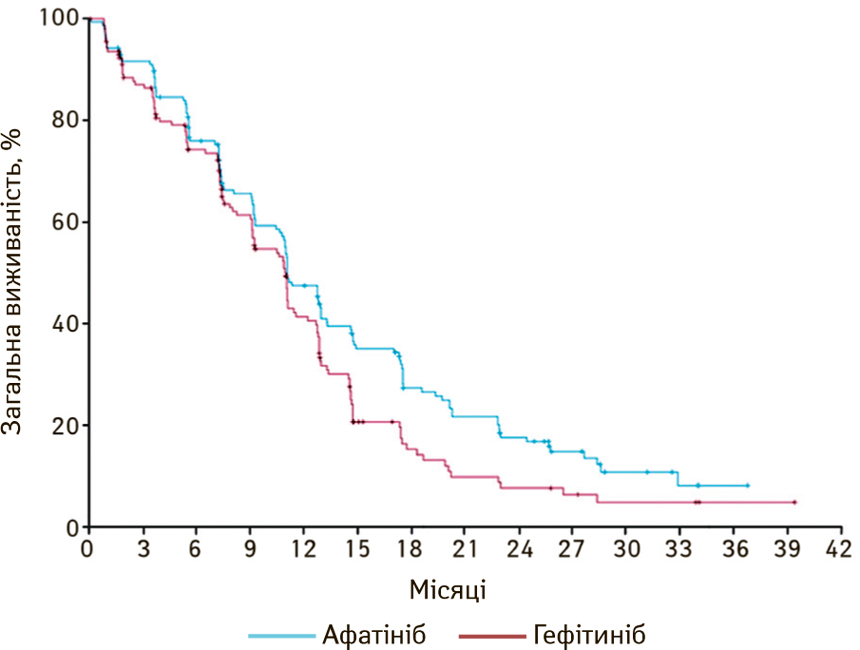
У дослідженні FLAURA 2017 р. були рандомізовані 556 пацієнтів з наявністю EGFR-мутацій, які отримували осимертиніб проти терапії гефітинібом та ерлотинібом. Медіана безрецидивної виживаності була значно вищою у пацієнтів групи осимертинібу — 18,9 міс проти 10,2 міс у групі гефітинібу та ерлотинібу відповідно. Об’єктивна відповідь суттєво не відрізнялася — 80 і 76%. Медіана загальної відповіді становила 17,2 міс проти 8,5 міс. Негативні прояви були однаковими [30]. Даних для оцінки загальної виживаності ще не достатньо (рис. 14).
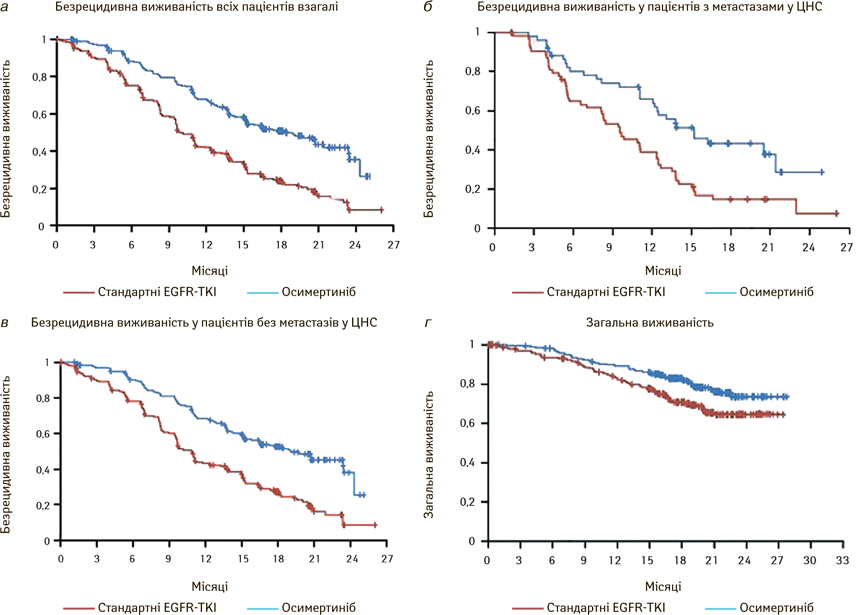
Тож у цьому дослідженні осимертиніб був більш ефективний, ніж гефітиніб і ерлотиніб, у пацієнтів з метастатичним НДКРЛ.
У дослідженні AURA 3 порівняли ефективність осимертинібу і пеметрекседу у 419 пацієнтів з EGFR T790M+ мутаціями, які отримували інгібітори тирозинкінази як першу лінію терапії [31]. Медіана безрецидивної виживаності була значно вищою у пацієнтів, які отримували осимертиніб (10,1 міс проти 4,4 міс). Об’єктивна відповідь на лікування також була вищою в групі осимертинібу (71,0% проти 31,0%). Медіана безрецидивної виживаності у пацієнтів з метастазами в головному мозку так само була вищою при застосуванні осимертинібу (8,5 міс проти 4,2 міс). При цьому кількість негативних проявів у групі осимертинібу була в 2 рази меншою, ніж при використанні ерлотинібу та гефітинібу (23,0% проти 47,0%) [31] (рис. 15).
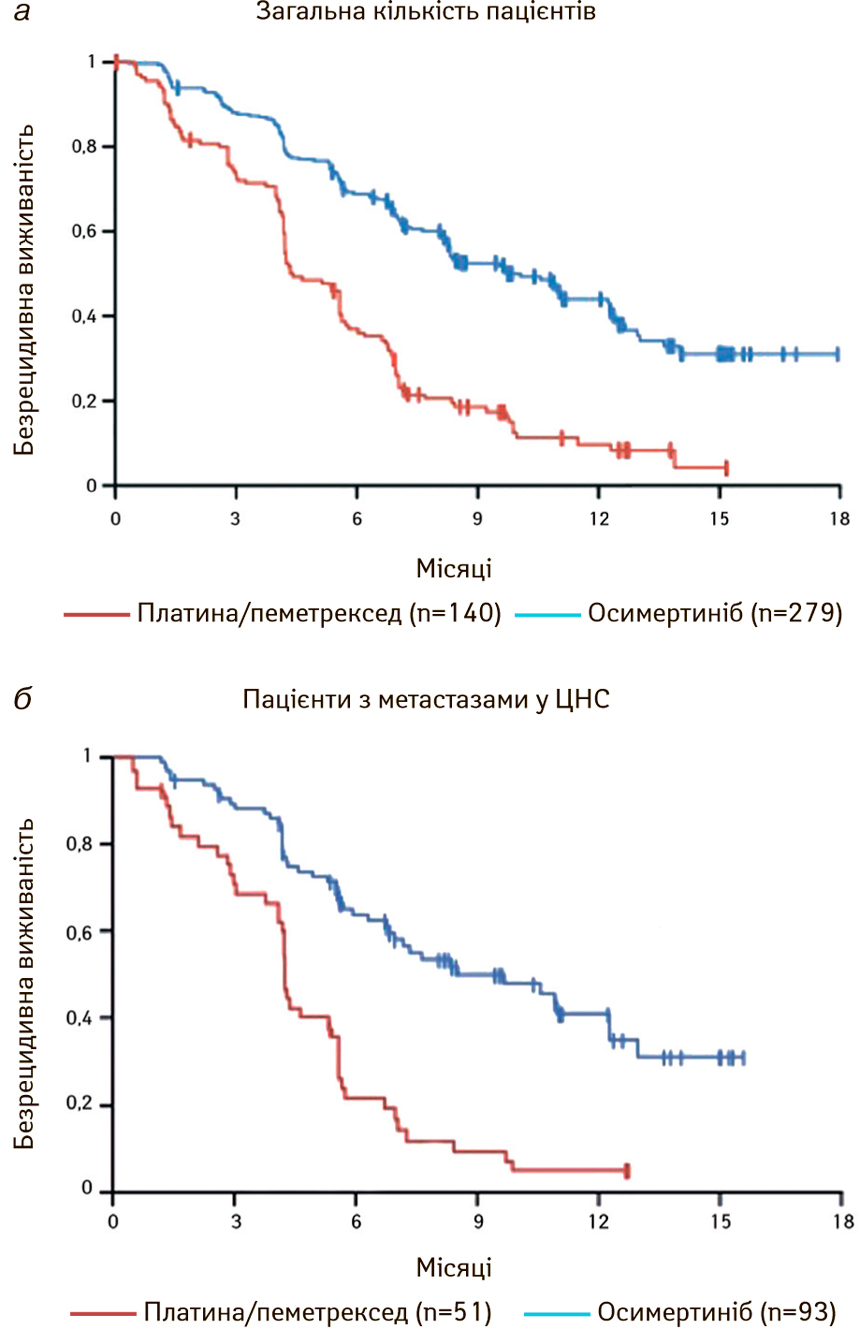
Отже, осимертиніб також може застосовуватися в якості першої лінії терапії у пацієнтів із НДКРЛ з наявністю EGFR-мутацій.
ВИСНОВКИ
1. Визначення драйверних мутацій є першим кроком у виборі оптимальної тактики лікування у пацієнтів з НДКРЛ.
2. Однією з найрозповсюдженіших мутацій в світі (насамперед у Північній Америці та Азії) у хворих на РЛ є EGFR-мутація.
3. У хворих з наявністю EGFR-мутацій відповідь на лікування інгібіторами тирозинкінази становить 70,0–100,0%, а при їх відсутності — 0,0–30,0%. Серед всіх мутацій найбільше клінічне значення мають зміни у екзонах 18 (G719A/C), 21 (L858R і L861Q) та делеція екзона 19.
4. На сьогодні виділяють три генерації інгібіторів тирозинкінази EGFR: перша — ерлотиніб та гефітиніб, друга — афатініб, третя — осимертиніб. Показанням до застосування цієї групи препаратів є наявність мутацій гена EGFR. За наявності резистентності до ерлотинібу та гефітинібу може бути застосований осимертиніб.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Kris M.G. (2005) How today’s developments in the treatment of non-small cell lung cancer will change tomorrow’s standards of care. Oncologist, 2: 23–29. doi: 10.1634/theoncologist.10-90002-23
2. American Cancer Society (2018) Available at: https://www.cancer.org/cancer/small-cell-lung-cancer/detection-diagnosis-staging/survival-rates.html.
3. Spiro S.G., Silvestri G.A. (2005) One hundred years of lung cancer. Am. J. Respir. Crit. Care Med., 172(5): 523–529. doi: 10.1164/rccm.200504-531OE
4. Grilli R., Oxman A., Julian J. (1993) Chemotherapy for advanced non-small-cell lung cancer: how much benefit is enough? J. Clin. Oncol., 11(10): 1866–1872. doi: 10.1200/JCO.1993.11.10.1866
5. Non-small Cell Lung Cancer Collaborative Group. [No authors listed] (1995) Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. BMJ, 311(7010): 899–909. doi: https://doi.org/10.1136/bmj.311.7010.899
6. Cardenal F., López-Cabrerizo M., Antоn A. et al. (1999) Randomized phase III study of gemcitabine-cisplatin versus etoposide-cisplatin in the treatment of locally advanced or metastatic non-small-cell lung cancer. J. Clin. Oncol., 17(1): 12–18. doi: 10.1200/JCO.1999.17.1.12
7. Comis R.L. (2003) A brief history of the research and treatment of lung cancer from 1970 to 2003. Int. J. Clin. Oncol., 8(4): 230–233. doi: 10.1007/s10147-003-0337-5
8. Waechter F., Passweg J., Tamm M. et al. (2005) Significant progress in palliative treatment of non-small cell lung cancer in the past decade. Chest, (3): 738–747. doi: 10.1378/chest.127.3.738
9. Calvayrac O., Pradines A., Pons E. et al. (2017) Molecular biomarkers for lung adenocarcinoma. Eur. Respir. J., 49: 1601734. doi: 10.1183/13993003.01734-2016
10. FDA approves new pill to treat certain patients with non-small cell lung cancer. Press release of the Food and Drug Administration, November 13, 2015. Retrieved from: https://www.cancer.org/latest-news/fda-approves-tagrisso-osimertinib-for-non-small-cell-lung-cancer.html
11. Sandler A., Gray R., Perry M. et al. (2006) Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N. Engl. J. Med., 355(24): 2542–2550. doi: 10.1056/NEJMoa061884
12. Santos G., Shepherd F. A., Tsao M.S. (2011) EGFR mutations and lung cancer. Annu. Rev. Pathol., 6: 49–69. doi: 10.1146/annurev-pathol-011110-130206
13. Parikh P., Puri T. (2013) Personalized medicine: Lung Cancer leads the way. Indian J. Cancer, 50: 77–79. doi:10.4103/0019-509X.117005
14. Masters G.A, Temin S., Azzoli C.G. et al. (2015) Systemic therapy for Stage IV nonsmall-cell lung cancer: American Society of Clinical Oncology Clinical Practice Guideline update. J. Clin. Oncol., 33: 3488–3515. doi: 10.1200/JCO.2015.62.1342
15. Novello S., Barlesi F., Califano R. et al. (2016) Metastatic non-small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 27: Suppl 5: v1–v27. Retrieved from: https://www.esmo.org/Guidelines/Lung-and-Chest-Tumours/Metastatic-Non-Small-Cell-Lung-Cancer
16. Tan D.S., Yom S.S., Tsao M.S. et al. (2016) The International Association for the Study of Lung Cancer consensus statement on optimizing management of EGFR mutation-positive non-small cell lung cancer: status in 2016. J. Thorac. Oncol., 11: 946–963. doi: 10.1016/j.jtho.2016.05.008
17. Cappuzzo F., Ciuleanu T., Stelmakh L. et al. (2010) Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre, randomised, placebocontrolled phase 3 study. Lancet Oncol., 11: 521–529. doi: 10.1016/S1470-2045(10)70112-1
18. Zhou C., Wu Y.L., Chen G. et al. (2011) Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol., 12(8): 735–742. doi: 10.1016/S1470-2045(11)70184-X
19. Shepherd F.A., Rodrigues Pereira J., Ciuleanu T. et al. (2005) Erlotinib in previously treated non-small-cell lung cancer. N. Engl. J. Med., 353(2): 123–132. doi: 10.1056/NEJMoa050753
20. Rosell R., Carcereny E., Gervais R. et al. (2012) Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol., 13: 239–246. doi: 10.1016/S1470-2045(11)70393-X
21. Yamamoto N., Goto K., Nishio M. et al. (2017) Erratum to: Final overall survival in JO22903, a phase II, open-label study of first-line erlotinib for Japanese patients with EGFR mutation-positive non-small-cell lung cancer. Int. J. Clin. Oncol., 22(1): 79. doi: 10.1007/s10147-016-1052-3
22. Mok T.S., Wu Y.L., Thongprasert S. et al. (2009) Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N. Engl. J. Med., 361: 947–957. doi: 10.1056/NEJMoa0810699
23. Douillard J.Y., Ostoros G., Cobo M. et al. (2014) First-line gefitinib in Caucasian EGFR mutation-positive NSCLC patients: a phase-IV, open-label, single-arm study. Br. J. Cancer, 110: 55–62. doi: 10.1038/bjc.2013.721
24. Lee J.S., Park K., Kim S.W. et al. (2009) A randomized phase III study of gefitinib (Iressa) versus standard chemotherapy (gemcitabine plus cisplatin) as a first-line treatment for never-smokers with advanced or metastatic adenocarcinoma of the lung. (Abstract PRS. 4). J. Thorac. Oncol., 4 (Suppl. 1): S283.
25. Maemondo M., Inoue A., Kobayashi K. et al. (2010) Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N. Engl. J. Med., 362: 2380–2388. doi: 10.1056/NEJMoa0909530
26. Mitsudomi T., Morita S., Yatabe Y. et al. (2010) Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol., 11: 121–128. doi: 10.1016/S1470-2045(09)70364-X
27. Miller V., Hirsh V., Cadranel J. et al. (2012) Afatinib versus placebo for patients with advanced, metastatic non-small-cell lung cancer after failure of erlotinib, gefitinib, or both, and one or two lines of chemotherapy (LUX-Lung 1): a phase 2b/3 randomised trial. Lancet Oncol., 13(5): 528–538. doi: 10.1016/S1470-2045(12)70087-6
28. Yang J., Wu Y., Schuler M. et al. (2015) Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma (LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials. Lancet Oncol., 16: 141–151. doi: 10.1016/S1470-2045(14)71173-8
29. Park K., Tan E., O’Byrne K. et al. (2016) Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol., 17: 577–589. doi: 10.1016/S1470-2045(16)30033-X
30. Soria J., Ohe Y., Vansteenkiste J. et al. (2017) Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N. Engl. J. Med., 378(2): 113–125. doi: 10.1056/NEJMoa1713137
31. Mok T., Wu Y., Ahn M. et al. (2017) Osimertinib or Platinum-Pemetrexed in EGFR T790M-Positive Lung Cancer. N. Engl. J. Med., 376(7): 629–640. doi: 10.1056/NEJMoa1612674
Роль таргетной терапии в лечении больных раком легкого с положительными EGFR-мутациями (обзор литературы)
Запорожский государственный медицинский университет
Резюме. Важной проблемой в онкологии является лечение больных немелкоклеточным раком легкого (НМКРЛ) III–IV стадии. Актуальность вопроса связана с тем, что более половины пациентов с НМКРЛ имеют IIIB (22,0%) или IV стадию заболевания (32,0%). Основной целью лечения больных запущенным НМКРЛ, кроме повышения выживаемости, является улучшение качества жизни. Терапия запущенного рака легкого в начале XX столетия стартовала с неудовлетворительных результатов. В большинстве исследований медиана выживаемости составляла от 4 до 6 мес, общая выживаемость — от 10,0 до 15,0%. Но с 2000-х годов началась эра таргетной терапии, и в последнее десятилетие она заняла доминирующее место в научных исследованиях. А уже теперь, в 2018 г., по данным NCCN 2018 и ESMO 2017, определение драйверных мутаций является первым шагом в выборе оптимальной тактики лечения пациентов с запущенным раком легкого. Одной из самых распространенных мутаций в мире (прежде всего в Северной Америке и Азии) у больных раком легкого является EGFR-мутация. У больных с наличием EGFR-мутаций ответ на лечение ингибиторами тирозинкиназы составляет 70–100%, а при их отсутствии — 0–30%. На сегодня выделяют три поколения ингибиторов тирозинкиназы EGFR: первое — эрлотиниб и гефитиниб, второе — афатиниб, третье — осимертиниб.
немелкоклеточный рак легкого; рецептор эпидермального фактора роста (EGFR); ингибиторы тирозинкиназы; таргетная терапия.
Адреса:
Колеснік Олексій Петрович
69091, Запоріжжя, вул. Нижньодніпровська, 4/238
Запорізький державний медичний університет
Тел.: (097) 315-31-78
Факс: (0612) 96-34-96
E-mail: oleksiikolesnik@gmail.com
Correspondence
Kolesnik Oleksiy
4/238 Nyzhnodniprovska str., Zaporizhzhia 69091
Zaporizhzhia State Medical University
Tel.: (097) 315-31-78Fax: (0612) 96-34-96
E-mail: oleksiikolesnik@gmail.com














Leave a comment