Удосконалення методики алокомпозитного ендопротезування
Вирва О.Є. , Головіна Я.О., Малик Р.В., Головіна О.О.
Резюме. Мета. Вивчення біореконструкції довгої кістки, що уражена пухлиною, зниження відсотка ускладнень у разі алокомпозитного ендопротезування. Матеріал та методи. Удосконалено три методики сегментарної кісткової алопластики післярезекційних дефектів довгих кісток, проведена апробація розроблених методик. Перша методика — заміщення післярезекційного дефекту нижньої третини великогомілкової кістки артикулюючим алоімплантатом, друга — алокомпозитне ендопротезування верхньої третини стегнової кістки після видалення пухлини, третя методика — заміщення післярезекційного дефекту діафізарної частини довгої кістки сегментарним алоімплантатом. Результати. Дані методики були використані у 7 хворих (5 чоловіків та 2 жінок) на злоякісні пухлини довгих кісток. У результаті спостереження за пацієнтами відзначалися наступні ускладнення: ішемічний некроз м’яких тканин — 1 випадок; рецидив пухлини, що призвів до ампутації кінцівки — 1 хворий. У всіх випадках відзначалося зрощення алоімплантата та кістки реципієнта в термін спостереження від 6 до 12 міс. Середній термін спостережень за пацієнтами на момент підготовки даної публікації становив від 1 міс до 1 року. Загальна кількість ускладнень становила 2 випадки (28,5%) (за E. R. Henderson). Серед них механічних (переломи конструкцій, алоімплантатів) — 0, інфекційних — 0, рецидив пухлини — 1 пацієнт (14%), ішемічний некроз м’яких тканин у зоні оперативного втручання — 1 хвора (14%). Функціональні результати в середньому згідно зі шкалою MSTS були наступними: 71±14% (min — 45%, max — 76%), шкалою TESS — 73±16% (min — 48%, max — 80%). Висновки. Біореконструкція сегментарних післярезекційних дефектів довгих кісток сприяє відновленню кісткової тканини та оточуючих м’яких тканин. Розробка та удосконалення методик хірургічного лікування хворих на злоякісні пухлини кісток дозволяє застосовувати у практиці найбільш ефективні види лікування та підвищити якість життя даної категорії хворих.
DOI: 10.32471/clinicaloncology.2663-466X.41-1.27933
Одержано: 21.07.2021
Прийнято до друку 5.08.2021
Вступ
У сучасній ортопедії є безліч технік для реконструкції великих дефектів кісток та суглобів. У літературі описані різні методики реконструкції пострезекційних дефектів кісток: артродез, ротаційна пластика, алопластика, ендопротезування і алокомпозитне ендопротезування. Однією з методик, що найбільш часто використовуються, є алопластика (різні варіанти трансплантатів) з фіксацією до кістки реципієнта динамічними компресійними пластинами (Dynamic Compression Plate — DCP) і відновленням оточуючих м’язів [1, 2]. Альтернативою алопластики є реконструкція дефектів кісток ендопротезами (індивідуальними, модульними, мегаендопротезами) [3, 4]. Проте на сьогодні все більшої популярності здобувають комбіновані методи заміщення великих сегментарних дефектів кісток та суглобів. Поєднання індивідуального ендопротезування та сегментарної кісткової алопластики мало наслідком створення методики алокомпозитного ендопротезування (allograft prosthesis composite — APC ). Саме комбінація різних методик дозволяє звести до мінімуму недоліки обох методів та використати необхідні їх переваги [5, 6, 7].
Саме тому розробка оптимальних імплантатів для заміщення дефектів кісток та суглобів триває вже багато десятиліть. Для підбору «ідеального» імплантата, який має відповідати вимогам біосумістності, механічної стабільності та бути безпечним, потрібно проводити безліч різних досліджень та тестів [8]. Саме метод алокомпозитного ендопротезування (поєднання кісткової алопластики та ендопротезування) становить інтерес для проведення поглиблених досліджень.
Основними ускладненнями, які спостерігалися при використанні алокомпозитного ендопротезування, були наступні:
- інфекційні — 0–9%;
- резорбція алотрансплантата — 7–46%;
- переломи алотрансплантата — 12,5–27%;
- відсутність зрощення алотрансплантата з кісткою реципієнта — 4–22% [9, 10, 11].
Такі фактори, як хіміотерапія, променева терапія, довжина резекції кістки, ступінь диференціювання пухлини і проведення ревізійних втручань, супутні захворювання, попередні операції, складність і тривалість оперативного втручання, профілактичний антибактеріальний протокол, переливання крові, потенційно впливають на розвиток тих чи інших ускладнень [10, 11].
Мета даних розробок полягає в біореконструкції довгої кістки, що уражена пухлиною, у підвищенні міцності та довговічності фіксації ендопротеза, зниженні ризику перипротезного перелому у віддалений період, зниженні ризику розвитку порушень репаративних процесів у зоні контакту кісткового алотрансплантата та кістки реципієнта та створенні умов для відновлення функції опори та ходи нижніх кінцівок у найкоротші терміни.
Матеріали та методи
Перша методика — спосіб заміщення післярезекційного дефекту дистального відділу великогомілкової кістки артикулюючим сегментарним алоімплантатом (отримано патент України «Спосіб алокомпозитного ендопротезування», О.Є. Вирва, Я.О. Головіна, Р.В. Малик, № 145498, опубліковано 10.12.2020 р.).
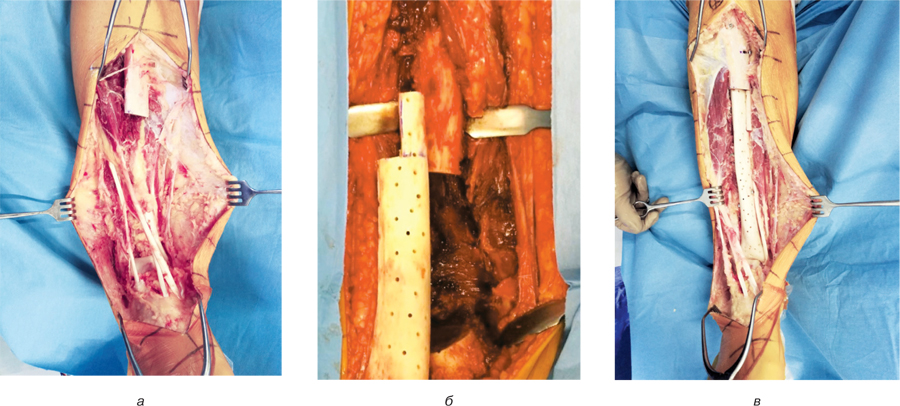
Першим етапом оперативного втручання є радикальне абластичне видалення пухлини кістки (сегментарна резекція) en block. Обов’язково проводиться експрес-біопсія — цитологічне дослідження кісткового мозку з каналу кістки для виявлення атипових клітин та у разі необхідності виконується розширення зони резекції ураженої кістки (рис. 1а.). У зоні резекції кістки проводиться «східцеподібна» остеотомія. Один кінець сегментарного кісткового алотрансплантату та кістки реципієнта обробляється таким чином, щоб їх частини, які виступають, повністю співпадали (рис. 1б).
Другим етапом проводиться саме заміщення післярезекційного дефекту довгої кістки. В інтрамедулярний канал сегментарного кісткового алотрансплантата вводять інтрамедулярний стрижень, проводять його блокування за допомогою гвинтів без застосування кісткового цементу (формують алокомпозитний ендопротез). Вільна частина стрижня вводиться у кістковомозковий канал кістки реципієнта, а алотрансплантат та кістка реципієнта з’єднуються таким чином, щоб «сходини» опилу кожного з них повністю співпадали (рис.1в). Далі проводиться блокування стрижня у кістці реципієнта. У зоні контакту кісткового алотрансплантата та кістки реципієнта додатково розташовуються вільні кісткові аутотрансплантати (з місцевих тканин кістки) та за допомогою швів фіксуються між собою. Після виконання заміщення дефекту кістки проводиться ретельне відновлення оточуючих м’язів.
Застосування даної методики алокомпозитного ендопротезування дозволяє відновити кісткову тканину, провести біореконструкцію дефекту довгої кістки та повернути функцію ураженої кінцівки в найкоротші терміни.
Особливостями даного методу є поєднання виконання східцеподібної остеотомії, інтрамедулярної фіксації алоімплантата та кістки реципієнта, а також первинної кісткової аутопластики зони контакту кісток.
Друга методика. Для удосконалення методики алокомпозитного ендопротезування з метою заміщення післярезекційних дефектів проксимального відділу стегнової кістки було розроблено власний ендопротез (рис. 2). Ендопротез має три частини. Проксимальна — з’ємна, яка фіксується до монолітної частини за допомогою гвинта та дає можливість встановити правильну ротацію. Ця частина ендопротезу має отвори для фіксації м’язів до протезу. Монолітна частина ендопротезу складається з двох компонентів. Верхня (середня) фіксується у кістковому алоімплантаті, має чіткі розміри самого алоімплантата (розмір діаметру інтрамедулярного каналу) та передбачає щільну безцементну фіксацію у алоімплантаті. Також ця частина ендопротезу має пористе покриття.
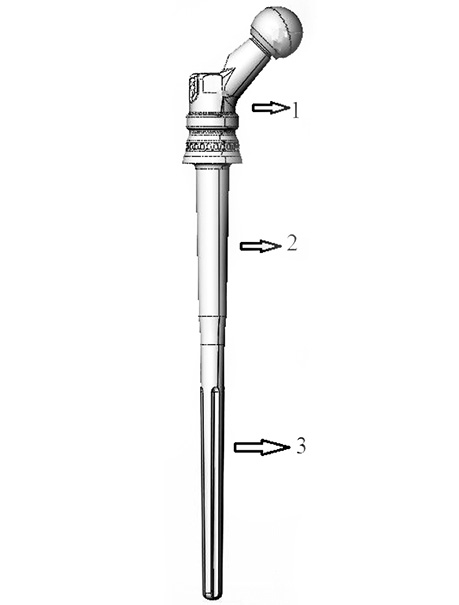
Рис. 2. Схематичне зображення ендопротезу проксимального відділу стегнової кістки для застосування методики алокомпозитного ендопротезування, де 1 — вертлюгова частина ендопротезу; 2 — частина для фіксації у кістковому сегментарному алоімплантаті; 3 — частина для фіксації у кістці реципієнта
Частина ендопротезу, яка фіксується у кістці реципієнта (саме ніжка ендопротезу), має ребра фіксації та відповідає розмірам каналу самої кістки реципієнта. Увесь ендопротез має керамічне покриття (рис. 3а). Під час імплантації ендопротезу також використовується східцеподібна остеотомія кістки реципієнта та алоімплантата для фіксації за типом «руського замка».
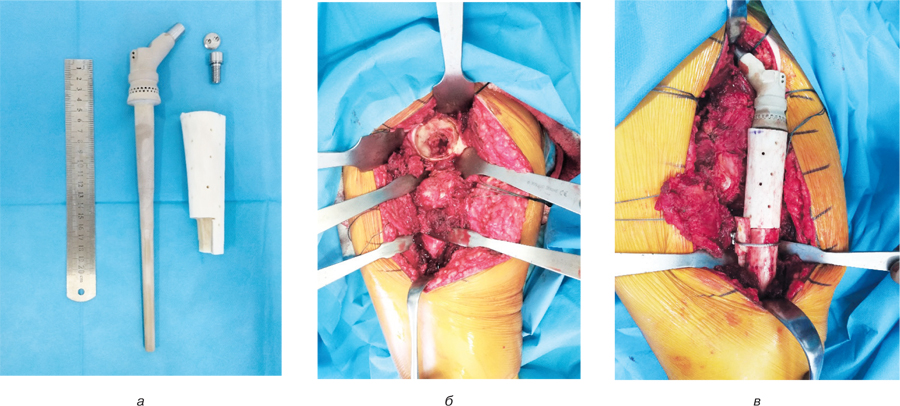
Першим етапом виконується імплантація ендопротезу у кістковий алоімплантат, другим — у кістку реципієнта. У зоні контакту алоімплантата та кістки реципієнта додатково розташовуються кісткові аутотрансплантати, що фіксуються за допомогою швів. Капсула кульшового суглоба відновлюється за допомогою тканинної поліетилентерефтолатної трубки — attachment tube (виробництва компанії Implantcast, Німеччина), яка вдягається на вертлюговий компонент ендопротезу. М’язи, що були відсічені та залишилися під час видалення пухлини, підшиваються до алоімплантата (рис.3 б, в).
Таким чином максимально зберігається кісткова тканина стегнової кістки, а завдяки конструкції ендопротезу та використанню фіксації кістки реципієнта та алоімплантата завдяки «східцеподібній» остеотомії досягається найбільша стабільність всієї конструкції. Особливості ендопротезу та його покриття дозволяють проводити імплантацію без використання кісткового цементу. Додаткове використання аутотрансплантатів та стабільність всієї конструкції дозволяє досягнути найкращих умов для репаративних процесів.
Ця методика відрізняється від відомих саме поєднанням індивідуального ендопротеза (його конструктивні особливості описані вище), з’єднанням алоімплантата та кістки реципієнта через східцеподібну остеотомію та первинною кістковою аутопластикою у зоні контакту кісток, а також повністю безцементною фіксацією ендопротеза у каналі кісток.
Третя методика — заміщення післярезекційних діафізарних дефектів довгих кісток сегментарним кістковим алоімплантатом.
Запропонована методика полягає у використанні сегментарного кісткового алоімплантата та аутотрансплантата з малогомілкової кістки з додатковою фіксацією накістковою пластиною.
Після видалення пухлини формується дефект діафізу кістки. Виділяється аутотрансплантат з малогомілкової кістки, який розташовується інтрамедулярно в сегментарному алоімплантаті таким чином, щоб кінці аутотрансплантату виступали за межі алоімплантата. Кінці аутотрансплантату імплантуються в каналі фрагментів кістки. Виконується остеосинтез накістковою пластиною. У зону контакту алоімплантата та кістки реципієнта також додатково екстраканально встановлюються кісткові аутотрансплантати.
Ця методика відрізняється від відомої тим, що аутотрансплантат з малогомілкової кістки імплантується без судинної ніжки, але додатково використовуються аутотрансплантати в зоні контакту алоімплантата та кістки реципієнта, що сприяє покращенню регенерації. Цей варіант можна використовувати у клініках, де немає можливості виконувати мікросудинну пластику.
Результати
Клінічна апробація розроблених методик алокомпозитного ендопротезування. Ці методики були застосовані у 7 хворих (5 чоловіків та 2 жінок) зі злоякісними пухлинами довгих кісток. Розподіл за нозологією був наступний: остеогенна саркома — 2 хворих, адамантінома — 1 пацієнт, недиференційована плеоморфна саркома — 2 хворих, саркома Юїнга — 1 пацієнт, мієлома — 1 хворий. Середній вік хворих становив — 35,6 років (від 18 років до 50 років). У 3 хворих патологічне пухлинне вогнище розташовувалося у дистальному відділі великогомілкової кістки. У цих випадках для заміщення післярезекційного дефекту кістки використовувався сегментарний артикулюючий алоімплантат. У 2 хворих пухлинний процес відзначався у діафізарній зоні стегнової кістки. Цим пацієнтам виконувалося заміщення післярезекційного дефекту кістки сегментарним діафізарним алоімплантатом. У 2 хворих пухлинним процесом уражався проксимальний відділ стегнової кістки. У таких випадках виконувалося алокомпозитне ендопотезування проксимального відділу стегнової кістки з кульшовим суглобом.
Згідно з протоколами лікування злоякісних пухлин кісток 6 хворим проводилася поліхіміотерапія.
Усім хворим обов’язково виконувалося рентгенографічна та комп’ютерна томографія (КТ) у післяопераційний період для контролю репаративних процесів, а також моніторингу онкопатології.
В одному випадку у хворого з адамантиномою дистального відділу великогомілкової кістки у зв’язку з локальним рецидивом пухлини та генералізацією онкопроцесу було виконано ампутацію нижньої кінцівки на рівні нижньої третини стегна.
У результаті спостереження за хворими, яким проводилося хірургічне лікування за розробленою методикою, відзначалися наступні ускладнення: ішемічний некроз м’яких тканин (внаслідок інтраопераційного перев’язування артерії, що була щільно оточена пухлиною) — 1 випадок; рецидив пухлини, що призвело до ампутації кінцівки — 1 хворий. Хворій з некрозом м’яких тканин у зоні оперативного втручання було виконано шкірно-м’язову пластику та таким чином вдалося зберегти кінцівку (клінічний приклад 1). У всіх випадках відзначалося зрощення алоімплантата та кістки реципієнта у термін спостереження від 6 до 12 міс. Середній термін спостережень за хворими становив від 1 міс до 1 року. Загальна кількість ускладнень — 2 випадки (28,5%) (за E.R. Henderson.) Серед них механічних (переломи конструкцій, алоімплантатів) — 0, інфекційних — 0, рецидив пухлини — 1 випадок (14%), ішемічний некроз м’яких тканин у зоні оперативного втручання — 1 хвора (14%). Функціональні результати в середньому становили згідно зі шкалою MSTS — 71±14% (min — 45%, max — 76%), шкалою TESS — 73±16% (min — 48%, max — 80%).
Клінічні приклади
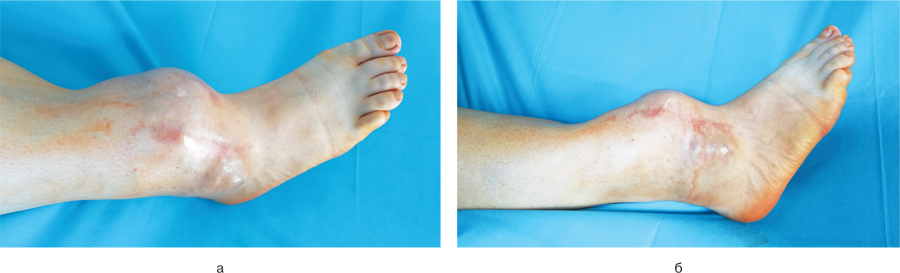
Клінічний приклад 1. У клініку інституту ДУ «Інститут патології хребта та суглобів ім. професора М.І. Ситенка Національної академії медичних наук» звернулася хвора Д., 44 роки, зі скаргами на наявність безболісного новоутворення в середній–нижній третині лівої гомілки (рис. 4 а, б).
З анамнезу хвороби було з’ясовано, що вперше ознаки пухлини помітила 2 роки до госпіталізації у ДУ «Інститут патології хребта та суглобів ім. професора М.І. Ситенка Національної академії медичних наук». В онкоцентрі за місцем проживання хвору було прооперовано, видалено тільки м’якотканинний компонент пухлини та встановлено діагноз — поліморфноклітинна саркома гомілки. З приводу рецидиву пухлини виконано повторну операцію з видалення пухлини та проведено 6 курсів поліхіміотерапії. За цей час ніяких втручань на вогнищі великогомілковій кістці не було проведено.
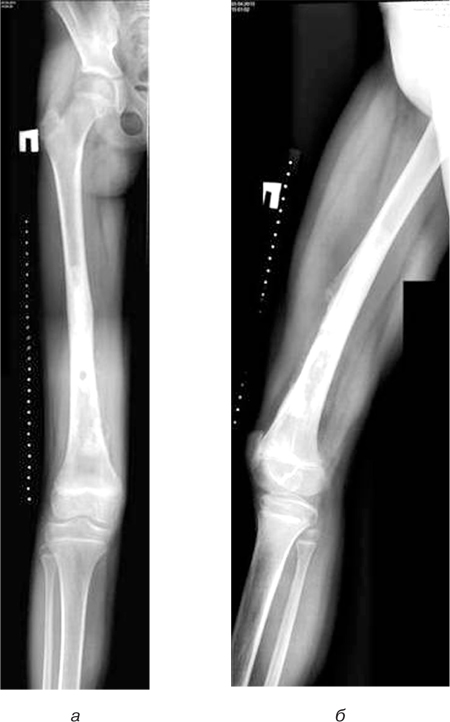
Пацієнтці у клініці інституту проведено комплексне обстеження, виконано рентгенологічне, КТ-дослідження (рис. 5).
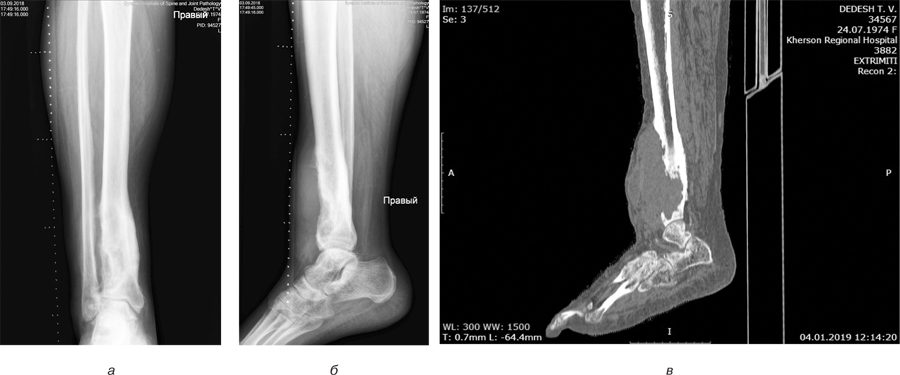
На рентгенограмах та КТ визначено масивну літичну деструкцію нижньої третини великогомілкової кістки з наявністю м’якотканинного компонента без пошкодження шкіряного покрову. Патологічне вогнище розташовувалося ексцентрично, переважно по передній поверхні кістки.
У результаті проведеного КТ-онкоскринінгу органів та систем організму метастатичних уражень не виявлено.
Під час аналізу гістологічного матеріалу було встановлено діагноз «недиференційована плеоморфна саркома правої великогомілкової кістки». Діагноз було підтверджено імуногістохімічним дослідженням. У результаті комплексної діагностики встановлено діагноз: «недиференційована плеоморфна саркома дистального відділу правої великогомілкової кістки T2N0M0, II стадія, II клінічна група».
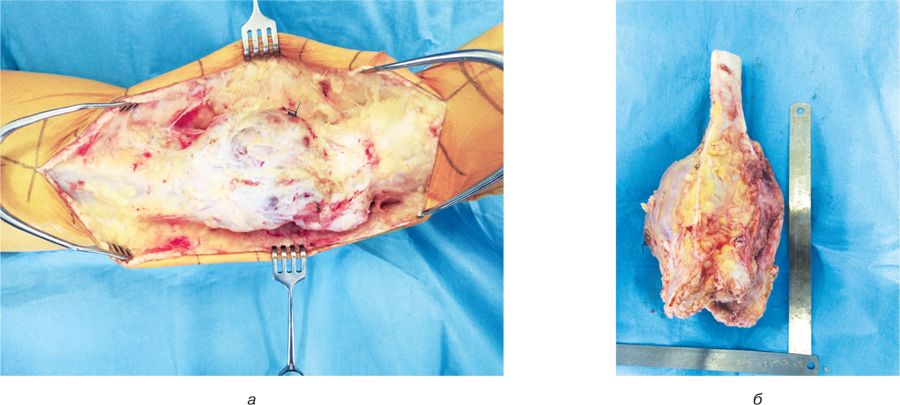
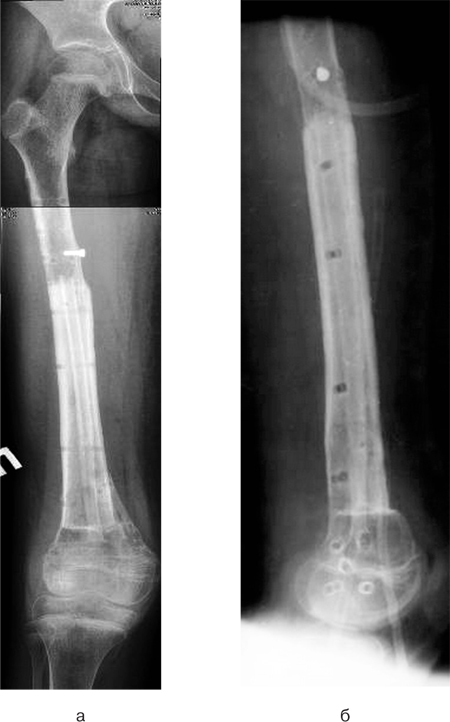
Хворій проведено хірургічне втручання: видалення пухлини en block (рис. 6а, б), заміщення післярезекційного дефекту нижньої третини великогомілкової кістки сегментарним артикулюючим алоімплантатом з фіксацією блоківним інтрамедулярним стрижнем. Інтраопераційно спостерігалася інвазія пухлиною передньої великогомілкової артерії, тому її було перев’язано та відсічено. Сухожилки розгиначів ступні та пальців було збережено. Під час операції використано східцеподібну остеотомію середньої третини великогомілкової кістки та сформовано відповідну частину на кістковому алоімплантаті. Ця форма кінців кісток дозволяє досягнути найбільшого контакту кістки реципієнта та кісткового алоімплантату, а також більш стабільної їх фіксації. Додатково в зону контакту кістки реципієнта та алоімплантата було розміщено кісткові аутотрансплантати для покращення первинного репаративного процесу. Дистальний міжгомілковий синдесмоз було фіксовано гвинтами (рис.7а, б). Рана була закрита та гомілково-ступневий суглоб фіксовано у циркулярній «вікончастій» гіпсовій пов’язці.
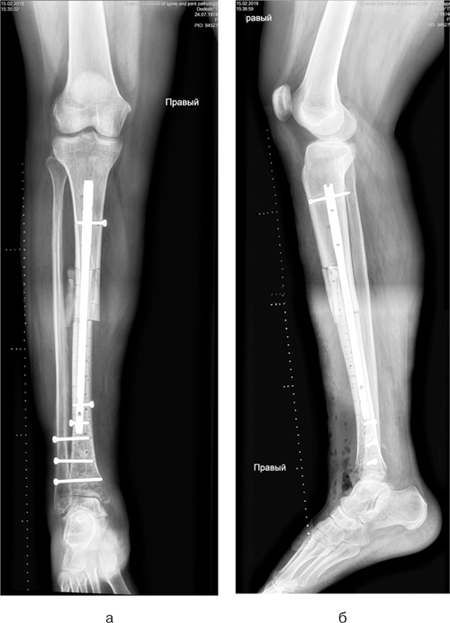
Протягом періоду спостереження після операції було визначено ішемічний некроз м’яких тканин передньої поверхні нижньої третини гомілки, що пов’язаний з видаленням передньої великогомілкової артерії. Проводилися некректомії, вакуумна терапія рани. Після «очищення» рани було виконано оперативне втручання — шкірно-фасціальну пластику дефекту м’яких тканин нижньої третини гомілки латеральним перфорантним шкірно-фасціальним транспозиційним надкісточковим клаптем у комбінації з вільно розщемленим клаптем.
Після операції нижню кінцівку фіксували у гіпсовій пов’язці. Через 1,5 міс на контрольному огляді спостерігалася повна перебудова трансплантатів м’яких тканин та 100% приживлення клаптів (рис. 8).

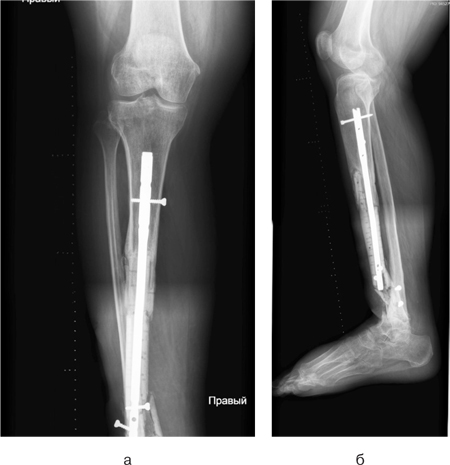
Через 1 рік спостереження на рентгенограмі гомілки спостерігалося зрощення кісткових трансплантатів з кісткою реципієнта. Хвора ходить без додаткової опори (рис.9).
Клінічний приклад 2. Хворий Ж., 45 років, поступив у клініку зі скаргами на біль у верхній третині лівого стегна. У результаті комплексного обстеження (клінічне, рентгенологічне (рентген (рис. 10а), КТ (рис. 10б)), патоморфологічне дослідження біопсійного матеріалу, дослідження стернального пунктату) встановлено діагноз: «мієлома проксимального відділу лівої стегнової кістки T2N0M0, II стадія, II клінічна група». Враховуючи цей діагноз, високий ризик розвитку патологічного перелому стегнової кістки, першим етапом було виконано оперативне втручання: видалення пухлини en block, заміщення післярезекційного дефекту верхньої третини лівої стегнової кістки алокомпозитним ендопротезом. Використовувався розроблений в ДУ «Інститут патології хребта та суглобів ім. професора М.І. Ситенка Національної академії медичних наук» індивідуальний ендопротез, а також сегментарний кістковий алоімплантат, що був підготовлений та простерилізований методом насичення антибіотиками (рис. 11).
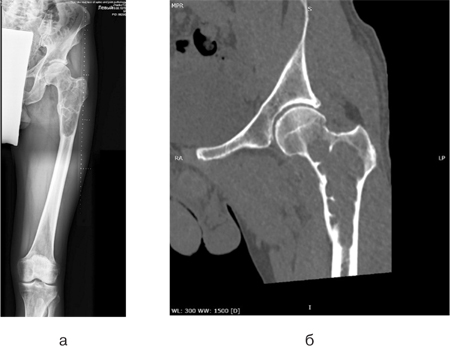
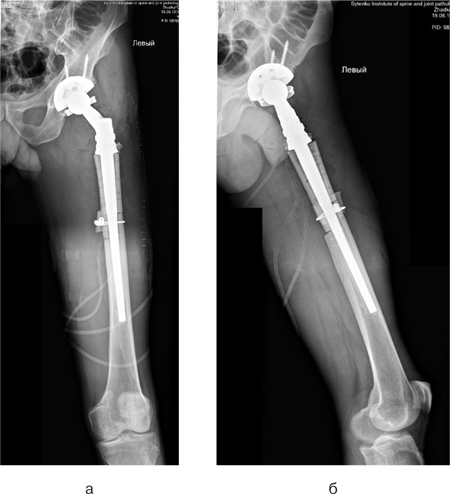
У післяопераційний період ускладнень не зафіксовано. Хворий знаходиться під спостереженням у клініці ДУ «Інститут патології хребта та суглобів ім. професора М.І. Ситенка Національної академії медичних наук». У подальшому планується лікування у онкогематологів.
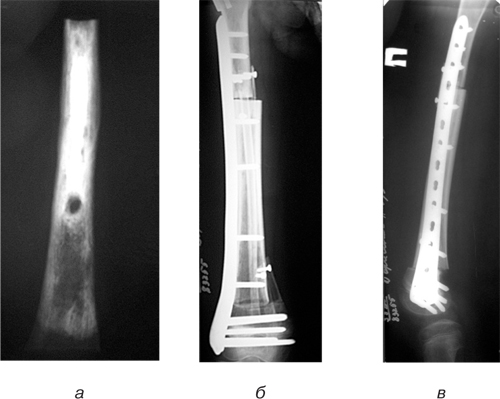
Клінічний приклад 3. Хвора Б., 10 років, звернулася у клініку ДУ «Інститут патології хребта та суглобів ім. професора М.І. Ситенка Національної академії медичних наук» зі скаргами на біль у правому стегні. У результаті комплексного обстеження встановлено діагноз: «остеосаркома діафізу правої стегнової кістки T2N0M0, II стадія, II клінічна група (рис. 12). Хвора пройшла курси неоад’ювантної поліхіміотерапії. Проведено оперативне втручання за III методикою. Післярезекційний дефект діафізу стегнової кістки заміщено сегментарним алоімплантатом з інтрамедулярно розташованим у ньому аутотрансплантатом з малогомілкової кістки та додатковою аутопластикою зон контакту кісток (рис. 13). Після оперативного втручання отримала ад’ювантну поліхіміотерапію. Через півроку на рентгенограмах стегна спостерігалося зрощення трансплантатів та повна перебудова кісткової тканини (рис. 14). Пацієнтка ходить без додаткової опори.
Обговорення
Згідно з даними робіт різних вчених, частота інфекційних ускладнень після алотрансплантації становить від 4% до 30%, що призводить до зростання кількості ампутацій до 50%. Причини виникнення інфекційних ускладнень після алопластики є звичайними, як і після будь-якої іншої ортопедичної операції. Але поряд з цим існує кілька унікальних факторів, які характерні для хірургічних втручань з видалення пухлин. Це тривалість операції, масивна дисекція та девіталізація тканин. Також у зону дефекту імплантують великий неживий біологічний матеріал. А у разі злоякісної пухлини імунна система пацієнта значно ослаблена в результаті впливу поліхіміотерапії. Усі ці фактори підвищують ризик виникнення інфекційних ускладнень [12, 13, 14]. Додатковими чинниками, які спричиняють виникнення інфекційних ускладнень, можуть бути: неадекватне закриття трансплантата м’якими тканинами, формування післяопераційної гематоми в ділянці трансплантації, потреба в наступних операціях, проведення післяопераційних поліхіміотерапії та променевої терапії.
Важливим для прогнозування розвитку несправжнього суглоба є тип з’єднання між донорською кісткою та кісткою реципієнта. R. Capanna визначив три основні типи з’єднання як базові: корково-корковий, корково-губчастий та губчасто-губчастий. Він встановив 50% корково-коркових зрощень, 91% — корково-губчастих та усіх губчасто-губчастих з’єднань за умов післяопераційної поліхіміотерапії. Відомо, що у разі щільного контакту між зіставленими фрагментами в корковому шарі діафіза кістки частота зрощень збільшується. Якщо розмір щілина перевищує 1 мм, частота зрощення значно зменшується. Клінічні дослідження показали, що для кращого зрощення потрібно застосовувати ригідну фіксацію. Також для стабілізації використовують накісткові пластини та інтрамедулярні фіксатори. Але частота переломів алотрансплантатів зростає після фіксації пластиною. З іншого боку, інтрамедулярна фіксація, навіть із проксимальним та дистальним замками, може не забезпечити адекватних умов для зрощення [15].
Оскільки зрощення трансплантата з кісткою є досить тривалим, для його прискорення пацієнтові необхідно вести активний спосіб життя. Процес зрощення може тривати від 3 до 9 міс після операції. Якщо хворий продовжує отримувати поліхіміотерапію, цей термін може збільшуватися [16].
Деколи після імплантації комбінації «алотрансплантат — ендопротез» також може статися резорбція кістки чи патологічний перелом [17, 18]. Тому часто проводять цементування протеза всередині алотрансплантата перед імплантацією. Усі переломи алотрансплантатів — складна проблема для онкологічних пацієнтів. Тому суворе дотримання правил імплантації алотрансплантата та методів фіксації дозволяє знизити ризик виникнення таких ускладнень. R. Windhager доповів про добрі результати лікування переломів алотрансплантата у 80% пацієнтів [19, 20].
Таким чином, удосконалення методики алокомпозитного ендопротезування має на меті покращення результатів використання даного виду хірургічного втручання та зменшення відсотка ускладнень.
Висновки
Біореконструкція сегментарних післярезекційних дефектів довгих кісток сприяє відновленню кісткової тканини та м’яких тканин, що її оточують.
Поєднання методик кісткової пластики та ендопротезування або металевої фіксації кісткових фрагментів дає змогу уникнути ускладнень, що викликають кожен із цих видів втручань окремо та покращити функціональні результати лікування онкологічних хворих.
Розробка та удосконалення методик хірургічного лікування пацієнтів зі злоякісними пухлинами кісток дозволяє застосовувати на практиці найбільш ефективні види лікування та підвищити якість життя даної категорії хворих.
Список використаної літератури
1. Bullens, P. H. J., de Waal Malefisit, M. C., Schrender, H.W.B. (2009). Survival of massive allografts in segmental oncological bone defect reconstructions. International Orthopaedics (SICOT), 33, 757–760. doi: 10.1007/s00264-008-0700-2.
2. Temple, H. T., Kuklo, T. R., Lehman, Jr R. A., Heekin, R. D., Berrey, B. H. (2000) Segmental limb reconstruction after tumor resection. Am J Orthop., 29(7), 524–529. Retrieved from http://pubmed.ncbi.nlm.nih.gov/10926402/
3. Ruggieri, P., Bosco, G., Pala, E., Errani, C., Mercuri, M. (2010) Local recurrence, survival and function after total femur resection and megaprosthetic reconstruction for bone sarcomas. Clin Orthop Relat Res., 468(11), 2860–2866. doi: 10.1007/s11999-010-1476-4.
4. Tan, P. K., Tan, M. H. (2009) Functional outcome study of mega-endoprosthetic reconstruction in limbs with bone tumour surgery. Ann Acad Med Singapore, 38(3), 192–196. Retrieved from https://link.springer.com/article/10.1007/s00402-012-1542-3
5. Вирва, О. Є., Головіна, Я. О., Малик, Р. В., Головіна, О. О. (2020). Системний огляд і метааналіз результатів модульного й алокомпозитного ендопротезування за умов кістково-суглобових дефектів після резекції пухлини. Ортопедія, травматологія і протезування, 2, 5–15. doi: 10.15674/0030-5987202025-15
6. Gharedaghi, M., Peivandi, M. T., Mazloomi, M., Shoorin, H. R., Hasani, M., Seyf, P., Khazaee, F. (2016). Evaluation of clinical results and complications of structural allograft reconstruction after bone tumor surgery. Arch Bone Joint Surg., 4(3), 236–242. Retrieved from https://pubmed.ncbi.nlm.nih.gov/27517069/
7. Sandoval, P. P., Lizaur‑Utrilla, A., Trigueros‑Rentero, M. A., Lopez‑Prats, F. A. (2019). Mid- to long-term results of allograft–prosthesis composite reconstruction after removal of a distal femoral malignant tumor are comparable to those of the proximal tibia. Knee Surgery, Sports Traumatology, Arthroscopy, 27, 2218–2225. doi:/10.1007/s00167-018-5110-4.
8. Корж, Н. А., Кладченко, Л. А., Малышкина, С. В. (2008). Имплантационные материалы и остеогенез. Роль оптимизации и стимуляции в реконструкции кости. Ортопедия, травматология и протезирование, 4, 5–14.
9. Bian, D. J., Larousserie, F., Thevenin, F. (2010). Results of 32 allograft-prosthesis composite reconstructions of the proximal femur. Clin. Orthop. Relat. Res., 468, 834–845. doi: 10.1007/s11999-009-1132-z
10. Hornicek, F. J., Gebhardt, M. C., Tomford, W. W., Sorger, J. I., Zavatta, M., Menzner, J. P., Mankin, H. J.(2001). Factors affecting nonution of the allograft-host junction. Clin. Orthop. Relat. Res., 382, 87–98. Retrieved from https://journals.lww.com/clinorthop/Fulltext/ 2001/01000/Factors_Affecting_Nonunion_ of_the_Allograft_Host.14.aspx
11. Mankin, H. J., Hornicek, F. J., Raskin, K. A. (2005). Infection in massive bone allografts. Clin. Orthop. Relat. Res., 432, 210–216. doi: 10.1097/01.blo.0000150371.77314.52
12. Colyer, R. A., Capello, W. N. (1994) Surgical treatment of the infected hip implant. Two-stage reimplantation with a one-month interval. Clin. Orthop. Relat. Res., 298, 75–79. Retrieved from https://journals.lww.com/clinorthop/ Abstract/1994/01000/Surgical_Treatment_ of_the_Infected_Hip_Implant_.12.aspx
13. Grimer, R. J., Belthur, M., Chandrasekar, C., Carter, S. R., Tillman, R. M. (2005). Two-stage revision for infected endoprostheses used in tumor surgery. Clin. Orthop. Relat. Res., 395, 193–203. doi: 10.1097/00003086-200202000-00022.
14. Jung Jochen, Schmid Nora Verena, Kelm Jens, Schmitt Eduard, Anagnostakos Konstantinos. (2009). Complications after spacer implantation in the treatment of hip joint infections. Int. J. Med Sci., 6 (5), 265–273. doi:10.7150/ijms.6.265
15. Capanna, R., Donati, D., Masetti, C., Manfrini, M., Panozzo, A., Cadossi, R., Campanacci, M. (1994). Effect of electromagnetic fields on patients undergoing massive bone graft following bone tumor resection: a double blind study. Clin. Orthop. Relat. Res., 306, 213–221. Retrieved from https://journals.lww.com/corr/Abstract/1994/09000/Effect_of_Electromagnetic_ Fields_on_Patients.30.aspx
16. Berrey, Jr. B. H.., Lord, C. F., Gebhardt, N. I. C., Mankin, H. J. (1990). Fractures of allografts: frequency, treatment and end-results. J. Bone Joint Surg. Am., 72, 825–833. doi:10.2106/00004623-199072060-00005
17. McGoveran, B. M., Davis, A. M., Gross, A. E., Bell, R. S. (1999). Evaluation of the allograftprosthesis composite technique for proximal femoral reconstruction after resection of a primary bone tumour. Can J Surg., 42(1), 3716. Retrieved from http://canjsurg.ca/wp-content/uploads/2014/03/42-1-37.pdf
18. Вырва, О. Е., Головина, Я. А., Малык, Р. В. (2015). Аллокомпозитное эндопротезирование при хирургическом лечении пациентов со злокачественными опухолями длинных костей (обзор литературы) Ортопедия, травматология, протезирование, 2, 120–126. doi: https://doi.org/10.15674/0030-598720152120-125
19. Kotz, R., Schiller, C., Windhager, R., Ritschl, P. (1991). Limb salvage: major reconstructions in oncologic and nontumoral conditions. Berlin-Heidelberg-New York.: Springer-Verlag, 99, 591–599. Retrieved from https://www.springer.com/gp/book/9783642758812
20. Wang, J., Temple, H. T., Pitcher, J. D., Mounasamy, V., Malinin, T. I., Scully Sean, P. (2006). Salvage of failed massive allograft reconstruction with endoprosthesis. Clin. Orthop. Relat. Res., 443, 296–301. doi: 10.1097/01.blo.0000194071.40892.ab.
УСОВЕРШЕНСТВОВАНИЕ МЕТОДИКИ АЛЛОКОМПОЗИТНОГО ЭНДОПРОТЕЗИРОВАНИЯ
ГУ «Институт патологии позвоночника и суставов имени профессора М.И. Ситенко АМН Украины», Харьков
Резюме. Цель. Изучение биореконструкции длинной кости, пораженной опухолью, уменьшение процента осложнений при аллокомпозитном эндопротезировании. Материалы и методы. Усовершенствовано три методики сегментарной костной аллопластики пострезекционных дефектов длинных костей, проведена апробация разработанных методик. Первая методика — замещение пострезекционного дефекта нижней трети большеберцовой кости артикулирующим аллоимплантатом, вторая методика — аллокомпозитное эндопротезирование верхней трети бедренной кости после удаления опухоли, третья методика — замещение пострезекционного дефекта диафизарной части длинной кости сегментарным аллоимплантатом. Результаты. Данные методики были применены у 7 больных (5 мужчин и 2 женщин) со злокачественными опухолями длинных костей. В результате наблюдения за пациентами отмечались следующие осложнения: ишемический некроз мягких тканей — 1 случай; рецидив опухоли, который привел к ампутации конечности — 1 пациент. Во всех случаях отмечалось сращение аллоимплантата и кости реципиента в сроки наблюдения от 6 до 12 мес. Средний срок наблюдения за пациентами на момент публикации данной статьи составил от 1 мес до 1 года. Общее количество осложнений составило — 2 случая (28,5%) (по E.R. Henderson.). Среди них механические (переломы конструкций, аллоимплантатов) — 0, инфекционных — 0, рецидив опухоли — 1 случай (14%), ишемический некроз мягких тканей в зоне оперативного вмешательства — 1 пациент (14%). Функциональные результаты в среднем составили согласно шкале MSTS — 71 ± 14% (min — 45%, max — 76%), шкале TESS — 73±16% (min — 48%, max — 80%). Выводы. Биореконструкция сегментарных пострезекционных дефектов длинных костей способствует восстановлению костной ткани и окружающих мягких тканей. Разработка и усовершенствование методик хирургического лечения пациентов со злокачественными опухолями длинных костей позволяет применять на практике наиболее эффективные виды лечения и повысить качество жизни данной категории больных.
Ключевые слова: злокачественные костные опухоли; саркома кости; костный аллоимплантат; хирургическое лечение; аллокомпозитное эндопротезирование.
Адреса:
Головіна Яніна
61024 Харків, вул. Пушкінська, 80
ДУ «Інститут патології хребта та суглобів ім. професора М. І. Ситенка НАМН України»
E-mail: dr.yanina.golovina@gmail.com
Correspondence:
Yanina Golovina
80 Pushkinskaya str., Kharkiv 61024
Sytenko Institute of Spine and Joint Pathology
E-mail: dr.yanina.golovina@gmail.com














Leave a comment