Індивідуалізація хіміотерапії у хворих на остеосаркому залежно від ангіографічних критеріїв прогнозу лікувального патоморфозу
Дедков А.Г.1, Бойчук С.И.1, Югринов О.Г.1, Грабовой А.Н.1, Вырва О.Е. 2, Ковальчук П.А.1, Новак Е.М.1, Головина О.А.2
- 1Національний інститут раку, Київ
- 2ГУ «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко НАМНУ», Харьков
Резюме. Досліджено результати комбінованого лікування 47 хворих на остеосаркому високого ступеня злоякісності (стадія ІІБ). У схему терапії включено метотрексат — 12 г/м2, цисплатин — 120 мг/м2 (внутрішньоартеріально), доксорубіцин — 75 мг/м2, іфосфамід — 8 г/м2. За допомогою ангіографічних критеріїв вдалося спрогнозувати несприятливий перебіг захворювання, інтенсифікувати неоад’ювантну хіміотерапію, індивідуалізувати тривалість курсів, покращити лікувальний патоморфоз та результати лікування хворих. Інтенсифікація неоад’ювантної хіміотерапії в групі хворих високого ризику в 37,5% випадків привела до підвищення ступеня лікувального патоморфозу. Високий ступінь лікувального патоморфозу досягнуто у 72,3% хворих. Двохрічна загальна виживаність становила 97,13±2,49%, безрецедивна — 87,23±4,90%.
 Вступ
Вступ
Первинні злоякісні новоутворення кісток зустрічаються переважно у дітей та осіб молодого працездатного віку. Згідно з даними Національного канцер-реєстру України, показник захворюваності на саркоми кісток та суглобів в Україні становить 1,3 на 100 тис. населення [1].
Основним методом лікування хворих на остеосаркому (ОС) високого ступеня злоякісності є комбінований, що складається з неоад’ювантної терапії, хірургічного органозберігаючого втручання та ад’ювантної терапії [2, 12, 16]. Перелік цитостатиків, що використовуються при ОС досить обмежений і давно відомий, а одним із перспективних напрямів покращення результатів лікування ОС є індивідуалізація схем хіміотерапії (ХТ) залежно від виявлених факторів прогнозу перебігу захворювання [3, 8, 10, 14].
Неоад’ювантна терапія хворих на саркоми кісток ґрунтується на цитостатичній дії хіміотерапевтичних агентів, що може посилюватися при внутрішньоартеріальному введенні з використанням рентгеноваскулярної технології [6, 18]. При внутрішньоартеріальній ХТ первинною мішенню хімічних агентів є патологічні судини самої пухлини. На думку деяких авторів, ангіогенез в пухлинній тканині прямо пропорційно залежить від ступеня її експансії та агресії. При ангіографічному дослідженні патологічні судини чітко візуалізуються, що дозволяє оцінити ступінь розвитку неоваскуляризації і передбачити підходи для використання засобів і методів локальної деструкції пухлини [4, 7, 17]. Сформульовано ангіографічні критерії оцінки неоваскуляризації, яка є головною складовою в характеристиці лікувального патоморфозу [18].
Динаміка ступеня васкуляризації в процесі неоад’ювантної ХТ може використовуватися для прогнозування ступеня лікувального патоморфозу. Є припущення, що ангіографічні ознаки неоваскуляризації пухлини корелюють з отриманим лікувальним патоморфозом і тому можуть застосовуватися для оцінки ефективності цитостатичної терапії первинних пухлин кісток [17, 18]. Можливість спрогнозувати ступінь лікувального патоморфозу дозволяє індивідуалізувати лікування і досягти максимальної відповіді пухлини на неоад’ювантну ХТ. Головним завданням неоад’ювантної терапії є створення умов для можливості радикального видалення з мінімальними негативними наслідками для пацієнта [9–11]. Розробка та впровадження ефективних методик неоад’ювантної та ад’ювантної терапії в схемах комбінованого лікування дозволяє суттєво поліпшити його результати [13, 15].
Метою дослідження було покращення ефективності комбінованого лікування шляхом інтенсифікації ХТ у хворих на ОС з прогностично несприятливим прогнозом перебігу захворювання.
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
Об’єктом дослідження стали 47 хворих на ОС високого ступеня злоякісності (стадія IIБ), пролікованих у 2009–2012 рр., у віці від 18 до 63 років (середній вік — 30,6±1,8 року). Осіб чоловічої статі було 24 (51%), жіночої — 23 (49%).
У 24 (51,06%) хворих пухлина локалізувалася у дистальному відділі стегнової кістки, у проксимальному відділі стегнової кістки — у 2 (4,2%), проксимальному відділі великогомілкової кістки — у 14 (29,78%), дистальному відділі великогомілкової кістки — у 2 (4,2%), проксимальному відділі плечової кістки — у 3 (6,38%), кістках таза — у 2 (4,2%) хворих.
Хворим на ОС високого ступеня злоякісності неоад’ювантну ХТ проводили за встановленою схемою з використанням 3 препаратів першої лінії терапії (метотрексат (МТХ) — 12 г/м2, цисплатин — 120 мг/м2, доксорубіцин — 60 мг/м2). За результатами ангіографії, перед початком першого курсу ХТ проводився аналіз динаміки рівня пухлинної неоваскуляризації. Рівень пухлинної неоваскуляризації оцінювали за 3 ступенями: 1-й — помірний, 2-й — незначний, 3-й — значний, що визначалися за інтенсивністю судинної сітки (кількістю судин на одиницю площі). Після оцінки відповіді пухлини на стандартну неоад’ювантну терапію прогнозували ступінь лікувального патоморфозу і пацієнтів розподіляли на 2 групи: з прогнозовано високим (1-ша група) або низьким (2-га група) ступенем патоморфозу. У 1-ї групи хворих застосовували лікування за стандартною схемою.
Друга група хворих продовжувала отримувати неоад’ювантну ХТ в інтенсивному режимі, що полягав у підвищенні дози цисплатину до 150 мг/м2 і пролонгованому його внутрішньоартеріальному введенні, а також у заміні МТХ на іфосфамід (8 г/м2).
В обох групах мало місце радикальне хірургічне втручання, після якого оцінювали фактичний лікувальний патоморфоз. На цьому етапі спрогнозований ступінь лікувального патоморфозу зіставляли з фактичним і аналізували специфічність ангіографічних ознак як критеріїв прогнозу ступеня лікувального патоморфозу. Специфічність розробленої методики прогнозування лікувального патоморфозу визначали за формулою:
Ч = (ІПЗ + ІНЗ)/(ХНЗ + ХПЗ + ІПЗ + ІНЗ) × 100%,
де ІПЗ — істинно позитивні заключення; ІНЗ — істинно негативні заключення; ХНЗ — хибно негативні заключення; ХПЗ — хибно позитивні заключення.
Лікувальний патоморфоз оцінювали за критеріями Huvos. Після хірургічного лікування пацієнти обох груп отримували ад’ювантну терапію препаратами, що використовувалися в неоад’ювантному режимі (1-ша група — 3 препарати, 2-га група — 4).
При встановленні у 1-й групі розбіжності спрогнозованого і фактично встановленого лікувального патоморфозу, тобто отримані низького ступеня лікувального патоморфозу, пацієнти переходили на режим ад’ювантної терапії 2-ї групи.
Контрольну групу становили 62 хворих з ОС довгих кісток , що отримували лікування у відділенні пухлин опорно-рухового апарату з 2004 по 2009 р. (історичний контроль). У схемі лікування застосовувалися ті ж цитостатики, але неоад’ювантна терапія проводилася за стандартною схемою без виділення групи високого ризику на цьому етапі.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
У 47 хворих, що закінчили лікування, оцінено відповідь пухлини на стандартну неоад’ювантну терапію шляхом аналізу динаміки рівня пухлинної неоваскуляризації за допомогою ангіографічного дослідження судинної строми пухлини та порівняння з клінічними та радіологічними даними. Усіх досліджуваних пацієнтів (n=47) було розподілено на 2 групи: з прогнозовано високим — 39 хворих (82,98%) та прогнозовано низьким ступенем патоморфозу — 8 хворих (17,02%). З 8 пацієнтів, що проходили неоад’ювантну ХТ з прогнозовано низьким ступенем патоморфозу (високий ризик), 2 (4,25%) мали первинний осередок ураження в кістках таза.
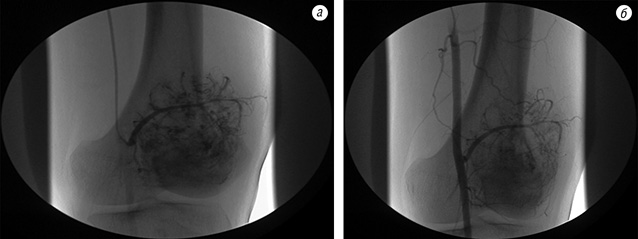
Після неоад’ювантної ХТ в 40 випадках (85,1%) під час контрольної рентгенографії в динаміці було встановлено зменшення розмірів м’якотканинного компонента, склерозування і більш чітке відмежування пухлини від навколишніх тканин (рис. 1). На ангіограмах відзначали значне зменшення неоваскуляризації пухлини (рис. 2).
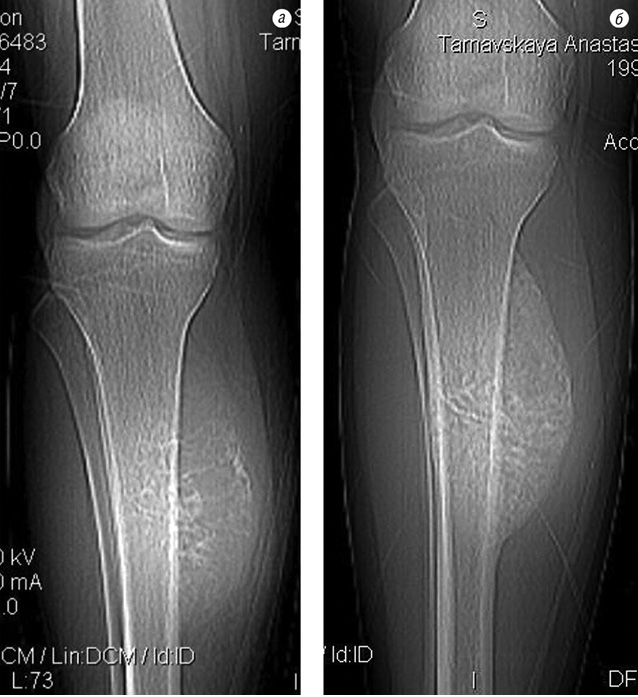
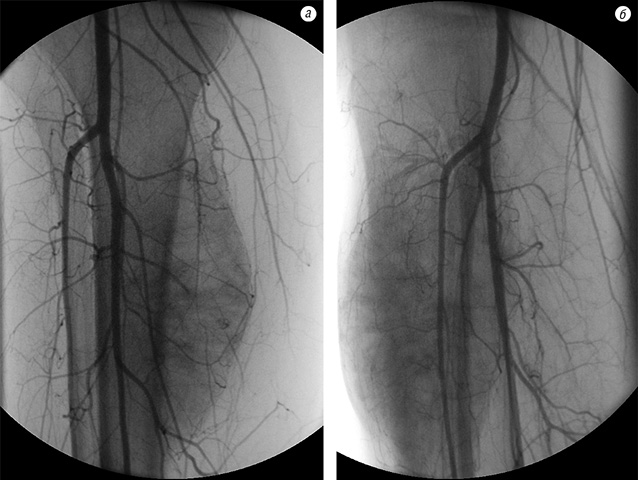
Під час допплер-УЗД визначалися підвищення ехогенності пухлини, зменшення кількості судин, які живлять пухлину, та розмірів м’якотканинного компонента; під час комп’ютерної томографії — зменшення об’єму пухлини від 17,4 до 63,0%.
У 8 пацієнтів (17,02%) після проведеного неоад’ювантного лікування за даними ангіографії відзначали помірне зменшення або стабільний рівень неоваскуляризації пухлини. Цим хворим проведено неоад’ювантну терапію за інтенсифікованою схемою.
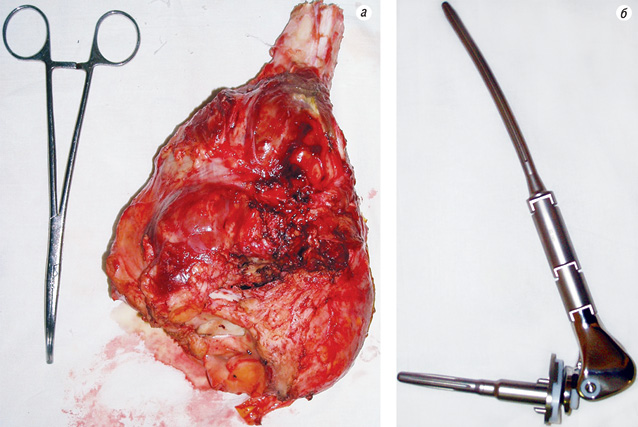
Після неоад’ювантного лікування хірургічний етап пройшли всі 47 хворих, із них у 43 (91,48%) виконано органозберігаючі хірургічні втручання, а у 4 (8,51%) (з групи високого ризику) — операції з видаленням органа (табл. 1). (Хірургічні втручання з видаленням органа проведено при первинному місцево-розповсюдженому процесі, при якому не було можливості провести радикальні органозберігаючі операції).
Таблиця 1 Розподіл хворих на ОС за обсягом хірургічного втручання
| Обсяг хірургічного втручання | Кількість хворих, n |
|---|---|
| Резекція кістки з пухлиною + ендопротезування колінного суглоба | 32 |
| Резекція кістки з пухлиною + ендопротезування тазостегнового суглоба | 4 |
| Резекція кістки з пухлиною + ендопротезування гомілково-ступневого суглоба | 4 |
| Екзартикуляція | 1 |
| Ампутація | 3 |
| Резекція кістки з пухлиною + ендопротезування плечового суглоба | 3 |
| Усього | 47 |
Після хірургічного етапу лікування спрогнозований ступінь лікувального патоморфозу порівнювали з фактичним і аналізували специфічність ангіографічних ознак як критеріїв прогнозу ступеня лікувального патоморфозу. Лікувальний патоморфоз досліджено у всіх пролікованих хворих досліджуваної групи після хірургічного втручання (табл. 2). У 34 випадках (72,34%) досягнутий високий ступінь лікувального патоморфозу (вище 90% некрозів пухлини). У 42 пацієнтів спрогнозований патоморфоз збігався з фактичним. У 5 випадках фактичний лікувальний патоморфоз був низьким, незважаючи на стандартний спрогнозований ризик згідно з даними ангіографії. Серед 8 хворих, що лікувалися у групі високого ризику та пройшли хірургічний етап лікування, інтенсифікація поліхіміотерапії привела в 3 (37,5%) випадках до високого лікувального патоморфозу (III ступінь за Huvos). Тобто специфічність методу прогнозування становила 89,36%.
Таблиця 2 Розподіл хворих з урахуванням отриманого патоморфозу та групи ризику
| Об’ємна частка життєздатної пухлинної тканини | Хворі зі стандартним ризиком (n=39) |
Хворі з високим ризиком (n=8) | ||
|---|---|---|---|---|
| n | % | n | % | |
| 0% (IV ступінь за Huvos) | 14 | 35,89 | 0 | 0,0 |
| 1–10% (III ступінь за Huvos) | 20 | 51,28 | 3 | 37,5 |
| 11–40% (II ступінь за Huvos) | 5 | 12,82 | 4 | 50,0 |
| Понад 40% (I ступінь за Huvos) | 0 | 0 | 1 | 12,5 |
| Усього | 39 | 100,0 | 8 | 100,0 |
Проведені гістологічні дослідження показали, що пухлини кісток у пацієнтів обраної групи характеризуються значною клітинною атипією й, відповідно, низьким рівнем диференціювання. Основу пухлини становить досить щільна маса клітин з незначною кількістю міжклітинної речовини (рис. 3). Для цих пухлин характерна наявність помірної кількості кровоносних мікросудин. Їх стінка утворена ендотелієм, зовні від якого розташовані лише поодинокі клітини фібробластичного ряду.
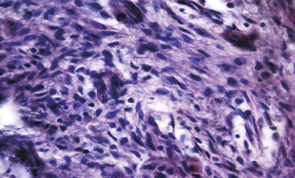
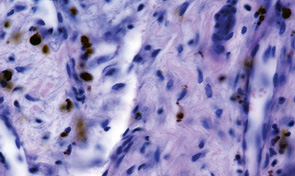
Проведення неоад’ювантної ХТ в 37 (78,72%) випадках привело до редукції пухлинної тканини майже у повному обсязі, а в 14 з них життєздатні елементи паренхіми пухлини не виявлялися. При цьому спостерігалися осередки некрозів, мікрокрововиливи, але провідними були явища фіброзу та реактивного остеогенезу. Пухлина заміщувалася фіброзною тканиною із більшими чи меншими осередками новоутворення кісткових балок (рис. 4). Зникали клітини з різко зміненими ядрами. У пухлині з’являлися, окрім осередків некрозу, й ділянки фіброзування. Кровоносні судини набували більш «зрілого» вигляду, у них часто можна було розрізнити адвентицію та гладкі міозити.
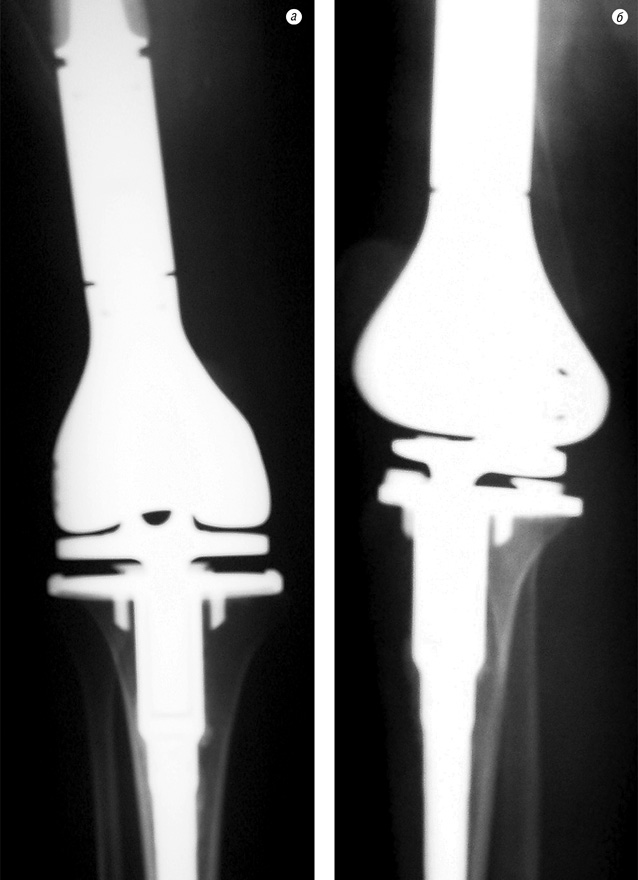
На рис. 5–7 продемонстровано клінічний приклад хворого з групи високого ризику на етапах лікування.
Клінічний приклад
Пацієнтка Ф. (34 роки) поступила в клініку зі скаргами на біль, наявність пухлини в нижній третині правого стегна. Діагностовано ОС дистального епіметафіза правої стегнової кістки в стадії IIB. На етапі неоад’ювантного лікування за даними ангіографічного дослідження в динаміці відмічено помірне зниження неоваскуляризації (див. рис. 5). Хвора переведена в групу високого ризику. Завдяки інтенсифікації ХТ вдалось досягнути стабілізації пухлинного процесу та провести органозберігаюче хірургічне лікування в обсязі резекції дистального відділу правої стегнової кістки з ендопротезуванням колінного суглоба (див. рис. 6–7). Лікувальний патоморфоз II ступеня за Huvos. Післяопераційний період протікав без ускладнень. Хвора закінчила ад’ювантне лікування. Термін спостереження — 16 міс без ознак прогресування хвороби.
У 2 хворих із групи високого ризику відзначено прогресування захворювання на етапі лікування з розвитком віддалених метастазів. Метастази в легені виявлено ще у 4 (8,51%) хворих після закінчення лікування (у 2 — з групи стандартного ризику) в строки від 12 до 28 міс від початку лікування (у середньому 16±2,3 міс). 2-річна загальна виживаність в основній групі становила 97,13±2,49%, а безрецедивна — 87,23±4,90%. У контрольній групі ці показники були такими: 95,16±2,80% та 79,03±5,17% (p>0,05) відповідно. Різниця статистично недостовірна, але простежено позитивну динаміку зростання безрецедивної виживаності.
ВИСНОВКИ
1. Відзначено корелятивну залежність ступеня неоваскуляризації після проведення ХТ за ангіографічними даними та лікувального патоморфозу. Специфічність методу прогнозування становила 89,36%.
2. Інтенсифікація ХТ у групі хворих високого ризику в 37,5% випадків привела до підвищення ступеня лікувального патоморфозу.
ЛІТЕРАТУРА
1. Федоренко З.П., Гайсенко А.В., Гулак Л.О. та ін. (2012) Бюлетень Національного Канцер-реєстру України № 13/ під ред. І.Б. Щепотіна. К.: 130 с.
2. Мачак Г.Н. (2007) Современные возможности и перспективы комбинированного лечения остеосаркомы. Автореферат диссертации д-ра мед. наук. М.: 48с. .
3. Трапезников Н.Н., Алиев М.Д., Мачак Г.Н. и др. (2000) Современные взгляды на проблему лечения остеосаркомы конечностей. Казан. Мед. Журн., 81(4): 317–318.
4. Bacci G., Ferrari S., Tienghi A. et al. (2010) A comparison of methods of loco-regional chemotherapy combined with systemic chemotherapy as neoadjuvant treatment of osteosarcoma of the extremity. Eur. J. Surg. Oncology, 27: 98–104.
5. Bacci G., Forni C., Longhi A. et al. (2007) Local recurrence and local control of non-metastatic osteosarcoma of the extremities. A 27-year experience in a single institution. J. Surg. Oncol., 96: 118–123.
6. Chiu T.I., Wany I.W., Chen Y. I. (2009) Intraarterial Cisplatin and intravenous adriamycin in nonmetastatic osteosarcoma at the extremities: a single institution experience in Tainan. Chang Yung. Med. I., 32: 72–80.
7. Hugate R.R., Wilkins R.M., Cynthia M.K. et al. (2008) Intraarterial Chemotherapy for Extremity Osteosa Adults. Clin. Orthop. Relat Res.: 1292–1301.
8. Kalifa C., Bellon N., Dupouy N. et al. (2002) Comparison of doxorubicin (DOXO) versus etoposide-ifosfamide (ETO-IFO) in addition to high-dose methotrexate (HD MTX) as preoperative chemotherapy in osteosarcoma (OS): A randomized trial by the SFOP.
9. Longhi A., Ferrari S., Ferrari C. et al. (2006) Late side effects of osteosarcome neoadjuvant chemotherapy: The experience at Rizzoli institute. J. Clin. Oncol., 24: 9508–9513.
10. Bacci G., Briocoli M. et al. (2003) Neoadjuvant chemotherapy for osteosarcoma of the extremities with metastases at presentation: recent experience at the Rizzoli Institute in 57 patients treated with cisplatin, doxorubicin, and a high dose of methotrexate and ifosfamide. Ann. Oncology, 14: 1126–1134.
11. Bacci G., Mercuri M., Lonhi A. et al. (2004) Neoadjuvant chemotherapy for the treatment of osteosarcoma of the extremities: a comparison of results obtained in single-institution and multicenter trials. Chir. Organi Mov., 89: 283–292.
12. Meyers P.A., Schwartz C.L., Krailo M. et al. (2005) Osteosarcoma: a randomized, prospective trial of the addition of ifosfamide and/or muramyltripeptide to cisplatin, doxorubicin, and high-dosemethotrexate. Ibid., 9: 2004–2011.
13. Massimo B., Giovanni G., Stefano F. et al. (2009)Phase 2 trial of two courses of cyclophosphamide and etoposide for relapsedhigh-risk osteosarcoma patients. Ibid., 115(13): 2980–2987.
14. Bacci G., Longi A., Versari M. et al. (2006) Prognostic factors for osteosarcoma of the extremity treated with neoadjuvant: 15-year experience in 789 patients treated at single institution. Cancer, 106(5): 1154–1161.
15. Schwartz S., Muller K., Fisher L. et al. (2005) Favorable outcome in excessive methotrexate (MTX) intoxication after high-dose (HD) MTX therapy by early use of carboxypeptidase G2 (CPG2). Journal of Clinical oncology, 2005 ASCO. An Meet Proc; 23 (16S): (Suppl) 8255.
16. Scott M.S. (2007) Chemotherapy in the Management of Osteosarcoma and Ewing’s Sarcoma. J. Natl. Compr. Canc. Netw., 5: 449–455.
17. Cullen J.W., Jamroz B.A., Stevens S.L. et al. (2005) The value of serial arteriography in osteosarcoma: delivery of therapy duration, and prediction of necrosis. J. Vascular Inter. Radiol.,16: 1107–1119.
18. Veda T., Nana N., Araki N. et al. (2008) Validation of radiographic evaluation criteria of preoperative chemotherapy for bone and soft tissue sarcomas: Japanese Orthopaedic Association Committee on Musculoskeletal Tumors Cooperative Study. I. Orthop. Sci.: 304–312.
Индивидуализация химиотерапии у больных остеосаркомой в зависимости от ангиографических критериев прогноза лечебного патоморфоза
2ГУ «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко НАМН Украины», Харьков
Резюме. Исследованы результаты комбинированного лечения 47 больных остеосаркомой высокой степени злокачественности (стадия ІІБ). В схему терапии был включен метотрексат — 12 г/м², цисплатин — 120 мг/м² (внутриартериально), доксорубицин — 75 мг/м², ифосфамид — 8г/м². С помощью ангиографических критериев удалось спрогнозировать неблагоприятное течение заболевания, интенсифицировать химиотерапию, индивидуализировать количество курсов, улучшить лечебный патоморфоз и результаты лечения. Интенсификация неоадьювантной химиотерапии в группе больных высокого риска в 37,5% привела к повышению степени лечебного патоморфоза. Высокая степень лечебного патоморфоза получена у 72,3% больных. Двухлетняя общая выживаемость составила 97,13±2,49%, безрецидивная — 87,23±4,90%.
Ключевые слова: остеосаркома, неоадъювантная химиотерапия, агнгиографические критерии прогноза, лечебный патоморфоз.
The individualisation of chemotherapy in patients with osteosarcoma depending on angiographic criteria of the treatment pathomorphosis
2«The M.I. Sitenko’s Institute of Vertebral and Joint’s Pathology NAMS of Ukraine», Harkiv
Summary. The results of combined treatment of 47 patient’s with high grade osteosarcoma (stage IIB) were examined. The Methotrexate (12 g/m2), Cisplatin (120 mg/m2 intraarterial), Doxorubicin (75 mg/m2) and Ifosfamide (8 g/m2) were included in the treatment scheme. Using the angiographic criteria we could prognose the poor disease course, to intensify individual chemotherapy, to improve the treatment pathomorphosis and treatment results. Due to the intensification of chemotherapy in high-risk group of patients we have received improvement of the treatment pathomorfosis in 37,5%. We received the high treatment pathomorphosis in 72,3% of patients. The 2-years overall survival was 97,13±2,49% and disease – free survival was 87,23±4,90%.
Key words: osteosarcoma, neoadjuvant chemotherapy, angiographic criteria of prognosis, treatment pathomorphosis.














Leave a comment