Деносумаб у пролонгованому лікуванні хворих на гігантоклітинну пухлину кісток
Дєдков А.Г., Костюк В.Ю. , Бойчук С.І., Максименко Б.В.
Резюме. Стандартом лікування пацієнтів з гігантоклітинною пухлиною (ГКП) є агресивний кюретаж з подальшим впливом фенолу, рідкого азоту та цементації або широка резекція ураженої частки кістки з реконструкцією. Але резекція в межах здорових тканин, а також у деяких випадках кюретаж при ураженні кісток таза або осьового скелета може призвести до серйозних ускладнень та тяжкої інвалідизації пацієнта. Для уникнення таких об’ємних втручань як альтернатива пропонується консервативне лікування з використанням деносумабу. У цьому дослідженні вивчалася можливість довгострокового використання деносумабу у разі неможливості повного видалення пухлини. У дослідження було включено 14 пацієнтів з ГКП з локалізацією в кістках таза та осьового скелета, які розпочали лікування між 2012 і 2019 роками та залишаються під спостереженням. Критеріями оцінки були термін ремісії та ускладнення. Медіана спостереження від початку введення деносумабу становила 54 міс (діапазон 16–112 міс). У 6 пацієнтів відмічали пухлину крижової кістки з ураженням S1, S2, у 5 пацієнтів — кістки таза та у 3 — хребців. Прогресування захворювання після припинення лікування деносумабом відзначено у 12 з 14 хворих (85,7%). Рецидиви захворювання у вигляді клінічних та радіологічних проявів виявлено через 3–6 міс у 9 хворих, у 3 хворих ремісія тривала від 2 до 6 років, 1 хворий мав прогресування через 2 міс. Пацієнти отримали від 13 до 60 ін’єкцій деносумабу, 12 — щомісячно при діагностуванні, а потім раз на 3 міс у якості підтримувальної терапії після появи ознак прогресування. У жодного з 14 пацієнтів не було зафіксовано злоякісної транcформації або метастазування протягом терміну лікування та спостереження, також не зафіксовано ознак остеонекрозу щелепи. Застосування деносумабу для лікування умовно неоперабельних пацієнтів з ГКП допомагає досягти довготривалої ремісії, за умови постійного введення препарату, і дає можливість уникнути каліцтва та післяопераційних ускладнень на тривалий час.
Одержано 7.12.2021
Прийнято до друку 17.12.2021
DOI: 10.32471/clinicaloncology.2663-466X.43-3.28479
Вступ
Гігантоклітинна пухлина (ГКП) — це новоутворення, схильне до агресивного літичного зростання, частих рецидивів та метастазування. Стандартним методом лікування хворих на ГКП є агресивний кюретаж з подальшим впливом фенолу, рідкого азоту та цементації або широка радикальна резекція ураженої частки кістки з реконструкцією [1, 2].
Найчастішою локалізацією ГКП є метаепіфіз довгої кістки, але ця пухлина може локалізуватися у крижах, хребцях або тазових кістках у 7–8% випадків, де резекція в межах здорових тканин може спричинити серйозні ускладнення, в результаті яких нерідко спостерігаються порушення роботи органів малого таза, інфекційні ускладнення, тривалий біль, що призводить до тяжкої інвалідності пацієнта, тривалого перебування в лікарні з дороговартісною допоміжною терапією [3, 4]. Для уникнення таких об’ємних втручань і у якості альтернативи до 2010 р. пропонувалося проводити передопераційну артеріальну емболізацію та променеву терапію [5, 6]. У березні 2010 р. в «The Lancet Oncology» було опубліковано результати застосування деносумабу (моноклонального антитіла до рецептора RANKL, активатора ядерного фактора росту) в якості системної таргетної терапії для пацієнтів з ГКП [7]. Оптимістичні результати перших випробувань деносумабу при лікуванні хворих на ГКП дали привід сподіватися на можливість безопераційної терапії таких пацієнтів. Під час подальшого опрацювання результатів цього дослідження, з’явилися серйозні докази того, що навіть успішне використання деносумабу на початку лікування призводить до підвищення частоти місцевих рецидивів та загрози злоякісної трансформації. У найбільшому клінічному дослідженні з використанням деносумабу S. Chawla еt al. повідомляли, що після прийому деносумабу у 26% пацієнтів з ГКП спостерігалися рецидиви або прогресування захворювання [8]. Метааналіз літературних даних, проведений E. Palmerini та співавторами в 2019 р., показав, що через 8–15 міс після припинення прийому деносумабу у 40% пацієнтів з неоперабельною ГКП спостерігалося прогресування пухлини [9]. Однак тривалість терапії вказаним препаратом та її наслідки і досі залишаються невизначеними, особливо стосовно неоперабельних випадків ГКП. Дослідники пропонують пожиттєво приймати деносумаб зі зниженням дози або кількості ін’єкцій та призначати його як підтримувальну терапію [9, 10].
Виходячи з того, що наша клініка з 2012 р. і до теперішнього часу використовує деносумаб у лікуванні хворих на ГКП, ми пропонуємо результати довготривалого використання деносумабу у неоперабельних або умовно неоперабельних (відмова від хірургічного лікування) пацієнтів з локалізацією ГКП у кістках таза та осьового скелета. У цьому дослідженні вивчалася доцільність довгострокового використання деносумабу за умови неможливості повного видалення пухлини.
Матеріали та методи
До дослідження було залучено 14 пацієнтів з гістологічно підтвердженою ГКП, локалізованою в кістках таза та осьового скелета, які розпочали лікування між 2012 і 2019 р. та перебувають під спостереженням у Національному інституті раку (Київ, Україна). Усім хворим проведено більше 12 ін’єкцій деносумабу. 7 із цих 14 хворих відмовилися від будь-якого хірургічного втручання внаслідок можливих інвалідизуючих ускладнень, та 7 було проведено паліативні втручання без повного видалення пухлинної тканини (табл. 1). До когорти входило 6 чоловіків та 8 жінок, середній вік — 30,1 років (діапазон 13–68 років). У 6 пацієнтів було виявлено пухлину крижової кістки з ураженням S1, S2, у 5 пацієнтів — кісток таза та у 3 — хребців.
Стадіювання хворих проводилось за М. Campanaccі [2]. В усіх пацієнтів було класифіковано ІІ–ІІІ стадію. У жодного хворого не відмічали метастазів у легеню на початку лікування. Медіана спостереження від початку введення деносумабу становила 54 міс (діапазон 16–112 міс). 7 пацієнтам з локалізацією в кістках таза та хребцях було проведено паліативні хірургічні втручання до або після перших введень деносумабу у вигляді часткових резекцій м’якотканинних компонентів (сідничні кістки) — 4 та декомпресійних ламінектомій — у 3 випадках з ураженням хребців зі стабілізацією металевим фіксатором.
Усі пацієнти отримували лікування деносумабом шляхом підшкірних ін’єкцій по 120 мг кожні 28 днів з додатковою навантажувальною дозою на 8-й день протягом першого місяця. Усім хворим призначали щоденне застосування препаратів кальцію (до 1000 мг) та вітаміну D (до 400 мг) протягом всього періоду лікування деносумабом.
Біль оцінювали відповідно до Візуально-аналогової шкали (BАШ). Оцінку проводили до початку лікування, а потім щомісяця. Ефект від лікування оцінювали за допомогою комп’ютерної томографії (КТ) та магнітно-резонансної томографії (МРТ). Під час КТ ми порівнювали об’єм та мінеральну щільність «капсули» пухлини. Моніторинг та оцінку ефективності лікування за КТ проводили кожні 3 міс. МРТ в період спостереження використовували за потреби для оцінки розмірів м’якотканинного компонента. З біохімічних аналізів контролювали показники електролітів та фосфатів.
Критеріями оцінки були термін ремісії, ускладнення. Ремісію визначали за даними клінічного обстеження: перш за все оцінювали больовий синдром і неврологічний статус, а також радіологічного — зміни на КТ та МРТ.
Результати та їх обговорення
Інтенсивний біль та порушення функціонального стану на початку лікування спостерігалися у 12 пацієнтів. У всіх хворих протягом першого місяця лікування спостерігалося зменшення вираженості болю та поліпшення функціонального стану, підвищення щільності та розвиток окостеніння в ділянці лізису кістки, у 4 пацієнтів — регресія пухлини понад 30% (рис. 1). За шкалою ВАШ середній показник болю знизився з 7,2±2,8 до 2,7±1,5 (р<0,05). Паралельно нівелювалися дизурічні розлади у пацієнтів з ГКП крижів.
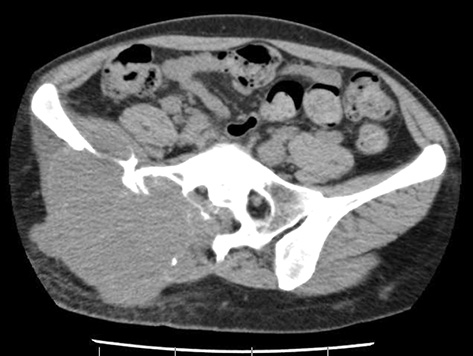
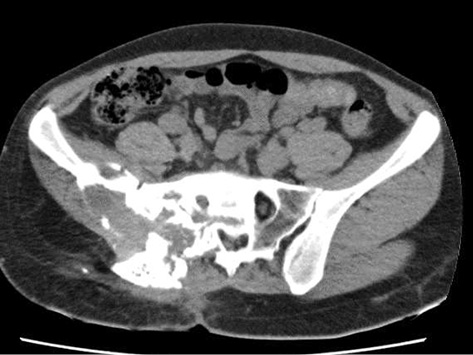
Після 12 ін’єкцій деносумабу лікування було припинено у 12 з 14 хворих. Прогресування захворювання після припинення лікування фактично відзначено у 12 (85,7%). Рецидиви хвороби у вигляді клінічних та радіологічних проявів виявлено через 3–6 міс у 8 хворих, у 1 — через 2 міс, у 3 хворих — через 24 і 72 міс. Дотепер 2 пацієнти продовжують отримувати ін’єкції деносумабу 1 раз на 3 міс після 12 ін’єкцій щомісячно, ознак прогресування у них не відмічено (табл. 1). Усього хворі отримали від 14 до 60 ін’єкцій деносумабу.
| № з/п | Вік | Стать | Локалізація | Стадія за Campa-nacci | Термін спостереження, з початку лікування деносумабом (міс) | Додаткове лікування | Загальна кількість ін’єкцій деносумабу | Термін ремісії без деносумабу (міс) |
| 1 | 18 | Ч | Сіднична | 2 | 50 | 37 | 6 | |
| 2 | 16 | Ж | Крижова (S2-3) | 2 | 66 | 24 | 4 | |
| 3 | 17 | Ж | Крижова (S1-2) | 2 | 50 | 39 | 3 | |
| 4 | 13 | Ж | Крижова (S2-3) | 2 | 54 | 40 | 4 | |
| 5 | 17 | Ж | Крижова (S1-2) | 2 | 101 | 25 | 5 | |
| 6 | 68 | Ч | Крижова (S1-3) | 3 | 18 | 14 | 5 | |
| 7 | 66 | Ч | Сіднична | 3 | 100 | ЧР+ ПТ+емб. | 18 | 72 |
| 8 | 31 | Ч | Сіднична | 3 | 37 | ЧР+емб. | 32 | 2 |
| 9 | 33 | Ж | Клубова | 3 | 112 | ЧР+ПТ+емб. | 60 | 25 |
| 10 | 28 | Ж | L2 | 2 | 40 | ДЛЕ | 28 | 4 |
| 11 | 16 | Ж | С6 | 2 | 36 | ДЛЕ | 19 | 5 |
| 12 | 30 | Ж | Сіднична | 3 | 109 | ЧР | 43 | 24 |
| 13 | 38 | Ч | L4 | 2 | 14 | ДЛЕ | 15 | |
| 14 | 30 | Ч | Крижова (S1-2) | 2 | 13 | 16 |
Примітка: ЧР — часткова резекція м’якотканинного компонента, ПТ — променева терапія 40–45 Гр, ДЛЕ — декомпресійна ламінектомія, емб. — емболізація.
Додаткове лікування. 3 хворим з рецидивом проведено емболізацію судин та променеву терапію, з них у 1 відмічається довготривала ремісія (більше 6 років (72 міс) одразу після променевої терапії), а у іншого — прогресування через 8 міс, але хворий перебуває в ремісії більше 24 міс після чергового 10-кратного введення деносумабу (усього 60 введень деносумабу та 112 міс спостереження від початку лікування). Ще 1 хворий після прогресування на фоні застосування деносумабу отримав емболізацію після 2 років лікування та хірургічного втручання. Під час спроби екскохлеації — крововтрата 2500 мл. 10 хворих після підтвердження рецидиву захворювання спостерігаються і отримують підтримувальні курси деносумабу по 120 мг 1 раз на 3 міс упродовж 8–42 міс без ознак прогресування. Інтервали між введеннями деносумабу обирали індивідуально залежно від клінічних ознак повернення симптомів ГКП та гіпокальціємії.
Ускладнення відзначено у 9 пацієнтів після основного курсу деносумабу (12 ін’єкцій). Розвиток основних небажаних явищ представлено в табл. 2. Найчастіше спостерігалася відносна безсимптомна гіпокальціємія — 57,1%.
| Небажані явища | Кількість пацієнтів, n/% |
| Нудота | 2/14,3 |
| Анемія | – |
| Судоми | 1/7,1 |
| Грипозний стан більше 3 діб | 2/14,3 |
| Нейропатія | – |
| Кожний висип | 1/7,1 |
| Гіпокальціємія | 8/57,1 |
| Остеонекроз щелепи | – |
| Злоякісна трансформація | – |
Варто наголосити, що у жодного з 14 пацієнтів не було зафіксовано злоякісної транcформації або метастазування протягом терміну лікування та спостереження. Усі пацієнти проходили курс лікування без перерви з приводу ускладнень. Ми не спостерігали будь-яких гематологічних порушень або порушень функції печінки і нирок. Дотепер у жодного пацієнта не розвинулися ознаки остеонекрозу щелепи.
Клінічний випадок
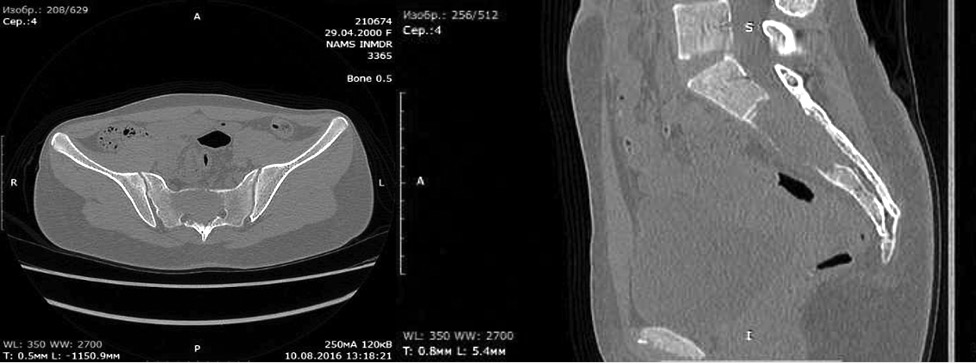
Пацієнтка О., 16 років, звернулася в Національний інститут раку зі скаргами на біль у крижах, дизуричні розлади. За даними КТ — літичне ураження хребців крижової кістки (рис. 2).
Виконано трепанобіопсію. Діагностовано гігантоклітинну пухлину S2–S3. Призначено деносумаб у дозі 120 мг підшкірно за дослідницьким протоколом. Через 3 тиж від початку лікування зникли біль та симптоми дизурії. Від хірургічного втручання хвора (родичі) відмовилася. Після 12 ін’єкцій деносумабу виявлено на КТ склерозування, осифікацію та відмежування ділянки ураження в крижовій кістці (рис. 3).
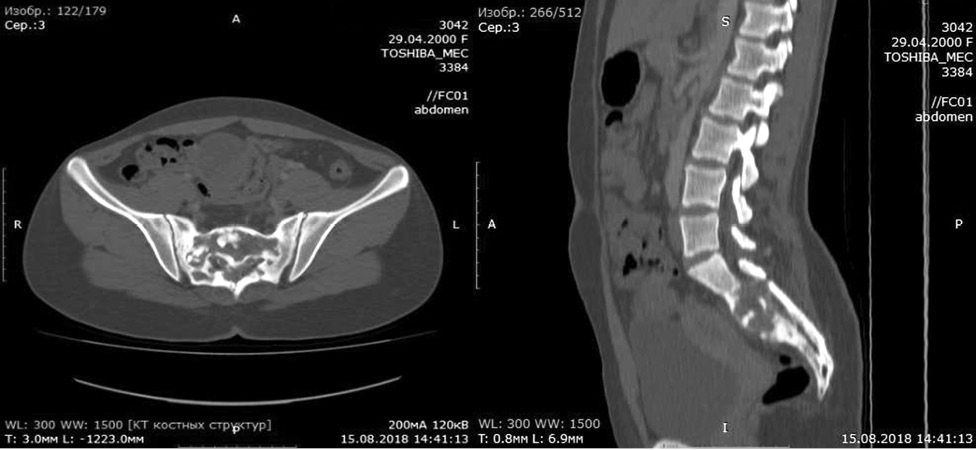
Лікування припинено. Хвора спостерігалася протягом 4 міс. На 5-й місяць спостереження відзначила відновлення больового синдрому. При КТ — лізис склеротичної «капсули», збільшення м’якотканинного компонента — пролонгація захворювання (рис. 4).
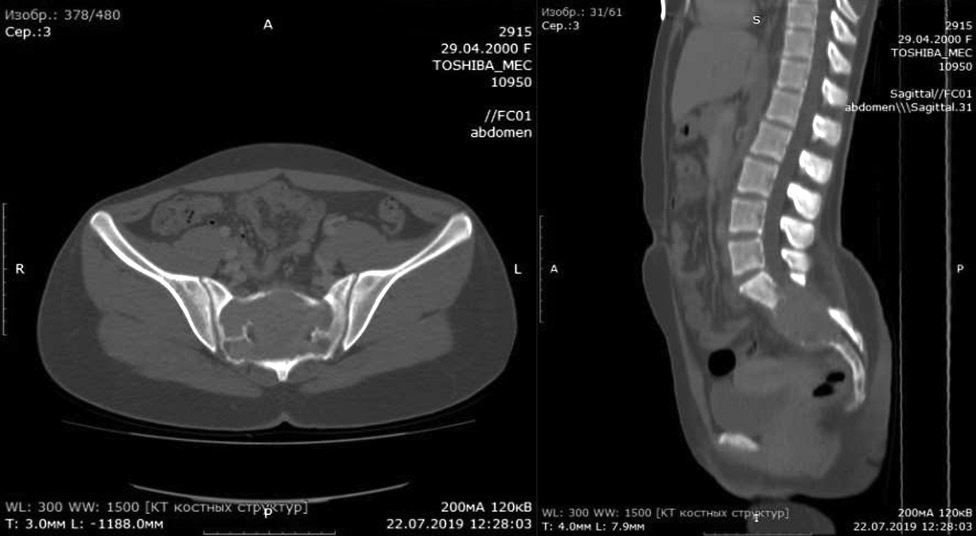
Відновлено ін’єкції деносумабу з позитивними клінічним та радіологічним ефектом. Після 6 щомісячних ін’єкцій хвору переведено на режим 1 ін’єкція в 3 міс та дотепер вона залишається під спостереженням без ознак прогресування (рис. 5)
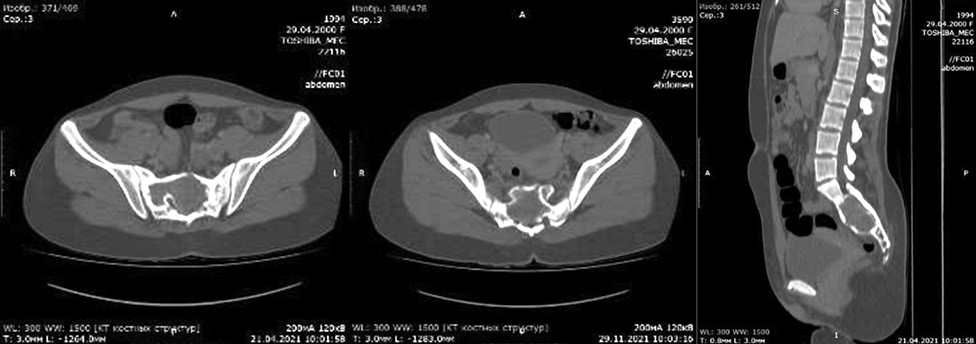
Термін спостереження становив 66 міс. Загальна кількість ін’єкцій деносумабу — 34. З ускладнень: гіпокальціємія безсимптомна, періодично незначний біль у м’язах, втомлюваність.
Таким чином, ми зафіксували ефект лікування деносумабом у всіх хворих як клінічно, так і радіологічно. Однак у всіх пацієнтів, які припинили лікування, спостерігалася пролонгація захворювання через 3–72 міс після припинення введення деносумабу. Такі спостереження оприлюднено в деяких дослідженнях, опублікованих в останні роки [9, 11, 12]. Без додаткових методик лікування при первинній терапії (променева терапія + емболізація) ремісія не перевищувала 6 міс. Досвід додавання променевої терапії в нашому дослідженні підтверджує необхідність застосування допоміжних методів лікування хворих на ГКП. У роботі S. Tsukamoto та співавторів повідомляється про високі ризики можливої злоякісної трансформації ГКП під впливом променевої терапії [13]. Але так само існує можливість такої трансформації при прогресуванні захворювання у разі рецидивування. Немає жодних доказів того, що променева терапія призводить до злоякісної трансформації ГКП частіше, ніж рецидивування на фоні лікування деносумабом. Можливість використання променевої терапії є особливо актуальною у разі локалізації пухлини у верхніх хребцях крижової кістки. Це особливе розташування ГКП, за якого, на наш погляд, використання кюретажу [11, 13, 14] є некоректним, оскільки нервозберігаючі втручання унеможливлюють використання швидкісного бура, фенолу або рідкого азоту, що є невід’ємним додатковим засобом впливу на стінки післяопераційної порожнини. Тому такі втручання мало відрізняються від паліативної циторедукції. Крім того, використання взагалі хірургічного втручання при значних ураженнях ГКП супроводжується значною крововтратою (від 1500 до 2500 мл), навіть при передопераційному введенні деносумабу, а рецидиви сягають 46% [12, 14]. Ми надаємо перевагу нехірургічному лікуванню пацієнтів з крижовими ГКП. Таку саму думку висловлюють A. Puri та співавтори [15].
E. Palmerini та співавтори показали, що в середньому через 8 міс після припинення прийому деносумабу у більшості пацієнтів з ГКП спостерігалося прогресування хвороби. Тому автори рекомендують пожиттєву терапію деносумабом. Аналогічні результати навели S. Chawla та співавтори, що були отримані у пацієнтів, які не підлягають лікуванню хірургічним шляхом і у яких cпостерігається високий рівень прогресування, а тому рекомендували знижувати дозу або рідше призначати деносумаб в якості підтримувальної терапії [8]. У нашому дослідженні мінімальний термін ремісії становив 3 міс, тому ми визначили режим підтримувальної терапії 1 раз на 2–3 міс.
Хоча в нашому дослідженні прогресування спостерігалося майже у всіх пацієнтів, вони надавали перевагу консервативному лікуванню, маючи інформацію про можливі наслідки всіх можливих методів. Тому ретельне інформування хворих про наслідки будь-якої методики — хірургічної або консервативної — дає можливість пацієнту самому обирати метод лікування.
Висновки
Застосування деносумабу для лікування умовно неоперабельних пацієнтів з ГКП кісток таза та хребців допомагає досягти довготривалої ремісії за умови постійного введення препарату і дає можливість уникнути каліцтва та можливих післяопераційних ускладнень на тривалий час. Багаторічне використання деносумабу можливе без розвитку суттєвих ускладнень у вигляді злоякісної трансформації або асептичного некрозу щелепи. Комбінація деносумабу з променевою терапією заслуговує на подальше існування як альтернатива хірургічному втручанню при ураженні крижової кістки, а також потребує подальшого вивчення. Деносумаб залишається високоефективним препаратом для лікування пацієнтів з ГКП у разі неоперабельних випадків.
Список використаної літератури
1. Fletcher, C., Bridge, J. A., Hogendoorn, P., & Mertens, F. (2013). WHO Classification of Tumours of Soft Tissue and Bone. Fourth Edition. Retrived from: http://apps.who.int/ bookorders/anglais/detart1.jsp?codlan= 1&codcol=70&codcch=4005.
2. Campanacci, M., Baldini, N., & Boriani, S. (1987). Sudanese A: giant-cell tumor of bone. Journal of Bone and Joint Surgery. American volume, 69, 106–114. doi: 10.2106 / 00004623-198769010-00018.
3. Becker, W., Dohle, J., Bernd, L., Braun, A., Cserhati, M., Enderle, A., …, Tunn, P. (2008). Local recurrence of giant cell tumor of bone after intralesional treatment with and without adjuvant therapy. Journal of Bone and Joint Surgery. American volume, 90, 1060–1067. doi: 10.2106/JBJS.D.02771.
4. Guo, W., Ji, T., Tang, X., & Yang, Y. (2009). Outcome of conservative surgery for giant cell tumor of the sacrum. Spine, 34, 1025–1031. doi: 10.1097/BRS.0b013e31819d4127.
5. Hosalkar, H., Jones, K., King, J., & Lackman, R. (2007). Serial arterial embolization for large sacral giant-cell tumors: mid- to long-term results. Spine, 32, 1107–1115. doi: 10.1097/01.brs.0000261558.94247.8d
6. Lackman, R. D., Khoury, L. D., Esmail, A., & Donthineni-Rao, R. (2002). The treatment of sacral giant cell tumours by serial arterial embolisation. Journal of Bone and Joint Surgery. British volume, 84, 873–877. doi: 10.1302/0301-620x.84b6.13178.
7. Thomas, D., Henshaw, R., Skubitz, K., Chawla, S., Staddon, A., Blay, J. Y., … Jun, S. (2010). Denosumab in patients with giant-cell tumour of bone: an open-label, phase 2 study. Lancet Oncology, 11, 275–280. doi: 10.1016/S1470-2045(10)70010-3.
8. Chawla, S., Henshaw, R., Seeger, L., Choy, E., Blay, J. Y., Ferrari, S., …, Jacobs, I. (2013). Safety and efficacy of denosumab for adults and skeletally mature adolescents with giant cell tumour of bone: interim analysis of an open-label, parallel-group, phase 2 study. Lancet Oncology, 14(9), 901–908. doi:10.1016/s1470-2045(13)70277-8.
9. Palmerini, E., Picci, P., Reichardt, P., & Downey, G. (2019). Malignancy in giant cell tumor of bone: a review of the literature. Technology in Cancer Research & Treatment, 18, 1533033819840000. doi: 10.1177/1533033819840000.
10. Rutkowski, P., Gaston, L., Borkowska, A., Stacchiotti, S., Gelderblom, H., Baldi, G. G., …, Grimer, R. (2018). Denosumab treatment of inoperable or locally advanced giant cell tumor of bone — Multicenter analysis outside clinical trial. European Journal of Surgical Oncology, 44(9), 1384–1390. doi: 10.1016/j.ejso.2018.03.020.
11. Errani, C., Tsukamoto, S., Leone, G., Righi, A., Akahane, M., Tanaka, Y., & Donati, D. M. (2018). Denosumab may increase the risk of local recurrence in patients with giant-cell tumor of bone treated with curettage. Journal of Bone and Joint Surgery, 100, 496–504. doi: 10.2106/JBJS.17.00057.
12. Boriani, S., Cecchinato, R., Cuzzocrea, F., Bandiera, S., Gambarotti, M., … Gasbarrini, A. (2020). Denosumab in the treatment of giant cell tumor of the spine. Preliminary report, review of the literature and protocol proposal. European Spine Journal, 29(2), 257–271. doi:10.1007/s00586-019-05997-0.
13. Tsukamoto, S., Tanaka, Y., Mavrogenis, A. F., Kido, A., Kawaguchi, M., Errani, C. (2020). Is treatment with denosumab associated with local recurrence in patients with giant cell tumor of bone treated with curettage? A systematic review. Clinical Orthopaedics and Related Research, 478, 1076–1085. doi: 10.1097/CORR.0000000000001074.
14. Chiao Yee Lim, Xingyu Liu, Fangzhou He, Haijie Liang, Yi Yang, …, Wei Guo. (2020). Retrospective cohort study of 68 sacral giant cell tumours treated with nerve-sparing surgery and evaluation on therapeutic benefits of denosumab therapy. Bone & Joint Journal, 102-B(2), 77–185. doi: 10.1302/0301-620X.102B2.BJJ-2019-0813.
15. Puri, A., Gupta, S. M., Gulia, A., Shetty, N., & Laskar, S. (2020). Giant cell tumors of the sacrum: Is non-operative treatment effective? European Spine Journal, 30(10), 2881–2886. doi: 10.1007/s00586-020-06650-x.
Адреса:
Дєдков Анатолій Григорович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: an.dedkov@gmail.com
Сorrespondence:
Dedkov Anatoliy
33/43 Lomonosova Str., Kyiv 03022
National Cancer Institute
E-mail: an.dedkov@gmail.com














Leave a comment