Лікування пацієнтів з лімфомою Ходжкіна після прогресії: хіміонечутливість, трансплантація та таргетні препарати
Рудюк Т.О., Новосад О.І., Крячок І.А.
Резюме. Лімфома Ходжкіна (ЛХ) дотепер у світі вважається виліковним захворюванням, оскільки до 90% пацієнтів на ранній стадії та 70–80% пацієнтів на пізніх стадіях досягають тривалої ремісії після першої лінії терапії. У близько 15–25% хворих на ЛХ відмічають первинну рефрактерну хворобу або рецидив після досягнення відповіді на першу лінію терапії та близько у половини з них діагностують хіміонечутливість та/або рецидив після трансплантації. Високодозова хіміотерапія та трансплантація аутологічних гемопоетичних стовбурових клітин є високоефективними у пацієнтів з рефрактерною хворобою або рецидивом та сприяють довготривалій виживаності у значної кількості хворих. Пацієнти, яких було проліковано завчасно за наявності захворювання високої групи ризику, недостатньої відповіді на стандартну терапію першої лінії або хіміочутливого рецидиву, мають сприятливий прогноз. Однак хворим із первинним хіміорезистентним захворюванням і пацієнтам з рецидивом захворювання, що не мають хіміочутливості, високодозова хіміотерапія та трансплантація аутологічних гемопоетичних стовбурових клітин не приносить користі. Для цієї групи осіб можливим є проведення алогенної трансплантації гемопоетичних клітин та/або таргетної імунотерапії.
Одержано 06.06.2022
Прийнято до друку 28.06.2022
DOI: 10.32471/clinicaloncology.2663-466X.45-1.28702

Вступ
На сьогодні Лімфома Ходжкіна (ЛХ) у світі вважається виліковним захворюванням, оскільки до 90% пацієнтів на ранній стадії та 70–80% на пізніх стадіях досягають тривалої ремісії після першої лінії терапії [1–4]. Захворюваність на ЛХ у світі становить приблизно 2,2 випадку на 100 тис. населення, а летальність хворих до одного року — приблизно 9%.
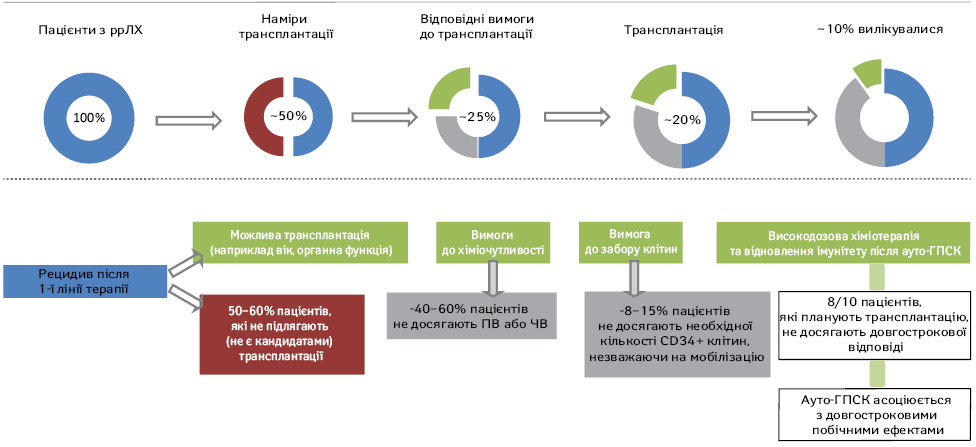
У близько 15–25% пацієнтів з ЛХ відмічають первинну рефрактерну хворобу або рецидив (ррЛХ) після досягнення відповіді на першу лінію терапії та приблизно у половини з них діагностують хіміонечутливість та/або рецидив після трансплантації.
Згідно з даними Національного канцер-реєстру України захворюваність на ЛХ в Україні становить приблизно 2,4 випадку на 100 тис. населення, летальність хворих до одного року — близько 16,3% [5]. На жаль, в Україні немає достовірних даних щодо загальної кількості пацієнтів з рецидивом ЛХ. Однак, за даними 2 центрів, у 2021 р. прогресування захворювання зареєстровано приблизно у 222 пацієнтів (52% — пізній або ранній рецидив, 48% — первинно-рефрактерні випадки). Згідно з локальною базою даних Національного інституту раку відмічається тенденція до зменшення кількості нових випадків ррЛХ, а саме: 53 у 2015 р. порівняно з 14 випадками у 2021 р.
За останні кілька років значний прогрес у методах лікування сприяв досягненню тривалої виживаності пацієнтів з ррЛХ.
Роль трансплантації аутологічних гемопоетичних стовбурових клітин (Aуто-ГПСК) у пацієнтів з рецидивом або рефрактерним перебігом ЛХ
У ході 2 рандомізованих досліджень було доведено, що для частини пацієнтів з ррЛХ хіміотерапія другої лінії (терапія «спасіння»/salvage) з подальшою високодозовою хіміотерапією (ВДХТ) з ауто-ГПСК дотепер залишається стандартом лікування, що покращує показники рівня безрецидивної виживаності (БРВ) [6–7].
На сьогодні розроблено різноманітні програми комбінації різних видів терапії «спасіння», що включають іфосфамід, карбоплатин та етопозид (ICE); дексаметазон, цитарабін і цисплатин (DHAP); етопозид, метилпреднізолон, цитарабін і цисплатин (ESHAP); гемцитабін, дексаметазон і цисплатин; гемцитабін, вінорельбін і ліпосомальний доксорубіцин (GVD). Саме ці режими є стандартом терапії 2-ї лінії, однак жоден з них не є кращим за інший.
Пацієнти, які досягли повної відповіді на salvage-терапію до ауто-ГПСК, мають кращий клінічний результат порівняно з хворими, які досягли часткової ремісії, або при рецидиві захворювання перейшло в рефрактерну форму. Так, C.H. Moskowitz та співавтори під час аналізу даних 75 пацієнтів виявили значно вищий рівень БРВ та загальної виживаності (ЗВ) у пацієнтів, які відповіли на терапію другої лінії стандартними дозами після рецидиву порівняно з тими, у кого відзначено погану відповідь (66 проти 17% та 62 проти 23%, p<0,001 відповідно) [8].
B. Sirohi, D. Cunningham та інші в ході проспективного аналізу виявили, що за наявності у пацієнтів повної відповіді (ПВ) після терапії «спасіння» рівень ЗВ є значно вищим у порівнянні з групою пацієнтів з частковою відповіддю (ЧВ)та з ррЛХ на момент проведення ауто-ГПСК (5-річна ЗВ становила 79 проти 59 проти 17%, p<0,0001). Відповідні 5-річні показники БРВ становили 69 проти 44 проти 14%, р <0,0001 [9].
C.H. Moskowitz та інші в дослідженні ІІ фази оцінювали salvage-терапію за схемою ICE перед ауто-ГПСК та можливість досягнення ПВ за наявності наступних факторів ризику на момент рецидиву: В-симптомів, екстранодального ураження або виникнення рецидиву протягом 1-го року після початку лікування. Встановлено, що пацієнти з двома та більше факторами ризику мали значно нижчі шанси на досягнення ПВ за схемою ICE [10]. У подальшому в дослідженні було виявлено, що несприятливий прогноз, пов’язаний із цими факторами, можна покращити за допомогою використання терапії за схемою aICE (брентуксимабу ведотин (brentuximab vedotin — BV), іфосфамід, карбоплатин та етопозид) [11].
Зовсім недавно в схеми лікування було включено нові таргетні препарати для досягнення кращої відповіді перед ауто-ГПСК, враховуючи важливість отримання негативного результату позитронно-емісійної томографії (ПЕТ) за шкалою Дювіль.
Ще у 2012 р. C.H. Moskowitz, M.J. Matasar та інші в дослідженні ІІ фази продемонстрували, що у разі досягнення на етапі до ауто-ГПСК у пацієнтів ПЕТ-негативного статусу рівень БРВ становив 80% порівняно з 29% у ПЕТ-позитивних пацієнтів [12]. Інші дослідження підтвердили, що наявність негативного статусу згідно з ПЕТ перед ауто-ГПСК є одним з найважливіших предикторів забезпечення позитивного результату після ауто-ГПСК [13–14].
Новий препарат для досягнення кращої відповіді на етапі До ауто-ГПСК
У зв’язку з досягненням кращих результатів відповіді на лікування BV було схвалено Управлінням з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA) у якості підтримуючої терапії після ауто-ГПСК у пацієнтів з наявністю факторів ризику раннього прогресування.
Фактори ризику раннього рецидиву після ауто-ГПСК детально вивчені та включають: тривалість першої ремісії <1 року або первинну рефрактерну хворобу, наявність екстранодального ураження або розповсюдженої стадії захворювання при рецидиві, відсутність хіміочутливості до терапії другої лінії та наявність залишкової активності фтордезоксиглюкози за даними ПЕТ [15].
На сьогодні 2 комбінації BV та режимів з препаратами платини вважаються особливо перспективними: BV + DHAP та BV + ESHAP (BRESHAP). Швидке досягнення метаболічної ПВ у 79% випадках при використанні BV + DHAP передбачає необхідність подальшого вивчення цього режиму щодо віддалених результатів лікування [16].
Більше того, дослідження іспанської групи GELTAMO додатково продемонструвало потенціал комбінації BV з хіміотерапією на етапі до ауто-ГПСК. Приблизно через 27 міс спостереження 74% пацієнтів досягли рівня БРВ 71%, а показник ЗВ становив 91% [17].
Комбінація BV та бендамустину виявилася високоактивною як терапія «спасіння» для пацієнтів з ррЛХ згідно з результатами дослідження I/ ІІ фази, де частота загальної відповіді становила 93% за рахунок досягнення ПВ (74% випадків) після 2 циклів терапії [18].
Також у роботі A.F. Herrera, A.J. Moskowitz та співавторів представлено позитивні проміжні результати дослідження I/II фази з використанням 4 циклів BV у поєднанні з комбінацією ніволумабу як початкової терапії «спасіння» для пацієнтів з ррЛХ. Частота загальної відповіді пролікованих пацієнтів (n=61) становила 82% за рахунок ПВ у 61% пацієнта [19].
Роль аллогенної трансплантації гемопоетичних клітин (Алло-ТГК) та таргетних препаратів у лікуванні пацієнтів з ррЛХ
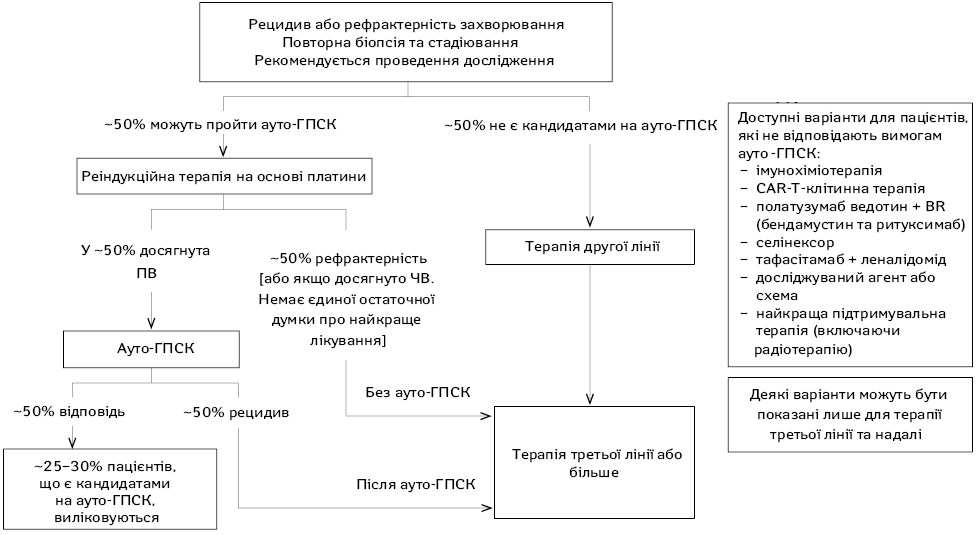
Хіміорефрактерний (хіміонечутливий) рецидив визначається як стабілізація або прогресування захворювання після двох курсів агресивної 2-ї лінії терапії. Питання, чи є ВДХТ з ауто-ГПСК доцільними у пацієнтів з першим або наступним рецидивом або первинним рефрактерним захворюванням є складним у зв’язку з відсутністю єдиних критеріїв визначення хіміорефрактерної хвороби в різних клінічних дослідженнях. Члени журі Міжнародної консенсусної конференції з високодозової терапії з трансплантацією гемопоетичних стовбурових клітин при агресивній НХЛ, що відбулася у квітні 1998 р., погодилися, що ВДХТ з ауто-ГПСК не показана при першому або наступному рецидиві хіміотерапії [20]. З іншого боку, невелика група пацієнтів з первинною рефрактерною хворобою може отримати користь від ВДХТ з ауто-ГПСК [21–24]. Тобто деякі пацієнти з недостатньо вираженою відповіддю після індукційної терапії все ж таки можуть досягти довгострокової виживаності без прогресії захворювання при застосуванні ВДХТ з ауто-ГПСК.
Алло-ТГК залишається терапевтичним методом з найвищими шансами на виліковування для пацієнтів з множинними ррЛХ за допомогою донорської імунної системи для запобігання рецидиву. Дані щодо результатів після аллогенної трансплантації кісткового мозку були вже детально розглянуто в різних наукових статтях [25]. Важливим фактором для аллогенної трансплантації кісткового мозку є наявність донора. Протягом останніх років у кількох дослідженнях оцінювали або розглядали використання гаплоідентичних донорів і отримали обнадійливі результати [26–30]. За наявності гаплоідентичних джерел і джерел пуповинної крові практично всі пацієнти матимуть донора, і це більше не є обмежувальним фактором для алло-ТГК [26–27, 31–33]. Нещодавно Європейським товариством з трансплантації крові та кісткового мозку було проведено реєстрове дослідження 709 пацієнтів (гаплоідентичних, n=98; сумісний брат і сестра, n=338; і відповідний неспоріднений донор, n=273), за результатами якого не виявлено суттєвих відмінностей у БРВ або ЗВ між типами донорів [27]. Оскільки ці результати розширюють можливості для підбору донорів, вибір пацієнтів та токсичність, що пов’язана з трансплантацією, стають першорядними для досягнення позитивних результатів.
До розробки нових методів лікування медіана виживаності хворих на ЛХ з рецидивом після ауто-ГПСК становила 25 міс [34]. За останні роки 2 класи препаратів різко змінили ландшафт пацієнтів з ррЛХ. На сьогодні багато нових препаратів досліджуються саме для лікування хворих з рецидивом після ауто-ГПСК, враховуючи схвалення BV та інгібіторів контрольної точки (сheckpoint inhibitors — CPIs) ніволумабу та пембролізумабу [35–37].
Багатоцентрове дослідження ІІ фази (Checkmate 205) включало лише пацієнтів з рецидивом ЛХ після ауто-ГПСК та BV і показало, що рівень загальної відповіді становив 68% (13% ПВ, 55% ЧВ) при використанні ніволумабу в дозі 3 мг/кг кожні 2 тиж [38]. При мінімальному 23-місячному спостереженні медіана БРВ становила 14,8 міс з 1-річною БРВ 54,6% і 1-річною ЗВ 94,9% [39]. Середній час до відповіді становив 2,1 міс, а медіана тривалості відповіді — 16 міс (95% довірчий інтервал 6,6-NR). Якість життя пацієнтів покращувалася протягом курсу лікування ніволумабом, а небажані явища спостерігалися зрідка, в основному у вигляді реакцій у місці інфузії 1–2-го ступеня у 20% пацієнтів. Серйозні небажані явища включали пневмоніт та аутоімуннний гепатит, які було зафіксовано в 1 пацієнта.
Дослідження Іb фази Keynote-013 включало пацієнтів з класичною ЛХ, у яких відмічали прогресію після BV та які отримували 10 мг/кг пембролізумабу кожні 2 тиж до прогресування захворювання [40]. Серйозні небажані явища спостерігалися у частини пацієнтів, включаючи гіпотиреоз 1–2-го ступеня — у 16%, тиреоїдит — у 6% і пневмоніт — у 10. У клінічному дослідженні Keynote-087 пембролізумаб вводили пацієнтам у фіксованій дозі 200 мг один раз на 3 тиж протягом 24 міс [41]. Загальна відповідь на терапію для всіх пацієнтів становила 69% (22% ПВ і 47% ЧВ).
Рівень ЗВ становив 73,9% у пацієнтів з прогресією захворювання після ауто-ГПСК+BV (n=69), 64,2% — у осіб, які не підлягають проведенню ауто-ГПСК через хіміорезистентну хворобу після 2-ї лінії терапії та BV (n=81), і 70% — у хворих з прогресією після ауто-ГПСК, які не отримували BV в якості консолідації ремісії (n=60; 41% пацієнтів проведено променеву терапію до ауто-ГПСК). Через 6 міс рівень БРВ становив 72,4% і ЗВ 99,5%, при цьому середню тривалість відповіді та ЗВ досягнуто не в усіх когортах. Подібно до результатів застосування ніволумабу, спостерігалося значне покращення якості життя пацієнтів. Найчастішим імунним небажаним явищем був гіпотиреоз низького ступеня (13,8%).
Аналогічно, проти ліганду PD-L1 було розроблено моноклональні антитіла, включаючи гуманізований IgG1, атезолізумаб і повністю людські IgG1, авелумаб і дурвалумаб, але дія та результати лікування цих препаратів знаходяться ще на стадії дослідження.
У дослідженні І фази авелумаб (NCT02603419) оцінюють у пацієнтів з ЛХ, які не підлягають трансплантації або з рецидивом після ауто- чи алло-ТГК [42]. ЗВ для всіх хворих, у яких є неможливим проведення трансплантації, становила 54,8% (ПВ 6,5% та ЧВ 48,4%), включаючи 8 пацієнтів після алло-ТГК. Інгібітори гістондеацетилази, у тому числі моцетиностат, панобіностат і вориностат, показали рівень ЗВ 4–59%, хоча з невеликою частотою повних ремісій і певною обмеженою токсичністю [43–46].
Отже, першочерговими залишаються міркування щодо часу застосування, ефективності та токсичності нових препаратів. Малоймовірно, що пацієнту у 2022 р. буде проведена трансплантація без попереднього використання BV та/або CPIs.
G. Shah та C. Moskowitz запропонували наступні рекомендації у разі ррЛХ після ауто-ГСПК [47]: для пацієнтів, які не отримували BV в попередній лінії терапії, BV залишається високоактивним вибором у разі першого рецидиву після ауто-ГСПК, оскільки частота ПР при застосуванні BV є вищою, ніж у разі призначення CPI.
Автори вважають, що пацієнтів має бути направлено на консультацію щодо проведення алло-ТГК під час початку лікування за допомогою CPI.
Якщо пацієнти досягли ПВ при використанні CPI, рекомендовано продовжувати лікування цими препаратами ще 3 міс додатково. Якщо ПВ зберігається, рекомендовано припинити терапію; слід проводити контрольні огляди, щоб вчасно перезапустити лікування цими препаратами, якщо захворювання прогресує, і повернутися до розгляду алло-ТГК на той час.
У разі досягнення ЧВ рекомендовано продовжити терапію, враховуючи клінічну ситуацію, оскільки пацієнти все ще можуть досягнути ПВ, але розпочати розглядати план щодо проведення алло-ТГК раніше.
Нарешті, якщо на фоні лікування CPI у хворого зафіксовано стабілізацію захворювання, рекомендовано продовжити терапію до остаточного прогресування патології.
У разі прогресування рекомендована терапія на основі алкілуючих препаратів із вибором схеми на основі попередніх методів лікування (рис. 1–2).
Висновок
ВДХТ та ауто-ГПСК є високоефективними методами терапії у пацієнтів з ррЛХ, що обумовлюють довготривалу виживаність у значної кількості хворих. Пацієнти, яких проліковано завчасно за наявності захворювання високого ризику, недостатньої відповіді на стандартну терапію першої лінії або хіміочутливого рецидиву, мають хороший прогноз. Однак хворим з первинним хіміорезистентним захворюванням і особам з рецидивом захворювання, що не є хіміочутливими, ВДХТ та ауто-ГПСК не приносять користі. Для цієї групи пацієнтів можливим є проведення алло-ТГК та/або таргетної імунотерапії.
Конфлікт інтересів
Автори заявляють про відсутність конфлікту інтересів.
Список використаної літератури
1. Viviani, S., Zinzani, P.L., Rambaldi, A., Brusamolino, E., Levis, A., Bonfante, V., … Gianni, A. M. (2011). ABVD versus BEACOPP for Hodgkin’s lymphoma when high-dose salvage is planned. The New England Journal of Medicine, 365(3), 203–212. doi: 10.1056/NEJMoa1100340.
2. Merli, F., Luminari, S., Gobbi, P. G., Cascavilla, N., Mammi, C., Ilariucci, F., … Federico, M. J. (2016). Long-term results of the HD2000 trial comparing ABVD versus BEACOPP versus COPP-EBV-CAD in untreated patients with advanced Hodgkin lymphoma: a study by Fondazione Italiana Linfomi. Journal of Clinical Oncology, 34(11), 1175–1181. doi: 10.1200/JCO.2015.62.4817.
3. Johnson, P., Federico, M., Kirkwood, A., Fosså, A., Berkahn, L., Carella, A., … Barrington, S. N. (2016). Adapted treatment guided by interim PET-CT scan in advanced Hodgkin’s lymphoma. The New England Journal of Medicine, 374(25), 2419–2429. doi: 10.1056/NEJMoa1510093.
4. Radford, J., Illidge, T., Counsell, N., Hancock, B., Pettengell, R., Johnson, P., … Barrington, S. N. (2015). Results of a trial of PET-directed therapy for early-stage Hodgkin’s lymphoma. The New England Journal of Medicine, 372(17), 1598–1607. doi: 10.1056/NEJMoa1408648.
5. Федоренко, З. П., Гулак, Л. О., Михайлович, Ю. Й., Горох, Є. Л., Рижов, А. Ю., Сумкіна, О. В., & Куценко, Л. Б. (2022). Рак в Україні, 2020–2021. Захворюваність, смертність, показники діяльності онкологічної служби. А. Ф. Шипко (Ред.), Бюлетень Національного канцер-реєстру України, 22,101.
6. Schmitz, N., Pfistner, B., Sextro, M., Sieber, M., Carella, A. M., Haenel, M., … Diehl, V. (2002). Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin’s disease: a randomised trial. Lancet, 359(9323), 2065–2071. doi: 10.1016/S0140-6736(02)08938-9.
7. Linch, D. C., Winfield, D., Goldstone, A. H., Moir, D., Hancock, B., McMillan, A., … Hudson, G. V. (1993). Dose intensification with autologous bone-marrow transplantation in relapsed and resistant Hodgkin’s disease: results of a BNLI randomised trial. Lancet, 341(8852), 1051–1054. doi: 10.1016/0140-6736(93)92411-l.
8. Moskowitz, C. H., Kewalramani, T., Nimer, S. D., Gonzalez, M., Zelenetz, A. D., & Yahalom, J. (2004). Effectiveness of high dose chemoradiotherapy and autologous stem cell transplantation for patients with biopsy-proven primary refractory Hodgkin’s disease. The British Journal of Haematology, 124, 645–52. doi: 10.1111/j.1365-2141.2003.04828.x.
9. Sirohi, B., Cunningham, D., Powles, R., Murphy, F., Arkenau, T., & Norman, A. (2008). Long-term outcome of autologous stem-cell transplantation in relapsed or refractory Hodgkin’s lymphoma. Annals of Oncology, 19, 1312–1319. doi: 10.1093/annonc/mdn052.
10. Moskowitz, C. H., Nimer S. D., Zelenetz, A. D., Trippett, T., Hedrick, E. E., Filippa, D. A., … Yahalom, J. (2001). A 2-step comprehensive high-dose chemoradiotherapy second-line program for relapsed and refractory Hodgkin disease: analysis by intent to treat and development of a prognostic model. Blood, 97, 616–623. doi: 10.1182/blood.v97.3.616.
11. Moskowitz, A. J., Schöder, H., Gavane, S., Thoren, K. L., Fleisher, M., Yahalom, J., … Moskowitz, C. H. (2017). Baseline metabolic tumor volume is an independent prognostic factor for relapsed and refractory Hodgkin lymphoma patients receiving PET-adapted salvage therapy with brentuximab vedotin and augmented ICE. Hematological Oncology, 35(suppl 2), 36–37. doi: 10.1182/blood-2017-06-788877.
12. Moskowitz, C. H., Matasar, M. J., Zelenetz, A. D., Nimer, S. D., Gerecitano, J., Hamlin, P., … Yahalom, J. (2012). Normalization of pre-ASCT, FDG-PET imaging with second-line, non- cross-resistant, chemotherapy programs improves event-free survival in patients with Hodgkin lymphoma. Blood, 119, 1665–70. doi: 10.1182/blood-2011-10-388058.
13. Gentzler, R. D., Evens, A. M., Rademaker, A. W., Weitner, B. B., Mittal, B. B., Dillehay, G. L., … Winter, J. N. (2014). F-18 FDG-PET predicts outcomes for patients receiving total lymphoid irradiation and autologous blood stem-cell transplantation for relapsed and refractory Hodgkin lymphoma. The British Journal of Haematology, 165, 793–800. doi: 10.1111/bjh.12824.
14. Akhtar, S., Al-Sugair, A. S., Abouzied, M., Abouzied, M., Alkadhi, Y., Dingle, M., … Maghfoor, I. (2013). Pre-transplant FDG-PET-based survival model in relapsed and refractory Hodgkin’s lymphoma: outcome after high- dose chemotherapy and auto-SCT. Bone Marrow Transplantation, 48, 1530–1536. doi: 10.1038/bmt.2013.88.
15. Martínez, C., Canals, C., Sarina, B., Alessandrino, E. P., Karakasis, D., Pulsoni, A., … Sureda, A. (2013). Identification of prognostic factors predicting outcome in Hodgkin’s lymphoma patients relapsing after autologous stem cell transplantation. Annals of Oncology, 24(9), 2430–2434. doi: 10.1093/annonc/mdt206.
16. Hagenbeek, A., Zijlstra, J. M., Plattel, W. J., Morschauser, F., Lugtenburg, P. J., Brice, P., … Hagenbeek, A. (2021). Combining brentuximab vedotin with DHAP as salvage treatment in relapsed/refractory Hodgkin lymphoma: the phase II HOVON/LLPC transplant BRaVE study. Blood, 106(4), 1129–1137. doi: 10.3324/haematol.2019.243238.
17. Garcia-Sanz, R., Sureda, A., De La Cruz, F., Canales, M., Gonzalez, A. P., Pinana, J. L., … Martinez, C. (2019). Brentuximab vedotin and ESHAP is highly effective as second-line therapy for Hodgkin lymphoma patients (long-term results of a trial by the Spanish GELTAMO group). Annals of Oncology, 30, 612–620. doi: 10.1093/annonc/mdz009.
18. Lacasce, A. S., Bociek, R. G., Sawas, A., Caimi, P., Agura, E., Matous, J., … Advani, R. (2018). Brentuximab vedotin plus bendamustine: a highly active first salvage regimen for relapsed or refractory Hodgkin lymphoma. Blood, 132, 40–48. doi: 10.1182/blood-2017-11-815183.
19. Herrera, A. F., Moskowitz, A. J., Bartlett, N. L., Vose, J. M., Ramchandren, R., Feldman, T. A., … Advani R. H. (2018). Interim results of brentuximab vedotin in combination with nivolumab in patients with relapsed or refractory Hodgkin lymphoma. Blood, 131, 1183–1194. doi: 10.1182/blood-2017-10-811224.
20. Takeda Pharmaceuticals. (Adcetris) summary of product characteristics. (2018). Retrieved from https://www.ema.europa.eu/ en/documents/productinformation/adcetris- epar-product-information_ en.pdf. Accessed 1 Jan 2020.
21. Younes, A., Gopal, A. K., Smith, S. E., Ansell, S. M., Rosenblatt, J. D., Savage, K. J., … Chen, R. (2012). Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphoma. Journal of Clinical Oncology, 30, 2183–2189. doi: 10.1200/JCO.2011.38.0410.
22. Chen, R., Gopal, A. K., Smith, S. E., Ansell, S. M., Rosenblatt, J. D., Savage, K. J., … Younes, A. (2016). Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood, 128, 1562–1566. doi: 10.1182/blood-2016-02-699850.
23. Walewski, J., Hellmann, A., Siritanaratkul, N., Ozsan, G. H., Ozcan, M., Chuncharunee, S., … von Tresckow, B. (2018). Prospective study of brentuximab vedotin in relapsed/refractory Hodgkin lymphoma patients who are not suitable for stem cell transplant or multi-agent chemotherapy. The British Journal of Haematology, 183, 400–410. doi: 10.1111/bjh.15539.
24. Chen, R., Palmer, J. M., Martin, P., Tsai, N., Kim, Y., Chen, B. T., … Forman, S. J. (2015). Results of a multicenter phase II trial of brentuximab vedotin as second-line therapy before autologous transplantation in relapsed/refractory Hodgkin lymphoma. Biology of Blood and Marrow Transplantation, 21, 2136–2140. doi: 10.1016/j.bbmt.2015.07.018.
25. Perales, M.-A., Ceberio, I., Armand, P., Burns, L. J., Chen, R., Cole, P. D., … Carpenter, P. A. (2015). Role of cytotoxic therapy with hematopoietic cell transplantation in the treatment of Hodgkin lymphoma: guidelines from the American Society for Blood and Marrow Transplantation. Biology of Blood and Marrow Transplantation, 21(6), 971–983. doi: 10.1016/j.bbmt.2015.02.022.
26. Ghosh, N., Karmali, R., Rocha, V., Ahn, K. W., DiGilio, A., Hari, P. N., … Hamadani, M. (2016). Reduced-intensity transplantation for lymphomas using haploidentical related donors versus HLA-matched sibling donors: a Center for International Blood and Marrow Transplant research analysis. Journal of Clinical Oncology, 34(26), 3141–3149. doi: 10.1200/JCO.2015.66.3476.
27. Martínez, C., Gayoso, J., Canals, C., Finel, H., Peggs, K., Dominietto, A., … Sureda, A. (2017). Post-transplantation cyclophosphamide-based haploidentical transplantation as alternative to matched sibling or unrelated donor transplantation for Hodgkin lymphoma: a registry study of the Lymphoma Working Party of the European Society for Blood and Marrow Transplantation. Journal of Clinical Oncology, 35(30), 3425–3432. doi: 10.1200/JCO.2017.72.6869.
28. Perales, M.-A., Ceberio, I., Armand, P., Burns, L. J., Chen, R., Cole, P. D., Evens, A. M., … Carpenter, P. A. (2015). Role of cytotoxic therapy with hematopoietic cell transplantation in the treatment of Hodgkin lymphoma: guidelines from the American Society for Blood and Marrow Transplantation. Biology of Blood and Marrow Transplantation, 21(6), 971–983. doi: 10.1016/j.bbmt.2015.02.022.
29. Castagna, L., Bramanti, S., Devillier, R., Sarina, B., Crocchiolo, R., Furst, S., … Blaise, D. (2017). Haploidentical transplantation with post-infusion cyclophosphamide in advanced Hodgkin lymphoma. Bone Marrow Transplantation, 52(5), 683–688. doi: 10.1038/bmt.2016.348.
30. Messer, M., Steinzen, A., Vervölgyi, E., Lerch, C., Richter, B., Dreger, P., & Herrmann-Frank, A. (2014). Unrelated and alternative donor allogeneic stem cell transplant in patients with relapsed or refractory Hodgkin lymphoma: a systematic review. Leukemia & Lymphoma, 55(2), 296–306. doi: 10.3109/10428194.2013.802780.
31. Majhail, N. S., Weisdorf, D. J., Wagner, J. E., Defor, T. E., Brunstein, C. G., & Burns, L. J. (2006). Comparable results of umbilical cord blood and HLA-matched sibling donor hematopoietic stem cell transplantation after reduced-intensity preparative regimen for advanced Hodgkin lymphoma. Blood, 107(9), 3804–3807. doi: 10.1182/blood-2005-09-3827.
32. Karantanos, T., Politikos, I., & Boussiotis, V. A. (2017). Advances in the pathophysiology and treatment of relapsed/refractory Hodgkin’s lymphoma with an emphasis on targeted therapies and transplantation strategies. Blood and Lymphatic Cancer, 7, 37–52. doi: 10.2147/BLCTT.S105458.
33. Thompson, P. A., Perera, T., Marin, D., Oran, B., Popat, U., Qazilbash, M., … Hosing, C. M. (2016). Double umbilical cord blood transplant is effective therapy for relapsed or refractory Hodgkin lymphoma. Leukemia & Lymphoma, 57(7), 1607–1615. doi: 10.3109/10428194.2015.1105370.
34. Moskowitz, A. J., Perales, M.-A., Kewalramani, T., Yahalom, J., Castro-Malaspina, H., Zhang, Z., … Moskowitz, C. H. (2009). Outcomes for patients who fail high dose chemoradiotherapy and autologous stem cell rescue for relapsed and primary refractory Hodgkin lymphoma. British Journal of Haematology, 146(2):158–163. doi: 10.1111/j.1365-2141.2009.07727.x.
35. Khan, N., & Moskowitz, A. J. (2017). Where do the new drugs fit in for relapsed/refractory Hodgkin lymphoma? Current Hematologic Malignancy Reports, 12(3), 227–233. doi: 10.1007/s11899-017-0384-z.
36. Borchmann, S., & von Tresckow, B. (2017). Novel agents in classical Hodgkin lymphoma. Leukemia & Lymphoma, 58(10), 2275–2286. doi: 10.1111/bjh.15695.
37. Jethava, Y., Guru Murthy, G. S., & Hamadani, M. (2017). Relapse of Hodgkin lymphoma after autologous transplantation: Time to rethink treatment? Hematology Oncology and Stem Cell Therapy, 10(2), 47–56. doi: 10.1016/j.hemonc.2016.12.002.
38. Fanale, M., Engert, A., Younes, A., Fanale, M., Santoro, A., Zinzani, P. L., … Ansell, S. M. (2017). Nivolumab for relapsed/refractory classical Hodgkin lymphoma after autologous transplant: full results after extended follow-up of the phase 2 Checkmate 205 trial. Hematology & Oncology, 35(2), 135–136. doi: 10.1200/JCO.2017.76.0793.
39. Timmerman, J. M., Engert, A., Younes, A., Santoro, A., Armand, P., Fanale, M. A., … Ansell, S. (2016). Checkmate 205 update with minimum 12-month follow up: a phase 2 study of nivolumab in patients with relapsed/refractory classical Hodgkin lymphoma. Blood, 128(22), 1110. doi.org/10.1182/blood.V128.22.1110.1110.
40. Armand, P., Shipp, M. A., Ribrag, V., Michot, J. M., Zinzani, P. L., Kuruvilla, J., … Moskowitz, C. H. (2016). Programmed death-1 blockade with pembrolizumab in patients with classical Hodgkin lymphoma after brentuximab vedotin failure. Journal of Clinical Oncology, 34(31), 3733–3739. doi: 10.1200/JCO.2016.67.3467.
41. Chen, R., Zinzani, P. L., Fanale, M. A., Armand, P., Johnson, N. A., Brice, P., … Moskowitz, C. H. (2017). Phase II study of the efficacy and safety of pembrolizumab for relapsed/refractory classic Hodgkin lymphoma. Journal of Clinical Oncology, 35(19), 2125–2132. doi: 10.1200/JCO.2016.72.1316.
42. Chen, R., Gibb, A. L., Collins, G. P., Popat, R., El‐Sharkawi, D., Burton, C., … Radford, J. (2017). Blockade of the PD-1 checkpoint with anti-PD-L1 antibody avelumab is sufficient for clinical activity in relapsed/refractory classical Hodgkin lymphoma (CHL). Hematology & Oncology, 35(2), 67. doi.org/10.1002/hon.2437.
43. Kirschbaum, M. H., Goldman, B. H., Zain, J. M., Cook, J. R., Rimsza, L. M., Forman, S. J., & Fisher, R. I. (2012). A phase 2 study of vorinostat for treatment of relapsed or refractory Hodgkin lymphoma: Southwest Oncology Group Study S0517. Leukemia & Lymphoma, 53(2), 259–262. doi: 10.3109/10428194.2011.608448.
44. Younes, A., Sureda, A., Ben-Yehuda, D., Zinzani, P. L., Ong, T. C., Prince, H. M., … Engert, A. (2012). Panobinostat in patients with relapsed/refractory Hodgkin’s lymphoma after autologous stem-cell transplantation: results of a phase II study. Journal of Clinical Oncology, 30(18), 2197–2203. doi: 10.1200/JCO.2011.38.1350.
45. DeAngelo, D. J., Spencer, A., Bhalla, K. N., Prince, H. M., Fischer, T., Kindler, T., … Ottmann, O. G. (2013). Phase Ia/II, two-arm, open-label, dose-escalation study of oral panobinostat administered via two dosing schedules in patients with advanced hematologic malignancies. Leukemia, 27(8), 1628–1636. doi: 10.1038/leu.2013.38.
46. Younes, A., Oki, Y., Bociek, R. G., Kuruvilla, J., Fanale, M., Neelapu, S., … Martell, R. E. (2011). Mocetinostat for relapsed classical Hodgkin’s lymphoma: an open-label, single-arm, phase 2 trial. The Lancet Oncology, 12(13), 1222–1228. doi: 10.1016/S1470-2045(11)70265-0.
47. Shah, G. L., & Moskowitz, C. H. (2018). Transplant strategies in relapsed/refractory Hodgkin lymphoma. Blood, 131(15), 1689–1697. doi: 10.1182/blood-2017-09-772673.
Адреса для листування:
Рудюк Тимур Олегович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: tymur.rudiuk@gmail.com
Сorrespondence:
Rudiuk Tymur
33/43 Lomonosova Str., Kyiv
National Cancer Institute
E-mail: tymur.rudiuk@gmail.com














Leave a comment