Погляд на проблему лікування пацієнтів з плоскоклітинним раком язика Т1-2N0M0
Галай О.О.1, Білинський Б.Т.2, Бондаренко С.Г.1, Дуда О.Р. 1, Друзюк О.В.1, Карп С.Ю.1, Лудчак В.Ю.1, Сендега І.М.1, Сліпецький Р.Р.2, Шмідт М.Р.1, Цьолко Т.Р.1
- 1Львівський онкологічний регіональний лікувально-діагностичний центр
- 2Львівський національний медичний університет імені Данила Галицького
Резюме. Мета. Розглянути причини недостатньої ефективності лікування хворих на рак язика Т1-2N0M0. Обʼєкт і методи. Проведено ретроспективний аналіз даних про 97 пацієнтів, що знаходилися на лікуванні у відділенні пухлин голови та шиї Львівського онкоцентру з причини плоскоклітинного раку язика Т1-2N0M0. Виділено 6 груп у залежності від методу лікування. У 29 (29,9%) хворих проведено лише хірургічне лікування, у 41 (42,3%) випадку — операцію + променеву терапію, у 7 (7,2%) — хіміопроменеве лікування після операції. У 8 (8,2%) хворих проведено лише курс променевої терапії, у 4 (4,1%) випадках — лише хіміопроменеву терапію, а 8 (8,2%) пацієнтів відмовилися від лікування. У 77 пацієнтів проведено хірургічне втручання, з них у 29 (37,7%), окрім видалення первинної пухлини, зроблено селективну лімфаденектомію І–ІІІ рівнів. Результати. Медіана виживаності хворих, які отримали лікування, становила 87 міс, а у пацієнтів, що відмовилися від нього, сягала лише 5 міс (95% довірчий інтервал (ДІ) 4,2–5,7). П’ятирічна виживаність у хворих з категорією Т1 становила 71,4%, та була достовірно кращою, ніж у пацієнтів з раком язика Т2, за якої вона становила 48,8% (χ2=30,1; p=0,00042). П’ятирічна виживаність у підгрупі без лімфаденектомії була нижчою і становила 54,5% (95% ДІ 47,3–61,7), а у разі її виконання — 62,6% (95% ДІ 53,1–72,1). Якщо променева терапія застосовувалася перед операцією (n=13), загальний рівень виживаності становив 20,2±4,9 міс, водночас при проведенні опромінення в ад’ювантному режимі (n=28) цей показник досягав 49,2±7,0 міс. Висновки. При ранньому раку язика І–ІІ стадії перевагу має первинне хірургічне лікування, що покращує показники загальної 5-річної виживаності. Навіть за відсутності ураження регіонарних лімфатичних вузлів (N0) доцільно проведення курсу ад’ювантної променевої терапії.
Одержано 22.11.2021
Прийнято до друку 8.12.2021
DOI: 10.32471/clinicaloncology.2663-466X.45-1.28864
Вступ
Не дивлячись на відносно сприятливий прогноз при лікуванні хворих з ранніми стадіями раку язика Т1-2N0M0, частота рецидиву досягає 20–30% [1, 2]. Відсутність надійних критеріїв ранньої діагностики субклінічних регіонарних метастазів призвела до впровадження в клінічну практику профілактичних заходів на зонах регіонарного лімфовідтоку. Це в основному променевий і хірургічний методи.
Для покращення результатів лікування інколи проводять профілактичну підщелепну лімфаденектомію І–ІІІ рівнів, але навіть за такої тактики кількість рецидивів залишається значною. В основі сучасного підходу до лікування раку язика лежить хірургічне втручання з наступним курсом променевої терапії залежно від конкретної клінічної ситуації [3]. Основною причиною прогресування захворювання є реалізація регіонарних метастазів, частота яких досягає 50% і більше після радикального лікування [4, 5].
Метою цього дослідження було розглянути причини недостатньої ефективності лікування хворих на рак язика Т1-2N0M0.
Обʼєкт і методи
Проведено ретроспективний аналіз даних 97 пацієнтів, що знаходилися на лікуванні у відділенні пухлин голови та шиї Львівського онкологічного центру у 2009–2018 рр. з причини раку язика (С02 згідно з Міжнародною класифікацією хвороб десятого перегляду) Т1-2N0M0. Гістологічно в усіх морфологічно було підтверджено плоскоклітинний рак.
Виділено 6 груп залежно від методу лікування. У 29 (29,9%) хворих проведено лише хірургічне втручання, у 41 (42,3%) випадку — операцію+променеву терапію, 7 (7,2%) — хіміопроменеве лікування після операції. У 8 (8,2%) хворих проведено лише курс променевої терапії, у 4 (4,1%) — лише хіміопроменеву терапію, а 8 (8,3%) пацієнтів відмовилися від лікування. Окрім основних груп, виділено декілька підгруп залежно від послідовності методів лікування (табл. 1).
| N | Метод лікування | Кількість (n) | Кількість (%) | |
| 1 | Хірургія | 23 | 23,7 | |
| 1а | Хірургія+лімфаденектомія | 6 | 6,2 | |
| 2 | Хірургія+променева терапія | 17 | 17,5 | |
| 2а | Хірургія+лімфаденектомія+променева терапія | 11 | 11,3 | |
| 2б | Променева терапія+хірургія | 9 | 9,3 | |
| 2в | Променева терапія+ хірургія+лімфаденектомія | 4 | 4,1 | |
| 3 | Хірургія+лімфаденектомія+хіміопроменева терапія | 7 | 7,2 | |
| 4 | Променева терапія | 8 | 8,2 | |
| 5 | Хіміопроменева терапія | 4 | 4,1 | |
| 6 | Відмова | 8 | 8,3 | |
| Загалом | 97 | 100 | ||
Променева терапія проводилася в дозі 60–70 Гр., хіміотерапія включала 4–6 курсів (цисплатин+фторурацил). Оцінку виживаності проводили шляхом аналізу кривих за методом Каплана —Майера.
Результати та їх обговорення
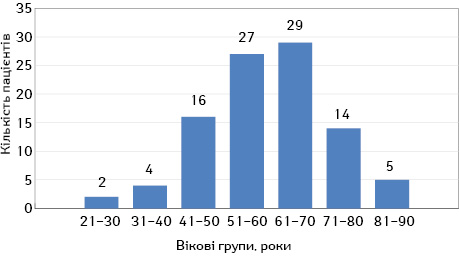
Більшість пацієнтів становили чоловіки — 67,1% (n=73), жінки — 32,9% (n=24). Середній вік хворих — 59,9±1,3 роки, але найчастіше 29,9% (n=29) це були пацієнти вікової групи 61–70 років (рис. 1).
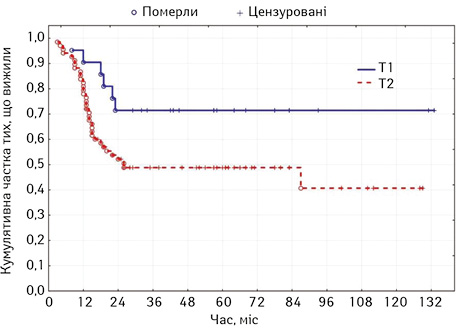
Медіана виживаності хворих, які отримали лікування, становила 87 міс, а у пацієнтів, що відмовилися від нього, — лише 5 міс (95% ДІ 4,2–5,7). П’ятирічна виживаність у хворих з категорією Т1 становила 71,4%, та була достовірно вищою, ніж у хворих з раком язика Т2, за якої вона становила 48,8% (χ2=30,1; p=0,00042) (рис. 2).
У 77 пацієнтів проведено резекцію язика, у 29 (37,7%) з них, окрім видалення первинного вогнища, зроблено підщелепну селективну лімфаденектомію І–ІІІ рівнів. Питання превентивної лімфодисекції за відсутності клінічних метастазів залишається відкритим і дискутабельним. За даними E.M. Diaz, у 26% хворих, яким проведено профілактичну лімфодисекцію, було виявлено регіонарні метастази [4]. За даними інших джерел, частота прихованих метастазів коливається в межах 20–40% [5, 6].
Поза тим, одним з факторів, що впливають на частоту прогресування, є товщина первинної пухлини. Так у разі товщини <4 мм метастази на шиї виникають лише в 5,7% випадків [7]. J. Jing [8] повідомляє, що за товщини пухлини більше 5 мм різко підвищується частота регіонарного метастазування. Тому при місцево-розповсюдженому процесі всім хворим показана лімфодисекція, а у хворих з процесом Т1-2, профілактична лімфодисекція показана за товщини пухлини понад 5 мм. Водночас у сучасних настановах з доказової медицини більш значимим фактором є глибина інвазії пухлини, ніж її товщина, і цей показник є одним з критеріїв визначення категорії Т при раку язика у TNM-класифікації 8-го перегляду [3, 9].
На даний час деякі автори пропонують проводити профілактичну лімфодисекцію вже при розповсюдженні пухлинного процесу, який відповідає Т2 і більше. Виконувати чи не виконувати профілактичну лімфодисекцію хворим з клінічно відсутніми метастазами? Якщо виконувати, у яких випадках? Ці питання залишаються актуальними і зумовлені складністю виявлення мікрометастазів [10].
У нашому дослідженні у 4 з 77 пацієнтів (13,8%) після операції категорія сN0 змінилася на рN1. Слід зазначити, що такий відносно низький рівень виявлених метастазів у лімфатичні вузли не враховує наявності мікрометастазів. Згідно з класифікацією IJCC мікрометастаз — це наявність депозиту клітин пухлини до 2 мм у діаметрі [10]. При гістологічному дослідженні видаленої клітковини шиї виконується мікроскопічне вивчення підозрілих ділянок лімфатичного вузла, але не часто проводиться дослідження >2 ділянок лімфовузла. За даними А. Ferlito та ін. [12], при повторному дослідженні видалених лімфатичних вузлів методом імуногістохімії частота хибнонегативних результатів становила 5–58%.
Для того щоб дослідити лімфатичний вузол розміром 1 см і виявити мікрометастаз (0,2 мм), необхідно зробити до 50 зрізів. Такий обсяг роботи в рутинній практиці виконати складно і дорого. За допомогою рутинного гістологічного дослідження неможливо виявити всі мікрометастази.
Згідно з даними M.W. van den Brekel та ін. було проведено повторне детальне дослідження матеріалу у 96 хворих після профілактичної шийної лімфодисекції N0. У 37% випадках встановлено макро- та мікроскопічні метастази. У 33% випадках метастатичний вузол мав розмір <1 см, у 10% уражених лімфатичних вузлів діагностовано лише мікрометастази [11]. Більш детальне гістологічне дослідження та імуногістохімія значно покращують можливості пошуку мікрометастазів, але не дивлячись на це, ризик того, що деякі з них будуть пропущені, залишається високим. Якщо таких пацієнтів не лікувати, мікрометастази можуть проявитися за час спостереження і погіршити прогноз захворювання. Навіть при клінічно негативних лімфатичних вузлах і негативному рутинному гістологічному дослідженні майже у 40% випадків при повторному дослідженні було виявлено метастази [12].
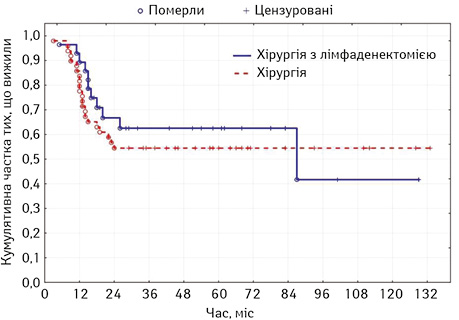
Загальна 5-річна виживаність відображена в табл. 2. Згідно з нашими даними 5-річна виживаність у підгрупі без лімфаденектомії була нижчою і становила 54,5% (95% ДІ 47,3–61,7), а при її виконанні — 62,6% (95% ДІ 53,1–72,1) (рис. 3).
| Метод лікування | Кількість хворих | Загальна 5-річна виживаність |
| ХР без ЛЕ | 23 | 50,0% (95% ДІ 29,6–70,4) |
| ХР+ЛЕ | 6 | 73,7% (95% ДІ 64,5–82,9) |
| ХР+ПТ | 17 | 52,3% (95% ДІ 40,0–64,6) |
| ХР+ЛЕ+ПТ | 11 | 100,0% |
| ПТ+ХР | 9 | 0% |
| ПТ+ХР+ЛЕ | 4 | 25,0% (95% ДІ 3,3–46,7) |
| ХР+ЛЕ+ПТ+ХТ | 7 | 38,1% (95% ДІ 18,2–58,0) |
| ПТ | 8 | 50,0% (95% ДІ 32,3–67,7) |
| ПТ+ХТ | 4 | 66,7% (95% ДІ 39,5–93,9) |
| Відмова від лікування | 8 | 0% |
Примітка: ХР — хірургія, ЛЕ — лімфаденектомія, ПТ — променева терапія, ХТ — хіміотерапія.
Варто зазначити, що частота прогресування навіть після радикальної шийної лімфаденектомії досягає 24–41% [7, 13, 14].
За даними різних авторів, ад’ювантна променева терапія знижує частоту розвитку регіонарних рецидивів не менше як у 2 рази [14–16]. Але M.K. Nair [17] вказував, що у 10% хворих з клінічно встановленими метастазами, які отримували профілактичну променеву терапію на зони регіонарного метастазування, протягом 3 років після закінчення лікування було виявлено метастази в регіонарні лімфатичні вузли.
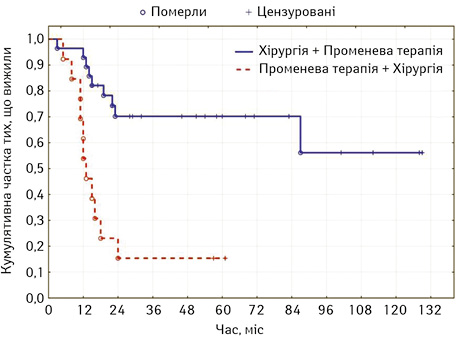
Загальний рівень виживаності при комбінованому лікуванні становив 39,3±4,9 міс. Суттєву різницю встановлено при порівнянні показників 5-річної загальної виживаності залежно від послідовності проведення променевого та хірургічного етапів лікування (χ2=14,8; р=0,0001). Так, якщо променева терапія проводилася перед операцією (n=13) загальний рівень виживаності становив 20,2±4,9 міс, водночас при проведенні опромінення в ад’ювантному режимі (n=28) цей показник досягав 49,2±7,0 міс (рис. 4).
Якщо хворі отримували лише променеву терапію без хірургічного втручання, загальна 5-річна виживаність склала 50% (95% ДІ 32,3–67,7).
Висновки
При ранній стадії раку язика (І–ІІ) перевагу надають первинному хірургічному лікуванню, що покращує показники загальної 5-річної виживаності. Навіть за відсутності ураження регіонарних лімфатичних вузлів (N0) доцільним є проведення курсу ад’ювантної променевої терапії.
Список використаної літератури
- 1. Марголин, Г., Мудунов, А. М., Гельфанд, И. М., Алымов, Ю. В., Ахундов, А. А., Подвязников, С. О., … Захарова, Е. Н. (2018). Необходимость и преимущества персонифицированной шейной лимфодиссекции при раке слизистой оболочки полости рта T1-2N0M0. Путь к радикальной операции. Опухоли головы и шеи, 8(4), 26–31.
- 2. Ikram, M., Jafferbhoy, S. F., & Onali, M. A. (2006). Neck recurrence in early carcinoma tongue. Journal of Pakistan Medical Association, 56(10), 448–51.
- 3. National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology. Head and neck cancers. Version 1. 2020. Retrieved from: http:// oncolife.com.ua/doc/nccn/Head and Neck Cancers.pdf.
- 4. Diaz, E. M. Jr., Holsinger, F. C., Zuniga, E. R., Roberts, D. B., & Sorensen, D. M. (2003). Squamous cell carcinoma of the buccal mucosa: one institution’s experience with 119 previously untreated patients. Head Neck, 25, 267–273. doi: 10.1002/hed.10221.
- 5. Lee, K. H., Veness, M. J., & Pearl-Larson, T. (2005). Role of combined modality treatment of buccal mucosa squamous cell carcinoma. Australian Dental Journal, 50(2), 108–113. doi: 10.1111/j.1834-7819.2005.tb00349.x.
- 6. Trigo, J., Hitt, R., & Koralewski, P. (2004). Cetuximab monotherapy is active in patients with platinum-refractory recurrent/metastatic squamous cell carcinoma of the head and neck (SCCH): results of a phase II study. Journal of Clinical Oncology, 22(14), 487.
- 7. Ganly, I., Goldstein, D., & Carlson, D. L. (2013). Long-term regional control and survival in patients with «low-risk» early stage oral tongue cancer managed by partial glossectomy and neck dissection without postoperative radiation tumor thickness in oral tongue cancer. Cancer, 119(6), 1168–1176. doi: 10.1002/cncr.27872.
- 8. Jing, J., Li, L., & Sun, G. (2006). Prognostic predictors of squamous cell carcinoma of the buccal mucosa with negative surgical margins. Journal of Oral and Maxillofacial Surgery, 64(6), 896–901. doi: 10.1016/j.joms.2006.02.007.
- 9. Amin, M. B., Gress, D. M., Vega, L. R., Edge, S. B., Greene, F. L., Byrd, D. R., … Compton, C. C. (2018). AJCC Cancer Staging Manual, Eighth Edition. Springer: NY.
- 10. Ferlito, A., Rinaldo, A., Devaney, K. O. (2008). Detection of lymph node micrometastases in patients with squamous carcinoma of the head and neck. European Archives of Oto-Rhino-Laryngology, 265(10), 1147–1153. doi: 10.1007/s00405‑008‑0715‑8.
- 11. Van den Brekel, M. W., Stel, H. V., & van der Valk, P. (1992). Micrometastases from squamous cell carcinoma in neck dissection specimens. European Archives of Oto-Rhino-Laryngology, 249(6), 349–353. doi: 10.1007/BF00179388.
- 12. Van den Brekel, M. W., van der Waal, I., & Meijer, C. J. (1996). The incidence of micrometastases in neck dissection specimens obtained from elective neck dissections. Laryngoscope, 106(8), 987–991. doi: 10.1097/00005537-199608000-00014.
- 13. D’Cruz, A. K., Vaish, R., & Kapre, N. (2015). Elective versus therapeutic neck dissection in node-negative oral cancer. The New England Journal of Medicine, 373(6), 521–529. doi: 10.1056/NEJMoa1506007.
- 14. Huang, S. F., Kang, C. J., & Lin, C. Y. (2008). Neck treatment of patients with early stage oral tongue cancer: comparison between observation, supraomohyoid dissection, and extended dissection. Cancer, 112(5), 1066–1075. doi: 10.1002/cncr.23278.
- 15. Shim, S. J., Cha, J., & Koom, W. S. (2010). Clinical outcomes for T1-2N0-1 oraltongue cancer patients underwent surgery with and without postoperativeradiotherapy. Journal of Radiation Oncology, 5, 43. doi: 10.1186/1748-717X-5-43.
- 16. So, Y. K., Oh, D., & Choi, N. (2018). Efficacy of postoperative neck irradiation for regional control in patients with pN0 oral tongue cancer: propensity analysis. Head Neck, 40(1), 163–9. doi: 10.1002/hed.24980.
- 17. Nair, M. K., Sankaranayan, R., & Padmanabhan, T. K. (1988). Evaluation of the role of radiotherapy in the management of carcinoma of the buccal mucosa. Cancer, 61, 1326–1331. doi: 10.1002/1097-0142(19880401)61:7<1326::aid-cncr2820610709>3.0.co;2-z.
Адреса:
Галай Олег Орестович
79031, Львів, вул. Гашека, 2А
Львівський онкологічний регіональний лікувально-діагностичний центр
Тел.: (067) 960-62-28; (032) 295-41-02
E-mail: ohalay@gmail.com
Сorrespondence:
Halay Oleh
2А Hashek Str., Lviv 79031
Lviv State Oncological Regional Treatment and Diagnostic Center
Phone: (067) 960-62-28; (032) 295-41-02
E-mail: ohalay@gmail.com














Leave a comment