Визначення пухлинних клітин у незміненій паренхімі — достовірна ознака розповсюдження раку легені
Болгова Л.С. 1, Пономаренко А.О.2, Ганул В.А.1
- 1Національний інститут раку, Київ, Україна
- 2Національний університет «Києво-Могилянська академія», Київ, Україна
Резюме. Висока захворюваність на рак легені (РЛ), несприятливий клінічний перебіг, низька ефективність лікування ставлять перед дослідниками різноманітні завдання щодо визначення причин виникнення, гістогенезу та морфологічних особливостей росту і розповсюдження цього патологічного процесу. Мета. Визначити наявність ракових клітин у незміненій паренхімі легені на різній відстані від видаленої пухлини на операційному матеріалі. Матеріали і методи. Досліджено зіскрібки з розрізів незміненої паренхіми легені поруч з периферичним краєм видаленої ракової пухлини різних гістологічних типів (14 хворих), на відстані 2 і 5 см. Проведено квантитативні дослідження. Використано методи забарвлення за Паппенгеймом та за Папаніколау та проведено імуноцитохімічні реакції з моноклоналами Cytokeratin-7, Napsin A. Результати дослідження і висновки. Визначено пухлинні клітини в усіх досліджених зонах незміненої паренхіми при трьох гістологічних типах РЛ. Використано новий підхід в отриманні досліджуваного матеріалу з великої ділянки паренхіми методом зіскребків з поверхні її розрізів на різній відстані від периферичного краю видалених пухлин та квантитативної оцінки з використанням цитологічного методу. Вивчено групу змішаного типу РЛ — залозистоплоскоклітинну, яка становила 36%. Наявність такого варіанту РЛ може свідчити про єдине джерело розвитку залозистого і плоскоклітинного типів. Результати проведених досліджень засвідчують широку розповсюдженість ракових клітин по незміненій паренхімі поряд і на значній відстані від видаленої ракової пухлини, що обґрунтовує відомий онкопульмонологам світу несприятливий перебіг захворювання і поганий прогноз та ставить нові завдання — вивчення гістогенезу, пошук ефективного лікування і профілактики РЛ.
Одержано 15.11.2022
Прийнято до друку 23.11.2022
DOI: 10.32471/clinicaloncology.2663-466X.47-3.29178
ВСТУП
Висока захворюваність на рак легені (РЛ) і смертність у населення всього світу ставлять нагальні питання перед науковцями різного профілю [4, 19, 20]. Вивчаються питання гістогенезу РЛ, розповсюдження захворювання повітроносними шляхами для того, щоб наблизитися до вирішення проблем ранньої діагностики, підвищення ефективності лікування, прогнозу, розробки профілактичних програм, що має вагоме медичне і соціальне значення.
Щодо гістогенезу РЛ є велика кількість експериментальних і патологоанатомічних публікацій, але єдиної обґрунтованої думки поки що не існує [1–3, 5–8, 22].
У 2000 р. P. Giraud зі співавторами [9] для позначення наявності пухлинних клітин в альвеолах використали термін «аерогенна дисемінація». Починаючи з 2013 р. з’явилися публікації, присвячені розповсюдженню недрібноклітинного РЛ повітроносними шляхами в співставленні з прогнозом [7, 10, 11].
Проведено кількісні дослідження поодиноких ракових клітин чи їх кластерів та їх кількості в альвеолах залежно від характеристики первинної ракової пухлини, її розмірів, структури та наявності інвазії в плевру, у лімфатичні вузли. Виявлено пряму залежність між розмірами пухлинного вузла, солідною структурою РЛ та поширеністю пухлинного процесу в інші структури, що відповідає більшій кількості ракових клітин у повітроносних шляхах, в альвеолах [10, 11, 15, 21].
Дослідники вивчали наявність поодиноких клітин чи їх кластерів в альвеолах при залозистому (ЗР) [12, 14, 16, 17] і плоскоклітинному раку (ПР) [13, 18]. Виявлено цікавий факт розповсюдження пухлинних клітин повітроносними шляхами у хворих, прооперованих у ранній І стадії ЗР і ПР, що має значення для характеру прогнозу [17, 18, 24] і ставить питання щодо більш детального, обґрунтованого вивчення гістогенезу РЛ.
Водночас залишається невизначеним, яким чином проходить відокремлення ракових клітин від основного пухлинного вузла, що необхідно ще вивчити.
Автори, які досліджували розповсюдженість пухлинних клітин по паренхімі органа, використовували гістологічний метод. Для цього брали окремі шматочки тканини. За допомогою цитологічного методу можна отримати матеріал з будь-якої за розмірами поверхні методом зіскребка з поверхні проведеного розрізу та з різних ділянок незміненої паренхіми, видаленої разом з пухлиною. Цьому питанню присвячено наше дослідження.
МЕТА
Визначити наявність ракових клітин у незміненій паренхімі легені на різній відстані від видаленої пухлини на операційному матеріалі.
МАТЕРІАЛ І МЕТОДИ
Вивчено операційний матеріал 14 хворих на РЛ різних гістологічних типів. У пацієнтів відмічали ІІ і ІІІ клінічні стадії. ПР виявлено у 4, ЗР — у 5 і залозистоплоскоклітинний тип (ЗПР) у 5 хворих. Гістологічну верифікацію проводили патологоанатоми згідно з Міжнародною гістологічною класифікацією [23]. Матеріал для цитологічних досліджень отримували у вигляді зіскребків по краю пухлини, зі свіжих розрізів паренхіми легені на відстані 2 см від периферичного краю ракової пухлини і на максимальній відстані від нього — до 5 см. Зіскребки виконували від зовнішнього краю легені в напрямку до ракової пухлини для збереження чистоти експерименту. За допомогою мікроскопа проводили не тільки виявлення пухлинних клітин, але й квантитативну їх оцінку. З кожної поверхні отримували зіскребки і готували по 3 цитологічних препарати для різних методів забарвлення та імуноцитохімічних реакцій. Використовували методи забарвлення за Паппенгеймом та Папаніколау. Імуноцитохімічні реакції проводили за спеціальною методикою для уточненої ідентифікації ракових клітин з моноклоналами CK7, Napsin A. Препарати вивчали за допомогою мікроскопа OLYMPUS BX41 на різних збільшеннях: ×200; ×400; ×1000.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ І ОБГОВОРЕННЯ
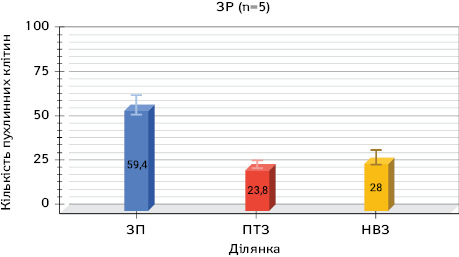
Вивчення наявності і квантитативного складу пухлинних клітин у макроскопічно незміненій паренхімі на різній відстані від периферичного краю видаленої під час операції ЗР легені у 5 хворих
У цитологічних препаратах, виготовлених зі зіскребків паренхіми легені біля периферичного краю самої ракової пухлини у 5 хворих на ЗР, вивчали наявність і проводили кількісну оцінку пухлинних клітин. У препаратах різних хворих їх нараховувалося від 40 до 87, що в середньому становило 59,4±9,8.
У препаратах на відстані 2 см від краю пухлини з перитуморальної зони (ПТЗ) в окремих пацієнтів виявляли від 8 до 55 ракових клітин, що становило в середньому 23,8±9,8. Водночас у цитологічних препаратах, виготовлених з ділянки на відстані 5 см від краю пухлини, ракові клітини знаходили в різній кількості — від 7 до 82 в окремих хворих, що в середньому становило 28,0±15,7.
Проведені дослідження дозволили виявити ракові клітини в усіх зазначених місцях макроскопічно незміненої паренхіми легені і на різній відстані від прооперованої пухлини, що свідчить про широку розповсюдженість пухлинного процесу. Позитивна імуноцитохімічна реакція з моноклоналами Cytokeratin-7, Napsin-А дозволила додатково ідентифікувати пухлинні клітини ЗР (рис. 1–3).
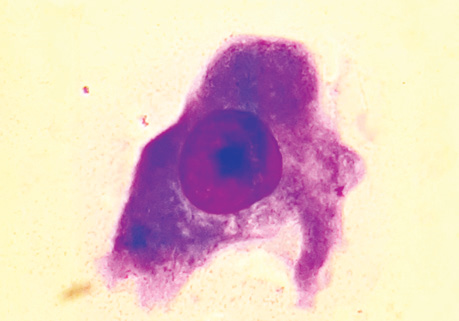
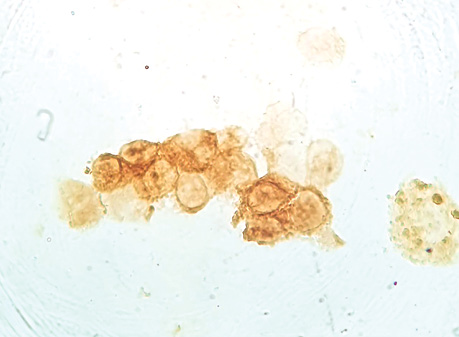
Вивчення наявності пухлинних клітин у паренхімі на різній відстані від периферичного краю видаленого під час операції ЗПР легені у 5 хворих
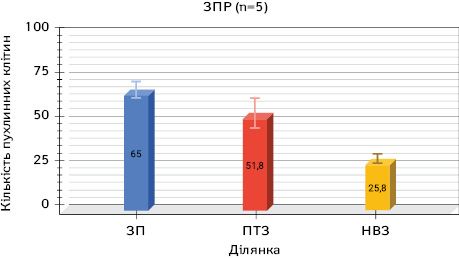
Серед усіх установлених гістологічних типів РЛ у 5 (36%) хворих визначений комбінований тип — ЗПР, що дозволило провести аналогічні дослідження в цій групі пацієнтів.
У цитологічних препаратах, отриманих з найближчої ділянки біля краю ракової пухлини в усіх 5 хворих, пухлинні клітини виявлено в різній кількості — від 44 до 78, що в середньому становило 65±7,1.
У цитологічних препаратах, отриманих з ПТЗ, виявлено від 3 до 81 ракової клітини в матеріалі різних пацієнтів цієї групи, що в середньому становило 51,8±16,3.
У препаратах з незміненої паренхіми з НВЗ від пухлини теж визначалися ракові клітини в різній кількості в окремих хворих. Наявність клітин була різною і коливалася від 0 до 48 і в середньому становила 25,8±10,0.
Отримані результати дослідження групи із ЗПР продемонстровано на рис. 4–6.
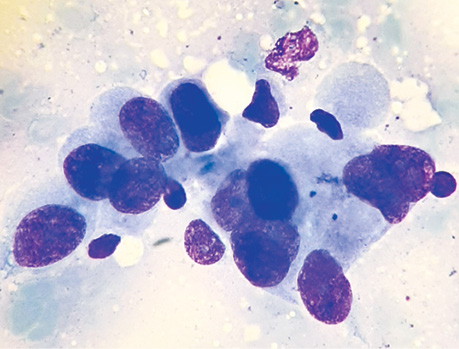
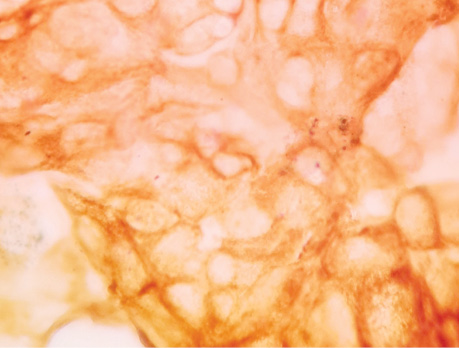
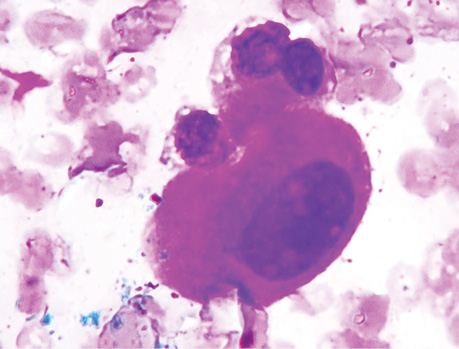
Виявлення пухлинних клітин у паренхімі незміненої легені на різній відстані від периферичного краю видаленого під час операції ПР легені у 4 хворих
Вивчення забарвлених за методом Паппенгейма цитологічних препаратів, виготовлених із зіскребків з ділянки поруч з краєм пухлини, дозволило виявити пухлинні клітини в різній кількості в усіх пацієнтів цієї групи — від 59 до 89, що в середньому становило 74,7±8,4.
Аналіз цитологічних препаратів, отриманих з ділянки на відстані 2 см від краю пухлини з ПТЗ, дозволив виявити від 6 до 47 клітин у різних пацієнтів, що в середньому становило 21,5±11,4.
Вивчення препаратів з НВЗ дозволило визначити пухлинні клітини в меншій кількості — від 6 до 16 в кожному випадку, що в середньому становило 9,5±2,8 (рис. 7–9).
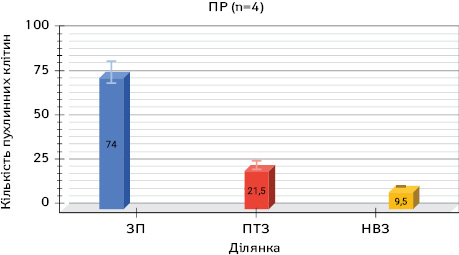
На рис. 1, 4, 7 продемонстровано кількість пухлинних клітин на різній відстані від периферичного краю видаленої ракової пухлини у разі різних гістологічних типів РЛ: ЗП — зона пухлини; ПТЗ — перитуморальна зона пухлини — 2 см від краю пухлини; НВЗ — найбільш віддалена зона — 5 см від краю пухлини.
ВИСНОВКИ
Підсумовуючи отримані квантитативні дані щодо наявності ракових клітин у цитологічних препаратах, можна зазначити, що у всіх з них на різній відстані від пухлинного вузла виявляли ракові клітини, але в різній кількості залежно від гістологічного типу і відстані від периферичного краю видаленої пухлини. Так, у ділянці поряд з пухлиною виявляється найбільша кількість ракових клітин при всіх гістологічних типах РЛ, як видно з рис. 1–3. У паренхімі перитуморальної зони в разі ЗПР у цитологічних препаратах було виявлено у 2,5 раза більше пухлинних клітин, ніж у двох інших гістологічних типах. Проте в НВЗ у разі ПР пухлинних клітин було майже в 3 рази менше, ніж при двох інших гістологічних типах, що опосередковано може свідчити про більш сприятливий перебіг захворювання у пацієнтів із цією гістологічною формою РЛ.
Нами використано новий підхід в отриманні досліджуваного матеріалу з обширної ділянки паренхіми методом зіскребків з поверхні її розрізів на різній відстані від периферичного краю видалених пухлин та її квантитативну оцінку з використанням цитологічного методу.
У проведеному нами оригінальному дослідженні виконано співставлення розповсюдження пухлинних клітин у незміненій паренхімі залежно від різної відстані від периферичного краю видаленої пухлини трьох гістологічних типів РЛ, що не описано в літературі.
Вивчено групу комбінованого типу пухлини — ЗПР, яка становила 36% і може свідчити про єдине джерело розвитку ЗР і ПР.
Результати проведених нами досліджень засвідчують широку розповсюдженість ракових клітин макроскопічно незміненою паренхімою поряд і на значній відстані від видаленої ракової пухлини, що обґрунтовує відомий онкопульмонологам світу несприятливий перебіг захворювання та ставить нові завдання щодо вивчення гістогенезу, діагностики, лікування і профілактики РЛ.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Болгова, Л. С., & Туганова Т. Н. (2013). Рак легкого: вопросы гистогенеза и цитологической диагностики. Київ: KIM.
2. Болгова, Л. С., & Ярощук, Т. М. (2010). Гистогенез рака легкого. Вопросы онкологии, 56(4), 469–476.
3. Демура, С. А., Коган, Э. А., & Горячкина, В. Л. (2018). Хронические заболевания, предрак и рак легкого, ассоциированные с патологией булавовидных клеток респираторных и терминальных бронхиол. Архив патологии, 80(5), 63–68. doi.org/10.17116/patol20188005163.
4. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., Гулак, Л. О., & Куценко, Л. Б. (2022). Рак в Україні, 2020–2021. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. (Vol. 23). Кропивницький: Поліум.
5. Bolgova, L. S., Tuganova, T. N., Alekseenko, O. I., Litvinets, O. M., Suprun, G. A., & Ponomarenko, A. A. (2020). Histogenesis of central lung cancer: cytological investigation. Experimental oncology, 42(4), 310–313. doi.org/10.32471/exp-oncology.2312-8852.vol-42-no-4.15232.
6. Bolgova, L. S., Tuganova, T. N., Alekseenko, O. I., & Ponomarenko, A. A. (2022). On the origin of lung cancer development. Experimental oncology, 44(1), 17–22. doi.org/10.32471/exp-oncology.2312-8852.vol-44-no-1.17227.
7. Chen, Z., Fillmore, C. M., Hammerman, P. S., Kim, C. F., & Wong, K. K. (2014). Non-small-cell lung cancers: a heterogeneous set of diseases. Nature Reviews Cancer, 14(8), 535–546. doi.org/10.1038/nrc3775.
8. Ferone, G., Lee, M. C., Sage, J., & Berns, A. (2020). Cells of origin of lung cancers: lessons from mouse studies. Genes & Development, 34(15–16), 1017–1032. doi.org/10.1101/gad.338228.120.
9. Giraud, P., Antoine, M., Larrouy, A., Milleron, B., Callard, P., De Rycke, Y., … Touboul, E. (2000). Evaluation of microscopic tumor extension in non-small-cell lung cancer for three-dimensional conformal radiotherapy planning. International Journal of Radiation Oncology, Biology, Physics, 48(4), 1015–1024. doi.org/10.1016/s0360-3016(00)00750-1.
10. Heng, W. S., Gosens, R., & Kruyt, F. (2019). Lung cancer stem cells: origin, features, maintenance mechanisms and therapeutic targeting. Biochemical Pharmacology, 160, 121–133. doi.org/10.1016/j.bcp.2018.12.010.
11. Jia, M., Yu, S., Gao, H., & Sun, P. L. (2020). Spread Through Air Spaces (STAS) in Lung Cancer: A Multiple-Perspective and Update Review. Cancer Management and Research, 12, 2743–2752. doi.org/10.2147/CMAR.S249790.
12. Kadota, K., Kushida, Y., Kagawa, S., Ishikawa, R., Ibuki, E., Inoue, K., … Haba, R. (2019). Limited Resection Is Associated With a Higher Risk of Locoregional Recurrence than Lobectomy in Stage I Lung Adenocarcinoma With Tumor Spread Through Air Spaces. The American Journal of Surgical Pathology, 43(8), 1033–1041. doi.org/10.1097/PAS.0000000000001285.
13. Kadota, K., Kushida, Y., Katsuki, N., Ishikawa, R., Ibuki, E., Motoyama, M., … Haba, R. (2017). Tumor Spread Through Air Spaces Is an Independent Predictor of Recurrence-free Survival in Patients With Resected Lung Squamous Cell Carcinoma. The American Journal of Surgical Pathology, 41(8), 1077–1086. doi.org/10.1097/PAS.0000000000000872.
14. Kadota, K., Nitadori, J. I., Sima, C. S., Ujiie, H., Rizk, N. P., Jones, D., … Travis, W. D. (2015). Tumor Spread through Air Spaces is an Important Pattern of Invasion and Impacts the Frequency and Location of Recurrences after Limited Resection for Small Stage I Lung Adenocarcinomas. Journal of Thoracic Oncology, 10(5), 806–814. doi.org/10.1097/JTO.0000000000000486.
15. Liu, H., Yin, Q., Yang, G., & Qie, P. (2019). Prognostic Impact of Tumor Spread Through Air Spaces in Non-small Cell Lung Cancers: a Meta-Analysis Including 3564 Patients. Pathology Oncology Research, 25(4), 1303–1310. doi.org/10.1007/s12253-019-00616-1.
16. Lokuhetty, D., White, V. A., & Cree, I. A. (2021). Thoracic Tumours. WHO Classification of Tumours (5th ed.). International Agency for Research on Cancer.
17. Lu, S., Tan, K. S., Kadota, K., Eguchi, T., Bains, S., Rekhtman, N., … Travis, W. D. (2017). Spread through Air Spaces (STAS) Is an Independent Predictor of Recurrence and Lung Cancer-Specific Death in Squamous Cell Carcinoma. Journal of Thoracic Oncology, 12(2), 223–234. doi.org/10.1016/j.jtho.2016.09.129.
18. Onozato, M. L., Kovach, A. E., Yeap, B. Y., Morales-Oyarvide, V., Klepeis, V. E., Tammireddy, S., … Mino-Kenudson, M. (2013). Tumor islands in resected early-stage lung adenocarcinomas are associated with unique clinicopathologic and molecular characteristics and worse prognosis. The American Journal of Surgical Pathology, 37(2), 287–294. doi.org/10.1097/PAS.0b013e31826885fb.
19. Rodak, O., Peris-Díaz, M. D., Olbromski, M., Podhorska-Okołów, M., & Dzięgiel, P. (2021). Current Landscape of Non-Small Cell Lung Cancer: Epidemiology, Histological Classification, Targeted Therapies, and Immunotherapy. Cancers, 13(18), 4705. doi.org/10.3390/cancers13184705.
20. Sung, H., Ferlay, J., Siegel, R. L., Laversanne, M., Soerjomataram, I., Jemal, A., & Bray, F. (2021). Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. Cancer Journal for Clinicians, 71(3), 209–249. doi.org/10.3322/caac.21660.
21. Wang, S., Hao, J., Qian, C., & Wang, H. (2019). Tumor Spread Through Air Spaces Is a Survival Predictor in Non-Small-Cell Lung Cancer. Clinical Lung Cancer, 20(5), e584–e591. doi.org/10.1016/j.cllc.2019.05.012.
22. Whitsett, J. A., & Kalinichenko, V. V. (2011). Integrin α6β4 defines a novel lung epithelial progenitor cell: a step forward for cell-based therapies for pulmonary disease. The Journal of Clinical Investigation, 121(7), 2543–2545. doi.org/10.1172/JCI58704.
23. Yagi, Y., Aly, R. G., Tabata, K., Barlas, A., Rekhtman, N., Eguchi, T., … Travis, W. D. (2020). Three-Dimensional Histologic, Immunohistochemical, and Multiplex Immunofluorescence Analyses of Dynamic Vessel Co-Option of Spread Through Air Spaces in Lung Adenocarcinoma. Journal of Thoracic Oncology, 15(4), 589–600. doi.org/10.1016/j.jtho.2019.12.112.
24. Yanagawa, N., Shiono, S., Endo, M., & Ogata, S. Y. (2018). Tumor spread through air spaces is a useful predictor of recurrence and prognosis in stage I lung squamous cell carcinoma, but not in stage II and III. Lung Cancer (Amsterdam, Netherlands), 120, 14–21. doi.org/10.1016/j.lungcan.2018.03.018.
Адреса для листування:
Болгова Лідія Севастянівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Е-mail: bolgova2006@ukr.net
Сorrespondence:
Lidiia Bolgova
33/43 Lomonosov Str., Kyiv 03022
National Cancer Institute
Е-mail: bolgova2006@ukr.net














Leave a comment