Зміни жорсткості та морфологічні особливості карциносаркоми Уоркер-256 з магнітними наночастинками під впливом постійного магнітного поля
Орел В.Е.1, Динник О.Б.2, Сивак Л.А.1, Орел В.Б.1, Дасюкевич О.Й.1, Рихальський О.Ю.1, Галкін О.Ю.3, Дєдков А.Г.1, Головко Т.С.1
- 1Національний інститут раку, Київ, Україна
- 2Інститут еластографії, Київ, Україна
- 3Національний технічний університет України «Київський політехнічний інститут імені Ігоря Сікорського», Київ, Україна
Резюме. Мета. Дослідити зміни параметра жорсткості пухлини та морфологічні особливості карциносаркоми Уоркер-256 з магнітними наночастинками (МНЧ) під впливом постійного магнітного поля (ПМП) на основі магнітомеханічного ефекту. Об’єкт і методи. Дослідження проведено з використанням неінбредних самок щурів з карциносаркомою Уоркер-256. Усіх тварин з пухлинами було розподілено на три групи. Щури 1-ї групи (контроль) мали пухлини без МНЧ і зовнішнього впливу. Тваринам 2-ї групи, що мали в пухлинах МНЧ, також не проводили зовнішнього впливу. На щурів 3-ї групи, з перещепленими пухлинами та МНЧ, впливали ПМП. Було використано МНЧ оксиду заліза Fe3O4 діаметром <50 нм (Sigma, Aldrich, CША). У якості джерела неоднорідного ПМП використовували дипольний аплікатор з неодимовим магнітом (магнітна індукція 134 мТл у центрі). Для оцінки жорсткості з визначенням модуля Юнга (пружності) карциносаркоми Уоркер-256 використовували ультразвукову зсувнохвильову еластографію за допомогою апарату Soneus P7 (Ultrasign, Україна). Гістологічні дослідження проводили за стандартною методикою з використанням мікроскопа Olympus BX-41 (Olympus Europe GmbH, Японія). Нелінійну кінетику росту пухлин тварин оцінювали за допомогою розрахунку фактора росту. Статистичний аналіз достовірності отриманих даних між двома та трьома групами, відповідно, проводили за допомогою t-критерію Стьюдента та дисперсійного аналізу (Analysis of Variance — ANOVA). Результати. Протипухлинний вплив на кінетику росту карциносаркоми Уоркер-256 спостерігався лише під впливом ПМП з МНЧ. В іншому досліді без впливу ПМП статистично достовірних змін у кінетиці росту пухлини з МНЧ не було зареєстровано. Показник жорсткості був вищим у пухлині, аніж у нормальних тканинах на протилежній кінцівці. У 1-й контрольній групі величина модуля Юнга в пухлині була в 1,7 раза вищою, ніж у здоровій кінцівці. У 2-й групі показник жорсткості пухлини був у 1,9 та 2,7 раза вищим, ніж у контрольній групі та МНЧ + ПМП відповідно. У 3-й групі модуль Юнга у пухлині був на 28% нижчим, аніж у контрольній групі та мав найближче значення до нормальних тканин у протилежній кінцівці. У пухлинах тварин з МНЧ під впливом ПМП виявляли більш масивні зони некрозу, подекуди апоптозу. Висновки. Використання ПМП у якості впливу на параметри жорсткості карциносаркоми Уоркер-256 з МНЧ на основі магнітомеханічного ефекту ініціюють зменшення величини модуля Юнга в пухлині та фактора росту порівняно з пухлинами тварин контрольної групи та з МНЧ без впливу. У пухлинах тварин з МНЧ під впливом ПМП відмічали більш масивні зони некрозу.
Одержано 4.11.2022
Прийнято до друку 15.11.2022
DOI: 10.32471/clinicaloncology.2663-466X.49-1.29200
ВСТУП
В останні роки було розроблено багатофункціональні та багатоступеневі наномедичні системи доставки протипухлинних лікарських засобів з метою поліпшення їх фармакокінетики і біорозподілу під час хіміотерапії пацієнтів зі злоякісними новоутвореннями. Зокрема, магнітні наночастинки (МНЧ) оксиду заліза (Fe3O4) були одними з перших препаратів на основі неорганічних наночастинок, які стали доступними в експериментальних та клінічних дослідженнях [1].
Стратегія магнітної нанотерапії дозволяє покращити доставку ліків, попередити поширення хіміорезистентності та знизити ризик метастазування первинної пухлини [2]. МНЧ, доставлені до пухлини під дією магнітних полів, залежно від величини ініційованого магнітомеханічного впливу можуть генерувати різні компоненти та концентрації активних форм кисню, що впливає на активність мітохондріальних ферментів та структуру ДНК. Механохімічні процеси у взаємодії пухлини з МНЧ та її мікрооточенням виступають у ролі фактора впливу на резистентність до хіміотерапії або модулятора туморогенезу, опосередкованого механосигнальними шляхами клітин [3].
Відомо, що ріст злоякісних пухлин супроводжується варіаціями величин механічних сил всередині пухлини, а також між пухлиною та тканинами, що її оточують. Механічні параметри мікрооточення пухлини суттєво відрізняються від нормальних тканин, перитуморальна тканина характеризується підвищеними жорсткістю та тиском міжтканинної рідини [4]. У відповідь на будь-які зміни величини механічної напруги, прикладеної до клітини або до ділянки тканини, виникають активні сили, спрямовані на відновлення вихідного значення механічної напруги, що, як правило, перекриває її у зворотний бік («гіпервідновлення»). Якщо нав’язані ззовні зміни механічної напруги розподілено нерівномірно або анізотропно, то активні відповіді будуть спрямовані на зниження найбільших з нав’язаних напруг [5]. У кожному разі початкове збурення призводить до активної механічної реакції, яка змінює форму клітини чи тканини. Результати попередніх досліджень показують, що деякі морфогенетичні процеси керуються механічно ініційованими реакціями (вірогідно, і генетичною активністю). Тобто локальні механічні зміни при злоякісному процесі можуть впливати на механохімічні реакції організму [6]. Враховуючи вищезазначене, порівняння жорсткості як механічного параметра карциносаркоми Уоркер-256 у відповідь на МНЧ з її морфологічними особливостями може в перспективі розширити уявлення про зміни механочутливості під час нанотерапії та допомогти розробити методику хіміотерапії з використанням нанотехнологій у поєднанні з традиційними методами лікування.
МЕТА РОБОТИ
Метою роботи було дослідження зміни параметрів жорсткості та морфологічних особливостей карциносаркоми Уоркер-256 з МНЧ під впливом постійного магнітного поля (ПМП) на основі магнітомеханічного ефекту.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Об’єктами дослідження були неінбредні самки щурів масою 160,5±2,1 г, отримані з віварію Національного інституту раку України. Дизайн дослідження розроблено з дотриманням відповідних рекомендацій [7]. У якості експериментальної моделі було використано карциносаркому Уоркер-256. Походження карциносаркоми Уоркер-256 — спонтанна аденокарцинома молочної залози вагітної безпородної самки щура. Ця експериментальна модель злоякісної пухлини використовується в дослідженнях пухлин молочної залози, кістки та деяких інших злоякісних новоутворень [8, 9]. Кінетика росту цієї моделі передбачає три стадії: трансформацію нормальної клітини в пухлину (ініціація), промоцію («підбурювання») і прогресію пухлини протягом короткого періоду — 12–16 діб. Зростання пухлини відбувається за кінетикою першого порядку між 7-ю і 13-ю добою після імплантації із середньою константою швидкості 34,3% на добу для пухлин великого розміру і 27,7% на добу для малих пухлин. Ріст пухлини підпорядковувався експоненційній кривій росту [10]. Враховуючи вищевказане, визначення механічних параметрів пухлини проводили до 9-ї доби, оскільки протягом цього проміжку часу реєструється виражене збільшення об’єму карциносаркоми Уоркер-256 [11].
Усіх тварин з перещепленими пухлинами було розподілено на три групи (n=6 на групу). Щурам 1-ї групи (контроль) не вводили МНЧ та не проводили зовнішнього впливу. У 2-й групі тварин з МНЧ у пухлинах також не піддавали зовнішньому впливу. Пухлини щурів 3-ї групи з МНЧ піддавали впливу ПМП. Клітини карциносаркоми Уоркер-256 (2 ·106 в середовищі 199) вводили в праву задню кінцівку тварин. МНЧ (0,5 мг) вводили разом з пухлинними клітинами. Щурам 3-ї групи проводили експозицію ПМП через день (загалом 5 разів), уперше — через 1 добу після перещеплення пухлини. Тварин поміщали в положення лежачи на 80 хв з інгаляцією 1–2% ізофлурану під час впливу ПМП. Розміри перещеплених пухлин оцінювали за допомогою цифрового штангенциркуля та сонографічно, розрахунки об’єму пухлини проводили згідно з [12].
Дослідження на тваринах проводили відповідно до Закону України від 21.02.2006 р. № 3447-IV «Про захист тварин від жорстокого поводження» та Європейської Директиви 2010/63/ЄС про захист тварин, які використовуються в наукових цілях.
У дослідженні використовували МНЧ оксиду заліза Fe3O4 діаметром <50 нм (Sigma-Aldrich, CША) з питомим магнітним моментом 56,31 емо/г, коерцитивною силою 6,48 Е та площею петлі гістерезису 350,95 ерг/г. У якості джерела неоднорідного ПМП застосовували локалізатор у формі диполів з неодимовим магнітом з магнітною індукцією 134 мТл, яку вимірювали в центрі за допомогою датчика Холла. Магнітну силу (2,93·10-10–7,54·10-13 Н), що діяла на МНЧ у пухлині, розраховували відповідно до [13].
Виходячи з того, що у більшості солідних пухлин механічні параметри відрізняються від таких у навколишніх здорових тканинах [14], ми використовували ультразвукову зсувнохвильову еластографію (ЕГ) для оцінки жорсткості тканини шляхом визначення модуля Юнга (пружності) карциносаркоми Уоркер-256 [15]. Ультразвукову ЕГ проводили за допомогою універсальної цифрової портативної системи експертного класу Soneus P7 (Ultrasign, Україна).
Для гістологічних досліджень використовували зразки пухлинної тканини, які збирали у щурів після евтаназії у стерильних умовах через 9 діб після імплантації. Одразу після евтаназії під наркозом у тварин видаляли фрагменти пухлини, фіксували у 10% нейтральному формаліні протягом 7 діб, потім заливали в парафін та виготовляли зрізи товщиною 5–6 мкм, які забарвлювали гематоксилін-еозином (hematoxylin and eosin — H&E) за стандартною методикою [16] та досліджували з використанням мікроскопа Olympus BX-41(Olympus Europe GmbH, Японія).
Нелінійну кінетику росту карциносаркоми Уоркер-256 оцінювали за фактором росту φ та коефіцієнтом гальмування пухлин ϰ [17]. Статистичний аналіз достовірності отриманих даних проводили за допомогою t-критерію Стьюдента для порівняння двох груп та дисперсійного аналізу (ANOVA) з критерієм найменшої значущої різниці (найменшої значущої різниці — LSD) та критерієм Геймса — Хоуелла залежно від однорідності вибірки для порівняння трьох груп між собою. Попередньо для перевірки гіпотези про нормальний розподіл застосовували тест Шапіро — Вілка. З метою аналізу даних використовували пакет SPSS Statistics 25, IBM.
РЕЗУЛЬТАТИ ТА ОБГОВОРЕННЯ
У табл. 1 наведено результати впливу МНЧ та ПМП на нелінійну кінетику росту карциносаркоми Уоркер-256 з 1-ї до 9-ї доби після перещеплення пухлини за показником фактора росту φ та коефіцієнтом гальмування ϰ.
| Група тварин | Серія досліду | Фактор росту пухлини (φ), доба-1 | Коефіцієнт гальмування росту, ϰ |
| 1-ша | Контроль | 0,88±0,01 | 1,00 |
| 2-га | МНЧ | 0,91±0,02 | 0,98 |
| 3-тя | МНЧ + ПМП | 0,75±0,01*, + | 1,18 |
*Статистично значуща різниця при порівнянні з контролем, p <0,05;
+Статистично значуща різниця при порівнянні з МНЧ, p <0,05.
Згідно з одержаними даними, протипухлинний вплив на кінетику росту карциносаркоми Уоркер-256 спостерігався лише під впливом ПМП на пухлини з МНЧ. В іншій групі, без впливу ПМП статистично достовірної зміни в рості пухлини з МНЧ не було виявлено. У попередніх дослідженнях встановлено, що розмір і швидкість росту пухлини корелювали з кількістю загального білка, синтезованого в ній [10].
На рис. 1 зображено ЕГ карциносаркоми Уоркер-256, а в табл. 2 наведено зміни величини модуля Юнга для пухлин у відповідь на МНЧ і МНЧ + ПМП. Аналізуючи наведені дані, слід відмітити наступні особливості. У всіх групах показник жорсткості був достовірно вищим у пухлинах, аніж у нормальних тканинах на протилежній кінцівці. У 1-й контрольній групі тварин величина модуля Юнга в пухлині була в 1,7 раза вищою, ніж у здоровій кінцівці. У 2-й групі показник жорсткості пухлини мав найвище значення (у 1,9 та 2,7 раза вище, ніж у контрольній групі та МНЧ + ПМП відповідно), що пов’язано з накопиченням МНЧ у пухлині та її мікрооточенні [18]. У 3-й групі тварин з МНЧ під впливом ПМП модуль Юнга у пухлині був на 28% нижчим, аніж у контрольній групі. Варто зазначити, що показник жорсткості пухлини мав найближче значення до нормальних тканин у протилежній кінцівці саме після МНЧ + ПМП.
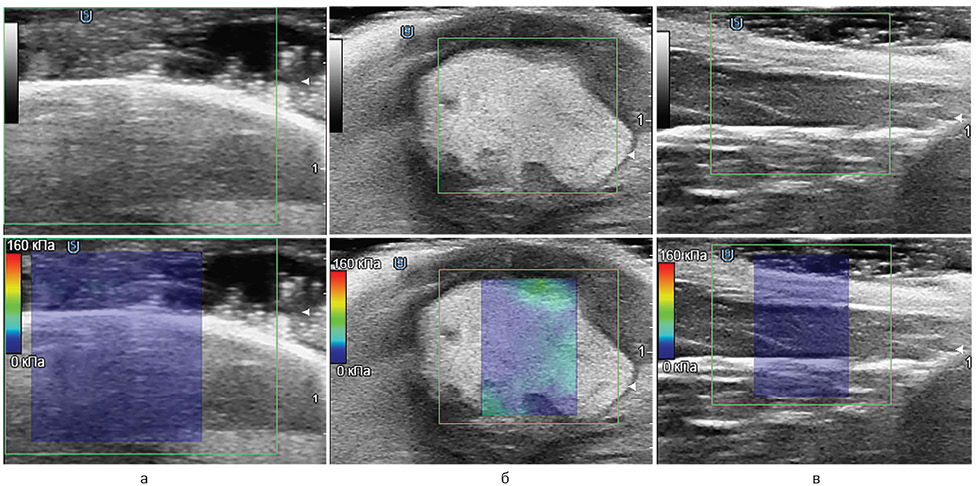
| Група тварин | Серія досліду | Пухлина, кПа | Здорова кінцівка, кПа | Співвідношення пухлини до здорової кінцівки |
| 1-ша | Контроль | 13,47±0,47 | 7,73±0,37* | 1,7 |
| 2-га | МНЧ | 26,17±1,55+ | 7,22±0,34* | 3,6 |
| 3-тя | МНЧ + ПМП | 9,72±0,27+, § | 6,63±0,36* | 1,5 |
*Статистично значуща різниця при порівнянні з пухлиною, p <0,05;
+Статистично значуща різниця при порівнянні з контролем, p <0,05;
§Статистично значуща різниця при порівнянні з МНЧ, p <0,05.
Вищенаведені експериментальні результати відмінностей в ЕГ між групами тварин можливо пояснити, спираючись на те, що зниження показника жорсткості пухлин з МНК відбувалося переважно під впливом ПМП внаслідок дистанційного впливу магнітної сили на більш рівномірний розподіл МНЧ у пухлині. Крім того, варто взяти до уваги й іншу особливість трактування отриманих результатів. Різниця в біомеханічних параметрах пухлин була обумовлена заміщенням пухлини тканинами, які мали нижчу жорсткість. Більш точну відповідь на це питання представлено в результатах гістологічних досліджень.
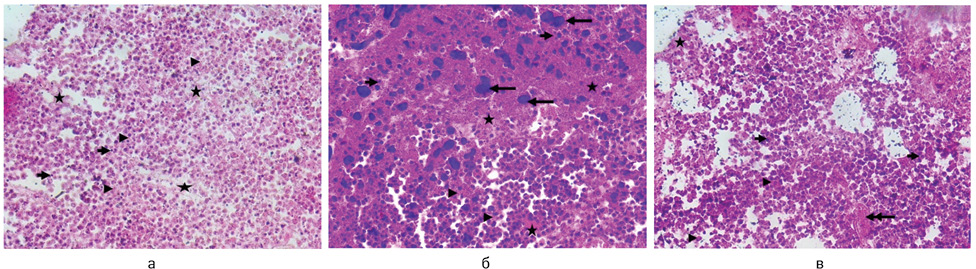
На рис. 2 наведено типові цифрові мікрофотографії гістологічних препаратів пухлин, а в табл. 3 — порівняння ознак їх деструкції між групами досліджених тварин.
| Група | 1-ша | 2-га | 3-тя |
| Серія досліду | Контроль | МНЧ | МНЧ + ПМП |
| Некроз | +++ | ++ | +++ |
| Апоптоз | ++ | +++ | + |
| Фіброзне заміщення | – | – | + |
| Геморагії | – | + | – |
| Компресія | – | + | – |
| Еозинофільні цитоплазматичні включення (автофагія) | ++ | +++ | ++ |
Вираженість явища: «-» — не спостерігається, «+» — поодиноке чи слабко виражене, «++» — помірно виражене, «+++» — виражене (значне).
Пухлини в 1-й контрольній групі (рис. 2, a) складалися переважно з саркоїдного компонента, представленого малодиференційованими клітинами з гіперхромними ядрами, подекуди відмічали сполучнотканинні волокна (до 10% загальної площі зрізу). Спостерігали масивні зони некрозу та апоптозу, представлені еозинофільними клітинами, що не містили ядер (каріорексис), виявляли фрагментовані ядра за межами клітин. Клітини містили еозинофільні цитоплазматичні включення, що може бути наслідком автофагії і є характерним для пухлинних клітин [19]. Пухлини у 2-й групі, в яких знаходилися МНЧ, (рис. 2, б), мали переважно саркоїдний компонент, м’язові та сполучнотканинні волокна практично відсутні. Відмічено ознаки компресії тканин у вигляді злиття гіперхромних ядер, оточених масивними зонами некрозу та апоптозу. У клітинах виявлено велику кількість еозинофільних цитоплазматичних включень. Відмічали крововиливи. У пухлинах з 3-ї групи, у яких знаходилися МНЧ під дією ПМП (рис. 2, в), мали місце масивні зони некрозу, подекуди апоптозу (каріорексис, фрагментовані ядра). Клітини/залишки клітин саркоїдного та м’язового походження містили велику кількість еозинофільних включень.
Для формалізації уявлень щодо отриманих результатів досліджень проаналізуємо їх, базуючись на інформації з літературних джерел. Оскільки зміни механічних сил у пухлині та її мікрооточенні є одним з факторів росту та метастазування [20], відмінності в кінетиці росту карциносаркоми Уоркер-256 між контрольною, МНЧ та МНЧ + ПМП групами залежали від змін механічних параметрів пухлин. По-перше, накопичення МНЧ у пухлинних клітинах призводить до реорганізації цитоскелета та підвищення жорсткості, що узгоджується з нашими результатами — найвищим значенням модуля Юнга у пухлинах з МНЧ [21]. Ознаки компресії тканини пухлини з МНЧ виникали внаслідок їх агрегації за відсутності ПМП як прояв феромагнітних властивостей та магнітних диполь-дипольних взаємодій між МНЧ. За даними попередніх досліджень, механічні напруги (1,3–13,3 кПа), котрі виникають у процесі росту злоякісних пухлин, здатні до деформації та компресії хаотичних судинних мереж злоякісних пухлин [22]. Тому наявність геморагій у пухлинах з МНЧ могла бути спровокована механічною компресією судин агрегатами МНЧ у 2-й групі. Найнижче значення модуля Юнга в пухлині обумовлено застосуванням аплікатора з постійним магнітом, яке сприяло розподілу МНЧ в опроміненій ділянці за градієнтом ПМП [23] та подальшому захопленню МНЧ фагоцитами [24], їх евакуації разом з клітинним детритом [25]. По-друге, під впливом магнітної сили виникають локальні механічні зміни і підвищення концентрації активних форм кисню та азоту, що, у свою чергу, викликає порушення білкових і ліпідних клітинних структур, апоптоз та некроз у клітинах пухлини з МНЧ [26]. У раніше опублікованих роботах показано, що параметр жорсткості пухлин HBCx-3 моделі раку молочної залози людини у безтимусних мишей nude зменшувався зі збільшенням вираженості некрозу та, навпаки, зростав у разі переважання фіброзного заміщення тканин пухлини [27]. Крім того, автори відмічають відмінності в динаміці зниження модуля Юнга між різними типами загибелі пухлинних клітин (апоптоз, некроптоз, фероптоз) [28]. У цьому дослідженні більш виражені ознаки автофагії у 2-й групі порівняно з 1-ю та 3-ю підтверджують зв’язок між механічними змінами пухлинних клітин, а саме цитоскелета й адгезійних молекул у позаклітинному матриксі, та активацією автофагії, як наслідок, впливу на транспорт аутофагосом та лізосом [29].
Таким чином, результати нашого дослідження на експериментальній моделі карциносаркоми Уоркер-256 з МНЧ у щурів під впливом ПМП узгоджуються з попередніми даними та надають більш розширене пояснення наслідків на основі магнітомеханічного ефекту. Отримана інформація свідчить про перспективність подальших досліджень магнітомеханічного ефекту в протипухлинній нанотерапії. Крім того, МНЧ можуть бути розроблені для вимірювання механічної жорсткості біомолекул і внутрішньоклітинних органел з метою вибору мішеней доставки протипухлинних препаратів. Магнітні пінцети — один з перспективних інструментів для дослідження жорсткості біомолекул шляхом застосування механічних сил, вплив останніх здатен до активації механочутливих мембранних каналів та покращення магнітно-керованої цільової доставки [30]. Водночас більш глибокі уявлення про обмеження та проблеми технології протипухлинної нанотерапії необхідні для її впровадження (трансляції) в подальшому в клінічну практику.
ВИСНОВКИ
Використання ПМП у якості впливу на параметри жорсткості карциносаркоми Уоркер-256 з МНЧ ініціює зменшення величини модуля Юнга в пухлині та фактор росту порівняно з пухлинами тварин контрольної групи та з МНЧ без впливу. У пухлинах тварин з МНЧ під впливом ПМП відмічали більш масивні зони некрозу, подекуди апоптозу. Для подальшого розгляду можливості впровадження (трансляції) технології протипухлинної нанотерапії на основі магнітомеханічного ефекту в клініку необхідно розширити наші уявлення про обмеження та проблеми, що виникають під час її використання.
Автори висловлюють вдячність кандидату біологічних наук Г.М. Кузнєцовій та кандидату біологічних наук Н.В. Дзюбенко за допомогу в проведенні гістологічних досліджень.
КОНФЛІКТ ІНТЕРЕСІВ
Автори заявляють про відсутність конфлікту інтересів.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Farzin, A., Etesami, S. A., Quint, J., Memic, A., & Tamayol, A. (2020). Magnetic Nanoparticles in Cancer Therapy and Diagnosis. Advanced Healthcare Materials, 9(9), e1901058. doi: 10.1002/adhm.201901058.
2. Nicolas-Boluda, A., Silva, A., Fournel, S., & Gazeau, F. (2018). Physical oncology: New targets for nanomedicine. Biomaterials, 150, 87–99. doi: 10.1016/j.biomaterials.2017.10.014.
3. Pratt, S., Lee, R. M., Chang, K. T., Hernández-Ochoa, E. O., Annis, D. A., Ory, E. C., … Martin, S. S. (2020). Mechanoactivation of NOX2-generated ROS elicits persistent TRPM8 Ca2+ signals that are inhibited by oncogenic KRas. Proceedings of the National Academy of Sciences of the United States of America, 117(42), 26008–26019. doi: 10.1073/pnas.2009495117.
4. Paszek, M. J., Zahir, N., Johnson, K. R., Lakins, J. N., Rozenberg, G. I., Gefen, A., … Weaver, V. M. (2005). Tensional homeostasis and the malignant phenotype. Cancer Cell, 8(3), 241–254. doi: 10.1016/j.ccr.2005.08.010.
5. Beloussov, L. V., & Grabovsky, V. I. (2006). Morphomechanics: goals, basic experiments and models. The International Journal of Developmental Biology, 50(2–3), 81–92. doi: 10.1387/ijdb.052056lb.
6. Rubashkin, M. G., Cassereau, L., Bainer, R., DuFort, C. C., Yui, Y., Ou, G., … Weaver, V. M. (2014). Force engages vinculin and promotes tumor progression by enhancing PI3K activation of phosphatidylinositol (3,4,5)-triphosphate. Cancer Research, 74(17), 4597–4611. doi: 10.1158/0008-5472.CAN-13-3698.
7. Shaw, R., Miller, S., Curwen, J., & Dymond, M. (2017). Design, analysis and reporting of tumor models. LabAnimal, 46(5), 207–211. doi: 10.1038/laban.1257.
8. Novaes, M. R. G. C., Villafranca, R. C., & Novaes, R. C. V. (2013). Histopathological aspects of Walker 256 tumor using the multifocal technique of inoculation. Turkish Bulletin of Hygiene and Experimental Biology, 70(1), 43–49. doi: 10.5505/TurkHijyen.2013.50465.
9. Amaral, L. A., Souza, G. H. O., Santos, M. R., Said, Y. L. V., Souza, B. B., Oliveira, R. J., & Santos, E. F. (2019). Walker-256 tumor: Experimental model, implantation sites and number of cells for ascitic and solid tumor development. Brazilian Archives of Biology and Technology, 62, e19180284. doi: 10.1590/1678-4324-2019180284.
10. Tayek, J. A., Istfan, N. W., Jones, C. T., Hamawy, K. J., Bistrian, B. R., & Blackburn, G. L. (1986). Influence of the Walker 256 carcinosarcoma on muscle, tumor, and whole-body protein synthesis and growth rate in the cancer-bearing rat. Cancer Research, 46(11), 5649–5654.
11. Martins, G. G., Lívero, F. A., Stolf, A. M., Kopruszinski, C. M., Cardoso, C. C., Beltrame, O. C., … Acco, A. (2015). Sesquiterpene lactones of Moquiniastrum polymorphum subsp. floccosum have antineoplastic effects in Walker-256 tumor-bearing rats. Chemico-biological Interactions, 228, 46–56. doi: 10.1016/j.cbi.2015.01.018.
12. Faustino-Rocha, A., Oliveira, P. A., Pinho-Oliveira, J., Teixeira-Guedes, C., Soares-Maia, R., da Costa, R. G., … Ginja, M. (2013). Estimation of rat mammary tumor volume using caliper and ultrasonography measurements. Lab Animal, 42(6), 217–224. doi: 10.1038/laban.254.
13. Merzouki, R., Samantaray, A. K., Pathak, P. M., & Bouamama O. (2013). Intelligent mechatronic systems. Modeling, control and diagnosis. London: Springer-Verlag. doi: 10.1007/978-1-4471-4628-5.
14. Samani, A., Zubovits, J., & Plewes, D. (2007). Elastic moduli of normal and pathological human breast tissues: an inversion-technique-based investigation of 169 samples. Physics in Medicine and Biology, 52(6), 1565–1576. doi: 10.1088/0031-9155/52/6/002.
15. Динник, О. Б., Жайворонок, М. М., Кобиляк, Н. М., & Харченко, М. С. (2014). Ультразвукова еластографія: теорія і практика створення навчального тренажера. Променева діагностика, променева терапія, 3, 42–53.
16. Kiernan, J. (2008). Histological and Histochemical Methods: Theory and Practice (4th ed.). New York: Cold Spring Harbor Laboratory Press.
17. Эмануэль, Н. М. (1977). Кинетика экспериментальных опухолевых процессов. Москва: Наука.
18. Orel, V. E., Mitrelias, T., Tselepi, M., Dynnyk, O. B., Romanov, A. V., Rykhalskiy, A. Y., … Schepotin, I. B. (2014). Analysis of ultrasound elastography images for tumor guerin carcinoma during magnetic nanotherapy, European Journal of Medical Physics, 30(S1), E36–E37, doi: 10.1016/j.ejmp.2014.07.114.
19. Yu, Z., Ma, J., Li, X., Liu, Y., Li, M., Wang, L., … Wang, Z. (2018). Autophagy defects and related genetic variations in renal cell carcinoma with eosinophilic cytoplasmic inclusions. Scientific Reports, 8(1), 9972. doi: 10.1038/s41598-018-28369-y.
20. Broders-Bondon, F., Nguyen Ho-Bouldoires, T. H., Fernandez-Sanchez, M. E., & Farge, E. (2018). Mechanotransduction in tumor progression: The dark side of the force. The Journal of Cell Biology, 217(5), 1571–1587. doi: 10.1083/jcb.201701039.
21. Perez, J. E., Fage, F., Pereira, D., Abou-Hassan, A., Asnacios, S., Asnacios, A., & Wilhelm, C. (2021). Transient cell stiffening triggered by magnetic nanoparticle exposure. Journal of Nanobiotechnology, 19(1), 117. doi: 10.1186/s12951-021-00790-y.
22. Stylianopoulos, T., Martin, J. D., Snuderl, M., Mpekris, F., Jain, S. R., & Jain, R. K. (2013). Coevolution of solid stress and interstitial fluid pressure in tumors during progression: implications for vascular collapse. Cancer Research, 73(13), 3833–3841. doi: 10.1158/0008-5472.CAN-12-4521.
23. Tracy, J., & Crawford, T. (2013). Magnetic field-directed self-assembly of magnetic nanoparticles. MRS Bulletin, 38, 915–920. doi: 10.1557/mrs.2013.233.
24. Shubayev, V. I., Pisanic, T. R., 2nd, & Jin, S. (2009). Magnetic nanoparticles for theragnostics. Advanced Drug Delivery Reviews, 61(6), 467–477. doi: 10.1016/j.addr.2009.03.007.
25. Lauber, K., Ernst, A., Orth, M., Herrmann, M., & Belka, C. (2012). Dying cell clearance and its impact on the outcome of tumor radiotherapy. Frontiers in Oncology, 2, 116. doi: 10.3389/fonc.2012.00116.
26. Guo, Y., Yang, W., Pu, G., Zhu, C., Zhu, Y., Li, J., … Chu, M. (2022). Low frequency vibrating magnetic field-triggered magnetic microspheres with a nanoflagellum-like surface for cancer therapy. Journal of Nanobiotechnology, 20(1), 316. doi: 10.1186/s12951-022-01521-7.
27. Chamming’s, F., Latorre-Ossa, H., Le Frère-Belda, M. A., Fitoussi, V., Quibel, T., Assayag, F., … Fournier, L. S. (2013). Shear wave elastography of tumour growth in a human breast cancer model with pathological correlation. European Radiology, 23(8), 2079–2086. doi: 10.1007/s00330-013-2828-8.
28. Van der Meeren, L., Verduijn, J., Krysko, D. V., & Skirtach, A. G. (2020). AFM Analysis Enables Differentiation between Apoptosis, Necroptosis, and Ferroptosis in Murine Cancer Cells. iScience, 23(12), 101816. doi: 10.1016/j.isci.2020.101816.
29. Hernández-Cáceres, M. P., Munoz, L., Pradenas, J. M., Pena, F., Lagos, P., Aceiton, P., … Bertocchi, C. (2021). Mechanobiology of Autophagy: The Unexplored Side of Cancer. Frontiers in Oncology, 11, 632956. doi: 10.3389/fonc.2021.632956.
30. Dobson, J. (2008). Remote control of cellular behaviour with magnetic nanoparticles. Nature Nanotechnology, 3(3), 139–143. doi: 10.1038/nnano.2008.39.
Адреса для листування:
Орел Валерій Еммануїлович
03022, Київ, вул. Ломоносова 33/43
Національний інститут раку
E-mail: valeriiorel@gmail.com
Сorrespondence:
Valerii Orel
33/43 Lomonosova Str., Kyiv, 03022
National Cancer Institute
E-mail: valeriiorel@gmail.com














Leave a comment