Неоад’ювантна таргетна терапія як новий підхід до лікування хворих на локалізований нирково-клітинний рак
Войленко О.А., Стаховський О.Е., Вітрук Ю.В., Кононенко О.А., Пікуль М.В., Гречко Б.О., Тимошенко А.В., Стаховський Е.О.
Резюме. Мета дослідження: підвищити ефективність лікування хворих на локалізований нирково-клітинний рак шляхом розробки комбінованого підходу з використанням неоад’ювантної таргетної терапії на основі визначення її ефективності в регресії пухлини та можливості подальшого проведення органозберігального оперативного лікування. Матеріали та методи. Результати розпочатого у 2015 р. проспективного рандомізованого дослідження, до якого було включено 118 хворих на локалізований нирково-клітинний рак. До групи неоад’ювантної таргетної терапії увійшло 58 (49,2%) пацієнтів, які перед операцією отримали 2 цикли терапії сунітинібом або пазопанібом з подальшим дослідженням його ефективності. Контрольну групу склали 60 (50,8%) хворих, яким виконано тільки хірургічне втручання. Групи були зіставними за віком, статтю, розміром пухлини, індексом маси тіла, рівнями гемоглобіну та креатиніну, загальною швидкістю клубочкової фільтрації (p>0,05). Усім пацієнтам проводили комплексне клінічне обстеження, що включало оцінку регресії пухлини за RECITS 1.1 та об’єму функціонуючої паренхіми нирки за розробленою у відділенні нефрометричною системою NCIU. Результати. Проведення неоад’ювантної таргетної терапії обумовило зменшення розміру пухлини в середньому на 12,3 мм, з (M±SD (95% довірчий інтервал)) 60,8±19,7 (55,7–66) до 48,5±16,4 (44,2–52,8) мм (t-тест; р<0,001). Неоад’ювантна таргетна терапія сприяла регресії нирково-клітинного раку у 50 (86,3%) випадках у середньому на 20,5±14,3 (16,8–24,3)%. У 8 (13,8%) хворих розмір пухлини не змінився. Випадків прогресування не відмічено. У 44 (75,9%) пацієнтів рівень регресії досягав 30%, в інших 14 (24,1%) — понад 30%, з максимальною регресією 60%. Не виявлено залежності між розміром пухлини та рівнем регресії (ANOVA, η2=0,01 power 0,1 (р=0,72)). Проведення неоад’ювантної таргетної терапії дозволило виконати резекцію нирки у 53 випадках (91,4%) проти лише 20 (33,3%) у групі без таргетної терапії (х2=42,1; р<0,0001). Висновки. Проведення неоад’ювантної таргетної терапії у хворих на локалізований нирково-клітинний рак обумовило регресію пухлини в середньому на 20,5±14,3% за розмірів первинної пухлини 60,7±19,8 мм, що забезпечило можливість проведення органозберігального оперативного лікування у 91,4% випадках у порівнянні з 33,3% серед пацієнтів без проведення таргетної терапії (x2=42,1; р<0,0001).
Одержано 4.08.2022
Прийнято до друку 31.10.2022
DOI: 10.32471/clinicaloncology.2663-466X.47-3.29236
Вступ
Резекція нирки стала операцією вибору в лікуванні пацієнтів з локалізованим нирково-клітинним раком (НКР) [1, 2], онкологічну та функціональну ефективність якої було доведено численними клінічними дослідженнями. При цьому чітко розроблених показань до резекції нирки до цього часу не існує.
У разі розміщення пухлини у воротах нирки або при пухлинах великого розміру (>4 см) у клінічній практиці частіше застосовується радикальна нефректомія, яка значно погіршує виживаність хворих за рахунок хронічної ниркової недостатності та значно знижує якість їх життя [3–6]. Зменшення розмірів пухлини в цій ситуації може змінити тактику на користь проведення резекції нирки, що дасть значні преференції хворому. Досягти цієї мети можливо за рахунок призначення таргетної терапії (ТТ) в неоад’ювантному режимі.
Аналіз сучасної літератури показав, що використання неоад’ювантної ТТ при локалізованому НКР проводилося лише в окремих клінічних випадках та в невеликих ретроспективних групах за імперативними показаннями (пухлина єдиної нирки, двобічні пухлини нирок, патологія протилежної нирки, яка значно порушує її функцію) [7–12], а рандомізованих досліджень з використання неоад’ювантної ТТ для лікування пацієнтів з локалізованим НКР не було взагалі. Враховуючи вищевказане, науково-дослідним відділенням пластичної та реконструктивної онкоурології заплановано та проводиться проспективне рандомізоване дослідження з вивчення ефективності неоад’ювантної ТТ в лікуванні хворих на НКР.
Мета дослідження — підвищити ефективність лікування пацієнтів з локалізованим НКР шляхом розробки комбінованого підходу з використанням неоад’ювантної ТТ на основі визначення її ефективності в регресії пухлини та можливості подальшого проведення органозберігального оперативного лікування.
Матеріали та методи
Хворих на локалізований НКР (Т1–2N0M0) з проміжними показаннями як до нефректомії, так і до резекції нирки (пухлина більше 20 мм, розміщена у воротах нирки, периферичне або полярне розміщення НКР, що поширюється на нирковий синус, за об’єму функціонуючої паренхіми нирки більше 50%), які дали інформовану згоду на участь у дослідженні, було рандомізовано на дві групи. В основну групу увійшли пацієнти, яким проводилося 2 блоки неоад’ювантної ТТ препаратами першої лінії (сунітиніб або пазопаніб) з подальшою оцінкою її ефективності за критеріями RECIST та оперативним лікуванням (резекція нирки або нефректомія); до контрольної — хворі, яким проводили лише оперативне втручання (резекція нирки або нефректомія).
Рандомізація проводилася методом випадкових чисел у рандомізаційному центрі Національного інституту раку. Дизайн дослідження представлено на рис. 1.
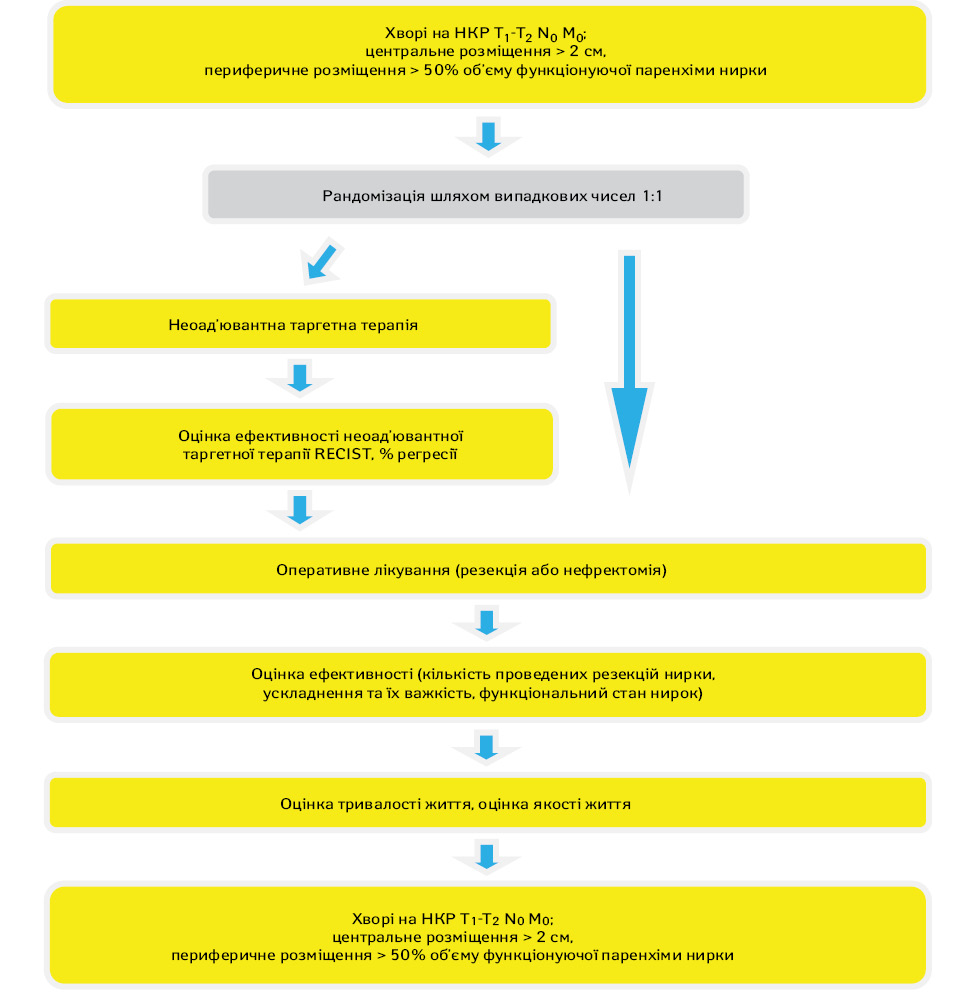
Протягом 2017–2018 рр. в дослідження було включено 118 пацієнтів. Загалом вік хворих коливався в межах 23–76 років, у середньому 54,9±11,1 (52,8–56,9) року. Чоловіків було 73 (61,9%), жінок — 45 (38,1%), співвідношення 1,6:1. Розміри пухлини варіювали від 32 до 124 мм, у середньому — 61,7±11,1 (58,3–65). Пухлину розміром 4 см і менше діагностовано у 9 (7,6%) пацієнтів, 4–7 см — у 69 (58,5%), 7–10 см — у 32 (27,1%) та більше 10 см — у 8 (6,8%) хворих. Медіана індексу маси тіла (ІМТ) рандомізованих пацієнтів становила 28,4 [25,6; 31,5]: серед них хворих зі зниженим ІМТ (<18,5) не було зовсім; з нормальним (18,5–24,9) було лише 27 (22,9%), у всіх інших 91 (77,1%) відмічали надмірну масу тіла, серед яких передожиріння (ІМТ 25–29,9) виявлено у 50 (42,4%), ожиріння І ступеня (ІМТ 30–34,9) — у 28 (23,7%), ожиріння ІІ ступеня (ІМТ 35–39,9) — у 11 (9,3%) та ожиріння ІІІ ступеня (ІМТ >40) — у 2 (1,7%) пацієнтів.
Слід відмітити, що близько половини хворих, а саме 57 (48,3%), мали супутню патологію з боку інших органів та систем, що впливало на функцію нирок як у до-, так і в післяопераційний період. Серед них: артеріальну гіпертензію впродовж більше 10 років виявляли у 47 (39,8%), ожиріння — у 41 (34,7%), кісти контралатеральної нирки — у 14 (11,9 %), сечокам’яну хворобу — у 11 (9,3%) пацієнтів, цукровий діабет — у 5 (4,2%), гіпоплазію контралатеральної нирки — у 2 (1,7%), перенесений в анамнезі інфаркт міокарда — у 3 (2,5%).
В основну групу рандомізовано 58 (49,2%) хворих на локалізований НКР, яким проведено 2 блоки неоад’ювантної ТТ, до контрольної групи — 60 (50,8%) пацієнтів. Порівняльні дані груп представлено в табл. 1.
| Показник | Статистичні одиниці | Основна група
n=58 (%) |
Контрольна група
n=60 (%) |
Статистична оцінка | |
| Вік, роки | M±SD
(95% CI) |
55,3±10,3
(52,6–58) |
54,5±12
(51,4–57,6) |
U-критерій Манна — Уітні;
р=0,8 |
|
| Стать: | чоловіча | n (%) | 39 (67,2) | 34 (56,7) | x2=1,39;
р=0,24 |
| жіноча | n (%) | 19 (32,7) | 26 (43,3) | ||
| T | 1а | n (%) | 7 (12,1) | 5 (8,3) | x2=7,3;
р=0,63 |
| 1b | n (%) | 35 (60,3) | 31 (51,7) | ||
| 2а | n (%) | 12 (20,7) | 22 (36,7) | ||
| 2b | n (%) | 4 (6,9) | 2 (3,3) | ||
| ECOG | Me
[25%; 75%] |
0 [0, 1] | 0 [0, 1] | U-критерій Манна — Уітні; р=0,63 | |
| Індекс маси тіла | Me
[25%; 75%] |
28,6
[25,3; 33,2] |
28,4
[26,9; 30,4] |
U-критерій Манна — Уітні; р=0,64 | |
| Гемоглобін | Me
[25%; 75%] |
130,5
[115; 141] |
135
[118; 149] |
U-критерій Манна — Уітні; р=0,2 | |
| Розмір пухлини нирки, мм | M±SD
(95% ДІ) |
60,7±19,8
(55,5–66) |
62,5±16,7
(58,2–66,9) |
U-критерій Манна — Уітні; р=0,56 | |
| Сумарна клубочкова фільтрація, мл/хв | M±SD
(95% ДI) |
88,6±26,1
(76,7–100,5) |
90,5±22,5
(80,5–100,5) |
U-критерій Манна — Уітні; р=0,83 | |
| Креатинін у крові, мкмоль/л | M±SD
(95% ДI) |
94,5±2
(89,3–99,7) |
90±2,4
(83,7–96,5) |
U-критерій Манна — Уітні; р=0,17 | |
| Хронічна ниркова недостатність | n (%) | 4 (6,9) | 3 (5) | x2=0,19;
р=0,66 |
|
| Супутня патологія | n (%) | 29 (50) | 28 (46,7) | x2=0,13;
р=0,71 |
|
Як видно з табл. 1, статистичної різниці в групах порівняння до проведення лікування за основними характеристиками виявлено не було.
ТТ проводили за стандартною схемою: пазопаніб 800 мг щоденно перорально протягом 2 міс, сунітиніб по 50 мг щоденно протягом 28 діб з перервою в прийомі препарату протягом 14 діб та повторним 28-денним курсом терапії.
Оперативне лікування проводили в термін більше 2 тиж після припинення або закінчення курсу неоад’ювантної ТТ задля повного виведення таргетного препарату з організму з метою кращої регенерації тканин після проведення оперативного лікування. Перевагу надавали резекції нирки за об’єму збереженої функціонуючої паренхіми більше 50%, у разі технічної можливості її проведення та за умови збереженого кровопостачання нирки та сечовідведення з неї.
Оцінку ефективності лікування проводили на основі променевих методів візуалізації (ультразвукове дослідження, комп’ютерна та магнітно-резонансна томографія, урографія), які використовували як при первинному обстеженні, так і під час усіх контрольних обстежень. Регресію первинної пухлини оцінювали за критеріями оцінки відповіді солідних пухлин на терапію (Response Evaluation Criteria in Solid Tumors — RECIST) [13]. Також було оцінено кількість проведених резекцій нирки та нефректомій у групах порівняння.
Статистична обробка отриманих результатів проводилася за допомогою програмного забезпечення SPSS. Оцінку розподілу неперервних даних у групі здійснювали шляхом побудови діаграм розподілу за критерієм Колмогорова — Смирнова. Описова статистика включала обчислення середньої величини зі стандартним відхиленням або медіани з 25–75 процентелями. Порівняння кількісних показників у групах проводили з використанням критерію Манна — Уітні, якісних — із застосуванням критерію Пірсона. Статистично значущими відмінностями вважали вірогідності помилки 1-го роду менше 5%, р<0,05.
Результати
У першу чергу ми оцінювали відсоток регресії пухлини у 58 хворих групи неоад’ювантної ТТ на основі мультиспіральної комп’ютерної томографії (МСКТ) органів грудної, черевної порожнини та малого таза з болюсним контрастним підсиленням на тому ж МСКТ з метою виключення похибки різних апаратів. Слід відмітити, що даних про наявність регіонарного та відділеного метастазування не було виявлено в жодному дослідженні. Ступінь регресії пухлини в кожному окремому випадку представлено на рис. 2.
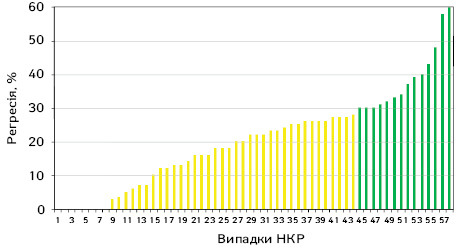
Дані, наведені на рис. 2, свідчать, що в переважній більшості випадків після проведення неоад’ювантної ТТ розмір пухлини зменшився. При цьому відсоток регресії пухлини коливався від 0% до 60% і в середньому становив (M±SD (95% довірчий інтервал (ДІ) 20,5±4,3 (16,8–24,3)%. Результати оцінки регресії пухлини за RECIST 1.1 представлено в табл. 2.
| Показник | n (%) | Медіана відсотка регресії,
Me [25%; 75%] |
| Прогресія | 0 | – |
| Стабілізація | 44 (75,9) | 16 [5,5; 23,5] |
| Часткова регресія | 14 (24,1) | 35,5 [31; 43] |
| Повна відповідь | 0 | – |
Як видно з табл. 2, після проведення неоад’ювантної ТТ прогресії захворювання не відмічали в жодному випадку. Відсутність відповіді на проведення ТТ (0% регресії) виявлено у 8 (13,8%) випадках. При цьому переважна більшість пацієнтів мала незначну позитивну відповідь на проведення ТТ за RECIST 1.1 (від 3 до 29% регресії локалізованого НКР), яку відмічали в 44 (76,9%) випадках. Часткову відповідь за RECIST 1.1 встановлено в 14 (24,1%) випадках, і вона сягала максимум 60%. У жодному випадку не було констатовано повної відповіді локалізованого НКР на проведення неоад’ювантної ТТ.
Результати порівняння розмірів пухлини нирки до та після проведення неоад’ювантної ТТ у хворих на локалізований НКР представлено на рис. 3.
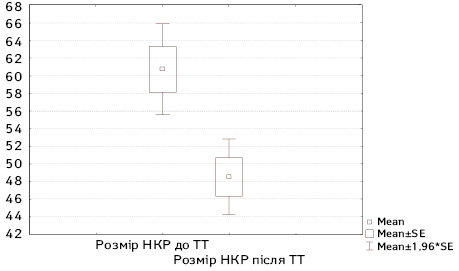
Як видно з рис. 3, проведення 2 блоків неоад’ювантної ТТ у хворих на локалізований НКР дозволило достовірно (t-test; р<0,001) знизити середній розмір пухлини нирки на 12,3 мм з (M±SD (95% ДI)) 60; 19,7 (55,7–66) до 48,5±16,4 (44,2–52,8) мм, що зіграло в ситуації локалізованого НКР ключову роль у виборі методу оперативного лікування.
Одним з головних критеріїв, що може вплинути на вибір методу лікування хворих на локалізований НКР, є об’єм функціонуючої паренхіми нирки, що входить до NCIU-нефрометрії [14, 15]. Саме тому нами проведено порівняльний аналіз цього показника до та після проведення неоад’ювантної ТТ у хворих на локалізований НКР, його результати представлено в табл. 3.
| Показник | Основна група до проведення ТТ, n=58 | Основна група після проведення ТТ, n=58 | Статистична оцінка |
|
Об’єм функціонуючої паренхіми, % (Me [25%; 75%]) |
62 [57; 77] | 83 [70; 90] | U-критерій Манна — Уітні;
р<0,001 |
Як видно з табл. 3, проведення 2 блоків неоад’ювантної ТТ у хворих на локалізований НКР дозволило достовірно (U-критерій Манна — Уітні; р<0,001) підвищити медіану об’єму функціонуючої паренхіми нирки на 21% з (Me [25%; 75%]) 62 [57; 77] до 83 [70; 90] мм.
Результати порівняння кількості проведених резекцій нирки та нефректомій за групами дослідження (з та без проведення неоад’ювантної ТТ у хворих на локалізований НКР) у ході виконання нашого рандомізованого дослідження представлено в табл. 4.
| Вид оперативного лікування | Основна група (неоад’ювантна ТТ)
n=58 |
Контрольна група (без ТТ)
n=60 |
Статистична оцінка |
| Резекція нирки, n (%) | 53 (91,4) | 20 (33,3) | x2=42,1;
р<0,001 |
| Нефректомія, n (%) | 5 (8,6) | 40 (66,7) |
Як видно з табл. 4, за умови однакових вихідних клінічних та нефрометричних параметрів у групах порівняння до проведення лікування зменшення розмірів НКР у групі неоад’ювантної ТТ дозволило в 53 випадках (91,4%) провести резекцію нирки, тоді як у групі, де ТТ не проводилася, кількість резекцій нирки була значно меншою і становила лише 20 (33,3%) випадків, різниця достовірна (x2=42,1; р<0,001).
У подальшому нами проведено пошук взаємозв’язку між розмірами пухлини нирки до та після проведення неоад’ювантної ТТ за допомогою кореляційного аналізу Пірсона, його результати представлено на рис. 4.
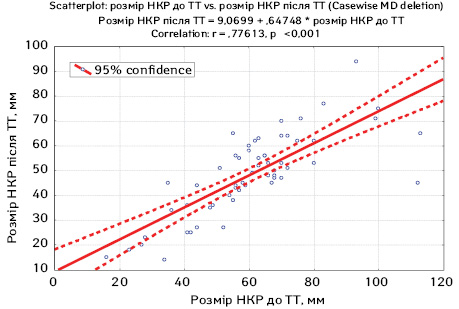
Як видно з рис. 4, у ході проведеного аналізу виявлено достовірну кореляційну пряму залежність (r=0,77613; р<0,001) розміру локалізованого НКР до проведення неоад’ювантної ТТ з розміром пухлини нирки після її проведення. Враховуючи рівень регресії пухлини нирки під дією неоад’ювантної ТТ, нами було побудовано криву прогнозування розмірів НКР після проведення неоад’ювантної ТТ на основі вихідних розмірів пухлини за даними МСКТ. Наприклад, за вихідних розмірів НКР 100 мм прогнозований розмір пухлини після проведення 2 курсів неоад’ювантної терапії з 95% вірогідністю буде знаходитися в межах 67—80 мм. Такий підхід дозволяє спрогнозувати, чи достатнім буде рівень регресії НКР для подальшого органозберігального оперативного лікування, зробити висновок про доцільність його проведення і дозволить за несприятливого результату зекономити кошти на придбанні препаратів, запобігти можливим побічним ефектам лікування таргетними препаратами та скоротити час до проведення операції, що може вплинути на онкологічну ефективність терапії та якість життя пацієнтів.
Важливим аспектом дослідження ефективності неоад’ювантної ТТ у хворих на локалізований НКР є визначення можливої залежності рівня об’єктивної відповіді на лікування від різних факторів, що, на нашу думку, в подальшому дасть можливість прогнозування ефективності терапії.
Нами проведено аналіз можливої залежності рівня об’єктивної відповіді локалізованого НКР від розміру первинного вогнища в нирці (рис. 5).
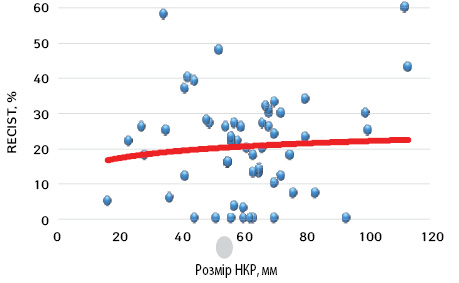
Представлені на рис. 5 дані свідчать про відсутність прямої кореляції між рівнем об’єктивної відповіді пухлини на проведення неоад’ювантної ТТ і розміром локалізованого НКР. Так, у разі пухлини розміром 113 мм рівень об’єктивної відповіді становив 43%, при цьому інша пухлина великого розміру (93 мм) зовсім не відповіла на проведення неоад’ювантної ТТ (0% регресії). Аналогічні розбіжності в рівнях об’єктивної відповіді спостерігалися при пухлинах невеликих розмірів. В одному випадку пухлина розміром 34 мм продемонструвала рівень об’єктивної відповіді на рівні 58%, в іншому випадку пухлина 36 мм дала рівень об’єктивної відповіді лише в 6%.
У подальшому нами проведено оцінку рівня регресії пухлини залежно від стадії захворювання за параметром Т (TNM-класифікації), яку представлено в табл. 5.
| Т-стадія (за TNM-класифікацією) | Регресія НКР, % M±SD (95% ДI) | Статистична оцінка |
| Т 1а, n=7 | 22,9+17,7
(6,5—39,2) |
ANOVA:
η2=0,01; power=0,1; p=0,72 |
| Т1b, n=35 | 18,8+3,2
(14,3—23,2) |
|
| Т2, n=16 | 22,3+16,3
(13,6—30,9) |
Як видно з табл. 5, сумарна статистична оцінка, проведена методом ANOVA, не виявила впливу Т-стадії НКР на відсоток регресії пухлини. Так, ефект впливу становив η2=0,01 за потужності впливу 0,1 і не був достовірно значущим (р=0,72). У подальшому нами проведено Post-hoc-аналіз методом Ньюмана — Кеулса, що засвідчив відсутність достовірної різниці між усіма підгрупами дослідження. Так, між Т1а та Т1b показник достовірності становив р=0,8, між групами Т1b та Т2 — р=0,6. Таким чином, ми не отримали підтвердження теорії про вищу ефективність ТТ у пацієнтів з невеликими розмірами первинного вогнища НКР [16].
Обговорення
Представлені в нашій роботі дані рандомізованого проспективного дослідження ефективності проведення неоад’ювантної ТТ в лікуванні хворих на локалізований НКР є єдиними у світовій літературі і показали досить перспективні результати.
Усе більша кількість наведених доказів у літературі вказує на зв’язок між хронічним захворюванням нирок і ризиком розвитку серцево-судинних захворювань. Органозберігальне лікування дозволяє зберегти додаткові функціональні нефрони за референтних показників онкологічної виживаності у порівнянні з нефректомією. Наразі розширюються показання до проведення органозберігальних оперативних втручань за межі стандартної стадії Т1а. Особливу увагу привертають двобічні ураження нирок, пухлини єдиної нирки та НКР зі симультанною патологією протилежної нирки, що значно знижує її функцію, коли проведення нефректомії може призвести до необхідності проведення діалізу у таких пацієнтів, що може бути проблематичним у зв’язку з недостатньою кількістю діалізних ліжок та високою вартістю процедури [17]. Саме в такому разі використання ТТ, що має на меті зменшення розміру пухлини та підвищення імовірності проведення резекції нирки, є досить привабливим з позиції максимального збереження функціональної паренхіми нирки [15].
В основу принципу використання неоад’ювантної ТТ при НКР покладено концепцію підвищення безпеки процедури та покращення локорегіонарного контролю [18]. Потенційна перевага використання такого підходу полягає в циторедуктивному ефекті вказаної терапії та переведенні пацієнтів, котрі мали підлягати органовиносному лікуванню, до числа тих, кому може бути проведено резекцію нирки. Ефективність цього виду лікування було досліджено з використанням сунітинібу, сорафенібу, а пізніше — пазопанібу та акситинібу [19].
Уперше позитивний ефект неоад’ювантної ТТ було описано А. Thomas та співавторами [12]. До дослідження було включено 19 пацієнтів з поширеним НКР, що не підходили для ініціальної нефректомії та підлягали терапії сунітинібом. Часткову регресію первинної пухлини відмічено у 16% (n=3) хворих, стабілізацію — у 37% (n=7) та прогресію захворювання — у 47% (n=9). Зменшення розміру пухлини відмічено у 8 з 19 (42%) пацієнтів та в середньому становило 24%, що дозволило виконати нефректомію у 4 випадках.
Більш значущою є роль неоад’ювантної ТТ у підвищенні вірогідності органозберігального лікування при НКР. J. Silberstein та співавторами доведено ефективність TT на групі з 14 пухлин (12 пацієнтів) з імперативними показаннями, у яких отримано середнє зменшення розміру НКР на 21,1%. У всіх випадках виконання резекції нирки отримано негативний хірургічний край та була відсутня необхідність у гемодіалізі [8]. Ця інформація підтвердила доцільність використання обраної методики у високоселективних пацієнтів з метою підвищення вірогідності резекції нирки.
В іншому дослідженні B.I. Rini та співавторів показано, доцільність використання пазопанібу (800 мг) в оптимізації збереження ниркової паренхіми при пухлинах високої складності та у випадках, коли нефректомія призвела б до зниження клубочкової фільтрації менше 30 мл/хв/1,73 м2. Загалом до дослідження було включено 25 пацієнтів, серед яких у 71% відмічено зменшення складності утворення та у 92% — зменшення пухлинного об’єму. Резекцію нирки в кінцевому результаті виконано у 80% (20 з 25) зі збільшенням ймовірно збереженої паренхіми зі 107 до 173 см3 (р=0,0015) [10]. В аналогічних дослідженнях J. Karam і співавторів та В. Lane і співавторів показано зменшення первинної пухлини на 28,3% та 32% відповідно з достовірно високим рівнем пацієнтів, що реагували на акситиніб та сунітиніб відповідно, що в кінцевому результаті дозволило використати органозберігальну тактику [11, 20]. Враховуючи невелику вибірку пацієнтів у літературних даних, доцільним є вивчення ролі обраного лікування на більш широких досліджуваних групах.
Представлені в нашій роботі результати дослідження ефективності проведення неоад’ювантної ТТ в лікуванні хворих на локалізований НКР виявилися доволі перспективними. Висока клінічна ефективність проведення неоад’ювантної ТТ в більшості випадків приводить до зменшення розмірів пухлини нирки у 91% пацієнтів та підвищує вірогідність подальшої органозберігальної тактики лікування, що дозволить значно знизити ризик розвитку хронічної ниркової недостатності, підвищити тривалість та якість життя пацієнтів внаслідок зниження інвалідизації.
Такий підхід дозволяє полегшити вибір хірургічної тактики при анатомічно складних пухлинах нирки. Досить важливим фактом є те, що використання неоад’ювантного лікування в онкології спрямоване на зменшення кількості побічних ефектів та покращення переносимості обраної терапії завдяки наявності двох функціонуючих нирок за максимального об’єму функціонуючої паренхіми, що значно підвищує дезінтоксикаційні можливості організму в цілому.
Проведений у нашій роботі аналіз взаємозв’язку між розмірами пухлини нирки до та після проведення неоад’ювантної ТТ за допомогою кореляційного аналізу Пірсона виявив достовірну кореляційну пряму залежність (r=0,77613; р<0,001), на основі чого було побудовано криву прогнозування розмірів НКР після проведення неоад’ювантної ТТ на основі вихідних розмірів пухлини за даними МСКТ (див. рис. 1). Такий підхід дозволяє спрогнозувати, чи достатнім буде рівень регресії локалізованого НКР для подальшого проведення органозберігального оперативного лікування, та може бути зроблено висновок про доцільність його проведення, і дозволить (у разі несприятливого результату) зекономити кошти на придбанні препаратів, запобігти можливим побічним ефектам лікування таргетними препаратами та скоротити час до проведення операції, що може вплинути на онкологічну ефективність терапії та якість життя пацієнтів.
Взаємозв’язок між розміром пухлини та ступенем регресії під впливом неоад’ювантної ТТ описали у своїй роботі B.K. Kroon та співавтори [16], які на основі лікування 78 хворих з метастатичним НКР різними препаратами групи інгібіторів тірозинкінази виявили пряму кореляційну залежність. Вони зробили висновок, що чим меншим є розмір первинної пухлини, тим вища ймовірність регресії пухлини і терапія буде більш ефективною. Однак отримані в нашій роботі результати не виявили залежності між рівнем об’єктивної відповіді пухлини на проведення неоад’ювантної ТТ і розміром локалізованого НКР.
Враховуючи всі вищенаведені дані, варто констатувати, що неоад’ювантна ТТ при локалізованому НКР є перспективним методом, спрямованим на покращення функціональних результатів лікування та зниження рівня інвалідизації пацієнтів. Крім того, впровадження методики сприяє також полегшенню вибору хірургічної тактики при анатомічно складних пухлинах нирки.
Вивчення неоад’ювантної ТТ при локалізованому НКР спрямоване на краще розуміння анатомо-функціональних змін нирок під впливом ТТ, точнішу оцінку її ефективності, визначення показань до її проведення, прогнозування перебігу етапів лікування та вибір типу хірургічного втручання.
Висновки
Проведення неоад’ювантної ТТ у хворих на локалізований НКР обумовило достовірну регресію пухлини в середньому на 20,5±14,3% за розміру первинної пухлини 60,7±19,8 мм, що забезпечило можливість проведення органозберігального оперативного лікування у 91,4% випадках у порівнянні з 33,3% серед пацієнтів, яким не проводили таку терапію (x2=42,1; р<0,0001).
Розроблено систему прогнозування рівня регресії пухлини внаслідок проведення неоад’ювантної ТТ, що дозволяє з 95% вірогідністю визначити показник зменшення її розмірів та доцільність такого лікування.
Отримані в нашому дослідженні позитивні результати проведення неоад’ювантної ТТ свідчать про клінічну обґрунтованість застосування комбінованого лікування хворих на локалізований НКР.
Список використаної Літератури
1. NCCN Guidelines Version 2. (2019). Kidney Cancer. Retrieved from https://www.nccn.org/professionals/physician_gls/pdf/kidney.pdf.
2. EAU Guidelines on Renal Cell Carcinoma. (2018). Retrieved from https://uroweb.org/guideline/renal-cell-carcinoma.
3. Smith, D. H., Thorp, M. L., Gurwitz, J. H., McManus, D. D., Goldberg, R. J., Allen, L. A., … Alan, S. (2013). Chronic kidney disease and outcomes in heart failure with preserved versus reduced ejection fraction: the Cardiovascular Research Network PRESERVE Study. Circulation: Cardiovascular Quality and Outcomes, 6(3), 333–342. doi: 10.1161/CIRCOUTCOMES.113.000221.
4. Go, A. S., Chertow, G. M., Fan, D., McCulloch, C. E., & Hsu, C. Y. (2004). Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. The New England Journal of Medicine, 351(13), 1296–1305. doi:10.1056/NEJMoa041031.
5. Herzog, C. A., Asinger, R. W., Berger, A. K., Charytan, D. M., Díez, J., Hart, R. G., … Ritz, E. (2011). Cardiovascular disease in chronic kidney disease. A clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney International, 80(6), 572–586. doi: 10.1038/ki.2011.223.
6. Huang, W. C., Levey, A. S., Serio, A. M., Snyder, M., Vickers, A. J., Raj, G. V., … Russo, P. (2006). Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a retrospective cohort study. The Lancet Oncology, 7(9), 735–740. doi: 10.1016/S1470-2045(06)70803-8.
7. Powles, T., Kayani, I., Blank, C., Chowdhury, S., Horenblas, S., Peters, J., … Bex, A. (2011). The safety and efficacy of sunitinib before planned nephrectomy in metastatic clear cell renal cancer. Annals of Oncology, 22(5), 1041–1047. doi: 10.1093/annonc/mdq564.
8. Silberstein, J. L., Millard, F., Mehrazin, R., Kopp, R., Bazzi, W., DiBlasio, C. J., … Derweesh, I. H. (2010). Feasibility and efficacy of neoadjuvant sunitinib before nephron- sparing surgery. BJU International, 106, 1270–1276. doi: 10.1111/j.1464-410X.2010.09357.
9. Hellenthal, N. J., Underwood, W., Penetrante, R., Litwin, A., Zhang, S., Wilding, G. E., … Kim, H. L. (2010). Prospective clinical trial of preoperative sunitinib in patients with renal cell carcinoma. The Journal of Urology, 184(3), 859–864. doi: 10.1016/j.juro.2010.05.041.
10. Rini, B. I., Plimack, E. R., Takagi, T., Elson, P., Wood, L. S., Dreicer, R., … Campbell, S. C. (2015). A phase II study of pazopanib in patients with localized renal cell carcinoma to optimize preservation of renal parenchyma. The Journal of Urology, 194, 297–303. doi: 10.1016/j.juro.2015.03.096.
11. Lane, B. R., Derweesh, I. H., Kim, H. L., O’Malley, R., Klink, J., Ercole, C. E., … Campbell, S. C. (2015). Presurgical sunitinib reduces tumor size and may facilitate partial nephrectomy in patients with renal cell carcinoma. Urologic Oncology, 33, 112e15–112e21. doi: 10.1016/j.urolonc.2014.11.009.
12. Thomas, A. A., Rini, B. I., Lane, B. R., Garcia, J., Dreicer, R., Klein, E. A., … Campbell, S. C. (2009). Response of the primary tumor to neoadjuvant sunitinib in patients with advanced renal cell carcinoma. The Journal of Urology, 181, 518–523. doi: 10.1016/j.juro.2008.10.001.
13. Eisenhauer, E. A., Therasse, P., Bogaerts, J., Schwartz, L. H., Sargent, D., Ford, R., … Verweij, J. (2009). New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1). European Journal of Cancer, 45(2), 228–247. doi: 10.1016/j.ejca.2008.10.026.
14. Stakhovskiy, E. O., Voylenko, O. A., Vitruk, Y. V., & Stakhovskiy, O. E. (2015). Application of nephrometry for choice of the treatment tactics in patients, suffering nephrocellular cancer. Klinichna khirurhiia, 3, 55–60.
15. Vitruk, I., Stakhovskyi, O., Voylenko, O., Kotov, V., Gavrylyuk, O., & Stakhovsky, E. (2014). N.C.I.U. nephrometry and remaining functional parenchyma as a new tool indicator for partial nephrectomy in RCC, 29th Annual EAU Congress, 11–15 April 2014. Stockholm, Sweden.
16. Kroon, B. K., de Bruijn, R., Prevoo, W., Horenblas, S., Powles, T., & Bex, A. (2013). Probability of downsizing primary tumors of renal cell carcinoma by targeted therapies is related to size at presentation. Urology, 81(1), 111–115. doi: 10.1016/j.urology.2012.09.014.
17. Shuch, B., Linehan, W. M., & Bratslavsky, G. (2011). Repeat partial nephrectomy: surgical, functional and oncological outcomes. Current Opinion in Urology, 21(5), 368–375. doi: 10.1097/MOU.0b013e32834964ea.
18. Bindayi, A., Hamilton, Z. A., McDonald, M. L., Yim, K., Millard, F., McKay, R. R., … Derweesh, I. H. (2018). Neoadjuvant therapy for localized and locally advanced renal cell carcinoma. Urologic Oncology, 36(1), 31–37. doi: 10.1016/j.urolonc.2017.07.015.
19. Hutson, T. E., Thoreson, G. R., Figlin, R. A., & Rini, B. I. (2016). The Evolution of Systemic Therapy in Metastatic Renal Cell Carcinoma. American Society of Clinical Oncology Educational Book, 35, 113–117. doi: 10.14694/EDBK_158892.
20. Karam, J. A., Devine, C. E., Urbauer, D. L., Lozano, M., Maity, T., Ahrar, K., … Wood, C. G. (2014). Phase 2 trial of neoadjuvant axitinib in patients with locally advanced non metastatic clear cell renal cell carcinoma. European Urology, 66(5), 874–880. doi: 10.1016/j.eururo.2014.01.035.
Адреса для листування:
Войленко Олег Анатолійович
03022, Київ, вул. Ломоносова 33/43
Національний інститут раку
E-mail: voylenko@ukr.net
Сorrespondence:
Oleg Voylenko
33/43 Lomonosova Str., Kyiv, 03022
National Cancer Institute
E-mail: voylenko@ukr.net














Leave a comment