Ефективність ІТК EGFR різних поколінь при НДРЛ з мутаціями EGFR: огляд клінічних досліджень та власний досвід застосування
Кобзєв О.І., Боярський О.О., Леонова В.В.
Резюме. За останні роки було досягнуто значних успіхів у лікуванні пацієнтів з недрібноклітинним раком легені з мутацією епідермального фактора росту (epidermal growth factor receptor — EGFR). Наразі розроблено вже три покоління інгібіторів тирозинкінази (ІТК) EGFR, що мають різні фармакологічні характеристики та клінічні профілі. Нами проведено огляд розвитку терапії за допомогою ІТК EGFR. У цьому контексті на особливу увагу заслуговує ІТК EGFR ІІІ покоління осимертиніб, який продемонстрував ряд переваг щодо ефективності та переносимості терапії, а також показників якості життя пацієнтів. Дані клінічних досліджень підтверджує і наш досвід у рутинній клінічній практиці.
DOI: 10.32471/clinicaloncology.2663-466X.47-3.29322
 Рак легені (РЛ) є основною причиною смертності від раку в усьому світі [1], на який припадає майже 20% смертей, пов’язаних з онкологічними захворюваннями. Поряд із цим РЛ знаходиться на другому місці за кількістю діагностованих випадків раку у світі, на нього припадає більше 10% нових випадків.
Рак легені (РЛ) є основною причиною смертності від раку в усьому світі [1], на який припадає майже 20% смертей, пов’язаних з онкологічними захворюваннями. Поряд із цим РЛ знаходиться на другому місці за кількістю діагностованих випадків раку у світі, на нього припадає більше 10% нових випадків.
В Україні рак легені є найбільш розповсюдженою локалізацією раку серед чоловіків, акумулюючи більше 15% усіх випадків. При цьому поширеність раку цієї локалізації серед жінок в Україні знаходиться на рівні 3,6% [2].
Донедавна базова схема лікування при недрібноклітинному раку легені (НДРЛ) включала хіміотерапевтичні препарати на основі платини, які, як правило, забезпечували помірні переваги у виживаності, при цьому у більшості пацієнтів прогресування захворювання виникало через 3–5 міс [3]. Розробка нових варіантів лікування для хворих на НДРЛ виявилася складною, що головним чином було пов’язано зі значною гетерогенністю захворювання з точки зору його гістологічних особливостей, геноміки та молекулярної біології. Однак протягом останнього десятиліття було виявлено декілька онкогенних факторів, на які можна активно впливати [4].
На сьогодні найкраще охарактеризованим онкогенним фактором НДРЛ є мутована форма рецептора епідермального фактора росту (epidermal growth factor receptor — EGFR). EGFR і його структурно споріднені рецептори HER2 (Neu, ErbB2), HER3 (ErbB3) і HER4 (ErbB4) складають сімейство тирозинкіназ ErbB [3, 5].
Ці рецептори утворюють ряд гомо- і гетеродимерів на поверхні пухлинних клітин та відіграють вирішальну роль у регуляції клітинної проліферації. Однак нерегульована передача сигналів через ці рецептори у зв’язку з надмірною експресією або наявність активувальних соматичних мутацій може призвести до розвитку НДРЛ [3, 5]. При НДРЛ активацію мутацій EGFR було зареєстровано у 10–15% випадків аденокарциноми у пацієнтів європеоїдної раси і у 50% випадків у пацієнтів азійського походження [6].
Для лікування пацієнтів, у пухлинах яких виявлено мутований EGFR, розроблено інгібітори тирозинкінази (ІТК), які блокують передачу сигналів від EGFR [3, 5,6]. Мутації гена EGFR відмічають у 1/5 українських пацієнтів з НДРЛ (аденокарцинома), при цьому їх поширеність є вищою серед жінок та не залежить від віку пацієнтів [7].
ІТК EGFR порівняно із хіміотерапією
ІТК EGFR І покоління — гефітиніб і ерлотиніб, і ІТК ІІ покоління — афатиніб, спочатку порівнювали з різними схемами хіміотерапії платиновмісними препаратами. Незважаючи на те, що ці дослідження мали подібний дизайн і, без сумніву, підтверджували ефективність застосування ІТК EGFR як препаратів І лінії терапії у хворих на НДРЛ з мутацією EGFR, порівняння між дослідженнями для визначення того, який ІТК найбільше підходить для певного пацієнта, було неможливим.
Кілька досліджень III фази продемонстрували перевагу ерлотинібу, гефітинібу та афатинібу порівняно зі стандартною хіміотерапією платиновмісними препаратами щодо виживаності без прогресування (ВБП) для хворих з прогресуючим НДРЛ з мутацією EGFR, які раніше не отримували лікування. У дослідженні III фази EURTAC ерлотиніб забезпечив значну користь у ВБП порівняно з хіміотерапією на основі платини (9,7 проти 5,2 міс; p <0,0001) у пацієнтів з Європи [8].
У дослідженні III фази OPTIMAL також повідомлялося про значну перевагу щодо ВБП при застосуванні ерлотинібу порівняно з гемцитабіном/карбоплатином для пацієнтів азійського походження (13,1 проти 4,6 міс; p <0,0001) [9].
Результати подальшого дослідження III фази ENSURE підтвердили переваги щодо ВБП при застосуванні ерлотинібу порівняно з гемцитабіном/цисплатином для ширшої вибірки азійського населення (11,0 проти 5,5 міс; p <0,0001) [10].
Було показано, що гефітиніб значно покращував ВБП порівняно з паклітакселом/карбоплатином (9,5 проти 6,3 міс; p <0,001; підгрупа з мутацією EGFR), паклітакселом/карбоплатином (10,8 проти 5,4 міс; p <0,001) і цисплатином/доцетакселом (9,2 проти 6,3 міс; p <0,0001). Нарешті в дослідженнях LUX-Lung 3 та LUX-Lung 6 афатиніб значно подовжував ВБП порівняно з цисплатином/пеметрекседом (13,6 проти 6,9 міс; p=0,001) і цисплатином/гемцитабіном (11,0 проти 5,6 міс; p <0,0001) відповідно у пацієнтів з мутаціями [11, 12].
Незважаючи на складнощі в порівнянні між дослідженнями, відсутність прямих даних на той час спричинила необхідність у ряді метааналізів, спрямованих на порівняння результатів для доступних препаратів у І лінії лікування. У більшості із цих досліджень не виявили істотних відмінностей у ВБП між ІТК EGFR І та ІІ покоління.
За результатами переважної частини клінічних досліджень застосування ІТК EGFR не приносило значної користі щодо загальної виживаності (ЗВ) у співставленні з препаратом порівняння.
Формування резистентності до ІТК EGFR І покоління та розробка ІТК EGFR ІІІ покоління
Виявлення того, що в багатьох випадках T790M лежить в основі набутої резистентності до ІТК І покоління, спонукало до пошуку малих молекул, які потужно інгібують проліферацію T790M-позитивних пухлин. Одним з таких препаратів є ІТК EGFR ІІІ покоління — осимертиніб, необоротний інгібітор як первинних мутацій EGFR, так і вторинних мутацій Т790М, з вираженою селективністю порівняно з рецептором дикого типу [13]. У зв’язку з вираженою клінічною активністю у пацієнтів з Т790М-позитивними пухлинами осимертиніб спочатку був показаний пацієнтам з метастатичним НДРЛ з мутацією EGFR T790M після неефективності ІТК І лінії терапії. Однак після дослідження ІІІ фази FLAURA (осимертиніб порівняно з ерлотинібом або гефітинібом) осимертиніб також було схвалено як препарат І лінії для пацієнтів з НДРЛ з мутаціями EGFR [14].
FLAURA: осимертиніб у порівнянні з ерлотинібом або гефітинібом
Подвійне сліпе клінічне дослідження III фази FLAURA було проведено за участю хворих на НДРЛ з мутацією EGFR (Del19; L858R), включаючи пацієнтів з метастазами в головний мозок [14]. Первинною кінцевою точкою була ВБП. Виявлено суттєве покращення ВБП у пацієнтів, які отримували осимертиніб, порівняно з гефітинібом або ерлотинібом (медіана 17,7 проти 9,7 міс; відношення ризиків (ВР) 0,45; 95% довірчий інтервал (ДІ) 0,36–0,57; p <0,001). Перевага ВБП була однаковою в усіх підгрупах хворих, включаючи пацієнтів з мутаціями Del19 (ВР 0,43; 95% ДІ 0,32–0,56) і L858R (ВР 0,51; 95% ДІ 0,36–0,71) (рис. 1).
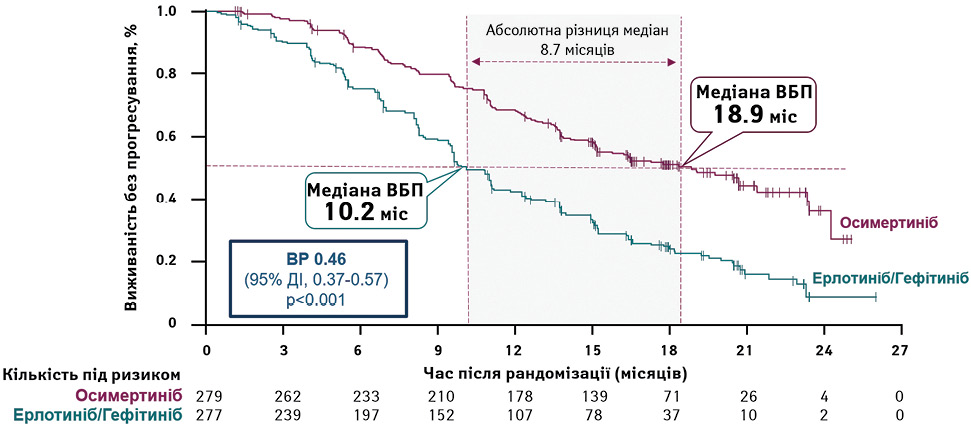
Примітки: ВБП — виживаність без прогресування, ВР – відносний ризик, ДІ – довірчий інтервал.
Осимертиніб є ефективним щодо наявних уражень центральної нервової системи (ЦНС) і знижує ризик прогресування захворювання у ЦНС відповідно до результатів рандомізованих досліджень і клінічних даних [15–17]. У дослідженні FLAURA ВБП у ЦНС (ВР 0,48; 95% ДІ 0,26–0,86; p=0,014) і частота відповіді у ЦНС (66% проти 43%; p=0,01) були значно кращими в групі, що отримувала осимертиніб, порівняно з пацієнтами, яким було призначено ерлотиніб/гефітиніб. Крім того, конкуруючий аналіз ризиків показав, що ймовірність прогресування у ЦНС (за відсутності прогресування поза ЦНС або смерті) через 12 міс становила 8% для осимертинібу та 24% для ерлотинібу/гефітинібу [16].
Цілком ймовірно, що покращення ВБП при застосуванні осимертинібу було пов’язане з його активністю щодо T790M. Нещодавні дослідження продемонстрували, що в багатьох випадках невелика кількість клітин у пухлинах з мутацією EGFR може також одночасно нести мутацію T790M, і ці клітини будуть відібрані та клонально розмножаться під час лікування ІТК І покоління [18]. Осимертиніб, ймовірно, навпаки, запобігає клональній експансії вже наявних клітин T790M або появі нових T790M-позитивних клонів. Не було виявлено статистично значущої різниці в частоті відповіді на лікування осимертинібом порівняно з EGFR ІТК І покоління. Однак тривалість відповіді була подовжена при застосуванні осимертинібу (медіана 17,2 проти 8,5 міс відповідно) [14].
Оновлений аналіз FLAURA продемонстрував, що осимертиніб забезпечив значну користь щодо підвищення ЗВ порівняно з гефітинібом/ерлотинібом (медіана 38,6 проти 31,8 міс; ВР 0,80; 95% ДІ 0,64–1,00; p=0,046) [19].
ЗВ була в основному однаковою для всіх підгруп пацієнтів, за винятком хворих азійського походження (ВР 1,00; 95% ДІ 0,75–1,32) і пацієнтів з L858R-позитивними пухлинами (ВР 1,00; 95% ДІ 0,75–1,32). Статистична різниця у величині ефекту терапії між азійськими та неазійськими пацієнтами спостерігалася на рівні 10% (p=0,0127) [20].
Так, в основній популяції осимертиніб показав перевагу перед ІТК І покоління щодо зниження ризику смерті на 20%, але в неазійській популяції, яка є більшою в Україні, ця перевага є ще вираженішою: зниження ризику смерті на 46% і абсолютна різниця медіан середньої виживаності у 19 міс (рис. 2).
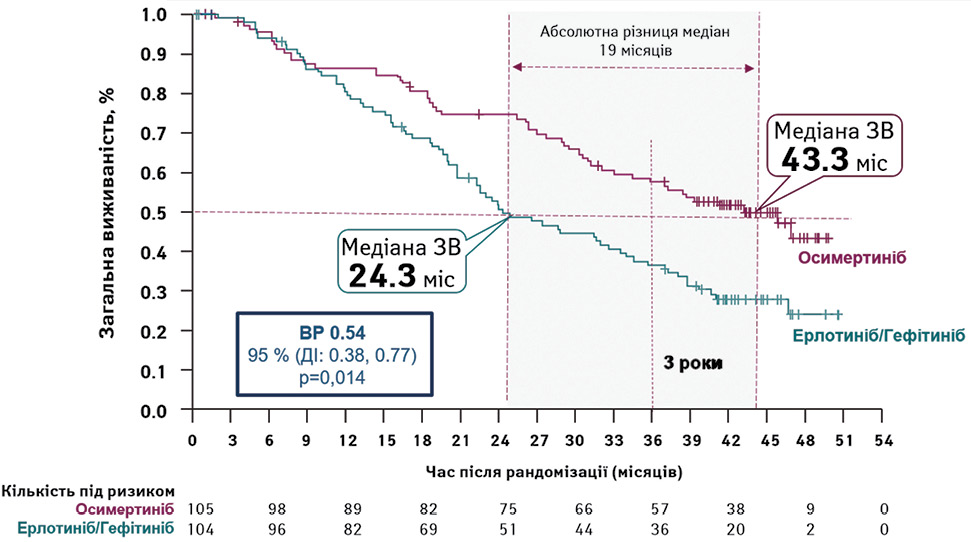
Примітки: ЗВ — загальна виживаність, ВР — відносний ризик, ДІ — довірчий інтервал.
Користь щодо ЗВ при застосуванні осимертинібу була подібною для пацієнтів з (ВР 0,83; 95% ДІ 0,53–1,30) і без (ВР 0,79; 95% ДІ 0,61–1,01) метастазів у головний мозок.
При цьому ЗВ в якості кінцевої точки роздягається Управлінням з контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA) як найнадійніша кінцева точка в контексті досліджень онкологічних препаратів, і, якщо можливо провести дослідження з адекватною оцінкою ЗВ, це зазвичай є кращою кінцевою точкою [21].
Профіль безпеки. Оскільки осимертиніб має низьку спорідненість до EGFR дикого типу, він має характеризуватися кращим профілем переносимості, ніж ІТК EGFR І покоління, і можна очікувати, що він матиме кращий профіль, ніж ІТК EGFR ІІ покоління, хоча прямих даних немає [14]. Так, у дослідженні FLAURA частота побічних ефектів ≥3 ступеня була нижчою для осимертинібу, ніж для гефітинібу/ерлотинібу (34% порівняно з 45% відповідно). Поширеними побічними ефектами, пов’язаними з лікуванням, були висип/акне (усі ступені — 54% порівняно з 74%; ступінь ≥3 — 1% порівняно з 7%), діарея (усі ступені — 49% порівняно з 51%; ступінь ≥3 — 2% для обох груп) та сухість шкіри (усі ступені — 33% для обох груп; ступінь ≥3 — <1% порівняно 1%). Небажані ефекти з боку серця (подовження інтервалу Q–T) частіше спостерігалися при застосуванні осимертинібу (усі ступені — 10% проти 5%; ступінь ≥3 — 2% проти <1%). Частота серйозних побічних ефектів (пов’язаних із лікуванням чи ні) становила 22% для осимертинібу та 25% для гефітинібу/ерлотинібу. Остаточне припинення прийому досліджуваного препарату через побічні ефекти, пов’язані з терапією, було подібним у всіх групах лікування (10% з осимертинібом; 14% з гефітинібом/ерлотинібом).
Крім того, у рамках дослідження FLAURA було проведено опитування пацієнтів, відповідно до якого в групі осимертинібу спостерігався статистично кращий емоційний стан (8,79 проти 4,91; p=0,004) та рівень соціального функціонування (7,66 проти 1,74; p <0,001) порівняно із ІТК І покоління [22].
Клінічний випадок. Наш практичний досвід підтверджує ефективність застосування осимертинібу у пацієнтів з НДРЛ. Зокрема, хочемо представити клінічний випадок пацієнтки, яка вже 3 роки безперервно, на постійній основі приймає осимертиніб, що забезпечує їй тривалу виживаність без прогресії захворювання.
Пацієнтка 1955 р. н. з метастатичною формою НДРЛ (ураження легень і метастази в кістки), яка ніколи не курила, на момент встановлення діагнозу мала скарги на загальну слабкість, біль у ділянці крижово-клубового зчленування.
Основний діагноз встановлено як периферичний рак середньої частки правої легені сT1bN3M1с(oss), стадія IVb, 2-га клінічна група (TNM-8). Відповідно до результатів імуногістохімічного дослідження встановлено, що пухлина представлена аденокарциномою, EGFR+, ALK-, ROS-, PDL1 5%.
Комп’ютерна томографія (КТ) органів грудної клітки, органів черевної порожнини, малого таза та головного мозку показала наявність вогнища ураження 13×15 мм периферичного відділу середньої частки правої легені, метастази в кістки, лімфовузли середостіння праворуч. Гістологія біопсії надключичного лімфовузла підтвердила наявність метастазів.
За результатами генетичного тестування було виявлено EGFR-мутацію Exon 19 Del в клітинах пухлини.
У пацієнтки спочатку були скарги на сильний біль у ділянці крижово-копчикового зчленування внаслідок метастатичного пошкодження кістки. Проведено променеву терапію на ділянку крижово-клубового зчленування (сумарна вогнищева доза 30 Гр), поки визначався мутаційний статус пухлини. Приблизно через 1 міс після початку лікування скарги на біль у кістках зникли.
Після виявлення EGFR мутації було розпочато таргетну терапію препаратом осимертинібу 80 мг із серпня 2019 р. Після призначення осимертинібу вже на наступному КТ-контролі в листопаді 2019 р. (тобто через 3 міс) було зафіксовано зменшення новоутворення на 60%, що відповідає критерію часткової відповіді на терапію. Такий результат зберігається протягом усього періоду лікування, який наразі становить вже більше 3 років.
Після року введення золедронової кислоти (4 мг внутрішньовенно через кожні 28 днів) у зв’язку з метастазами в кістці було прийнято рішення про припинення її застосування, оскільки спостерігалася стійка відповідь на лікування осимертинібом (рис. 3).
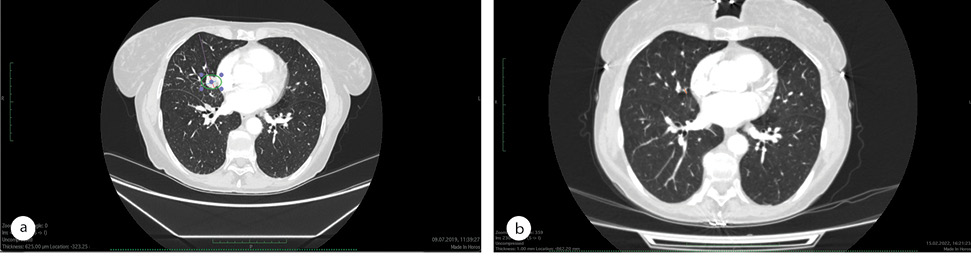
Останній КТ-контроль було проведено 15 лютого 2022 р. Часткова відповідь пухлини зберігається. Більше КТ-контроль після цієї дати не виконували, оскільки пацієнтці страшно діставатися до КТ-центру у зв’язку з воєнними діями.
Протягом лікування перерв у терапії не було, зниження дози препарату теж не проводили.
Здійснювали постійний контроль за клінічним аналізом крові. Клінічно значущих змін протягом лікування не відмічали.
Було зафіксовано наступні небажані ефекти: сухість шкіри обличчя, відчуття стягування шкіри в ділянці очей. Це небажане явище виникло через 6 міс від початку лікування, тривало кілька місяців, потім настала ремісія на кілька місяців, потім рецидив. Такий хвилеподібний перебіг спостерігається протягом усього лікування.
Таким чином, за останні роки було досягнуто значних успіхів у лікуванні хворих НДРЛ з мутацією EGFR. Дослідження FLAURA продемонструвало переваги ІТК EGFR ІІІ покоління осимертинібу в якості лікування І лінії порівняно з ІТК EGFR І покоління. Так, результати дослідження FLAURA підтвердили переваги осимертинібу щодо ВБП та ЗВ порівняно з гефітинібом/ерлотинібом, а також хорошу переносимість і активність щодо метастазів у ЦНС, що позиціонує осимертиніб як обґрунтований варіант лікування І лінії. Ефективність терапії І лінії з використанням осимертинібу хворих на НДРЛ з мутацією EGFR підтверджують результати, отримані нами в реальній клінічній практиці.
Список використаної літератури
1. World Health Organisation (2020). Cancer Fact Sheet 2020.
2. Бюлетень Національного канцер-реєстру України, 23. (2022).
3. Roskoski, Jr. R. (2014). The ErbB/HER family of protein-tyrosine kinases and cancer. Pharmacological research, 79, 34–74.
4. Shah, R., & Lester, J. F. (2020). Tyrosine Kinase Inhibitors for the Treatment of EGFR Mutation-Positive Non-Small-Cell Lung Cancer: A Clash of the Generations. Clinical lung cancer, 21(3), e216–e228. doi.org/10.1016/j.cllc.2019.12.003.
5. Yarden, Y., & Pines, G. (2012). The ERBB network: at last, cancer therapy meets systems biology. Nature Reviews Cancer, 12(8), 553–563.
6. Chan, B. A., & Hughes, B. G. (2015). Targeted therapy for non-small cell lung cancer: current standards and the promise of the future. Translational lung cancer research, 4(1), 36.
7. Шпарик, Я. В., Пономарьова, О. В., Соколов, В. В., Кобзєв, О. І., Суховерша, О. А., Борисюк, Б. О., … Шапочка, Д. О. (2020). Поширеність мутацій гена EGFR в українських пацієнтів з місцево-поширеним або метастатичним недрібноклітинним раком легені. Клінічна онкологія, 10 (1–2), 37–38.
8. Rosell, R., Carcereny, E., Gervais, R., Vergnenegre, A., Massuti, B., Felip, E., … Paz-Ares, L. (2012). Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. The lancet oncology, 13(3), 239–246.
9. Zhou, C., Wu, Y. L., Chen, G., Feng, J., Liu, X. Q., Wang, C., … You, C. (2011). Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. The lancet oncology, 12(8), 735–742.
10. Wu, Y. L., Zhou, C., Liam, C. K., Wu, G., Liu, X., Zhong, Z., … & Zuo, Y. (2015). First-line erlotinib versus gemcitabine/cisplatin in patients with advanced EGFR mutation-positive non-small-cell lung cancer: analyses from the phase III, randomized, open-label, ENSURE study. Annals of oncology, 26(9), 1883–1889.
11. Sequist, L. V., Yang, J. C. H., Yamamoto, N., O’Byrne, K., Hirsh, V., Mok, T., … Schuler, M. (2013). Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. Journal of clinical oncology, 31(27), 3327–3334.
12. Wu, Y. L., Zhou, C., Hu, C. P., Feng, J., Lu, S., Huang, Y., … Geater, S. L. (2014). Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. The lancet oncology, 15(2), 213–222.
13. Finlay, M. R. V., Anderton, M., Ashton, S., Ballard, P., Bethel, P. A., Box, M. R., … Wrigley, G. L. (2014). Discovery of a potent and selective EGFR inhibitor (AZD9291) of both sensitizing and T790M resistance mutations that spares the wild type form of the receptor. J. Med. Chem., 57(20), 8249–8267.
14. Soria, J. C., Ohe, Y., Vansteenkiste, J., Reungwetwattana, T., Chewaskulyong, B., Lee, K. H., … Ramalingam, S. S. (2018). Osimertinib in untreated EGFR-mutated advanced non–small-cell lung cancer. New England journal of medicine, 378(2), 113–125.
15. Mok, T. S., Wu, Y. L., Ahn, M. J., Garassino, M. C., Kim, H. R., Ramalingam, S. S., … Papadimitrakopoulou, V. A. (2017). Osimertinib or platinum–pemetrexed in EGFR T790M–positive lung cancer. New England Journal of Medicine, 376(7), 629–640.
16. Reungwetwattana, T., Nakagawa, K., Cho, B. C., Cobo, M., Cho, E. K., Bertolini, A., … Vansteenkiste, J. (2018). CNS response to osimertinib versus standard epidermal growth factor receptor tyrosine kinase inhibitors in patients with untreated EGFR-mutated advanced non-small-cell lung cancer. Journal of Clinical Oncology, 36(33), 3290–3297.
17. Xing, P., Mu, Y., Hao, X., Wang, Y., & Li, J. (2019). Data from real world to evaluate the efficacy of osimertinib in non-small cell lung cancer patients with central nervous system metastasis. Clinical & translational oncology : official publication of the Federation of Spanish Oncology Societies and of the National Cancer Institute of Mexico, 21(10), 1424–1431. doi.org/10.1007/s12094-019-02071-5.
18. Kohsaka, S., Petronczki, M., Solca, F., & Maemondo, M. (2019). Tumor clonality and resistance mechanisms in EGFR mutation-positive non-small-cell lung cancer: implications for therapeutic sequencing. Future Oncology, 15(6), 637–652.
19. Ramalingam, S. S., Gray, J. E., Ohe, Y., Cho, B. C., Vansteenkiste, J., Zhou, C., … Planchard, D. (2019). Osimertinib vs comparator EGFR-TKI as first-line treatment for EGFRm advanced NSCLC (FLAURA): final overall survival analysis, Ann Oncol., 30, 851–934.
20. Ramalingam, S. S., Vansteenkiste, J., Planchard, D., Cho, B. C., Gray, J. E., Ohe, Y., … Soria, J. C. (2020). Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. New England Journal of Medicine, 382(1), 41–50. doi.org/10.1056/NEJMoa1913662.
21. Clinical Trial Endpoints for the Approval of Cancer Drugs and Biologics Guidance for Industry U.S. Department of Health and Human Services Food and Drug Administration Oncology Center of Excellence Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) December 2018.
22. Leighl, N. B., Karaseva, N., Nakagawa, K., Cho, B. C., Gray, J. E., Hovey, T., … Novello, S. (2020). Patient-reported outcomes from FLAURA: Osimertinib versus erlotinib or gefitinib in patients with EGFR-mutated advanced non-small-cell lung cancer. European Journal of Cancer, 125, 49–57. doi.org/10.1016/j.ejca.2019.11.00.














Leave a comment