Трансабдомінальна ультрасонографія в діагностиці поліпів ободової кишки
Щербіна О.В., Коваль О.В., Жайворонок М.М.
Резюме. Аденоматозні зазубрені поліпи товстої кишки характеризуються ризиком переродження у злоякісні пухлини. Методи колоректального скринінгу можуть запобігти цьому та знизити смертність внаслідок раку. Мета. Оцінити можливості трансабдомінальної ультрасонографії (УСГ) в діагностиці поліпів ободової кишки. Матеріали та методи. Проведено аналіз результатів трансабдомінальної УСГ у 74 пацієнтів, у яких під час гістологічного аналізу матеріалів було діагностовано поліп товстої кишки. Вік обстежуваних варіював у межах 31–78 років, серед них 46 (62,2%) чоловіків та 28 (37,8%) жінок. Результати. Усього було виявлено 172 поліпів — з них 33 (19,2±3,0%) у висхідній, 23 (13,4±2,6%) — у поперечній, 47 (27,3±3,4%) — у низхідній і 69 (40,1±3,7%) — у сигмовидній ободовій кишці. Кількість поліпів сигмовидної ободової кишки була достовірно (p <0,01) більшою, ніж в інших відділах ободової кишки. У 75 (43,6±3,8%) випадках розміри поліпів були меншими за 10 мм, у 97 (56,4±3,8%) — понад 10 мм (p <0,05). Кількість поліпів розміром <10 мм у висхідній ободовій кишці становила 12 (16,0±4,2%), розміром >10 мм — 21 (21,6±4,2%), у поперечній ободовій кишці — 6 (8,0±3,1%) та 17 (17,5±3,9%), у низхідній ободовій кишці — 19 (25,3±4,9%) та 28 (28,9±4,6%), а у сигмовидній ободовій кишці — 38 (50,7±5,8%) та 31 (32,0±4,7%) відповідно. Лише у сигмовидній ободовій кишці кількість виявлених поліпів розміром <10 мм достовірно (p <0,05) перевищувала кількість поліпів розміром >10 мм. У 79 (45,9±3,8%) випадках поліпи були на ніжці, у 93 (54,1±3,8%) — на широкій основі. У висхідній ободовій кишці було виявлено 13 (36,4±8,4%) поліпів на ніжці та 20 (63,6±8,4%) — на широкій основі (p <0,05). Для поперечної ободової кишки ці показники становили 6 (26,1±9,2%) та 17 (73,9±9,2%) (p <0,001), для низхідної ободової кишки — 16 (34,0±7,1%) та 31 (66,0±7,1%) (p <0,001), а для сигмовидної — 41 (59,4±5,9%) та 28 (40,6±5,9%) поліпів. Лише у сигмовидній ободовій кишці кількість виявлених поліпів на ніжці достовірно (p <0,01) перевищувала таку на широкій основі. Аденоматозні поліпи у 47 (40,3±4,5%) випадках були на ніжці, у 72 (59,7±4,5%) — на широкій основі (p <0,05), залозисті поліпи — у 32 (60,4) ±6,7%) випадках на ніжці, у 21 (39,6±6,7%) — на широкій основі (p <0,05). При УСГ аденоматозні поліпи на ніжці було виявлено у 46 (97,9±2,1%) з 47 випадків, на широкій основі — у 64 (88,9±3,7%) з 72, залозисті поліпи на ніжці — у 31 (96,9±3,1%) з 32 випадків, на широкій основі — у 15 (71,4±9,9%) з 21 відповідно. Поліпи на ніжці при УСГ виявляли достовірно (p <0,05) краще, ніж на широкій основі. При УСГ поліпи у висхідній ободовій кишці виявлено у 27 (81,8±6,7%), у поперечній ободовій кишці — у 18 (78,3±8,6%), у низхідній ободовій кишці — у 44 (93,6±3,6%), у сигмовидній ободовій кишці — у 67 (97,1±2,0%) випадках відповідно. Частота виявлення поліпів у сигмовидній ободовій кишці при УСГ виявилася достовірно вищою (p <0,05), ніж у висхідній та поперечній. Чутливість УСГ під час діагностики аденоматозних поліпів ободової кишки становила 87,4%, специфічність — 66,7%, точність — 86,4%. У діагностиці залозистих поліпів ободової кишки ці показники становили 92,5; 80,0; 91,4% відповідно. Висновки. Середня кількість поліпів товстої кишки у пацієнтів літнього віку є достовірно (p <0,05) більшою, ніж у молодому. Ультрасонографічно поліпи сигмовидної кишки виявляються достовірно (p <0,05) частіше, ніж висхідної та поперечної ободової кишки. Чутливість сонографічної колонографії в діагностиці аденоматозних поліпів становить 87,4%, залозистих поліпів — 92,5%, за розмірів поліпів <10 мм — 86,7%, >10 мм — 92,8% відповідно.
Одержано 28.02.2023
Прийнято до друку 06.03.2023
DOI: 10.32471/clinicaloncology.2663-466X.49-1.29919
Вступ
Поліпи товстої кишки є доброякісними утвореннями на поверхні слизової оболонки органа, частина з яких протягом 5–15 років може перероджуватися у злоякісні пухлини, проникаючи в глибокі шари стінки товстої кишки. Методи колоректального скринінгу можуть запобігти розвитку раку та знизити смертність внаслідок нього. Колоноскопія вважається «золотим стандартом», з яким порівнюють інші методи, хоча менш інвазивні методи, такі як комп’ютерна томографічна колонографія (КТК), стають дедалі популярнішими [1]. Ризик розвитку колоректального раку (КРР) підвищується серед осіб з аденоматозними поліпами, а також тих, у кого серед родичів першої лінії було виявлено онкопатологію. У пацієнтів з аденоматозними поліпами вірогідність виникнення КРР підвищується вдвічі, а якщо діагностовано рак у кількох родичів першого ступеня спорідненості, то ризик зростає у 3–4 рази [2, 3].
Літній вік, малорухливий спосіб життя, абдомінальне ожиріння, куріння та загальна кількість поліпів, виявлених під час контрольної колоноскопії, є факторами ризику розвитку КРР. Пацієнти із зазубреними поліпами І ступеня також потребують більш ретельного спостереження, ніж інші із залозистими поліпами. Зазубрені та сидячі поліпи розміром навіть менше 10 мм характеризуються вищою ймовірністю виникнення онкопатології, ніж залозисті поліпи на ніжці [4]. Захворюваність та смертність від КРР можуть знижуватися в міру поліпшення скринінгу та спостереження за пацієнтами з поліпами [5].
Методи скринінгу та спостереження значною мірою різняться за ефективністю. Основними показниками ефективності методів скринінгу є зниження захворюваності та смертності від КРР. Оскільки в більшості випадків цей вид онкопатології розвивається з передракових поліпів, що повільно ростуть, методи скринінгу і спостереження також можуть бути оцінені за їх здатністю виявляти поліпи різних розмірів і типів. Поліпи товстої кишки можна розділити на різні категорії: розміром до 5 мм (маленькі), від 6 до 10 мм (середні) та більші за 10 мм (великі). Поліпи розміром понад 10 мм зазвичай вважаються клінічно значущими, а поліпи до 5 мм — клінічно незначущими. Ефективний скринінг здатний виявляти поліпи середнього та великого розміру [6].
У переродженні аденоми товстої кишки на аденокарциному важлива роль відводиться генній трансформації в клітинах новоутворення [7]. За даними ряду авторів, приблизно 15–35% випадків спорадичного КРР виникають за попередньої наявності зазубрених поліпів та аденом [8–12]. Проксимальні та дистальні гіперпластичні поліпи характеризуються підвищеним ризиком формування метахронних сидячих зубчастих поліпів [13, 14]. Деякі аденоми розміром до 9 мм можуть прогресувати до занедбаних станів протягом 2–3 років. Визначення біологічного значення цих поліпів є необхідним, щоб напрацювати показання до поліпектомії [15].
Колоноскопічна поліпектомія є основою ефективної профілактики КРР. Епідеміологічні дані зі США, де захворюваність на цей вид раку стабільно знижується паралельно з поліпшенням скринінгу, надають незаперечні докази ефективності поліпектомії [16, 17]. КТК є менш інвазивним методом, альтернативним колоноскопії. Результати багатоцентрових досліджень демонструють ефективність КТК у візуалізації поліпів та аденокарцином розміром 6–10 мм, що сприяло її включенню до програми скринінгу КРР. Показано, що скринінг за допомогою КТК для виявлення неоплазії на пізніх стадіях є ефективнішим, ніж колоноскопія [18, 19].
Під час рутинних сонографічних досліджень товстої кишки випадково можуть виявити великі поліпи на стінці у вигляді утворень округлої або овальної форми, з чітким контуром, зниженою ехогенністю. При кольоровому доплерівському дослідженні нерідко визначаються колірні судинні сигнали. Своєчасне виявлення таких утворень дозволить знизити частоту КРР, оскільки нерідко під час їх гістологічного дослідження виявляють ранню карциному [20].
Чутливість гідроколоносонографії поступово зростає зі збільшенням розмірів поліпів. Сонографія характеризується чутливістю, порівнянною з КТК, у разі уражень розміром понад 6 мм, але вона виявляється нижчою при розмірах пухлини менше 5 мм. Використання ультразвукової контрастної речовини значно покращує візуалізацію виявлених утворень, особливо на тлі фекальних залишків [21].
Цікавою є оцінка можливостей ультрасонографії (УСГ) під час діагностики поліпів ободової кишки.
Мета дослідження — оцінка діагностичної ефективності УСГ в ідентифікації, визначенні локалізації та поширеності раку ободової кишки.
Матеріали та методи
Проведено ретроспективний аналіз результатів УСГ у 74 пацієнтів з поліпами ободової кишки. Діагноз «поліп» було встановлено в результаті колоноскопічного дослідження з біопсією. Вік обстежуваних варіював у межах 31–78 років, серед них було 46 (62,2%) чоловіків та 28 (37,8%) жінок. Кількість пацієнтів молодого віку (≤44 роки) — 14 (18,9%), з них 9 (12,2%) чоловіків та 5 (6,7%) жінок, середнього віку (45–59 років) — 37 (50,0%): 21 (28,4%) чоловік та 16 (21,6%) жінок, від 60 років — 23 (31,1%): 16 (21,6%) чоловіків, 7 (9,5%) жінок відповідно (табл. 1).
| Вік, років | Стать | Усього | |
| чоловіки | жінки | ||
| <45 | 9 (12,2) | 5 (6,7) | 14 (18,9) |
| 45–59 | 21 (28,4) | 16 (21,6) | 37 (50,0) |
| ≥60 | 16 (21,6) | 7 (9,5) | 23 (31,1) |
| Усього | 46 (62,2) | 28 (37,8) | 74 (100,0) |
УСГ органів черевної порожнини проводили після колоноскопічного дослідження. Деяким пацієнтам її здійснювали для скринінгу.
Статистична обробка результатів дослідження проводилася з використанням однофакторного дисперсійного аналізу із застосуванням критеріїв хі-квадрату. Достовірність відмінностей між середніми показниками оцінювали за t-критерієм Стьюдента.
Результати
У 74 пацієнтів діагностували 172 поліпи, з них 33 (19,2±3,0%) — у висхідній ободовій кишці, 23 (13,4±2,6%) — у поперечній ободовій кишці, 47 (27,3±3,4%) — у низхідній ободовій кишці та 69 (40,1±3,7%) — у сигмовидній ободовій. Кількість поліпів сигмовидної ободової кишки була достовірно більшою, ніж низхідної ободової (p <0,05), поперечної ободової (p <0,001) та висхідної ободової (p <0,001) кишок. Крім того, поліпи низхідного відділу ободової кишки відмічали достовірно (p <0,01) частіше, ніж поперечного.
Серед пацієнтів молодого віку кількість поліпів становила 19 (11,0±2,4%), середнього віку — 74 (41,3±3,8%) (p <0,05) та похилого віку — 82 (47,7±3,8%) (p <0,05) відповідно. Середня кількість поліпів на одного хворого серед осіб молодого віку становила 1,36±0,41, середнього віку — 1,92±0,48, похилого віку — 3,57±0,67 відповідно. Середня кількість поліпів на одного пацієнта серед осіб похилого віку достовірно перевищувала відповідний показник осіб середнього (p <0,05) та молодого (p <0,01) віку (табл. 2).
| Вік, років | Кількість поліпів | Кількість пацієнтів | Середня кількість поліпів на пацієнта |
| ≤44 | 19 (11,0±2,4%) | 14 (18,9±4,6%) | 1,36±0,41 |
| 45–59 | 71 (41,3±3,8%) | 37 (50,0±5,8%) | 1,92±0,48 |
| ≥60 | 82 (47,7±3,8%) | 23 (31,1±5,4%) | 3,57±0,67
p 3–2 <0,05 p 3–1 <0,01 |
З усіх поліпів висхідної ободової кишки (33 поліпи) на молодий вік припадало 4 (12,1±5,7%), середній вік — 15 (45,5±8,7%), на літній вік — 14 (42,4±8,6%) відповідно. Для поперечної ободової кишки (23 поліпи) ці показники становили — 3 (13,0±7,0%), 11 (47,8±10,4%) і 9 (39,1±10,2%), для низхідної ободової кишки (47 поліпів) — 7 (14,9±5,2%), 19 (40,4±7,2%) і 21 (44,7±7,3%) та для сигмовидної ободової кишки (69 поліпів) — 5 (7,2±3,1%), 26 (37,7±5,8%) і 38 (55,1±6,0%) відповідно. Частота виявлення поліпів серед осіб літнього віку виявилася найбільшою в сигмовидній ободовій кишці (55,1±6,0%), однак різниця всередині вікових груп між відділами ободової кишки не була достовірною.
Серед пацієнтів молодого віку (19 поліпів) кількість поліпів у висхідній ободовій кишці становила 4 (21,0±9,4%), у поперечній ободовій кишці — 3 (15,8±8,4%), у низхідній ободовій кишці — 7 (36,8±11,1%), у сигмовидній ободовій кишці — 5 (26,3±10,1%) відповідно. Серед осіб середнього віку ці показники (71 поліп) становили 15 (21,1±4,8%), 11 (15,5±4,3%), 19 (26,8±5,3%) та 26 (36,6±5,7%), а серед осіб похилого віку (82 поліпи) — 14 (17,1±4,2%), 9 (11,0±3,5%), 21 (25,6±4,8%) та 38 (46,3±5,5%) відповідно. Частота виявлення поліпів у сигмовидній ободовій кишці серед осіб літнього віку виявилася найвищою (46,3±5,5%), однак різниця всередині відділів ободової кишки між віковими групами не була достовірною.
За розмірами всі поліпи було розподілено на 2 групи: <10 мм (I група) та >10 мм (II група). У 75 (43,6±3,8%) випадках розміри поліпів були меншими за 10 мм, у 97 (56,4±3,8%) — понад 10 мм (p <0,05). Кількість поліпів у висхідній ободовій кишці в I групі становила 12 (16,0±4,2%), у II групі — 21 (21,6±4,2%), у поперечній ободовій кишці — 6 (8,0±3,1%) та 17 (17,5±3,9%), у низхідній ободовій кишці — 19 (25,3±4,9%) та 28 (28,9±4,6%), а в сигмовидній — 38 (50,7±5,8%) та 31 (32,0±4,7%). Лише в сигмовидній кишці кількість виявлених поліпів розміром менше 10 мм достовірно (p <0,05) перевищувала кількість поліпів розміром понад 10 мм.
У табл. 3 наведено порівняння частоти виявлення поліпів між відділами ободової кишки за розмірів менше і більше 10 мм. Поліпи розміром до 10 мм у сигмовидній ободовій кишці реєструвалися достовірно частіше, ніж у низхідній (p <0,01), поперечній (p <0,001) і висхідній (p <0,001) ободовій кишці. Такі поліпи в низхідній ободовій кишці відмічали достовірно частіше, ніж у поперечній ободовій кишці (p <0,05).
| Розміри поліпів, мм | Висхідна ободова кишка | Поперечна ободова кишка | Низхідна ободова кишка | Сигмовидна ободова кишка | Кількістьполіпів |
| 1 | 2 | 3 | 4 | ||
| <10 | 12 (16,0±4,2%) | 6 (8,0±3,1%) | 19 (25,3±4,9%)
p 3–2 <0,05 |
38 (50,7±5,8%)
p 4–3 <0,01 p 4–2 <0,001 p 4–1 <0,001 |
75 |
| >10 | 21 (21,6±4,2%) | 17 (17,5±3,9%) | 28 (28,9±4,6%)
p 3–2 <0,05 |
31 (32,0±4,7%) | 97 |
Як видно з табл. 4, у висхідній ободовій кишці частка поліпів розміром менше 10 мм становила 36,4±8,4%, а більше 10 мм — 63,6±8,4% (p <0,05), у поперечній ободовій кишці — 26,1±9,2% та 73,9±9,2% (p <0,001), у низхідній ободовій кишці — 40,4±7,2% та 59,6±7,2%, у сигмовидній ободовій кишці — 55,1±6,0% і 44,9±6,0% відповідно.
| Відділи ободової кишки | Розмір поліпів, мм | Усього | |
| <10 | >10 | ||
| Висхідна ободова кишка | 12 (36,4±8,4%) | 21 (63,6±8,4%)
p <0,05 |
33 |
| Поперечна ободова кишка | 6 (26,1±9,2%) | 17 (73,9±9,2%)
p <0,001 |
23 |
| Низхідна ободова кишка | 19 (40,4±7,2%) | 28 (59,6±7,2%) | 47 |
| Сигмовидна ободова кишка | 38 (55,1±6,0%) | 31 (44,9±6,0%) | 69 |
За типом всі поліпи було поділено на 2 групи: на ніжці та на широкій основі. У 79 (45,9±3,8%) випадках виявляли поліпи на ніжці, у 93 (54,1±3,8%) — на широкій основі. У висхідній ободовій кишці (33 поліпи) 13 (36,4±8,4%) поліпів було на ніжці, 20 (63,6±8,4%) — на широкій основі (p <0,05). Для поперечної ободової кишки (23 поліпи) ці показники становили 6 (26,1±9,2%) та 17 (73,9±9,2%) (p <0,001), для низхідної ободової кишки (47 поліпів) — 16 (34,0±7,1%) та 31 (66,0±7,1%) (p <0,001), а для сигмовидної кишки (69 поліпів) — 41 (59,4±5,9%) та 28 (40,6±5,9%). Лише у сигмовидній кишці кількість виявлених поліпів на ніжці достовірно (p <0,01) перевищувала кількість поліпів на широкій основі (табл. 5).
| Відділи ободової кишки | Тип поліпа | Усього | |
| на ніжці | на широкій основі | ||
| Висхідна ободова кишка | 13 (36,4±8,4%) | 20 (63,6±8,4%)
p <0,05 |
33 |
| Поперечна ободова кишка | 8 (26,1±9,2%) | 15 (73,9±9,2%)
p <0,001 |
23 |
| Низхідна ободова кишка | 16 (34,0±7,1%) | 31 (66,0±7,1%)
p <0,001 |
47 |
| Сигмовидна ободова кишка | 42 (59,4±5,9%)
p <0,01 |
27 (40,6±5,9%) | 69 |
У табл. 6 наведено порівняння кількості поліпів різних розмірів залежно від їх типу. Серед поліпів на ніжці 36 (45,6±5,6%) мали розміри менше ніж 10 мм, а 43 (54,4±5,6%) — понад 10 мм. З-поміж поліпів на широкій основі 39 (41,9±5,1%) мали розмір до 10 мм, а 54 (58,1±5,1%) — понад 10 мм. Серед поліпів на широкій основі достовірно (p <0,05) переважали поліпи розміром понад 10 мм.
| Тип поліпів | Розмір поліпів, мм | Усього | |
| <10 | >10 | ||
| На ніжці | 36 (45,6±5,6%) | 43 (54,4±5,6%) | 79 |
| На широкій основі | 39 (41,9±5,1%) | 54 (58,1±5,1%)
p <0,05 |
93 |
Як показано в табл. 7, за гістологічним типом всі поліпи було розділено на аденоматозні (119 випадків) і залозисті (53 випадки). Аденоматозні поліпи у 47 (40,3±4,5%) випадках були на ніжці, у 72 (59,7±4,5%) — на широкій основі (p <0,05), залозисті поліпи у 32 (60,4±6,7%) випадках — на ніжці, 21 (39,6±6,7%) — на широкій основі (p <0,05).
| Поліпи ободової кишки (n=172) | |||
| аденоматозні (n=119) | залозисті (n=53) | ||
| на ніжці | на широкій основі | на ніжці | на широкій основі |
| 47 (40,3±4,5%) | 72 (59,7±4,5%)
p <0,05 |
32 (60,4±6,7%)
p <0,05 |
21 (39,6±6,7%) |
У табл. 8 представлено результати УСГ у діагностиці поліпів, виявлених у різних відділах ободової кишки під час колоноскопії. При УСГ поліпи у висхідному відділі ободової кишки виявлено у 27 (81,8±6,7%), у поперечному відділі — у 18 (78,3±8,6%), у низхідному відділі — у 44 (93,6±3,6%), у сигмовидній ободовій кишці — у 67 (97,1±2,0%) випадках відповідно. Частота виявлення поліпів у сигмовидній кишці при УСГ є достовірно вищою (p <0,05), ніж у висхідному та поперечному відділах ободової кишки.
| Метод дослідження | Локалізація, n=172 | |||
| Висхідна ободова кишка | Поперечна ободова кишка | Низхідна ободова кишка | Сигмовидна ободовакишка | |
| Колоноскопія | n=33 | n=23 | n=47 | n=69 |
| УСГ | 27
(81,8±6,7%) |
18
(78,3±8,6%) |
44
(93,6±3,6%) |
67
(97,1±2,0%) p 4–3 <0,05 p 4–1 <0,05 |
У табл. 9 представлено результати УСГ у діагностиці поліпів з урахуванням гістологічного типу. При УСГ аденоматозні поліпи на ніжці було виявлено у 46 (97,9±2,1%) із 47 випадків, на широкій основі — у 64 (88,9±3,7%) із 72, залозисті поліпи на ніжці — у 31 (96,9±3,1%) з 32 випадків, на широкій основі — у 15 (71,4±9,9%) з 21 відповідно. Поліпи на ніжці при УСГ визначалися достовірно (p <0,05) краще, ніж на широкій основі (рис. 1–4).
| Метод дослідження | Аденоматозні (n=119) | Залозисті (n=53) | ||
| на ніжці | на широкій основі | на ніжці | на широкій основі | |
| Колоноскопія | 47 | 72 | 32 | 21 |
| УСГ | 46
(97,9±2,1%) p <0,05 |
64
(88,9±3,7%) |
31
(96,9±3,1%) p <0,05 |
15
(71,4±9,9%) |
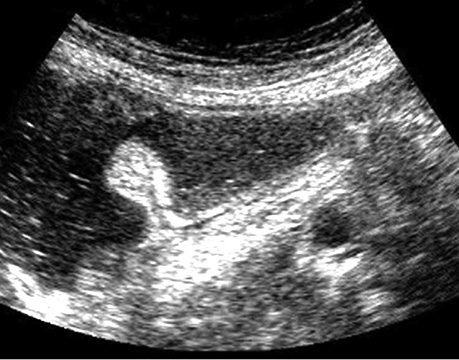
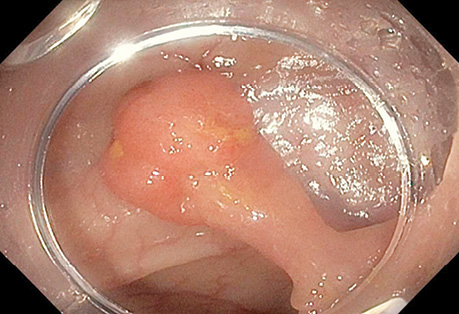
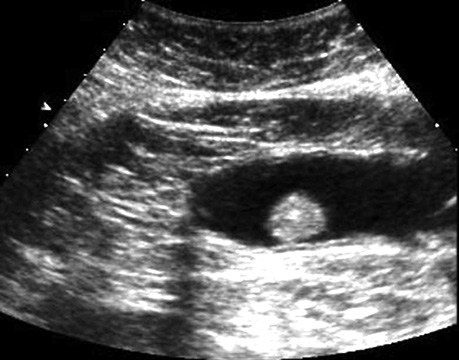
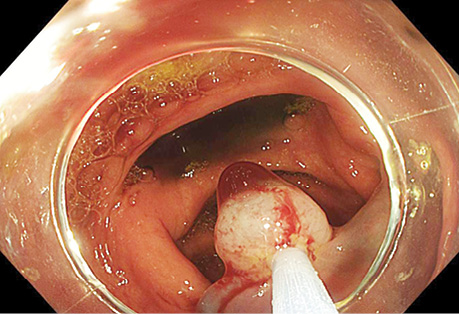
Результати УСГ у діагностиці аденоматозних поліпів ободової кишки представлено в табл. 10. Чутливість УСГ становила 87,4%, специфічність — 66,7%, точність — 86,4%, позитивна прогностична цінність — 98,1%, негативна прогностична цінність — 26,7%.
| Аденоматозні поліпи (n=125) | |||
| є (n=119) | немає (n=6) | ||
| поліпи при УСГ | поліпи при УСГ | ||
| істинно позитивний | хибно негативний | істинно позитивний | хибно негативний |
| 104 | 15 | 4 | 2 |
| Чутливість, % | 87,4 | ||
| Специфічність, % | 66,7 | ||
| Точність, % | 86,4 | ||
| Позитивна прогностична цінність, % | 98,1 | ||
| Негативна прогностична цінність, % | 26,7 | ||
Результати УСГ у діагностиці залозистих поліпів ободової кишки представлено в табл. 11. Чутливість УСГ становила 92,5%, специфічність — 80,0%, точність — 91,4%, позитивна прогностична цінність — 98,0%, негативна прогностична цінність — 50,0%.
| Залозисті поліпи (n=58) | |||
| є (n=53) | немає (n=5) | ||
| поліпи при УСГ | поліпи при УСГ | ||
| істинно позитивний | хибно негативний | істинно позитивний | хибно негативний |
| 49 | 4 | 4 | 1 |
| Чутливість, % | 92,5 | ||
| Специфічність, % | 80,0 | ||
| Точність, % | 91,4 | ||
| Позитивна прогностична цінність, % | 98,0 | ||
| Негативна прогностична цінність, % | 50,0 | ||
Обговорення
Аденоматозні зазубрені поліпи товстої кишки мають високий ризик переродження у злоякісні пухлини. Скринінг має велике значення для своєчасного виявлення великих поліпів, а це може знизити смертність від раку [1]. Методи скринінгу та спостереження за КРР сильно різняться за ефективністю. Остання визначається можливостями того чи іншого методу у виявленні поліпів різних розмірів. Поліпи розміром більше 10 мм зазвичай вважаються клінічно значущими і потребують видалення. За ефективного скринінгу можна виявляти поліпи середнього (5–10 мм) розміру [6].
Частина дослідників припускає, що для осіб з численними ректосигмоїдними гіперпластичними поліпами розміром до 10 мм характерний середній ризик розвитку прогресуючої неоплазії і вони потребують звичайної колоноскопії. M. Monachese та співавтори (2021) вважають, що особи з невеликими проксимальними та дистальними гіперпластичними поліпами мають підвищений ризик формування метахронних сидячих зубчастих поліпів [13, 14].
Колоноскопічна поліпектомія є золотим стандартом ефективної профілактики КРР. Додаткову підтримку надають рандомізовані контрольовані дослідження калу на приховану кров та гнучка сигмоїдоскопія [16, 17].
КТК є менш інвазивним методом, альтернативним колоноскопії. Результати багатоцентрових досліджень демонструють ефективність КТК у візуалізації поліпів розміром 6–10 мм, що сприяло її включенню до програми скринінгу КРР. Показано, що на пізніх стадіях неоплазії товстої кишки КТК дозволяє отримати більше інформації, ніж колоноскопія. Після негативного результату КТК щодо КРР рідко спостерігаються клінічні симптоми неоплазії [19].
Під час рутинної сонографії товстої кишки також випадково можуть виявити пристінкові утворення. Однак її ефективність є досить низькою. Використання кольорового доплерівського режиму допомагає виявити колірні судинні сигнали в пухлинних утвореннях, тим самим допомагаючи оцінити характер неоплазії [20].
Гідроколоносонографія характеризується вищою чутливістю, ніж рутинна сонографія черевної порожнини, ефективність її поступово підвищується зі збільшенням розмірів утворень на стінках товстої кишки [21]. Результати УСГ, отримані нами, наближаються до даних інших дослідників, отриманих за допомогою КТК. У наших дослідженнях показано діагностичну значущість методу з урахуванням локалізації, розмірів та гістологічного типу поліпів ободової кишки.
Висновки
Середня кількість поліпів товстої кишки у пацієнтів літнього віку є достовірно (p <0,05) більшою, ніж у молодих осіб.
Ультрасонографічно поліпи сигмовидної кишки виявляють достовірно (p <0,05) частіше, ніж висхідної та поперечної ободової кишки.
Чутливість сонографічної колонографії в діагностиці аденоматозних поліпів становить 87,4%, залозистих поліпів 92,5%, за розмірів поліпів <10 мм — 86,7%, >10 мм — 92,8% відповідно.
Інформація щодо конфлікту інтересів: відсутній.
Список використаної литератури
1. Huck, M. B., & Bohl, J. L. (2016). Colonic Polyps: Diagnosis and Surveillance. Clinics in Colon and Rectal Surgery, 29, 296–305. doi: 10.1055/s-0036-1584091.
2. Lieberman, D. A., Rex, D. K., Winawer, S. J., Giardiello, F. M., Johnson, D. A., & Levin, T. R. (2012). United States Multi-Society Task Force on Colorectal Cancer. Guidelines for colonoscopy surveillance after screening and polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology,143(3), 844–857. doi: 10.3322/canjclin.56.3.143.
3. Lautrup, C. K., Mikkelsen, E. M., Lash, T. L., Katballe, N., & Sunde, L. (2015). Familial colorectal cancer risk may be lower than previously thought: a Danish cohort study. Cancer Epidemiology, 39(5), 714–719. doi: 10.1016/j.canep.2015.07.004.
4. Ye, X., Han, P., Wu, Z., Cui, Y., Chen, C., & Gao, Q. (202,). New management of surveillance in patients with baseline serrated polyps: a large single-center retrospective cohort study in China. European Journal of Gastroenterology & Hepatology, 35(2), 181–190. doi.org/10.21203/rs.3.rs-1997952/v1.
5. Welch, H. G., & Robertson, D. J. (2016). Colorectal Cancer on the Decline–Why Screening Can’t Explain It All. The New England Journal of Medicine, 374, 1605–1607. doi: 10.1056/NEJMp1600448.
6. Robertson, D. J., Kaminski, M. F., & Bretthauer, M. (2015). Effectiveness, training and quality assurance of colonoscopy screening for colorectal cancer. Gut, 64(6), 982–990. doi.org/10.1136/gutjnl-2014-308076.
7. Crockett, S., & Nagtegaal, I. (2019). Terminology, Molecular Features, Epidemiology, and Management of Serrated Colorectal Neoplasia. Gastroenterology, 157(4), 949–966.e4. doi: 10.1053/j.gastro.2019.06.041.
8. Abdeljawad, K., Vemulapalli, K. C., Kahi, C. J., Cummings, O. W., Snover, D. C., & Rex, D. K. (2015). Sessile serrated polyp prevalence determined by a colonoscopist with a high lesion detection rate and an experienced pathologist. Gastrointestinal Endoscopy, 81, 517−524. doi: 10.1016/j.gie.2014.04.064.
9. Bailie, L., Loughrey, M., & Coleman, H. (2017). Lifestyle Risk Factors for Serrated Colorectal Polyps: A Systematic Review and Meta-analysis. Gastroenterology, 152, 92–104. doi: 10.1053/j.gastro.2016.09.003.
10. Macaron, C., Vu, H., Lopez, R., Pai, R., & Burke, C. (2015). Risk of Metachronous Polyps in Individuals With Serrated Polyps. Diseases of the colon and rectum, 58, 762–768. doi: 10.1097/DCR.0000000000000406.
11. Pereyra, L., Zamora, R., Gómez, E., Fischer, C., Panigadi, G. N., González, R., … Boerr, L. (2016). Risk of Metachronous Advanced Neoplastic Lesions in Patients with Sporadic Sessile Serrated Adenomas Undergoing Colonoscopic Surveillance. The American journal of gastroenterology, 111, 871–878. doi: 10.1038/ajg.2016.120.
12. Anderson, J. C., Butterly, L. F., Robinson, C. M., Weiss, J. E., Amos, C., & Srivastava, A. (2018). Risk of Metachronous HighRisk Adenomas and Large Serrated Polyps in Individuals With Serrated Polyps on Index Colonoscopy: Data From the New Hampshire Colonoscopy Registry. Gastroenterology, 154, 117−127.e2. doi: 10.1053/j.gastro.2017.09.011.
13. Monachese, M., Mankaney, G., El-Khider, F., Rouphael, C., Lopez, R., & Burke, C. (2021). Association between baseline hyperplastic polyps and metachronous serrated lesions. Gastrointestinal endoscopy, 93, 1401–1407.e1. doi: 10.1016/j.gie.2020.11.028.
14. Gupta, S., Lieberman, D., Anderson, J. C., Burke, C. A., Dominitz, J. A., Kaltenbach, T., … Rex, D. K. (2020). Recommendations for follow-up after colonoscopy and polypectomy: a consensus update by the us multi-society task force on colorectal cancer. Gastroenterology, 158, 1131–1153.e5. doi: 10.1053/j.gastro.2019.10.026.
15. Vleugels, J. L. A., Hazewinkel, Y., Fockens, P., & Dekker, E. (2017). Natural history of diminutive and small colorrectal polyps: a systematic literature review. Gastrointestinal Endoscopy, 85, 1169–1176. doi: 10.1016/j.gie.2016.12.014.
16. Kahi, C. J. (2019). Reviewing the evidence that polypectomy prevents cancer. Gastrointestinal Endoscopy Clinics of North America, 29, 577–585. doi: 10.1016/j.giec.2019.05.001.
17. Pellisé M. (2015). Colonoscopy in the screening, follow-up and treatment of colorectal cancer and precursor lesions. Colonoscopy in the screening, follow-up and treatment of colorectal cancer and precurcor lesions. Gastroenterology and Hepatology, 1, 1–7. doi: 10.1016/S0210-5705(15)30022-4.
18. Kaminski, M. F., Hassan, C., & Bisschops, R. (2014). Advanced imaging for detection and differentiation of colorectal neoplasia: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy, 46, 435–449. doi: 10.1055/s-0034-1365348.
19. Kim, D. H., Pooler, B. D., Weiss, J. M., & Pickhardt, P. J. (2012). Five-year colorectal cancer outcomes in a large negative CT colonography screening conhort. European Radiology, 22, 1488–1494. doi: 10.1007/s00330-011-2365-2.
20. Kuzmich, S., Harvey, C. Y., Kuzmich, T., & Tan, T. K. L. (2012). Ultrasound detection of colonic polyps: perspective. The British Journal of Radiology, 85, e1155–e1164. doi: 10.1259/bjr/60593124.
21. Martínez García, D., Maria, T. B. A., Javier, E. B. M., Jose, M. L. L., Carlos, B. R., Francisco, J. M. P., … Paula, R. E. (2021). Hydrocolonic Sonography. A Forgotten Technique. Japanese J Gstro Hepato., 6(21), 1–11. https://jjgastrohepto.org/wp-content/uploads/2021/07/JJGH-v6-1583.pdf.
Адреса для листування:
Коваль Оксана Володимирівна
030049, Київ, Повітрофлотський просп., 9
E-mail: drkovalov@gmail.com
Correspondence:
Oksana Koval
030049, Kyiv, Povitroflotskyi Ave., 9
E-mail: drkovalov@gmail.com














Leave a comment