Клінічна характеристика, особливості лікування та досягнення кінцевих точок, оцінені в реальній клінічній практиці застосування талазопарібу у пацієнтів із HER2-негативним BRCA-асоційованим раком грудної залози
Резюме. Анотація. Талазопаріб — інгібітор полі(аденозиндифосфат-рибозо)полімерази, схвалений на основі результатів дослідження EMBRACA для лікування дорослих пацієнтів із BRCA-асоційованим HER2-негативним місцевопоширеним (пРГЗ)/метастатичним раком грудної залози (мРГЗ). На даний час немає опублікованих результатів досліджень щодо ефективності призначення талазопарібу в реальній клінічній практиці у Сполучених Штатах Америки (США). Оцінка клінічної характеристики хворих, особливостей лікування та досягнення кінцевих точок на тлі застосування талазопарібу у пацієнтів із HER2-негативним BRCA-асоційованим РГЗ проводилася шляхом ретроспективного аналізу медичних карт пацієнтів. Отримані з вибірки дані узагальнено методом описової статистики. Серед 84 пацієнтів, включених в аналіз, у 35,7% випадків РГЗ був гормон-рецепторпозитивним (HR-позитивним) а у 64,3% — тричі негативним пРГЗ/мРГЗ (ТНРГЗ). 29,8% пацієнтів мали >2 балів за шкалою Східної кооперативної групи онкологів (ECOG), 19,0% — метастази в головний мозок. Гермінальні мутації BRCA1 та BRCA2 виявлені у 64,3 та 35,7% пацієнтів відповідно. 14,3% пацієнтів отримували талазопаріб у 1-й лінії терапії пРГЗ та мРГЗ, 40,5% — у 2-й лінії, 45,2% — у 3-й або 4-й лініях лікування. Медіана часу до невдачі лікування становила 8,5 міс (95% довірчий інтервал (ДІ) 8,0–9,7), медіана реальної виживаності без прогресування (рВБП) — 8,7 міс (95% ДІ 8,0–9,9), медіана часу від ініціації терапії талазопарібом до старту наступної хіміотерапії — 12,2 міс (95% ДІ 10,5–20,1 міс), а частота об’єктивної відповіді (рЧОВ) — 63,1% (95% ДІ 52,2–74,0). При нескоригованому аналізі отриманих результатів статистично значущих відмінностей при оцінці кінцевих точок між підгрупами пацієнтів із HR-позитивним та ТНРГЗ не виявлено. Встановлено, що наявність метастазів у головному мозку та кількість балів за шкалою ECOG ≥2 пов’язані зі значно вищим ризиком невдачі призначеного лікування, прогресування або смерті. Отже, результати застосування талазопарібу, отримані в умовах реальної клінічної практики, є зіставними із такими, отриманими у дослідженні EMBRACA.
DOI: 10.32471/clinicaloncology.2663-466X.50-2.30589
Адаптовано за матеріалами: Savill, K. M. Z., Ivanova, J., Asgarisabet, P., Falkenstein, A., Balanean, A., Niyazov, A., … Mahtani, R. L. (2023). Characteristics, Treatment, and Outcomes of Real-World Talazoparib-Treated Patients With Germline BRCA-Mutated Advanced HER2-Negative Breast Cancer. The Oncologist, XX, 1–11. doi.org/10.1093/oncolo/oyad021.
Вступ
 Рак грудної залози (РГЗ) продовжує посідати провідне місце в загальній структурі злоякісних пухлин та значною мірою впливає на рівень смертності від злоякісних новоутворень. У Сполучених Штатах Америки (США) у 2022 р. зареєстровано 290 560 нових випадків РГЗ та 43 780 випадків смерті від цього виду раку. Місцевопоширений (пРГЗ)/метастатичний (мРГЗ) характеризується несприятливим прогнозом: 5-річна загальна виживаність (ЗВ) за наявності віддалених метастазів становить 29,0% [1, 2].
Рак грудної залози (РГЗ) продовжує посідати провідне місце в загальній структурі злоякісних пухлин та значною мірою впливає на рівень смертності від злоякісних новоутворень. У Сполучених Штатах Америки (США) у 2022 р. зареєстровано 290 560 нових випадків РГЗ та 43 780 випадків смерті від цього виду раку. Місцевопоширений (пРГЗ)/метастатичний (мРГЗ) характеризується несприятливим прогнозом: 5-річна загальна виживаність (ЗВ) за наявності віддалених метастазів становить 29,0% [1, 2].
Як відомо, вибір оптимальної терапевтичної схеми для пацієнтів з пРГЗ/мРГЗ залежить від молекулярних особливостей пухлинних клітин, таких як статус рецепторів стероїдних гормонів (HR), експресія рецептора епідермального фактора росту людини 2 (HER2) та наявність мутацій генів BRCA. Гермінальні мутації в генах BRCA1/2 асоційовані з підвищеним ризиком розвитку пРГЗ/мРГЗ та несприятливим прогнозом для таких хворих[3]. Водночас мутації в генах BRCA1/2 виявляють у менш ніж 5,0% хворих з мРГЗ [4–7]. Для пацієнтів з мутаціями BRCA1/2 характерними є гірші показники виживаності, специфічної для РГЗ, порівняно із такими у хворих із BRCA-негативним та спорадичним РГЗ [3].
Продемонстровано, що пригнічення активності полі(АДФ-рибоза)-полімераз (англ. poly(ADP-ribose) polymerase — PARP) блокує здатність пухлинних клітин ефективно відновлювати пошкодження ДНК [7]. Починаючи з 2018 р., Управлінням з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA) схвалено два інгібітори PARP, а саме олапариб і талазопаріб, для лікування дорослих пацієнтів із BRCA-асоційованим HER2-негативним мРГЗ [8, 9].
У жовтні 2018 р. на основі даних, отриманих у дослідженні III фази EMBRACA (NCT01945775), FDA схвалено талазопаріб для застосування у дорослих пацієнтів із BRCA-асоційованим HER2-негативним мРГЗ та пРГЗ [10]. У дослідженні EMBRACA порівнювали ефективність та профіль безпеки талазопарібу з терапією на вибір лікаря (капецитабін, ерибулін, гемцитабін та вінорельбін) у пацієнтів з поширеним РГЗ з діагностованою гермінальною мутацією BRCA1/2. У цьому дослідженні продемонстровано статистично значуще підвищення виживаності без прогресування (ВБП) на тлі застосування талазопарібу (медіана ВБП становила 8,6 проти 5,6 міс у групах талазопарібу та контролю відповідно; відношення ризиків (ВР) 0,54; 95% довірчий інтервал (ДІ) 0,41–0,71; p<0,001)) і значно вища частота об’єктивної відповіді (ЧОВ) (62,6% проти 27,2%; ВР 5,0; 95% ДІ 2,9–8,8; p<0,001) [11, 12]. Медіана тривалості відповіді на терапію у групі талазопарібу становила 6,9 міс, тоді як у групі монохіміотерапії цей показник становив 3,9 міс [13].
На даний час немає опублікованих результатів досліджень щодо ефективності призначення талазопарібу в реальній клінічній практиці у США. Тому метою цього ретроспективного дослідження (NCT04987931) визначено висвітлення клінічної характеристики хворих, особливостей лікування й досягнення кінцевих точок, оцінених в умовах реальної клінічної практики застосування талазопарібу у пацієнтів із HER2-негативним BRCA-асоційованим РГЗ.
Методи
Дизайн дослідження та джерела даних
У цьому дослідженні проведено ретроспективний аналіз медичних карт пацієнтів. Забір даних здійснювався онкологами з Cardinal Health Oncology Provider Extended Network (OPEN) на основі заздалегідь визначених критеріїв включення.
Критерії включення такі: пацієнти віком ≥18 років з підтвердженим HER2-негативним BRCA-асоційованим пРГЗ/мРГЗ; перше призначення талазопарібу не раніше 16 жовтня 2018 р. (дата схвалення FDA); тривалість періоду подальшого спостереження щонайменше 6 міс з індексної дати, окрім випадків смерті пацієнтів у цей проміжок часу. Забір даних здійснювався в період з 20 серпня 2021 до 11 жовтня 2021 р.
Критерії виключення наступні: участь у будь-яких інших клінічних дослідженнях РГЗ після початку терапії талазопарібом, застосування інгібіторів PARP у неоад’ювантному/ад’ювантному режимах, відсутність відомої гермінальної мутації гена BRCA1/2, невідомий статус HER2 та наявність будь-якого іншого злоякісного новоутворення, крім карциноми in situ або немеланомного раку шкіри, впродовж останніх 5 років.
Кінцеві точки: медіана часу до невдачі лікування — час від початку лікування талазопарібом до прогресування захворювання, токсичності або смерті хворого; реальна виживаність без прогресування (рВБП) — час від початку лікування талазопарібом до настання смерті з будь-якої причини чи прогресування захворювання; час від ініціації терапії талазопарібом до старту наступної хіміотерапії; реальна частота об’єктивної відповіді (рЧОВ), розрахована як сума повідомлених лікарями повних та часткових відповідей, поділених на загальну кількість пацієнтів, які відповіли на призначене лікування; реальна тривалість відповіді на лікування та загальна виживаність (ЗВ), розрахована як час від початку лікування талазопарібом до настання смерті з будь-якої причини.
Результати
Пацієнти
Загалом в аналіз включили 84 пацієнтів, які отримували лікування в 9 онкологічних лікувальних установах за місцем проживання та відповідали критеріям включення. Серед пацієнтів переважали особи жіночої статі (97,6%) європеоїдної раси (71,4%), більшість з яких були неіспаномовними (84,5%). Частка пацієнтів афроамериканського походження становила 16,7% досліджуваної популяції, тоді як 15,5% хворих мали латиноамериканське походження. Середній вік пацієнтів на початку лікування талазопарібом становив 62 роки (мінімальний–максимальний вік 35,9–91,0), а географічний розподіл був таким: західні регіони США — 57,1%, південні — 20,2%, середньозахідні — 15,5% та північно-східні — 7,1%. 50,0% пацієнтів мали комерційну страховку, 41,7% — Medicare, а 11,9% — Medicaid.
На момент включення в дослідження у всіх пацієнтів підтверджено IV стадію РГЗ, у 96,4% хворих діагностовано вісцеральні метастази, а у 19,0% — метастази в головний мозок. Частка пацієнтів з оцінкою за шкалою Східної кооперативної групи онкологів (ECOG) >2 становила 30,0%. Гермінальна мутація BRCA1 виявлена у 64,3% пацієнтів, тоді як гермінальна мутація BRCA2 — у 35,7% пацієнтів. У 79,8% випадків наявність гермінальних мутацій BRCA1/2 виявлена шляхом тестування за допомогою мультигенних панелей, у 4,8% — за допомогою точкового визначення відповідних мутацій, а у 15,5% пацієнтів типи використаних панелей не встановлено. У 69,0% пацієнтів молекулярно-генетичне тестування проводилося перед 1-ю лінією терапії пРГЗ/мРГЗ, у 25,0% пацієнтів визначення статусу гермінальних мутацій у генах BRCA1/2 проведено під час 1-ї лінії лікування, у 2,4% — між 1-ю та 2-ю лініями, у 3,6% — під час 3-ї лінії лікування. Медіана часу від отримання результатів молекулярно-генетичного дослідження до початку терапії талазопарібом становила 15,8 міс (8,6–37,2 міс). Серед 44 пацієнтів з тричі негативним РГЗ (ТНРГЗ) та доступністю результатів дослідження щодо виявлення рівня експресії PD-L1 позитивний PD-L1-статус встановлено у 47,7% хворих. Окрім цього, серед пацієнтів із доступними результатами тестування щодо статусу мутацій у генах PIK3CA та ESR1 позитивний статус щодо мутації PIK3CA виявлено у 2 із 29 пацієнтів (6,9%), а позитивний статус щодо мутації ESR1 — у 1 із 8 пацієнтів (12,5%). У 35,7% (n=30) хворих РГЗ був гормон-рецепторпозитивним (HR-позитивним). Тип ТНРГЗ встановлено у 64,3% пацієнтів (n=54). Незважаючи на те що вірогідних відмінностей у розподілі пацієнтів з HR-позитивним та ТНРГЗ за статтю, расою та етнічним походженням не виявлено, середній вік хворих на початку лікування був вищим серед хворих із HR-позитивним РГЗ (68,6 проти 59,1 року; p<0,01). Що стосується географічного розподілу пацієнтів, включених у дослідження, то більшість хворих із ТНРГЗ проживала в західних регіонах США. Окрім цього, менша частка пацієнтів із HR-позитивним РГЗ мала комерційну страховку порівняно із хворими із ТНРГЗ (20,0% проти 66,7%; p<0,01), тоді як більша частка пацієнтів із HR-позитивним РГЗ користувалася програмою безоплатної медичної допомоги пацієнтам віком ≥65 років у США Medicare порівняно із хворими із ТНРГЗ (70,0% проти 25,9%; p<0,01). У значно більшої частки пацієнтів з HR-позитивним РГЗ загальний статус відповідав ≥2 за шкалою ECOG на початку дослідження порівняно з пацієнтами з ТНРГЗ (46,7% проти 20,4% відповідно; p=0,01). Статистично значущих відмінностей щодо частки вісцеральних метастазів або метастазів у головний мозок між досліджуваними підгрупами пацієнтів із HR-позитивним і ТНРГЗ не виявлено.
Схеми лікування
14,3% пацієнтів отримували талазопаріб у 1-й лінії терапії пРГЗ та мРГЗ, 40,5% — у 2-й лінії, 34,5% — у 3-й і 10,7% — у 4-й лінії лікування. Серед пацієнтів із ТНРГЗ порівняно із підгрупою хворих із HR-позитивним РГЗ талазопаріб частіше призначали як терапію 1-ї лінії (46,3% проти 30,0%). Водночас серед пацієнтів із ТНРГЗ талазопаріб найчастіше призначався як терапія 2-ї лінії, а серед хворих із HR-позитивним РГЗ — як терапія 3-ї лінії.
Більшість учасників дослідження (91,7%) отримували талазопаріб у дозі 1 мг/добу. Решта (8,3%) — у дозі 0,75 мг/добу. 15,5% пацієнтів потребували редукції дози або тимчасової перерви в лікуванні. Підтримувальна терапія («на вимогу» або із профілактичною метою) призначалася у 75,0% випадків. При цьому найчастіше призначали антиеметичні (64,3% пацієнтів) та антидіарейні засоби (56,0% пацієнтів). У близько 8,3% пацієнтів проводили переливання еритроцитарної маси (середнє значення [стандартне відхилення (SD)] кількості виконаних трансфузій на пацієнта становило 2,1 [1,1]).
На ранніх стадіях РГЗ 39,3% пацієнтів отримували (нео)ад’ювантну хіміотерапію та/або гормональну терапію. 85,7% пацієнтів до моменту призначення талазопарібу отримували системну терапію, яка могла включати хіміотерапію, гормональну, таргетну та/або імунну терапію для лікування пРГЗ та мРГЗ. Найпоширенішими режимами попереднього лікування пРГЗ та мРГЗ у HR-позитивних пацієнтів були комбіноване призначення інгібіторів циклінзалежних кіназ CDK4/6 та гормональної терапії (89,7%), неплатинова монохіміотерапія (31,0%), однокомпонентна гормональна терапія (27,6%) та комбінована гормональна терапія (24,1%), в той час як пацієнти із ТНРГЗ перед застосуванням талазопарібу найчастіше отримували комбіновану хіміотерапію на основі платини (41,9%), неплатинову монохіміотерапію (39,5%), комбінацію імунотерапії та неплатинової хіміотерапії (27,9%) та комбіновану неплатинову хіміотерапію (25,6%).
Після терапії талазопарібом 23,3% пацієнтів із HR-позитивним РГЗ отримували системну терапію, а 20,0% — хіміотерапію. Серед пацієнтів із ТНРГЗ ці показники становили 29,6 та 27,8% відповідно.
Кінцеві точки
Медіана тривалості спостереження від моменту призначення талазопарібу становила 8,2 міс (мінімум–максимум 2,0–33,2 міс). Медіана часу до невдачі лікування становила 8,5 міс (95% ДІ 8,0–9,7) (рисунок А), а медіана рВБП — 8,7 міс (95% ДІ 8,0–9,9) (рисунок Б). Медіана часу від ініціації терапії талазопарібом до старту наступної хіміотерапії, яка призначалася після талазопарібу в будь-якій лінії лікування, становила 12,2 міс (95% ДІ 10,5–20,1 міс) (рисунок Г). Медіана ЗВ, оцінена на тлі прийому талазопарібу, становила 11,6 міс (95% ДІ 10,1–14,8 міс) (рисунок В), однак враховуючи те, що більшість (54,8%) пацієнтів були живими на момент збору даних, рівень цензурування результатів сягав понад 50%. рЧОВ для талазопарібу становила 63,1% (95% ДІ 52,2–74,0), а медіана тривалості відповіді на лікування — 7,1 міс (95% ДІ 5,5–8,7 міс).
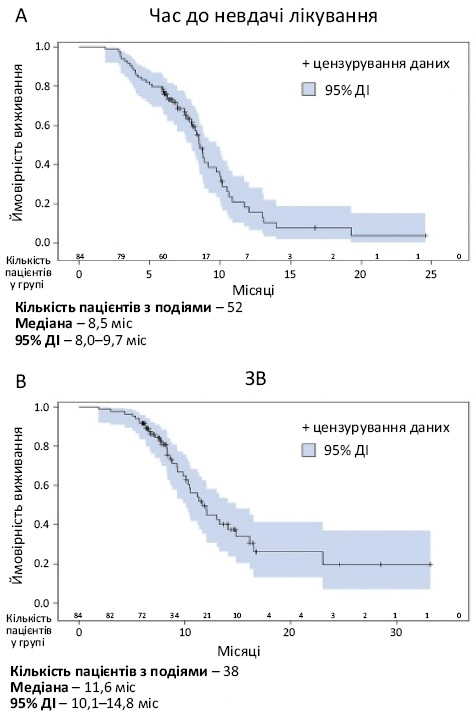
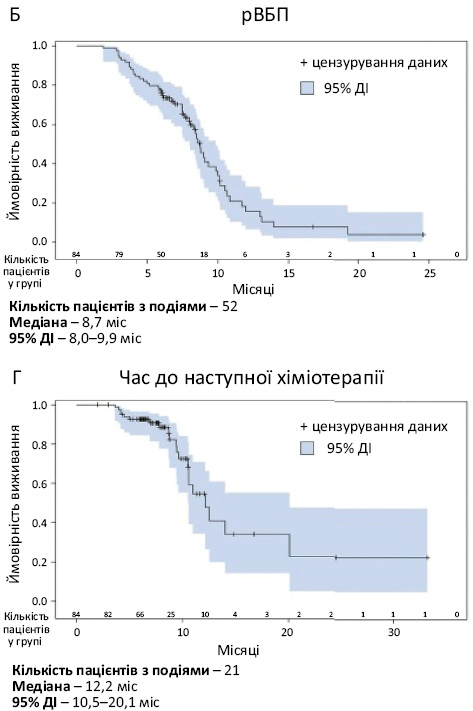
При нескоригованому аналізі отриманих результатів статистично значущих відмінностей у часі до невдачі лікування, рВБП, часі від ініціації терапії талазопарібом до старту наступної хіміотерапії, рЧОВ та тривалості відповіді на лікування між підгрупами пацієнтів із HR-позитивним та ТНРГЗ не виявлено.
Характеристики пацієнтів, асоційовані з тривалістю часу до невдачі лікування та рВБП, виявлені за допомогою одно- та багатофакторного аналізу. Останній дав змогу скоригувати дані з урахуванням віку пацієнтів на момент призначення талазопарібу, HR-статусу, расової приналежності, наявності метастазів у головний мозок, ECOG-статусу і лінії терапії.
При побудові одно- та багатофакторної моделі пропорційних ризиків Кокса виявлено, що наявність метастазів у головний мозок та кількість балів за шкалою ECOG ≥2 пов’язані зі значно вищим ризиком невдачі призначеного лікування (відносний ризик (ВР) часу до невдачі лікування становив 2,3; 95% ДІ 1,1–4,8; p=0,02 і 2,7; 95% ДІ 1,3–5,8; p=0,01 відповідно), а також значно вищим ризиком прогресування або смерті (ВР рВБП 2,4; 95% ДІ 1,2–5,0; p=0,02 і 2,7; 95% ДІ 1,3–5,8; p=0,01 відповідно).
Обговорення
Метою цього дослідження було висвітлення клінічних результатів застосування талазопарібу в реальній практиці у США для лікування дорослих пацієнтів з HER2-негативним BRCA-асоційованим пРГЗ/мРГЗ впродовж перших 3 років після схвалення препарату FDA.
Демографічні та клінічні характеристики пацієнтів у цьому ретроспективному аналізі та в реєстраційному дослідженні EMBRACA відрізнялися: пацієнти в цьому дослідженні були старшими (середній вік початку лікування талазопарібом становив 62 проти 45 років), на момент старту терапії мали гірший функціональний стан за шкалою ECOG (>2 балів у 29,8% проти 2,1% у дослідженні EMBRACA) і отримували терапію талазопарібом у пізніших лініях лікування (45,2% пацієнтів отримували талазопаріб як 3-тю або 4-ту лінію лікування, тоді як у дослідженні EMBRACA 24,0% пацієнтів розпочали терапію талазопарібом після 2 або 3 попередніх цитотоксичних схем лікування поширеного РГЗ) [11, 13].
Незважаючи на ці відмінності, медіани рВБП і рЧОВ, досягнуті в цьому дослідженні, відповідали таким у дослідженні EMBRACA. Медіана рВБП для талазопарібу серед реальних пацієнтів становила 8,7 міс (медіана періоду спостереження 8,2 міс), а рЧОВ — 63,1%, а для пацієнтів у дослідженні EMBRACA медіана ВБП для талазопарібу становила 8,6 міс (медіана періоду спостереження 11,2 міс), а ЧОВ — 62,6% [10–13]. Медіана ЗВ у цьому дослідженні становила 11,6 міс та була коротшою порівняно із такою в дослідженні EMBRACA, у якому вона сягала 19,3 міс [13]. Проте медіана тривалості спостереження від моменту призначення талазопарібу в цьому дослідженні становила лише 8,2 міс, рівень цензурування результатів сягав понад 50%, а пацієнти були старшими та отримали більш інтенсивне попереднє лікування порівняно з учасниками дослідження EMBRACA.
У дослідженні EMBRACA редукції дози або тимчасової перерви в лікуванні потребували 53,1 та 62,6% пацієнтів відповідно, а у цьому дослідженні зазначені показники становили 14,3 та 6,0% відповідно [13].
Результати, отримані в цьому дослідженні, були зіставними із такими у французькому дослідженні IV фази ViTAL, яке включало 86 пацієнтів з HER2-негативним BRCA-асоційованим пРГЗ/мРГЗ. Зокрема, медіана часу до невдачі лікування становила 8,5 міс у дослідженні, проведеному в умовах реальної клінічної практики у США, а медіана часу до припинення терапії, визначена як проміжок часу між першою та останньою дозою цього препарату або першою дозою та смертю пацієнта, становила 8,6 міс у дослідженні, проведеному у Франції [14].
Окрім цього, показники рВБП та рЧОВ, отримані в цьому дослідженні, були кращими порівняно із такими, отриманими в невеликому дослідженні (n=47), проведеному в Туреччині. Варто зауважити, що у дослідженні, проведеному в Туреччині, пацієнти отримували більш інтенсивну терапію до моменту призначення талазопарібу, а сам препарат призначався у більш пізніх лініях лікування. Так, ≥3 лінії лікування до моменту призначення талазопарібу отримали 10,7 проти 51,5% пацієнтів у дослідженнях, проведених у США та Туреччині відповідно. Медіана рВБП становила 8,7 проти 6,5 міс, а медіана рЧОВ — 63,1 проти 31,9% у дослідженнях, проведених у США та Туреччині відповідно [15].
Основними недоліками цього аналізу є те, що згідно з дизайном воно є ретроспективним дослідженням бази даних електронних медичних записів, а тому отримані дані можуть бути неповними або неточними. Окрім цього, це дослідження включало обмежену кількість пацієнтів (n=84), а забір даних здійснювався з баз даних обмеженої кількості онкологічних лікувальних установ (n=9). Пацієнти були відібрані на основі заздалегідь визначених критеріїв включення, а тому результати можуть не бути репрезентативними для всіх пацієнтів, які отримували талазопаріб. Модель обстеження та лікування пацієнтів може відрізнятися в інших лікарів-онкологів, які також курують пацієнтів із пРГЗ/мРГЗ, проте не були залучені до проведення цього дослідження. Варто зауважити, що незважаючи на обмежений розмір вибірки (n=84), мутації в генах BRCA1/2 виявляють у менш ніж 5% пацієнтів з мРГЗ [6], а проведення тестування на мутацію BRCA не завжди є доступним. Ще одним фактором, який може вплинути на результати цього дослідження, є відсутність чітких загальноприйнятих критеріїв визначення окремих змінних, зокрема відповіді на лікування.
Висновки
Це дослідження дало змогу отримати перші опубліковані результати ефективності застосування талазопарібу у пацієнтів з HER2-негативним BRCA-асоційованим пРГЗ/мРГЗ, які отримували призначене лікування в умовах реальної клінічної практики. Результати, отримані у цьому дослідженні, є зіставними із такими в реєстраційному дослідженні EMBRACA, що підтверджує той факт, що рандомізовані контрольовані дослідження залишаються золотим стандартом для оцінки безпеки та ефективності фармакологічних втручань. Однак кінцеві точки, які оцінюються у клінічних випробуваннях та у реальній практиці, можуть відрізнятися. Крім того, основним обмеженням клінічних випробувань є відсутність репрезентативності та узагальненості даних щодо реальних пацієнтів, для яких препарат було затверджено. Необхідність добровільної згоди пацієнтів на участь у клінічних дослідженнях не дає змоги отримати дані від близько 95% пацієнтів у США, а тому результати таких досліджень не завжди можуть бути відтворені в реальній клінічній практиці. Однією з переваг цього дослідження є расова та етнічна різноманітність пацієнтів, що дозволяє отримати дані, характерні для реальної клінічної практики.
Отже, результати, отримані в реальній клінічній практиці, підтверджують результати клінічного дослідження EMBRACA щодо ефективності застосування талазопарібу у пацієнтів з HER2-негативним BRCA-асоційованим пРГЗ/мРГЗ.
Список використаної літератури
1. American Cancer Society (ACS). (2022). Cancer statistics center: breast.
2. Liang, Y., Zhang, H., Song, X., & Yang, Q. (2020). Metastatic heterogeneity of breast cancer: Molecular mechanism and potential therapeutic targets. Seminars in cancer biology, 60, 14–27. doi.org/10.1016/j.semcancer.2019.08.012.
3. Baretta, Z., Mocellin, S., Goldin, E., Olopade, O. I., & Huo, D. (2016). Effect of BRCA germline mutations on breast cancer prognosis: A systematic review and meta-analysis. Medicine, 95(40), e4975. doi.org/10.1097/MD.0000000000004975.
4. Meynard, G., Villanueva, C., Thiery-Vuillemin, A., Mansi, L., & Curtit, E. (2017). 4458 — real-life study of BRCA genetic screening in metastatic breast cancer, European Society for Medical Oncology (ESMO) 2017 Congress. Ann Oncol., 28 (suppl. 5) (94), v74–v108.
5. Fasching, P. A., Hu, C., Hart, S. N., Polley, E. C., & Couch, F. (2018). Abstract PD1-02: Cancer predisposition genes in metastatic breast cancer — Association with metastatic pattern, prognosis, patient and tumor characteristics. Cancer Res 15 February 2018. 78 (4_Supplement): PD1–02. doi.org/10.1158/1538-7445.SABCS17-PD1-02.
6. Robson, M., Im, S. A., Senkus, E., Xu, B., & Conte, P. (2017). Olaparib for Metastatic Breast Cancer in Patients with a Germline BRCA Mutation. The New England journal of medicine, 377(6), 523–533. doi.org/10.1056/NEJMoa1706450.
7. Cortesi, L., Rugo, H. S., & Jackisch, C. (2021). An Overview of PARP Inhibitors for the Treatment of Breast Cancer. Targeted oncology, 16(3), 255–282. doi.org/10.1007/s11523-021-00796-4.
8. United States Food and Drug Administration (FDA). (2018). FDA approves olaparib for germline BRCA-mutated metastatic breast cancer. http://www.fda.gov/drugs/ resources-information-approved-drugs/fda-approves-olaparib-germline-brca-mutated-metastatic-breast-cancer. Accessed February 20, 2023.
9. United States Food and Drug Administration (FDA). (2018). FDA approves talazoparib for gBRCAm HER2-negative locally advanced or metastatic breast cancer. https://www.fda. gov/drugs/drug-approvals-and-databases/fda-approves-talazoparib-gbrcam-her2-negative-locally-advanced-or-metastatic-breast-cancer. Accessed February 20, 2023.
10. Clinical Trials.gov. (2022). A study evaluating talazoparib (BMN 673), a PARP inhibitor, in advanced and/or metastatic breast cancer patients with BRCA mutation (EMBRACA Study) (EMBRACA). clinicaltrials.gov/ct2/show/NCT01945775. Accessed February 20, 2023.
11. Litton, J. K., Rugo, H. S., Ettl, J., Hurvitz, M. D., & Blum, J. L. (2018). Talazoparib in Patients with Advanced Breast Cancer and a Germline BRCA Mutation. The New England journal of medicine, 379(8), 753–763. doi.org/10.1056/NEJMoa1802905.
12. Zimmer, A. S., Gillard, M., Lipkowitz, S., & Lee, J. M. (2018). Update on PARP Inhibitors in Breast Cancer. Current treatment options in oncology, 19(5), 21. doi.org/10.1007/s11864-018-0540-2.
13. Litton, J. K., Hurvitz, S. A., Mina, L. A., Rugo, H. S., & Ettl, J. (2020). Talazoparib versus chemotherapy in patients with germline BRCA1/2-mutated HER2-negative advanced breast cancer: final overall survival results from the EMBRACA trial. Annals of oncology : official journal of the European Society for Medical Oncology, 31(11), 1526–1535. doi.org/10.1016/j.annonc.2020.08.2098.
14. Loirat, D., de Labarre, M. D., Essner, C., Hrab, I., & Pujol, P. (2022). Abstract P1-18-28: phase IV study evaluating effectiveness and safety of talazoparib in patients with locally advanced or metastatic HER2 negative breast cancer and a BRCA1 or BRCA2 mutation (ViTAL). Cancer Res., 82(Suppl_4): P1-18-28. doi.org/10.1158/1538- 7445.sabcs21-p1-18-28.
15. Sendur, M. A. N., Cakar, B., Hızal, M., Eraslan, E., & Gokmen, E. (2021). 124P talazoparib in locally advanced or metastatic breast cancer patients: Experience from an early access program in Turkey. Ann Oncol Elsevier, 32 (Suppl_2), 74. doi.org/10.1016/j.annonc.2021.03.138.














Leave a comment