Особливості хірургічного етапу лікування раку грудної залози за наявності згрупованих мікрокальцифікатів
Смоланка І.І. (ст.), Мовчан О.В., Ляшенко А.О. , Лобода А.Д., Смоланка І.І. (мол.), Досенко І.В., Іванкова О.М.
Резюме. Групи мікрокальцифікатів грудної залози — це відкладення кальцію, які вважаються маркерами раку грудної залози (РГЗ), якщо їх виявляють на мамографії. Часто поєднуються із солідною пухлиною, а іноді тільки вони є джерелом морфологічної верифікації діагнозу. Метою роботи було оцінити вплив наявності згрупованих мікрокальцифікатів грудної залози на безрецидивну виживаність хворих на РГЗ, проаналізувати основні хірургічні втручання для хворих з мікрокальцифікатами та без них. Матеріали та методи. Маємо досвід обстеження 60 хворих. Перша група — 30 хворих на місцево-поширений РГЗ, при якому наявність солідної пухлини супроводжувалася групами мікрокальцинатів, що виходили за її межі, утворювали скупчення, «доріжки» тощо. У 2-гу групу включили 30 пацієнтів із РГЗ ідентичних стадій, але без діагностованих згрупованих мікрокальцифікатів. Результати. Наявність згрупованих мікрокальцифікатів ускладнювала досягнення «чистого краю» R0 резекції і потребувала виконання більшої частки онкопластичних втручань та підшкірних мастектомій. Виявлена суттєва різниця в безрецидивній виживаності між хворими з наявністю мікрокальцифікатів та без них на 5-річний термін — 73,4% проти 86,7%. Рецидиви здебільшого виникали у хворих, яким виконували традиційні онкозберігаючі втручання, що робить онкопластичні операції та підшкірні мастектомії методом вибору для хірургічного лікування хворих з наявністю згрупованих мікрокальцифікатів.
Одержано 28.07.2023
Прийнято до друку 7.06.20213
DOI: 10.32471/clinicaloncology.2663-466X.50-2.30837
Група мікрокальцифікатів (ГМК) грудної залози — це 5 і більше відкладень діаметром <0,5 мм у тканині грудної залози. Альберт Саломон, німецький хірург, який сфотографував понад 3000 хірургічних зразків, намагаючись охарактеризувати зв’язок ГМК із запальним раком грудної залози (РГЗ) та поширенням пухлини на лімфатичні вузли, був першим, хто повідомив про цю радіологічну характеристику [1].
ГМК спочатку було ідентифіковано в діагностичній мамографії в 1951 р., і з тих пір набуває все більшого значення в діагностиці раку. Вважається, 30–50% злоякісних новоутворень молочної залози, які не пальпуються, проявляють себе лише ГМК на мамографії [2]. Морфологія окремих мікрокальцифікатів і морфологія кластерів мікрокальцинатів наразі вивчені та досліджені недостатньо [3, 4], хоча ГМК широко виявляються на мамограмах, ГМК класифікуються як підозра на рак грудної залози у п’ятій версії системи звітності та даних щодо візуалізації грудей (BI-RADS) [5]. Кальцифікати, пов’язані з раком, як правило. дрібні й потребують збільшення задля чіткої візуалізації. ГМК необхідно визначати з точки зору морфології та локалізації [6].
Для класифікації ризику тип і вміст ГМК є критичними. Наприклад, плейоморфна або тонка лінійна ГМК, як було показано в метааналізі за участю понад 10 000 осіб, істотно пов’язані з раком [7].
Водночас більшість кальцифікатів грудей є дистрофічними і розвиваються в кінцевих протоково-часточкових одиницях; вони пов’язані з різними клінічними подіями, включаючи запалення [8].
Біохімічно ГМК поділяють на два типи: тип I, який утворюється з оксалату кальцію (CO), і тип II, який складається з гідроксиапатиту (HA). Класифікація базується не тільки на хімічному складі, а й також на мамографічних характеристиках, таких як форма, розподіл і щільність [9]. Різниця між типами є важливою, оскільки дослідження свідчать, що тип II часто пов’язаний зі злоякісними ураженнями [10].
ГМК пов’язують як з доброякісними, так і зі злоякісними утвореннями молочної залози; їх відмічають у різних доброякісних утвореннях, включаючи фіброаденоми, фіброаденоматоз і склерозуючий аденоз, вони можуть бути пов’язані з двома процесами, які також зі злоякісним інвазивним раком, а саме некрозом і фіброзом [11].
Залучення макрофагів є ще однією ознакою злоякісних новоутворень. Показано, що асоційовані з пухлиною макрофаги (ТАМ), які вивільняють цитокіни, відіграють важливу роль у генезі ГМК. ГМК пов’язана з кістами, ділянками пошкодження, такими як адипонекроз або запалення, і минулими хірургічними втручаннями, вони часто переповнені макрофагами [12].
Коли ГМК асоціюються з епітеліальними клітинами, субпопуляція епітеліальних клітин молочної залози може зазнати епітеліально-мезенхімального переходу (EMT) [13]. При запальному раку молочної залози експресія певних остеогенних білків, таких як остеопонтин і кістковий морфогенетичний білок 2, посилює патологічне утворення мікрокальцинатів [14, 15]. Альтерації, що пов’язані з мінералізацією, описуються остеогенною моделлю утворення кальцифікатів. Це вімічається в проліферативних і прекурсорних епітеліальних ураженнях, пов’язаних з ГМК [16]. Хоча ці остеогенні аспекти добре задокументовані для інвазивного місцево-поширеного РГЗ та клітинних ліній РГЗ in vitro, існує брак публікацій, що висвітлюють згадані особливості. Диференціація на основі біохімічних особливостей може підвищити прогностичну цінність ГМК на мамограмах, для цього потрібні біопсії, які забезпечують достатньо зразків для хімічної оцінки, і цей підхід наразі призначений виключно для діагностичних цілей. У цьому разі використання профілю мас-спектрометрії з тонкоголкових аспіраційних зразків може бути вдосконаленням [17].
Окрема форма ГМК описана як магнійзаміщений гідроксиапатит (Mg-HA). З’ясовано, що кореляція цього типу ГМК із злоякісними новоутвореннями становить 100%. При наявності ГМК ймовірність пропустити карциному, протокову карциному in situ становить близько 20%. Кілька досліджень показали, що видалення джерела мікрокальцифікатів значно знижує ризик виникнення інвазивного раку [18–20].
Мета — дослідити зв’язок ГМК грудної залози з тактикою хірургічного лікування та безрецидивною виживаністю хворих на РГЗ.
МАТЕРІАЛИ ТА МЕТОДИ
Маємо досвід обстеження 60 хворих: 1-ша група — 30 хворих на місцево-поширений РГЗ (МПРГЗ), при якому наявність солідної пухлини супроводжувалася ГМК, що виходили за її межі, утворювали скупчення, «доріжки» тощо; 2-га група — 30 пацієнтів із РГЗ ідентичних стадій, але без діагностованих ГМК.
Щоб уникнути неефективності інвазивних маніпуляцій, таких як трепанобіопсія, ми вирішили проводити трепанобіопсію під стереотаксисом саме цих утворень. У всіх випадках нам вдалося гістологічно підтвердити діагноз і визначити імуногістохімічну картину захворювання з метою проведення адекватного спеціального лікування.
Відповідно до отриманих імуногістохімічних результатів біоптатів із ГМК найбільше пацієнтів із люмінальним В субтипом РГЗ — 33,33±5,17% та 43,33±6,72% в обох групах. Тричі негативних та HER2-позитивних пацієнтів приблизно однакова кількість в обох групах, цікаво було виділити групу з відносно новим показником — HER2-низьким — 2 (6,67±2,00%) у 1-й групі та 1 (3,33±1,42%) у 2-й групі, які також отримували таргетну терапію (табл. 1).
| Імуногістохімічний субтип | З ГМК | Без ГМК | ||
| n | % | n | % | |
| Люм А | 7 | 23,33±3,02 | 3 | 10,0±1,42 |
| Люм В | 10 | 33,33±5,17 | 10 | 33,33±5,17 |
| Тричі негативний | 8 | 26,67±7,32 | 11 | 36,67±6,13 |
| Люм B з HER2-позитивним | 3 | 10,0±1,42 | 5 | 16,67±3,08 |
| Люм B з HER2-низьким | 2 | 6,67±2,00 | 1 | 3,33±1,42 |
| Усього | 30 | 100,00 | 30 | 100,00 |
Неоад’ювантний етап лікування був ідентичним для хворих обох груп і включав проведення системної поліхіміотерапії згідно зі стандартами (4 курси за схемою АС, далі 12 курсів монотерапії паклітакселом, причому хворим з ампліфікацією Her2/neu призначення паклітакселу поєднували з введенням трастузумабу).
На хірургічному етапі більшості пацієнток виконували органозберігаючі операції, причому основним критерієм вибору було досягнення «чистого краю» резекції (R0). Це зумовило відмінності в кількості тих чи інших операцій для кожної групи хворих. Так, у групі без мікрокальцифікатів найбільш поширеним втручанням була квадратектомія з регіонарною лімфодисекцією (83%), до того ж різноблочна квадрантектомія (лампектомія), що зазвичай асоціюється з меншим обсягом тканин, які видаляють, проведена в 47% прооперованих. А в групі з наявністю мікрокальцифікатів такі операції виконані менш ніж у половини хворих. У групі з наявністю ГМК було складніше досягти «чистого краю» резекції, що потребувало виконання більш вдосконалених хірургічних втручань. Так, у цієї групи кількість підшкірних мастектомій з одномоментним ендопротезуванням у поєднанні з онкопластичними квадрантектоміями (квадрантектоміями, що потребували більш широких висічень тканини грудної залози і, відповідно, мобілізації, формування та переміщення фігурних клаптів грудної залози) становила 50%, тоді як у групі без ГМК подібні операції становили лише 13% (табл. 2).
| Вид лікування | З ГМК, n, (%) | Без ГМК, n, (%) | p |
| Різноблочна квадрантектомія | 6 (20,0±4,45) | 14 (46,67±4,25) | >0,05 |
| Моноблочна квадрантектомія | 8 (26,7±3,69) | 11 (36,7±1,42) | >0,05 |
| Радикальна мастектомія | 1 (3,3±3,69) | 1 (3,3±3,69) | >0,05 |
| Підшкірна мастектомія з одномоментним ендопротезуванням | 5 (16,7±3,42) | 2 (6,67±2,00) | >0,05 |
| Онкопластичні квадрантектомії | 10 (33,3±3,08) | 2 (6,67±2,00) | >0,05 |
| Усього | 30 (100,00) | 30 (100,00) |
РЕЗУЛЬТАТИ
Аналізували результати комплексного лікування в обох групах пацієнтів за показником безрецидивної виживаності в термін до 5 років. Виявлено, що протягом 2-річного періоду моніторингу не було суттєвих відмінностей у безрецидивному виживанні серед пацієнтів з наявністю або відсутністю ГМК. Подібна тенденція очікувалася й у майбутньому, зважаючи, що у всіх випадках було досягнуто «чистого краю» резекції. Починаючи з третього року, у першій групі відмічена тенденція до зниження показника безрецидивної виживаності порівняно з групою пацієнтів без ГМК. На 5-й рік спостереження зафіксована суттєва різниця показника безрецидивної виживаності між групами — 86,7% проти 73,4% (табл. 3, рисунок). Таким чином, наявність ГМК підвищувала вірогідність рецидиву на 13,3%.
| Виживаність, років | Група хворих, n (%) | |
| з ГМК | без ГМК | |
| 1 | 29 (96,7±3,69) | 29 (96,7±3,69) |
| 2 | 28 (93,3±2,00) | 28 (93,3±2,00) |
| 3 | 26 (86,7±3,25) | 27 (90±2,69) |
| 4 | 24 (80,0±4,45) | 27 (90±2,69) |
| 5 | 22 (73,4±3,69) | 26 (86,7±3,25) |
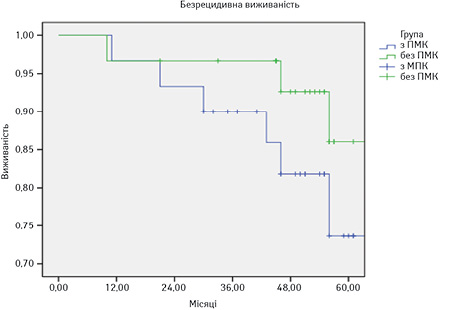
Отже, наявність мікрокальцифікатів підвищує вірогідність рецидиву онкопроцесу навіть при досягненні «чистого краю» резекції (R0).
Характерною особливістю було те, що всі рецидиви в групі мікрокальцинатів виникли у хворих, яким виконувалися традиційні органозберігаючі операції (квадрантектомії та лампектомії). Виконання онкопластичних квадрантектомій та підшкірних мастектомій було виправдане в ракурсі підвищення безрецидивної виживаності.
Таким чином, ГМК може відігравати важливу прогностичну роль при інвазивних карциномах і погіршувати прогноз порівняно з пухлинами без ГМК. Наявність, склад і тип ГМК в ураженнях грудних залоз можуть вплинути на результати лікування й показники безрецидивної виживаності. Важливо, щоб наявність і морфологічні особливості ГМК були правильно інтерпретовані для ухвалення правильної тактики лікування.
ВИСНОВКИ
1. Наявність ГМК, що супроводжують солідні пухлини, потребує виконання більшої кількості онкопластичних втручань та підшкірних мастектомій, що пов’язане з більшими складнощами в досягненні «чистого краю» R0.
2. Наявність ГМК підвищує ризик рецидиву пухлини на 13,3% в 5-річний термін.
3. Виконання широких висічень з переміщенням фігурних клаптів (онкопластичні операції) та підшкірні мастектомії є методом вибору хірургічної техніки за наявності ГМК.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Azam, S., Eriksson, M., Sjölander, A., Gabrielson, M., Hellgren, R., Czene, K., & Hall, P. (2021). Mammographic microcalcifications and risk of breast cancer. British Journal of Cancer, 125, 759–765. doi.org/10.1038/s41416-021-01459-x.
2. American Cancer Society. Last Revised. (2022). Retrieved from http://www.cancer.org/ cancer/breast-cancer/ screening-tests-and-early-detection/ american-cancer-society- recommendations-for-the-early-detection-of-breast-cancer.html.
3. Diori Karidio, I., & Sanlier, S. (2021). Reviewing cancer’s biology: an eclectic approach. Journal of the Egyptian National Cancer Institute, 33, 32–37. doi.org/10.1186/s43046-021-00088-y.
4. Kozegar, E., Soryani, M., Behnam, H., Salamati, M., & Tan, T. (2020). Computer aided detection in automated 3-D breast ultrasound images: a survey. Artificial Intelligence Review, 53, 1919–1941. doi.org/10.1007/s10462-019-09722-7.
5. Logullo, A., Prigenzi, K., Nimir, C., Franco, A., & Campos, M. (2022). Breast microcalcifications: Past, present and future (Review). Molecular and Clinical Oncology, 16(4), 81–89. doi: 10.3892/mco.2022.2514.
6. Weerakkody, Y., Niknejad, M., & Yap, J. (2023). Breast imaging-reporting and data system (BI-RADS). Retrieved from doi.org/10.53347/rID-10003.
7. Po-Hao, C., Ghosh, E., Slanetz, P., & Eisenberg, R. (2012). Segmental Breast Calcifications. American Journal of Roentgenology, 199, 124–133. Retrieved from W532-W542. 10.2214/AJR.11.8198.
8. Livasy, C. (2015). Breast Pathology. In H.M. Reisner (Ed.), Pathology: A Modern Case Study. Retrieved from accessmedicine.mhmedical.com/content.aspx?bookid= 1569§ionid=95971193.
9. Ghammraoui, B., Makeev, A., Zidan, A., Alayoubi, A., & Glick, S. (2019). Classification of breast microcalcifications using dual-energy mammography. Journal of Medical Imaging (Bellingham), 6(1), 013502. doi: 10.1117/1.JMI.6.1.013502.
10. Jang, S., Gardner, J., & Ro, J. (2011). Diagnostic approach and prognostic factors of cancers. Advances in Anatomic Pathology, 18(2), 165–172. doi: 10.1097/PAP.0b013e3182.
11. Huang, N., Chen, J., Xue, J., Yu, B., Chen, Y., Yang, W., … Wu, J. (2015). Breast Sclerosing Adenosis and Accompanying Malignancies: A Clinicopathological and Imaging Study in a Chinese Population. Medicine (Baltimore), 94(49), e2298. doi: 10.1097/MD.0000000000002298.
12. Smolanka, I., Bagmut, I., Movchan, O., Sheremet, M., Bilyi, O., Lyashenko, A., … Ivankova, O. (2023). Features of VEGF and IL-6 expression in patients with inflammatory breast cancer considering molecular-biological characteristics. Journal of medicine and life, 16, 153–159. doi:10.25122/jml-2022-0172.
13. Leggetti, S., Hruska, A., Guo, M., & Wong, I. Y. (2021). The epithelial-mesenchymal transition and the cytoskeleton in bioengineered systems. Cell Communication and Signaling, 19, 32–42. doi.org/10.1186/s12964-021-00713-2.
14. Stamnitz, S., Krawczenko, A., Szałaj, U., Górecka, Ż., Antończyk, A., Kiełbowicz, Z., … Klimczak, A. (2022). Osteogenic Potential of Sheep Mesenchymal Stem Cells Preconditioned with BMP-2 and FGF-2 and Seeded on an nHAP-Coated PCL/HAP/β-TCP Scaffold. Cells, 11(21), 3446–3457. doi.org/10.3390/cells11213446.
15. Bonfiglio, R., Scimeca, M., Urbano, N., Bonanno, E., & Schillaci, O. (2018). Breast microcalcifications: Biological and diagnostic perspectives. Future Oncology. 14, 3097–3099. doi: 10.2217/fon-2018-0624.
16. Azadi, S., Torkashvand, E., Mohammadi, E., & Tafazzoli-Shadpour, M. (2023). Analysis of EMT induction in a non-invasive breast cancer cell line by mesenchymal stem cell supernatant: Study of 2D and 3D microfluidic based aggregate formation and migration ability, and cytoskeleton remodeling. Life Science, 320, 121545. doi: 10.1016/j.lfs.2023.121545.
17. Zubor, P., Kubatka, P., Kajo, K., Dankova, Z., Polacek, H., Bielik, T., … Golubnitschaja, O. (2019). Why the Gold Standard Approach by Mammography Demands Extension by Multiomics? Application of Liquid Biopsy miRNA Profiles to Breast Cancer Disease Management. International Journal of Molecular Sciences, 20(12), 2878–2892. doi.org/10.3390/ijms20122878.
18. van Seijen, M., Lips, E., Thompson, A., Nik-Zainal, S., Futreal, A., Hwang, E. S., … Wesseling, J. (2019). Ductal carcinoma in situ: to treat or not to treat, that is the question. British Journal of Cancer, 121(4), 285–292. doi: 10.1038/s41416-019-0478-6.
19. Tot, T., Gere, M., Hofmeyer, S., Bauer, A., & Pellas, U. (2021). The clinical value of detecting microcalcifications on a mammogram, Seminars in Cancer Biology, 72, 165–174. doi.org/10.1016/j.semcancer.2019.10.024.
20. Cha, Y., Eun, N., Kim, D., Bae, S., & Ahn, S. (2022). Residual Tumor Patterns of Breast Cancer on MRI after Neo-Adjuvant Chemotherapy: Impact on Clinicopathologic Factors and Prognosis. Diagnostics (Basel), 12(10), 2294–2303. doi: 10.3390/diagnostics12102294.
Адреса для листування:
Ляшенко Андрій Олександрович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: artz.doctor@gmail.com
Сorrespondence:
Andriy Lyashenko
33/43 Yulia Zdanovska str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: artz.doctor@gmail.com














Leave a comment