Морфологічні дослідження у визначенні гістогенезу раку легень
Болгова Л.С., Туганова Т.М., Алексєєнко О.І.
Резюме. Великий обсяг літератури, присвячений визначенню джерела розвитку раку легень (РЛ), не дозволив вченим дійти до узгодженої єдиної думки, що зумовлює подальше дослідження цього питання. Відома різностороння медична література, дотична до питання гістогенезу РЛ, дозволила розкрити вузлові питання. Так, встановлено, що структура легень в центральній частині подібна до такої в периферичних відділах. Виявлено стовбурову клітину (СК) легень, до яких належать пневмоцити (альвеолоцити) ІІ типу — АТІІ. Численні дослідники на експериментальних моделях виявили, що місце переходу базальних клітин бронхіального епітелію в альвеолярний є найбільш вразливим і саме тут розвиваються реактивні гіперпластичні зміни епітелію в разі дії токсичних речовин. Але до цього часу не розкриті структурні морфологічні ознаки початку розвитку і росту РЛ. Мета дослідження — обґрунтування єдиного джерела розвитку і характерної структури росту раку легень. Матеріал і методи дослідження. Ексфоліативна цитологічна діагностика проведена у 807 хворих, гістологічні дослідження здійснені на операційному матеріалі 120 хворих. Забарвлення цитологічних препаратів проведено за методом Папаніколау та Паппенгеймом, гістологічні — гематоксиліном і еозином, за Папаніколау та за W. Howell, D. Black. Результати дослідження. Проведені макроскопічні, морфометричні, гістологічні, імуногістохімічні та цитологічні дослідження, які дозволили визначити характер росту РЛ, який бере початок з клітин альвеолярного епітелію і розвивається до її центру. Виявлений напрямок росту підтверджується низкою морфологічних та імуногістохімічних ознак змін клітин і розпадом РЛ у центрі альвеоли, що відповідає загальновизнаному морфогенезу ракової пухлини. Висновок. Зафіксовано початок росту і його пролонгація в альвеолах, що можна вважати доведеним фактом єдиного джерела розвитку, а також направлення і характер росту РЛ.
Одержано 12.10.2023
Прийнято до друку 23.10.2023
DOI: 10.32471/clinicaloncology.2663-466X.51-3.31158
ВСТУП
РЛ є найбільш частим злоякісним захворюванням людини в усьому світі [24, 40, 85, 93]. Відмічено підвищений рівень смертності внаслідок його розвитку [11, 28, 32, 53, 82, 91]. Зокрема, в Україні, за уточненими даними, у 2020 р. захворіли на РЛ 10 351 особа, а померли — 8339 (81%). Це надзвичайно високий рівень летальності. Залишається також підвищеною смертність до року з дня діагностики РЛ — 60–65% [85]. У всіх країнах світу РЛ діагностують у 60–70% пацієнтів пізно, на ІІІ–ІV стадіях, коли спеціальна терапія, яку ще можливо провести, не дозволяє досягти бажаних лікувальних результатів [24, 77].
Такий перебіг захворювання на РЛ можна пояснити безсимптомним його початком [25, 43, 72, 74] і пролонгацією до тих пір, коли вже виявлено фатальну клінічну картину, що вимушує пацієнта звернутися за медичною допомогою [15, 57–59, 83, 85, 91, 93, 96].
Зазначений стан обґрунтовує необхідність всебічних поглиблених наукових досліджень для уточнення як джерела розвитку, так і характеру біологічного росту РЛ, що дозволить підійти до вирішення нагальних питань в онкопульмонології.
В онкології, як відомо, діагностика на ранніх стадіях захворювання є єдиним надійним шляхом боротьби зі злоякісними пухлинами і, зокрема, з РЛ [1, 5, 8, 12, 40, 48, 80, 99]. Оскільки розвиток і розповсюдження РЛ багато в чому є взаємозв’язаними, виникла необхідність вивчити спеціальну медичну літературу щодо згаданих головних аспектів.
Більш ніж 50-річна ексфоліативна цитологічна діагностика РЛ за матеріалами мокротиння та промивних вод, мазків зі слизової оболонки бронхів і екзофітної пухлини, що в них розвинулася, взятих під час виконання фібробронхоскопії, дозволили нам визначити невисоку ефективність верифікації РЛ, що спонукає до проведення подальших досліджень [3–5, 9,]. У ситуації, що виникла, не вдається знайти пояснення звичному і майже загальновизнаному погляду на розвиток РЛ з бронхіального епітелію [10].
Поряд із цим у медичній літературі опубліковані патологоанатомічні дані про те, що зі зрілого циліндричного епітелію не може розвинутися РЛ [20, 21, 76].
Через отримані дані постає питання визначення гістогенезу РЛ, від чого залежить діагностика гістологічного типу і визначення тактики лікування. Для цього необхідно вивчити низку питань щодо структури легень, СК та медичної літератури, в якій висвітлені питання гістогенезу РЛ.
За результатами вивчених численних різносторонніх наукових досліджень, дотичних до проблеми РЛ, уточнено багато питань. Так, зафіксовано, що структура легень у периферичних відділах подібна до такої в центральних, тобто від бронхів різного калібру відходять бронхіолоальвеолярні (термінальні) структури, що має пряме відношення до визначення початку росту РЛ (рис. 1) [17, 67].
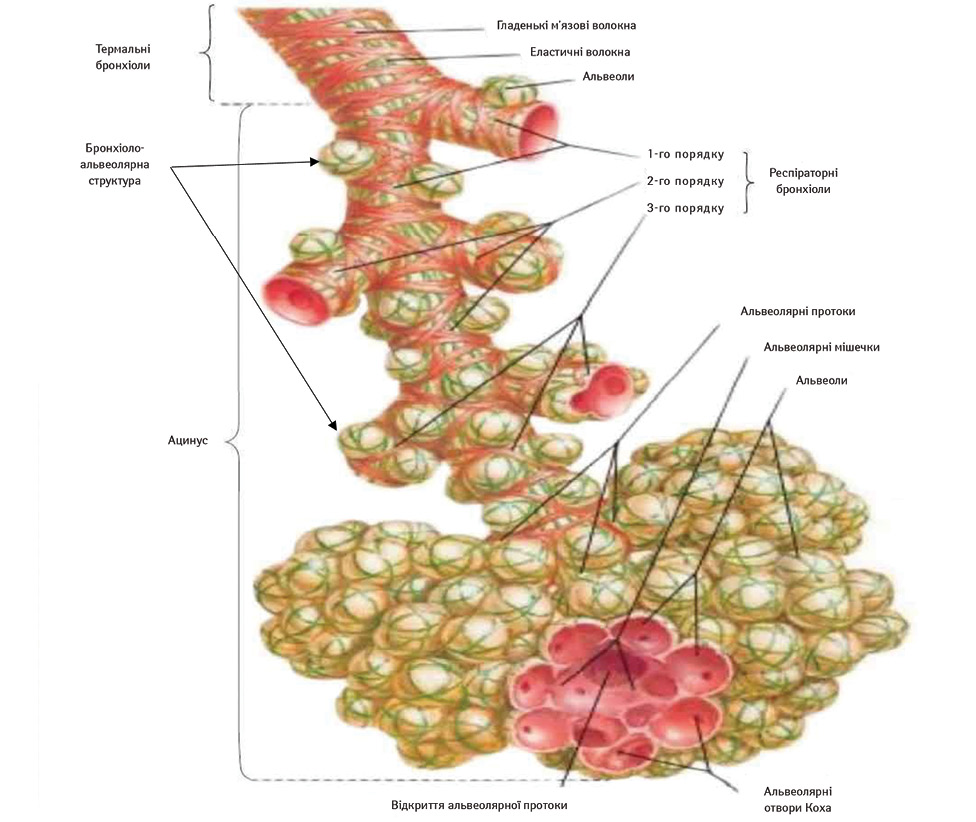
Велика кількість незалежних авторів дійшли висновку, що ракові й неракові захворювання розвиваються в термінальних бронхіолах легень [14, 15, 19, 47, 57, 64, 73]. Отримані результати підтверджуються всебічно обґрунтованим положенням І.К. Єсипової про те, що дані морфології та фізіології дозволили дійти до єдиної думки, згідно з якою функціональною одиницею легень, яка цілісно реагує в умовах різних патологічних процесів, є термінальна бронхіола. Це надзвичайно суттєве положення затверджено Міжнародною номенклатурою [16]. Відомо, що легені є залозистим органом і мають складну альвеолярно-трубчасту структуру з відповідними функціями.
Вельми важливими є дослідження науковців, які за допомогою мікроскопічних, електронномікроскопічних і радіологічних методів визначили СК легень, до яких належать пневмоцити (альвеолоцити) ІІ типу (АТІІ). Для них характерне найбільш швидке відновлення при пошкодженнях та найбільша кількість мітозів серед усіх епітеліальних клітин легень, що характеризує їх як СК легень [13, 15, 18, 26, 27, 34, 39, 45, 55, 62, 81, 95].
У низці досліджень науковці вивчали молекулярно-генетичні дані в процесі виникнення і розвитку РЛ, але не отримали однозначних результатів щодо гістогенезу РЛ [41, 65, 70, 91, 100].
Поряд із цим групи численних дослідників з багатьох наукових закладів, які працювали на експериментальному матеріалі, дійшли висновку, що найбільш виражена проліферація клітин починається в місці переходу базального епітелію бронхів в альвеолярний тип клітин [38, 46, 55], що підтверджує відому загальноморфологічну особливість розвитку патологічного процесу саме в місці переходу одного типу епітелію в інший. Такі переходи виявляють у легенях впродовж усіх бронхів різного калібру [66].
Низка науковців називають такі клітини «бронхіолоальвеолярними стовбуровими клітинами» (Bronchioalveolar stem cells — BASCs) [53, 55, 75, 76]. Установлений феномен має загальне патологоанатомічне і загальнобіологічне значення в розвитку захворювань легень. Місце переходу одного епітелію в інший називається «Status resistance minimum», тобто найменш стійке місце під час дії патогенних реагентів. На цьому загальновизнаному принципі (тобто в місці переходу циліндричного епітелію цервікального каналу в плоский епітелій ектоцервіксу, тобто в місці стику, звідки беруть матеріал для морфологічного дослідження) побудований клініко-морфологічний скринінг передраку і раку шийки матки у мільйонів жінок усього світу.
Відомі численні висновки патологоанатомів, які при вивченні гістологічної структури РЛ в одній пухлині виявляли ділянки різних гістологічних типів і ступенів диференціювання, що може опосередковано свідчити про єдиний генез розвитку РЛ [15, 42, 54, 59, 69, 82, 86, 87, 97].
Крім того, низка авторів стверджують, що аденокарцинома розвивається з альвеолярного епітелію [14, 27, 31, 33, 34, 58, 60, 91, 94]. Також наявні дані про розвиток аденокарциноми в центральних відділах легень, де є місця переходу базального епітелію бронха в альвеолярний [17, 67].
Плоскоклітинний РЛ, як передбачає W.D. Travis [91], починається з базальних клітин бронхіального епітелію, з якого можуть розвиватися різні гістологічні типи РЛ, що наближує автора до істинного джерела початку розвитку згаданого захворювання. Результати досліджень низки авторів свідчать про однакову ефективність лікування залозистого і плоскоклітинного РЛ, що теж може опосередковано підтвердити їх єдиний генез [71].
Окремим напрямком розвитку РЛ є вивчення розповсюдження клітин РЛ по паренхімі легень. Автори дійшли висновку, що РЛ поширюється в легенях по повітроносних шляхах [35, 49–51, 61, 63, 78, 79, 84, 88, 89, 92, 98].
У публікаціях, в яких йдеться про гістогенез РЛ, автори тільки в передбачуваній формі пишуть про різні джерела розвитку цього захворювання, тобто питання залишається відкритим [31, 32, 91, 36, 40, 56, 90].
Надзвичайно суттєвим є твердження А.А. Have-Opbroek та співавторів [44] про онкофетальний механізм канцерогенезу. Цю ідею підтверджують своїми дослідженнями H. Kathiriya та співавтори [52]. Дослідниками зафіксовано, що пошкоджені клітини циліндричного епітелію в період відновлення спочатку набувають морфологічних ознак альвеолярного епітелію і поступово диференціюються в циліндричний. Результати досліджень свідчать про те, що саме клітини альвеолярного епітелію можна вважати філогенетичними СК легень, а відтак і СК РЛ.
За результатами аналізу великого обсягу медичної літератури ХХІ ст. (більше 60 публікацій) та експериментальними даними, автори різних країн світу не дійшли єдиного висновку щодо джерела розвитку РЛ [37], що свідчить про необхідність поглибленого вивчення гістогенезу РЛ і обґрунтовує необхідність у подальших дослідженнях.
Крім того, виключення з Міжнародної гістологічної класифікації Всесвітньої організації охорони здоров’я (ВООЗ) РЛ бронхіолоальвеолярного типу [90, 91] підтверджує невизначеність єдиного джерела розвитку РЛ і зумовлює важливість подальшого вивчення згаданого питання.
Мета дослідження — обґрунтування єдиного джерела розвитку і характерної структури росту РЛ.
Ключовим моментом в онкоморфології є визначення гістогенезу пухлини, від чого залежить діагностика гістологічного типу і початок патогенетичного лікування. За даними спеціальної літератури встановлено, що існують різні погляди на причину розвитку і характер росту РЛ [2, 6, 7, 10, 11, 22, 23, 28–30, 68].
МАТЕРІАЛ І МЕТОДИ ДОСЛІДЖЕННЯ
У цій статті наведено результати багатьох наших досліджень, які виконувалися паралельно для верифікації патологічних процесів у легенях хворих, які обстежувалися в Національному інституті раку. Починаючи з 80-х років минулого сторіччя всі розробки відносно РЛ ми проводили під кутом визначення джерела розвитку РЛ, так як відомі дані медичної літератури свідчили про однозначний генез РЛ з бронхіального епітелію, а це не співпадало з нашими результатами [1–12, 28–30]. Інтерпретацію багатьох досліджень ми вивчаємо в цьому матеріалі. Цитологічні дослідження ексфоліативних і пункційних матеріалів проведені від сотень хворих з РЛ. Діагностичний ексфоліативний матеріал (807 осіб) забарвлювали за методами Паппенгейма, Папаніколау, W. Howell, D. Black, вивчали макроскопічні й мікроскопічні дані за операційними матеріалами 120 хворих на РЛ. Гістологічні препарати забарвлювали гематоксиліном і еозином за Папаніколау і за W. Howell, D. Black. Імуногістохімічні дослідження проводили з моноклоналами Ki-67 та PCNA (фірми DAKO). Мікроскопічні дослідження виконували за допомогою мікроскопів Olympus BХ41, Olympus CХ41 зі збільшеннями ×100; ×200; ×400; ×1000.
Нозологічні форми верифікували згідно з новими міжнародними гістологічними класифікаціями [90, 91].
РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ
Вважалося логічним, що в разі отримання матеріалу з екзофітно розвиненої в бронхах пухлини під час виконання фібробронхоскопії (ФБС) у цитологічному препараті повинні бути пухлинні клітини. Але багато років, оцінюючи ексфоліативний матеріал від хворих на РЛ, ми впевнилися, що в ньому не завжди можна знайти ракові клітини. Цей факт спонукав нас провести окреме спеціальне дослідження зіскребків з екзофітних пухлин у бронхах на операційному матеріалі [29] і співставити отримані дані з результатами цитологічної діагностики при виконанні ФБС-обстеження пацієнтів. За результатами проведених цитологічних досліджень на операційному [29] і поточному ексфоліативному діагностичному матеріалі встановлено, що є підґрунтя стверджувати, що ексфоліативна цитологічна діагностика РЛ можлива лише в 28–33% залежно від стану проростання ракової пухлини у слизову оболонку бронхів (табл. 1).
| Діагностичне (n=776) | Експериментальне (n=31) | ||
| Виявлені,% | |||
| Клітини раку | Клітини циліндричного епітелію | Клітини раку | Клітини циліндричного епітелію |
| 28–33 | 72–67 | 36 | 64 |
Встановлений феномен є 1-м імовірним доказом того, що результати ексфоліативної цитологічної діагностики залежать від рівня вростання РЛ в стінку слизової оболонки і проростання циліндричного епітелію, який його вистилає.
Водночас макроскопічне вивчення операційного матеріалу у 120 хворих на РЛ дозволило виявити характер росту РЛ по відношенню до стінки бронха і циліндричного епітелію (табл. 2). По об’єму перибронхіальна частина ракової пухлини була в 5–40 разів більша, ніж ендобронхіальна. Результати виконаних досліджень можна пояснити множинними (мультифокальними) джерелами розвитку РЛ, переважно перибронхіальними.
| Eндобронхіально | Eндо-, перибронхіально | Перибронхіально | |||
| n | % | n | % | n | % |
| 20 | 17 | 6 | 5 | 94 | 78 |
Виявлений ріст РЛ в альвеолах в гістологічних препаратах у всіх 100% спостережень з плоскоклітинним РЛ, у 85% — у препаратах АК і в 60% — дрібноклітинного РЛ. Також відмічено ріст у вигляді солідних пластів у всіх фенотипічних варіантах РЛ, але переважно у структурі дрібноклітинного РЛ (табл. 3).
| Плоскоклітинний рак | Aденокарцинома | Дрібноклітинний рак |
| 100% | 85% | 60% |
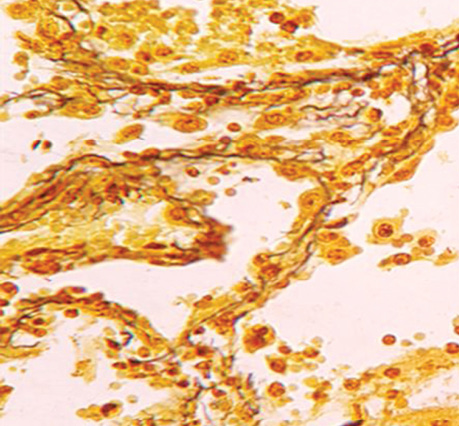
Особливість будови останнього полягає в тому, що ріст цього типу раку проходить більш швидко, і в альвеолах він виглядає солідним, тобто ракові клітини повністю заповнюють альвеоли. Свідченням того, що збільшення розміру пухлини проходить в альвеолах, є наявність чітких міжальвеолярних перетинок, в яких часто можна виявити судини з еритроцитами (рис. 2–5).
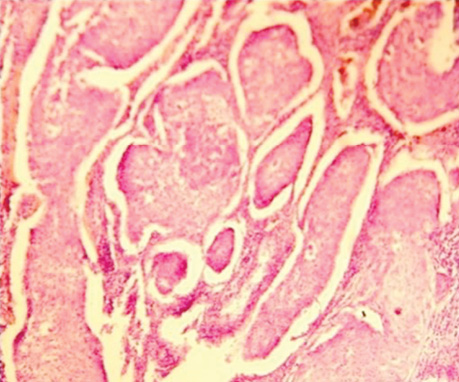
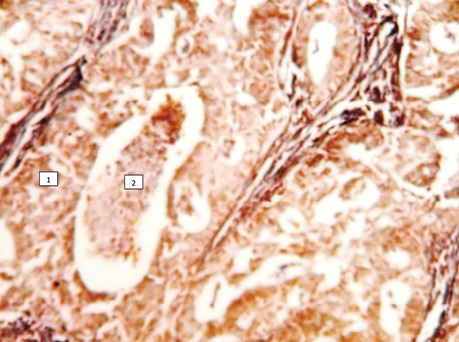
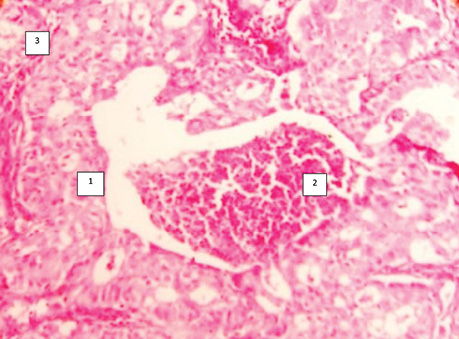
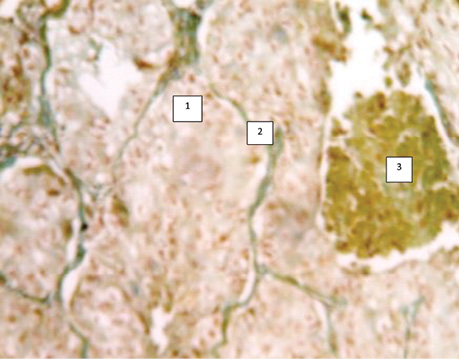
Вивчені квантитативні показники ядерцеутворювальних ділянок (ЯУД) хромосом клітин недрібноклітинного (плоскоклітинного і залозистого) типу РЛ, які свідчать про подібний рівень нуклеопротеїдних процесів в ядрах залозистого раку (8,7±0,1) і плоскоклітинного — (7,9±0,1) варіантів, що наближує їх за біологічною суттю й опосередковано може свідчити про їх єдиний генез. Визначені доказові показники морфофункціональних типів (МФТ) ЯУД хромосом в ядрах АТІІ (СК) з ознаками проліферації, які становили 5,3±0,1 порівняно з АТІІ без морфологічних змін (3,8±0,1), що може свідчити про кількісне збільшення нуклеопротеїдних речовин в СК і підтверджує процес їх можливої малігнізації, тобто, іншими словами, бути причиною розвитку РЛ.
Наступним етапом нашого дослідження було визначення наявності пухлинних клітин та АТІІ з їх морфологічними ознаками в макроскопічно не зміненій паренхімі видаленої долі легень з пухлиною. Для цього проведене спеціальне цитологічне дослідження у 23 хворих. З розрізів паренхіми легень на відстані 2 см і віддаленішої ділянки — 5 см і більше від периферичного краю пухлини (до вісцеральної плеври) виконані зіскребки з подальшим вивченням цитологічних препаратів [7].
У результаті досліджень установлено, що у всіх зазначених місцях на різній відстані від периферичного краю видаленої пухлини знайдені клітини раку і АТІІ з ознаками проліферації і атипії, що свідчать про розповсюдженість ракових клітин по незміненій паренхімі від периферичного краю видаленої пухлини до вісцеральної плеври. Зафіксоване явище може засвідчити поширеність ракових клітин від основного пухлинного вузла або множинний мультифокальний початок розвитку РЛ. Для уточнення виявленого явища проведено гістологічні дослідження, про які буде написано нижче.
Виявлені клітини АТІІ з ознаками проліферації й наявністю атипії, визначені не тільки за цитоморфологічними, але і за цитогенетичними (за морфофункціональними типами ЯУД хромосом) змінами та підтверджує їх малігнізацію, а також може бути джерелом розвитку РЛ [7].
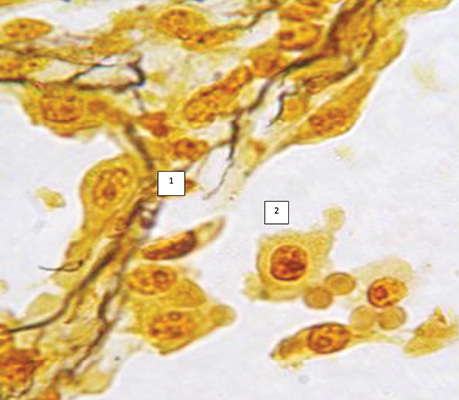
Окреме дослідження гістологічних препаратів помірнодиференційованого і низькодиференційованого плоскоклітинного РЛ, імпрегнованих розчином срібла за методикою W. Howell, D. Black, дозволило визначити позаядерцеві аргентофільні гранули (ПАГ) в клітинах альвеолярного епітелію без морфологічних змін, з ознаками проліферації і вираженої атипії, характерної для ракової пухлини. Установлена закономірність збільшення кількості показників і характеру розміщення ПАГ по мірі наростання ознак проліферації і атипії в клітинах АТІІ і дозволяє об’єктивно доказовим квантитативним методом підтвердити можливість їх малігнізації і пухлинної трансформації, що може підтвердити розвиток РЛ з альвеолярного епітелію (див. рис. 5, 7). Проведені цитоморфологічні, цитогенетичні (МФТ ЯУД) та ультраструктурні дослідження ракових клітин і АТІІ дають підстави стверджувати про мультифокальний ріст периферичного РЛ і підтвердити альвеологенну причину його розвитку [22, 23].
Виявлений ріст РЛ в альвеолах у гістологічних препаратах у всіх 100% спостережень з плоскоклітинним типом, у 85% — у препаратах аденокарциноми і в 60% — дрібноклітинного варіанта. Водночас відмічено ріст у вигляді солідних пластів у всіх фенотипічних варіантах РЛ, але переважав у структурі дрібноклітинного РЛ (див. табл. 3). Особливість будови останнього полягає в тому, що ріст цього типу раку проходить більш швидко, і в альвеолах він виглядає солідним, тобто ракові клітини повністю заповнюють альвеоли. Свідченням того, що ріст пухлини відбувається в альвеолах, є наявність чітких міжальвеолярних перетинок, в яких часто можна виявити судини з еритроцитами (див. рис. 3, 5).
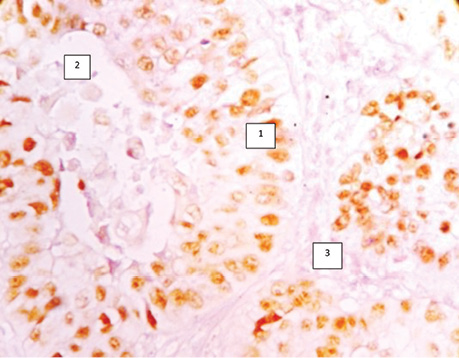
Вивчення гістологічних препаратів різних фенотипічних варіантів РЛ дозволило нам установити пріоритетний, не описаний у медичній літературі фундаментальний факт в онкопульмонології — характерний ріст РЛ, який починається зі стовбурових альвеолярних клітин, що знаходяться на базальній мембрані альвеоли і поширюється в напрямку до її центру, в якому розвивається некроз. Серед некротичних мас визначають пухлинні клітини з ознаками різного ступеня розпаду. Наявні місця, в яких ракові клітини відділяються від солідної структури пухлини, що достовірно свідчить про розпад пухлини в центрі солідної структури РЛ (див. рис. 3, 6, 7). Описаний процес є загальновідомою ознакою морфогенезу ракових пухлин, коли в їх центрі розвивається некроз у результаті швидкого розмноження пухлинних клітин і нестачі кровопостачання. Напрямок росту РЛ в альвеолах підтверджується численними достовірними морфологічними показниками. Це некротичні дрібнозернисті маси з пухлинними клітинами, які відділяються від внутрішніх країв солідних структур РЛ. В імуногістохімічних дослідженнях з моноклональними антитілами Ki-67 та PCNA виявлено ступінь вищої проліферативної активності пухлинних клітин, які знаходяться на базальній мембрані і значно нижчої в середині альвеоли, що підтверджує напрямок росту РЛ від базальної мембрани до її центру (рис. 8, 9).
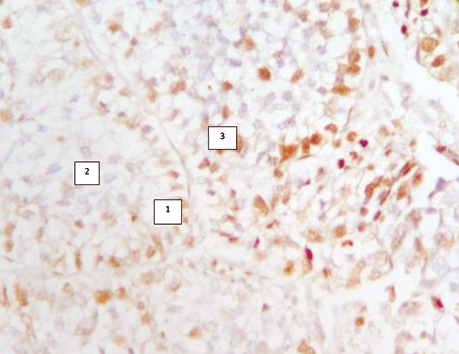
Виконані дослідження дозволили сформулювати низку висновків:
1. У результатах цитологічної ексфоліативної діагностики (776 хворих) зафіксовано цілісність циліндричного епітелію в 67–72% випадків, тобто ракові пухлини в бронхах у переважній більшості росли під ним, і це підтверджено спеціальним дослідженням зіскребків з екзофітної пухлини в бронхах за операційними матеріалами, що в 64% випадків не уможливлювало отримання пухлинних клітин.
2. Ріст РЛ (120 хв) в 94 (78%) пацієнтів має перибронхіальний ріст, тільки ендобронхіальний — у 20 (17%) і ендо-перибронхіальний — у 6 (5%). За об’ємом перибронхіальна частина ракової пухлини була в 5–40 разів більша, ніж ендобронхіальна, що підтверджує переважний перибронхіальний, а не ендобронхіальний ріст РЛ.
3. Квантитативні показники цитогенетичних досліджень (ядерце утворювальних ділянок ЯУД) хромосом мали близькі значення в елементах недрібноклітинних форм РЛ, що підтверджує єдиний їх генез.
4. Виявлені АТІІ з ознаками проліферації і наявністю атипії, визначені не тільки за цитоморфологічними, але і за цитогенетичними — ЯУД (за МФТ ядерцевих організаторів) змінами та підтверджує їх малігнізацію, що може бути джерелом розвитку РЛ.
5. Установлена закономірність збільшення кількості показників і характеру розміщення ПАГ в ядрах клітин по мірі наростання ознак проліферації і атипії в клітинах АТІІ дозволяє об’єктивно підтвердити можливість їх малігнізації і пухлинної трансформації та підтвердити розвиток РЛ з альвеолярного епітелію.
6. Вивчення гістологічних препаратів різних фенотипічних варіантів РЛ дозволило нам установити пріоритетний, не описаний у медичній літературі фундаментальний факт в онкопульмонології — характерний ріст РЛ, який починається від базальної мембрани альвеоли і поширюється в напрямку до її центру, що доведено численними достовірними морфологічними показниками та імуногістохімічними дослідженнями, які дозволили виявити ступінь проліферативної активності клітин у різних шарах пухлини, яка росте в альвеолі (Ki-67 та PCNA).
7. Результати наших досліджень можуть бути покладені в основу нового напрямку введення (циторедуктивних) лікарських форм — ендобронхіально чи пункційним способом прицільно та імунологічних засобів для поліпшення місцевого і загального імунного статусу, що може забезпечити підвищення ефективності консервативного лікування хворих на РЛ.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Болгова, Л. С., & Туганова, Т. Н. (2013). Распределение внеядрышковых аргентофильных гранул в альвеолярном эпителии легкого в процессе опухолевой трансформации. Новости клинической цитологи России, 1–2(17), 9–12.
2. Болгова, Л. С. (1999). О гистогенезе рака легкого. Онкология, 4, 262–265.
3. Болгова, Л. С. (2001). Метаплазия и дисплазия бронхиального эпителия (обзор литературы и современное представление). Клиническая лабораторная диагностика, 1, 46–49.
4. Болгова, Л. С. (2001). Научное обоснование оптимизации цитологической диагностики рака легкого. Лабораторная диагностика, 3, 53–56.
5. Болгова, Л. С., & Туганова Т. Н. (2013). Рак легкого: вопросы гистогенеза и цитологической диагностики. Київ: KIM.
6. Болгова, Л. С., & Ярощук, Т. М. (2010). Гистогенез рака легкого. Вопросы онкологии, 56(4), 469–476.
7. Болгова, Л. С., Aлeксeeнкo, O. I., Tугaнoвa, T. Н., Зотиков, Л. A., & Кротевич, М. С. (2008). Цитологические, цитогенетические и ультраструктурные исследования при изучении гистогенеза железистого рака легкого. Oнкология, 10(3), 334–338.
8. Болгова, Л. С., Tуганова, T. Н., Aлексеенко, O. I., Кротевич, М. С., & Шестакова, Т. С. (2010). Патологоанатомическое изучение характера роста и распространение рака легкого для уточнения гистогенеза. Онкология, 12(1), 112–126.
9. Болгова, Л. С., Гордиенко, Т. М., Манцуров, Н. Е., Крохмалев, С. Н., & Ковальчук, Э. Н. (2009). Эксфолиативная цитологическая диагностика рака легкого по бронхоскопическому материалу. Клиническая лабораторная диагностика, 3, 15–17.
10. Болгова, Л. С., Туганова, Т. М., & Пономаренко, А. О. (2021). Cytological research of exophytic tumors of the bronchi and the growth pattern of lung cancer. NaUKMA Research Papers. Biology and Ecology, 4, 26–31. doi: 10.18523/2617-4529.2021.4.26-31.
11. Болгова, Л. С., Туганова, Т. М., Алексєєнко, О. І., Пономаренко, А. О., & Захаричев, В. Д. (2022). Гістогенез раку легені — етапи дослідження. Медична інформатика та інженерія, 3(59), 30–41. doi.org/1011603/mie.1996-1960.2022.3.13371.
12. Болгова, Л. С., Туганова, Т. Н., Алексеенко, О. И., & Ярощук, Т. М. (2011). Исследование ядрышковых организатооов хромосом в эпителии паренхимы легкого для уточнения гистогенеза железистого рака. Онкология, 13(1), 17–21.
13. Вейбель, Э. Р. (1970). Морфометрия легких человека. Москва: Медицина.
14. Демура, С. А., Коган, Э. А., & Горячкина, В. Л. (2018). Хронические заболевания, предрак и рак легкого, ассоциированные с патологией булавовидных клеток респираторных и терминальных бронхиол. Архив патологии, 80(5), 63–68. doi.org/10.17116/patol20188005163.
15. Ерохин, В. В., & Романова, Л. К. (2000). Клеточная биология легких в норме и при патологии. Москва: Медицина.
16. Есипова, И. К. (1975). Легкое в норме. Новосибирск: Наука.
17. Есипова, И. К. (1975). Легкое в патологии. Новосибирск: Наука.
18. Загорулько, А. К., & Аскари, Т. А. (2002). Атлас ультраструктурной морфологии респираторного отдела легких. Симферополь: AZ — PRESS — СОНАТ.
19. Максимович, Н. А. (1980). Патологическая анатомия острых респираторных заболеваний и их значение в детской летальности. Aрхив патологии, 7, 20–24.
20. Непомнящих, Г. И. (2005). Биопсия бронхов: Морфогенез общепатологических процессов в легких. Москва: Изд-во РАНМ.
21. Непомящих, Г. И., Левицкий, В. А., Долговых, А. К., & Наумова, Л. А. (2002). Патоморфологическое и иммуногистохимическое исследование биоптатов крупных бронхов при раке легкого. Бюллетень экспериментальной биологии и медицины, 134(8), 227–232.
22. Туганова, Т. Н., & Болгова, Л. С. (2011). Сравнительные данные цитогенетических показателей альвеолярного эпителия и опухолевых клеток при плоскоклеточном раке легкого. Клиническая онкология, 3(3), 102–106.
23. Туганова, Т. Н., Болгова, Л. С., & Ярощук, Т. М. (2011). Исследования ядрышковых организаторов хромосом и эпителия паренхимы легкого для уточнения гистогенеза железистого рака. Онкология, 13(1), 17–21.
24. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., Гулак, Л. О., & Куценко, Л. Б. (2022). Рак в Україні, 2020–2021. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України (Vol. 23). Кропивницький: Поліум.
25. Bains, S., Eguchi, T., Warth, A., Yeh, Y. C., Nitadori, J. I., Woo, K. M., … Adusumilli, P. S. (2019). Procedure-specific risk prediction for recurrence in Patients undergoing lobectomy or sublobar resection for small (<2 cm) lung adenocarcinoma: an international cohort analysis. Journal of Thoracic Oncology, 14(1), 72–86.
26. Beers, M. Y., & Moodley, Y. (2017). When Is an Alveolar Type 2 Cell an Alveolar Type Cell? А Conundrum for Lung Stem Cell Biology and Regenerative Medicine. American Journal of respiratory cell and molecular biology, 57, 118–127. doi.org/10.1165/rcmb.2016-0426PS.
27. Bertoncello, I. (2015). Stem Cells in the Lung. Devlopment, Repair and Regeneration. Springer.
28. Bolgova, L. S., Tuganova, T. N., Alekseenko, O. I., & Ponomarenko, A. A. (2022). On the origin of lung cancer development. Experimental oncology, 44(1), 17–22. doi.org/10.32471/exp-oncology.2312-8852.vol-44-no-1.17227.
29. Bolgova, L. S., Tuganova, T. N., Alekseenko, O. I., Litvinets, O. M., Suprun, G. A., & Ponomarenko, A. A. (2020). Histogenesis of central lung cancer: cytological investigation. Experimental oncology, 42(4), 310–313. doi.org/10.32471/exp-oncology.2312-8852.vol-42-no-4.15232.
30. Bolgova, L. S., & Ponomarenko, A. A. (2020). Features of growth of peripheral lung cancer according to the results of macroscopic and cytological research. NaUKMA Research Papers. Biology and Ecology, 3, 43–47. doi: 10.18523/2617-4529.2020.3.43-47.
31. Brambilla, E., & Trawis, W. D. (2004). Adenosquamous carcinoma. World Health Organization Classification of Tumours. Pathology and genetics of Tumours of the Lung, Pleura, Thymus and Heart. Lyon: IARC Press.
32. Chen, Z., Fillmore, C. M., Hammerman, P. S., Kim, C. F., & Wong, K. K. (2014). Non-small-cell lung cancers: a heterogeneous set of diseases. Nature Reviews Cancer, 14(8), 535–546. doi.org/10.1038/nrc3775.
33. Dai, C., Xie, H., Su, H., She, Y., Zhu, E., Fan, Z., … Chen, C. (2017). Tumor spread through air spaces affects the recurrence and Overall survival in patients with lung adenocarcinoma >2 to 3 cm. Journal of Thoracic Oncology, 12(7), 1052–1060.
34. Desai, T. J., Brownfield, D. G., & Krasnow, M. A. (2014). Alveolar progenitor and Stem cells in lung development, renewal and cancer. Nature, 507(7491), 190–194.
35. Eguchi, T., Kameda, K., Lu, S., Bott, M. J., Tan, K. S., Montecalvo, J., … Adusumilli, P. S. (2019). Lobectomy is associated with better outcomes than sublobar resection in spread through air spaces (STAS)-positive T1 lung adenocarcinoma: A propensity score-matched analysis. Journal of Thoracic Oncology, 14(1), 87–98.
36. Eramo, A., Lotti, F., & Sette, G. (2008). Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death & Differentiation, 15(3), 504–514.
37. Ferone, G., Lee, M. C., Sage, J., & Berns, A. (2020). Cells of origin of lung cancers: lessons from mouse studies. Genes & Development, 34(15–16), 1017–1032. doi: 10.1101/gad.338228.120.
38. Frank, D. B., Penkala, I. J., Zepp, J. A., Sivakumar, A., Linares-Saldana, R., Zacharias, W. J., … Morrisey, E. E. (2019). Early lineage specification definesalveolar Epithelial ontogeny in the murine lung. Proceedings of the National Academy of Sciences of the United States of America, 116(10), 4362–4371. doi.org/10.1073/pnas.1813952116.
39. Giangreco, A., Reynolds, S. D., & Stripp, B. R. (2002). Terminal bronchioles harbor a unique airway stem cell population that localizes to the bronchoalveolar duct junction. American journal of pathology, 161(1), 173–182.
40. Grigoryeva, E. S., Kokova, D. A., Gratchev, A. N., Cherdyntsev, E. S., Buldakov, M. A., … Cherdyntseva, N. V. (2015). Smoking-related DNA adducts as potential diagnostic markers of lung cancer: new perspectives. Experimental oncology, 37(1), 5–12.
41. Guida, F., Sun, N., Bantis, L. E., Muller, D. C., Li, P., Taguchi, A., … Hanash, S. M. (2018). Assessment of Lung Cancer Risk on the Basis of a Biomarker Panel of Circulating Proteins. JAMA Oncology, 4(10), e182078. doi: 10.1001/jamaoncol.2078.
42. Hanna, J. M., & Onaitis, M. W. (2013). Cell of origin of lung cancer. Journal of Carcinogenesis and Mutagenesis, 12, 6. doi: 10.4103/1477-3163.109033.
43. Hassan, W. A., Takebayashi, S. I., & Abdalla, M. O. (2017). Correlation between histone acetylation and expression of Notch I in human lung carcinoma and its role in combinet small-cell lung carcinoma. Laboratory Investigation, 97(8), 913–921. doi: 10.1038/labivest.2017.36.
44. Have-Opbroek, A. A., Benfield, J. R., van Krieken, J. H., & Dijkman, J. H. (1997). The alveolar type II cell in the genesis of human adenocarcinomas and squamous cell carcinomas. Histopathology, 12, 319–336.
45. Heng, W. S., Gosens, R., & Kruyt, F. (2019). Lung cancer stem cells: origin, features, maintenance mechanisms and therapeutic targeting. Biochemical Pharmacology, 160, 121–133. doi.org/10.1016/j.bcp.2018.12.010.
46. Hogan, B. L., Barkauskas, C. E., Chapman, H. A., Epstein, J. A., Jain, R., Hsia, C. C., … Morrisey, E. E. (2014). Repair and Regeneration of the Respiratory System: Complexity, Plasticity, and Mechanisms of Lung Stem Cell Function. Cell Stem Cell, 15(2), 123–38. doi.org/10.1016/j.stem.2014.07.012.
47. Ito, T., Kato, H., Konaka, C., Hiroyuki, M., Hayata, I., & Ebihara, Y. (1988). A case of Roentgenographically occult triple lung cancer. Haigan. Lung cancer, 28(7), 895–900.
48. Ito, T., Kato, N., Konaka, C., Hiroyuki, M., Hayata, I., & Ebihara, Y., (1988). A case of roentgenographically occult triple lung cancer. Lung cancer, 28(7), 895–900.
49. Kadota, K., Kushida, Y., Kagawa, S., Ishikawa, R., Ibuki, E., Inoue, K., … Haba, R. (2019) Limited resection is associated with ahigher risk of locoregional recurrence than lobectomy in stage I lung adenocarcinoma with tumor spread through air spaces. American Journal of Surgical Pathology, 43(8), 1033–1041. doi: 10.1097/PAS.0000000000001285.
50. Kadota, K., Kushida, Y., Katsuki, N., Ishikawa, R., Ibuki, E., Motoyama, M., … Haba, R. (2017). Tumor Spread Through Air Spaces Is an Independent Predictor of Recurrence-free Survival in Patients With Resected Lung Squamous Cell Carcinoma. American Journal of Surgical Pathology, 41(8), 1077–1086. doi.org/10.1097/PAS.0000000000000872.
51. Kadota, K., Nitadori, J., Sima, C. S., Ujiie, H., Rizk, N. P., Jones, D. R., … Travis, W. D. (2015). Tumor spread through air spaces is an important pattern of invasion and impacts the frequency and location of recurrences after limited resection for small Stage I lung adenocarcinomas. Journal of Thoracic Oncology, 10(5), 806–814. doi.org/10.1097/JTO.0000000000000486.
52. Kathiriya, J. J., Brumwell, A. N., Jackson, J. R., Tang, X., & Chapman, H. A. (2020). Distinct Airway Epithelial Stem Cells Hide among Club Cells but Mobilize to Promote Alveolar Regeneration. Cell Stem Cell, 26(3), 346–358.e4. doi: 10.1016/j.stem.2019.12.014.
53. Kato, T., Oka, K., Nakamura, T., & Ito, A. (2015). Bronchioalveolar morphogenesis of human bronchial epithelial cells depending upon hepatocyte growth factor. Journal of Cellular and Molecular Medicine, 19(12), 2818–2826. doi: 10.1111/jcmm.12672.
54. Kentaro T. (1983). Multiple primary lung cancer including preinvasives squamous cancer and peripheral adenocarcinoma. Lung cancer, 23(4), 527–535.
55. Kim, C. F., Jackson, E. L., Woolfenden, A. E., Lawrence, S., Babar, I., Vogel, S., … Jacks, T. (2005). Identification of bronchioloalveolar stem cells in normal lung and lung cancer. Cell, 121(6), 823–835. doi: 10.1016/j.cell.2005.03.032.
56. Kitamura, H., Kameda, Y., Ito, T., & Hayashi, H. (1999). Atypical adenomatous hyperplasia of the lung. Implications for the pathogenesis of peripheral lung adenocarcinoma. American Journal of Clinical Pathology, 111, 610–622. doi: 10.1093/ajcp/111.5.610.
57. Koгaн, E. A., Kiчигина, O. Н., Демура, С. A., & Oстапенко, В. И. (2012). Mopфoлoгические, иммуногистохимические и радиологические проявления ремоделирования легечной ткани при саркоидозе легких. Aрхив патологии, 74(3), 37–43.
58. Koгaн, E., Koдoлoвa, I., & Сeкaмoвa, S. (1988). Морфогенез периферического рака легкого. Архив патологии, 50(6), 26–34.
59. Koган, Е. (1989). Предрак и рак легкого. Архив патологии, 51(11), 76–83.
60. Lii, P.-X., Zhou X.-Н., Luo, B., & Ren X.-G. (2007). The CT findings of endobronchial spread in lung adenocarcinoma. Chinese Journal of Radiology, 41(5), 475–479.
61. Liu, H., Yin, Q., Yang, G., & Qie, P. (2019). Prognostic Impact of Tumor Spread Through Air Spaces in Non-small Cell Lung Cancers: a Meta-Analysis Including 3564 Patients. Pathology Oncology Research, 25(4), 1303–1310. doi.org/10.1007/s12253-019-00616-1.
62. Liu, X., & Engelhardt, J. F. (2008) The Glandular Stem/Progenitor Cell Niche in6 Airway Development and Repair. Proceedings of the American Thoracic Society, 5(6), 682–688. doi: 10.1513/pats.200801-003AW.
63. Lu, S., Tan, K. S., Kadota, K., Eguchi, T., Bains, S., Rekhtman, N., … Travis, W. D. (2017). Spread through Air Spaces (STAS) Is an Independent Predictor of Recurrence and Lung Cancer-Specific Death in Squamous Cell Carcinoma. Journal of Thoracic Oncology, 12(2), 223–234. doi.org/10.1016/j.jtho.2016.09.129.
64. Mason, R. J. (2020). Pathogenesis of COVID-19 from a cell biologic perspective. European Respiratory Journal, 55(4), 2000607. doi: 10.1183/13993003.00607-2020.
65. Matsumoto, K., Arao T., Tanaka, K., Kaneda, H., Kudo, K., Fujita, Y., … Nishio K. (2009). mTOR signal and hypoxia-inducible factor-1 Alpha regulate CD133 expression in cancer cells. Cancer Research, 69(18), 7160–7164. doi: 10.1158/0008-5472.CAN-09-1289.
66. Navarro, S., & Driscoll, B. (2017). Regeneration of the Aging Lung: A Mini-Review. Gerontology, 63(3), 270–280. doi.org/10.1159/00045108.
67. Netter, F. (2019). Atlas of human anatomy. Amsterdam: Elsevier.
68. Okudela, K., Kojima, Y., Matsumura, M., Arai, H., Umeda, S., Tateishi, Y., … Ohashi, K. (2018). Relationship between non-TRU lung adenocarcinomas and Bronchiolar metaplasia — potential implication in their histogenesis. Histology and Histopathology, 33(3), 317–326. doi: 10.14670/HH-11-935.
69. Pennycuick, A., & Janes, S. M. (2020). On the origin of lung cancer. American Journal of Respiratore and Critical Care Medicine, 201(6), 646–647. doi.org/10.1164/recm.201911-2176ED.
70. Pezzella, F., & Gatter, K. (2015). Non-angiogenic tumours unveil a new chapter in cancer biology. Journal of Pathology, 235, 381–383. doi: 10.1002/path.4474.
71. Quint, L. E., Tummala, S., Brisson, L. J., Francis, I. R., Krupnick, A. S., Kazerooni, E. A., … Orringer, M. B. (1996). Distribution of distant metastases from newly diagnosed non- small cell lung cancer. Annals of Thoracic Surgery, 62(1), 246–250. doi: 10.1016/0003-4975(96)00220-2.
72. Reynolds, S. D., Giangreco, A., Power, J. H. T., & Stripp, B. R. (2000). Neuroepithelial bodies of pulmonary air ways serve as a reservoir of progenitor cells capable of epithelial regeneration. American Journal of Pathology, 156(1), 269–278. doi: 10.1016/S0002-9440(10)64727-X.
73. Rockx, B., Kuiken, T., Herfst, S., Bestebroer, T., Lamers, M. M., Oude Munnink, B. B., … Haagmans, B. L. (2020). Comparative pathogenesis of СOVID-19, MERS, and SARS in a nonhuman primate model. Science, 368(6494), 1012–1015. doi: 10.1126/science.abb7314.
74. Ruuji, T., Hisashi, N., Yuji, M., & Shosaku A. (1999). Cancer surveillance with growth as a polip in pulmonary bull. Lung cancer, 39(2), 165–170.
75. Sainz de Aja, J., Dost, A. F. M., & Kim, C. F. (2021). Alveolar progenitor cells and the origin of lung cancer. Journal of Internal Medicine, 289(5), 629–635. doi: 10.1111/joim.13201.
76. Salahudden, A. A., Choi, S. S., Rustagi, A., Zhu, J., van Unen, V., de la O, S. M., … Kuo, C. J. (2020). Progenitor identification and SARS- CoV-2 infection in human distal lung organoids. Nature, 588(7839), 670–675. doi: 10.1038/s41586-020-3014-1.
77. Semenova, E. A., Nagel, R., & Berns, A. (2015). Origins, genetic landscape, and emerging therapies of Small cell lung cancer. Genes & Development, 29(14), 1447–1462. doi: 10.1101/gad.263145.115.
78. Shiono, S., & Yanagawa, N. (2016). Spread through air spaces is a predictive factor of recurrence and a prognostic factor in stage I lung adenocarcinoma. Interdisciplinary Cardiovascular and Thoracic Surgery, 23, 567–572. doi: 10.1093/icvts/ivw211.
79. Shiono, S., Endo, M., Suzuki, K., Yarimizu, K., Hayasaka, K., & Yanagawa, N. (2018). Spread through air spaces is a prognostic factor in sublobar resection of non-small cell lung cancer. Annals of Thoracic Surgery, 106, 354–360. doi: 10.1016/j.athoracsur.2018.02.076.
80. Situ, D., Wang, J., Ma, Y., Zhu, Z., Hu, Y., Long, H., & Rong, T. (2011). Expression and prognostic Relevance of MUC1 in stage IB non-small cell lung cancer. Medical Oncology, 28(1), 596–604. doi.org/10.1007/s12032-010-9752-4.
81. Sneddon, J. B., & Werb, Z. (2007). Location, location, location: the cancer stem cells Niche. Cell Stem Cell, 1(6), 607–611. doi: 10.1016/j.stem.2007.11.009.
82. Sousaa, V. M. L., & Carvalho, L. (2018). Heterogenity in Lung Cancer. Pathobiology, 85, 96–107. doi: 10.1159/000487440.
83. Stahel, R. A., Peters, S., & Garassino, M. (2019). Thoracic tumours. Essentials for clinicians. II ed. University Hospital Zürich. Zürich: ESMO Press.
84. Sun, P. L., Liu, J. N., Cao, L. Q., Yao, M., & Gao, H. W. (2017). To evaluate the clinicopathologic Characteristics and outcome of tumor cells spreading through air spaces in patients with adenocarcinoma of lung. Zhonghua Bing Li Xue Za Zhi, 46, 303–308. doi: 10.3760/cma.j.issn.0529-5807.2017.05.004.
85. Sung, H., Ferlay, J., Siegel, R. L., Laversanne, M., Soerjomataram, I., Jemal, A., & Bray, F. (2021). Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. Cancer Journal for Clinicians, 71(3), 209–249. doi.org/10.3322/caac.21660.
86. Sutherland, K. D., & Berns, A. (2010). Cell of origin of lung cancer. Molecular Oncology, 4(5), 397–403. doi: 10.1016/j.molonc.2010.05.002.
87. Sutherland, K. D., Proost, N., Brouns, I., Adriaensen, D., Song, J. Y., & Berns, A. (2011). Cell of origin of small cell lung cancer: inactivation of Trp53 and Rb1 in distinct cell types of adult mouse lung. Cancer Cell, 19(6), 754–764. doi: 10.1016/j.ccr.2011.04.019.
88. Terada, Y., Takahashi, T., Morita, S., Kashiwabara, K., Nagayama, K., Nitadori, J. I., … Nakajima, J. (2019). Spread through air spaces is an independent predictor of recurrence in stage III (N2) lung adenocarcinoma. Interdisciplinary Cardiovascular and Thoracic Surgery, 29, 442–448. doi: 10.1093/icvts/ivz116.
89. Toyokawa, G., Yamada, Y., Tagawa, T., Kozuma, Y., Matsubara, T., Haratake, N., … Maehara, Y. (2018). Significance of spread through air spaces in resected pathological Stage I lung adenocarcinoma. Annals of Thoracic Surgery, 105, 1655–1663. doi: 10.1016/j.athoracsur.2018.01.037.
90. Travis, W., Nicholson, S., & Hirsch, F. R. (2004). Pathology and genetics of Tumours of the Lung, Pleura, Thymus and Heart. Lyon: IARC Press.
91. Travis, W. D., Brambilla, E., Muller-Hermelink, H. K., & Harris, C. C. (2004). Pathology and Genetics: Tumours of the Lung, Pleura, Thymus and Heart. Lyon: IARC Press.
92. Uruga, H., Fujii, T., Fujimori, S., Kohno, T., & Kishi, K. (2017). Semiquantitative assessment of tumor spread through air spaces (STAS) in early-stage lung adenocarcinomas. Journal of Thoracic Oncology, 12, 1046–1051. doi: 10.1016/j.jtho.2017.03.019.
93. Verovkina, N. O. (2018). Recent advances in immunotherapy in the treatment of cancer patients: the use of immunotherapy in non-small cell lung cancer. Clinical oncology, 8(32), 228–231.
94. Warth, A., Muley, T., Kossakowski, C. A., Goeppert, B., Schirmacher, P., Dienemann, H., & Weichert, W. (2015). Prognostic impact of intra-alveolar tumor spread in pulmonary adenocarcinoma. American Journal of Surgical Pathology, 39, 793–801. doi: 10.1097/PAS.0000000000000409.
95. Wicha, M. S., Liu, S., & Dontu, G. (2006). Cancer stem cells: an old idea — a paradigm shift. Cancer Research, 66(4), 1883–1890. doi: 10.1158/0008-5472.CAN-05-3153.
96. Xu, J., Yu, Q., & Liu, X. (1998). Proximal bronchial invasion of lung cancer: a clinicopathological study. Zhonghua Zhong Liu Za Zhi, 20(6), 448–450.
97. Xu, X., Rock, J. R., Lu, Y., Futtner, C., Schwab, B., Guinney, J., … Onaitis, M. W. (2012) Evidence for type II cells as cells of origin of K-Ras- induced distal lung adenocarcinoma. Proceedings of the National Academy of Sciences, 109, 4910–4915. doi: 10.1073/pnas.1112499109.
98. Yagi, Y., Aly, R. G., Tabata, K., Barlas, A., Rekhtman, N., Eguchi, T., … Travis, W. D. (2020). Three-Dimensional Histologic, Immunohistochemical, and Multiplex Immunofluorescence Analyses of Dynamic Vessel Co-Option of Spread Through Air Spaces in Lung Adenocarcinoma. Journal of Thoracic Oncology, 15(4), 589–600. doi.org/10.1016/j.jtho.2019.12.112.
99. Yi, E., Bae, M. K., Cho, S., Chung, J. H., Jheon, S., & Kim, K. (2018), Pathological prognostic factors of recurrence in early stage lung adenocarcinoma. ANZ Journal of Surgery, 88, 327–331. doi: 10.1111/ans.14033.
100. Zamay, T., Zamay, G., Kolovskaya, O., Zukov, R., Petrova, M., Gargaun, A., … Kichkailo, A. (2017). Current and Prospective Protein Biomarkers of Lung Cancer. Cancers, 9(11), 155. doi.org/10.3390/cancers9110155.
Адреса для листування:
Болгова Лідія Севастянівна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: bolgova2006@ukr.net
Сorrespondence:
Yulii Zdanovskoi
33/43 Yulia Zdanovska str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: bolgova2006@ukr.net














Leave a comment