Новий етап у персоналізованій терапії раку грудної залози: шанс на виліковування. Частина 2
Резюме. 23 червня 2023 р. відбулася Національна науково-практична конференція «Новий етап в персоналізованій терапії раку грудної залози: шанс на виліковування», в якій взяли участь провідні лікарі-мамологи, хіміотерапевти та клінічні онкологи з найбільших міст нашої країни — Києва, Дніпра, Харкова, Львова, Одеси. Конференцію продовжив Микола Федорович Анікусько, кандидат медичних наук, завідувач хірургічного відділення Київського міського клінічного онкологічного центру, та колеги, що поділилися практичними особливостями терапії пацієнтів з раком грудної залози (РГЗ).
DOI: 10.32471/clinicaloncology.2663-466X.52-4.31578
 2-гу частину конференції продовжив Микола Федорович Анікусько, кандидат медичних наук, завідувач хірургічного відділення Київського міського клінічного онкологічного центру (м. Київ) із доповіддю, що присвячена основним етапам клінічного шляху пацієнта з РГЗ на ранніх стадіях.
2-гу частину конференції продовжив Микола Федорович Анікусько, кандидат медичних наук, завідувач хірургічного відділення Київського міського клінічного онкологічного центру (м. Київ) із доповіддю, що присвячена основним етапам клінічного шляху пацієнта з РГЗ на ранніх стадіях.
Цей алгоритм дій включає діагностику, зокрема проведення BRCA-тестування на етапі первинної діагностики до початку лікування. Доповідач підкреслив, що саме визначення статусу BRCA під час встановлення діагнозу допомагає мультидисциплінарній команді зважено визначити підхід до вибору цілої стратегії лікування пацієнтів — а саме підходів до неоад’ювантної терапії, обсягу хірургічного втручання та вибору наступної ад’ювантної терапії.
Неоад’ювантна терапія пацієнтів з тричі негативним РГЗ (ТНРГЗ) може включати як хіміо-, так і імунотерапію, а у випадку HR+ пухлини — ендокринну терапію та хіміотерапію. Мета неоад’ювантної терапії — зменшити розмір пухлини або досягти її повної відсутності. Ступінь патологічної відповіді встановлюється під час оперативного втручання та є показником ефективності неоад’ювантної терапії.
Наступний етап лікування — ад’ювантна терапія. Мета лікування — запобігти рецидиву захворювання.
При THPГЗ терапією вибору є хіміотерапія та застосування олапарибу, якщо HR+ — тоді це хіміо- або ендокринна терапія + CDK4/6 інгібітори, або ендокринна терапія + олапариб.
Якщо на фоні лікування фіксують рецидив, тоді метою лікування є зменшення кількості та розміру пухлин, збільшення часу до прогресування хвороби.
Які ж особливості терапевтичних підходів до пухлин з різним гормоно-рецепторним статусом? Рекомендації Європейської спільноти медичної онкології (European Society for Medical Oncology — ESMO) пропонують варіанти (нео-)ад’ювантного лікування раннього HER2-негативного РГЗ, які включають ендокринну терапію, а хіміотерапію тільки в разі високого пухлинного навантаження. Важливим питанням щодо лікування раннього РГЗ є використання хіміотерапії у пацієнтів з HR+/HER2-пухлиною. За рекомендаціями ESMO — загалом застосування хіміотерапії можливе, якщо пухлина низькодиференційована, має високий рівень Кі-67, низький рівень експресії рецепторів ER та PR та сприятливі генетичні сигнатури. Також загалом застосування хіміотерапії не рекомендоване, якщо пухлина високодиференційована, має низький рівень Кі-67, високий рівень експресії рецепторів ER та PR та несприятливі генетичні сигнатури. Додатково потрібно враховувати рівні ризику розвитку раннього рецидиву та рівень пухлинного навантаження.
Автор доповіді звернув увагу, що оновлені рекомендації Американського співтовариства клінічної онкології (American Society of Clinical Oncology — ASCO) включають біомаркерний аналіз для прийняття рішень щодо ендокринної та хіміотерапії для пацієнтів з ранньою стадією інвазивного РГЗ. У рекомендаціях Національної онкологічної мережі США (The National Comprehensive Cancer Network — NCCN) від 2023 р. запропоновано розглядати можливість додавання олапарибу до ад’ювантної терапії протягом 1 року для пацієнтів при HR+/HER2-пухлинах із гермінальними мутаціями BRCA1/2, якщо залишаються 2–4 позитивних лімфатичних вузли після ад’ювантної хіміотерапії (категорія 2А), або є залишкова хвороба після неоад’ювантної терапії та відповідна клінічна і патологічна стадія, статус ER та ступінь злоякісності пухлини ≥3 балів (категорія 2А). Сірою (невизначеною) зоною залишається вибір і послідовність ад’ювантної терапії при HR+/HER2-РГЗ з мутаціями генів BRCA. Залишається без відповіді питання — що обрати — CDK4/6 інгібітори або олапариб?
У дослідженні PENELOPE-В пацієнтам проводили неоад’ювантну терапію у вигляді пальбоциклібу та супутню ендокринну терапію відповідно до локальних стандартів з наступним хірургічним втручанням. У результаті додавання пальбоциклібу до ендокринної терапії протягом року не покращувало показники виживаності без ознак інвазивного захворювання (ВБОІЗ), загальної виживаності (ЗВ) у жінок із раннім HR+/HER2-РГЗ після неоад’ювантної хіміотерапії. Разом із тим у дослідженні NATALEE (ASCO 2023) виявлено, що застосування олапарибу в ад’ювантному режимі у пацієнтів з HR+/HER2-РГЗ протягом 3 років спостереження дозволяє досягнути ВБОІЗ на рівні 90,4% для олапарибу порівняно з ендокринною терапією — 87,1%, тобто застосування олапарибу дозволяє підвищити 3-річну ВБОІЗ на 3,3%.
У дослідженні Olympia виявлено, що застосування олапарибу в ад’ювантному режимі у пацієнтів з HR+/HER2-РГЗ протягом 1 року дозволяє досягнути ВБОІЗ з абсолютною різницею ∆ 6,3% впродовж 3 років порівняно з групою плацебо.
Так, можна зробити висновок, що за наявності мутацій у генах BRCA пацієнти з HR+/HER2-РГЗ отримують більшу перевагу від застосування олапарибу в комбінації з гормонотерапією в ад’юванті, у той час, як пацієнти без BRCA-мутацій матимуть клінічну користь від додавання Рибоциклібу в якості ад’ювантної терапії. Отже, тестування на наявність мутацій BRCA на сьогодні є важливим фактором вибору ад’ювантної терапії у пацієнтів з раннім HR+/HER2-негативним РГЗ.
Стосовно лікування ТНРГЗ, то за низького ризику розвитку рецидиву рекомендовано не застосовувати ад’ювантну хіміотерапію, вважається доцільною профілактична операція. За високого ризику розвитку рецидиву потрібно розглянути терапію, наприклад PARP-інгібіторами. Профілактична операція є менш доцільною. Тобто важливим фактором є наявність чи відсутність патологічної відповіді на неоад’ювантну терапію та ризику розвитку рецидиву у пацієнтів з раннім ТНРГЗ.
Який саме режим неоад’ювантної терапії ліпше обрати для пацієнтів з мутаціями в генах BRCAm? Наразі послідовна схема на основі антрацикліну/таксану є стандартом лікування. Експерти ESMO вважають, що додавання препарату платини може розглядатися при ТНРГЗ. У той же час більшість експертів (60%) не надають перевагу рутинному застосуванню карбоплатину.
Рекомендації NCCN 2023 р. вказують на те, що підходи до застосування платини при ранньому ТНРГЗ залишилися незмінними і рутинне застосування препаратів платини як частини неоад’ювантної терапії ТНРГЗ не рекомендовано для більшості пацієнтів (зокрема для носіїв BRCA-мутацій), але може бути розглянуте у пацієнтів, для яких необхідне отримання кращого локального контролю, якщо препарати платини включені до схем на основі антрациклінів та ін.
NCCN пропонують розглянути можливість додавання олапарибу в ад’ювантну терапію протягом 1 року для пацієнтів із гермінальними мутаціями BRCA1/2 та ТНРГЗ при залишковій хворобі після неоад’ювантної терапії.
Доповідач звернув увагу аудиторії на цілу низку питань, які в зазначених рекомендаціях залишилися без відповіді, наприклад вибір неоад’ювантної терапії для пацієнтів з мутаціями в генах BRCA, та навів результати деяких досліджень, які можуть відповісти на ці питання. Так, відмічено, що пацієнти з раннім РГЗ та гермінальними мутаціями в генах BRCA зазвичай більш чутливі до стандартної хіміотерапії на основі антрациклінів і таксанів, ніж пацієнти без гермінальних мутацій у цих генах.
У дослідженнях GeparОСТО та GeparSixto у пацієнтів з раннім ТНРГЗ та гермінальними мутаціями в генах BRCA частота розвитку повної патологічної відповіді (pCR) була вищою порівняно з пацієнтами без мутацій у генах BRCA на тлі застосування хіміотерапії на основі таксану. Треба зазначити, що застосування терапії на основі платини для загальної популяції пацієнтів з раннім ТНРГЗ дійсно підвищувало частоту pCR, проте саме у підгрупі пацієнтів з мутаціями BRCA додавання карбоплатину вже не мало переваги щодо pCR порівняно із стандартною ХТ.
На сьогодні однією із сучасних схем неоад’ювантної ХТ (НАХТ) для пацієнтів з ТНРГЗ є комбінування карбоплатину з пембролізумабом. Проте питання ефективності такої схеми в досягненні pCR та виживаності без подій (ВБП) для пацієнтів з мутаціями BRCA — залишається відкритим. У KEYNOTE-522 дослідники приховали результати по підгрупах пацієнтів із статусом BRCA, тому на сьогодні вкрай важко зробити висновки щодо ефективності цієї комбінації за наявності BRCA-мутацій. Проте, спираючись на підгруповий аналіз GeparSixto та дані реальної клінічної практики, де зафіксовано, що у підгрупі пацієнтів з гермінальними мутаціями в генах BRCA додавання карбоплатину не забезпечує жодного поступового підвищення частоти ні pCR, ні ВБОІЗ — можна припустити, що додавання пембролізумабу до цієї схеми теж не матиме переваг для пацієнтів з мутаціями BRCA. Разом із тим комбінація карбоплатину з пембролізумабом значно збільшує вираженість гематологічних та негематологічних побічних реакцій, які характерні як для платиновмісних схем, так і для застосування пембролізумабу.
У дослідженні КEYNOTE-522 вивчали роль імунотерапії в неоад’ювантному лікуванні ТНРГЗ. Відмічено, що додавання пембролізумабу до хіміотерапії зумовило значне покращення показників ВБП порівняно з плацебо, показників патологічної повної відповіді, проте значно підвищувало рівень імуноопосередкованих побічних явищ (KEYNOTE-522). Приблизно кожен 4-й пацієнт у групі застосування пембролізумабу припинив лікування на етапі неоад’ювантної терапії через побічні реакції та непереносимість такої схеми.
Автор доповіді відмітив, що стратегії досліджень OlympiA та KEYNOTE-522 досить суттєво відрізняються одна від одної. Комбінованою первинною кінцевою точкою дослідження KEYNOTE-522 зазначено патологічну повну відповідь (ypT0/Tis ypN0) та ВБП, за оцінкою дослідника, з моменту початку лікування (неоад’ювантна терапія — операція — ад’ювантна терапія), а первинною кінцевою точкою дослідження OlympiA — ВБОІЗ (на тлі ад’ювантної терапії). Під час первинного аналізу даних дослідження OlympiA виявлено, що лікування олапарибом сприяло значному покращенню показника ВБОІЗ порівняно з плацебо.
У пацієнтів з ТНРГЗ та наявністю BRCA-мутацій у дослідженні OlympiA, які отримували олапариб після первинного лікування (пацієнти з ТНРГЗ, які не досягли pCR), показник ВБОІЗ був вищим, ніж показник ВБП, також не досягли pCR у пацієнтів за результатами дослідження KEYNOTЕ-522, в якому спостерігали всю популяцію пацієнтів, які приймали пембролізумаб, і ефективність терапії для пацієнтів у підгрупі BRCA залишається невідомою.
Доповідач звернув увагу, що оскільки прямі порівняльні дослідження цих лікарських засобів не проводилися, недоцільно здійснювати будь-які порівняння або робити будь-які висновки, тому що дизайн дослідження, демографічні та інші критерії можуть бути різними. Однак якщо порівняти 2 стратегії за вкрай важливим для пацієнтів показником ЗВ, то за результатами дослідження OlympiA досягнуто статистично та клінічно значущої переваги щодо ЗВ у пацієнтів як з HER2-негативним РГЗ, так і з ТНРГЗ зокрема. Важливо відмітити, що, дивлячись на графік загальної популяції, можна побачити, що криві ЗВ починають розходитися майже одразу від початку застосування олапарибу і досягають абсолютної різниці із групою плацебо у Δ=3,4% через 3 роки спостереження, а в підгрупі пацієнтів з ТНРГЗ абсолютна перевага олапарибу ще більша — 3,6% порівняно з плацебо (рисунок). У той час стратегія KEYNOTE-522, за даними дослідження, не дозволила пацієнтам з ТНРГЗ досягти статистичної достовірності за показником ЗВ і абсолютна різниця становила 2,8% протягом 3 років спостереження (на момент проведення проміжного аналізу 4). Частки розвитку віддалених рецидивів у дослідженні KEYNOTE-522 проти груп порівняння, проте ризик розвитку іншого типу раку знижувався саме при застосуванні олапарибу порівняно з плацебо.
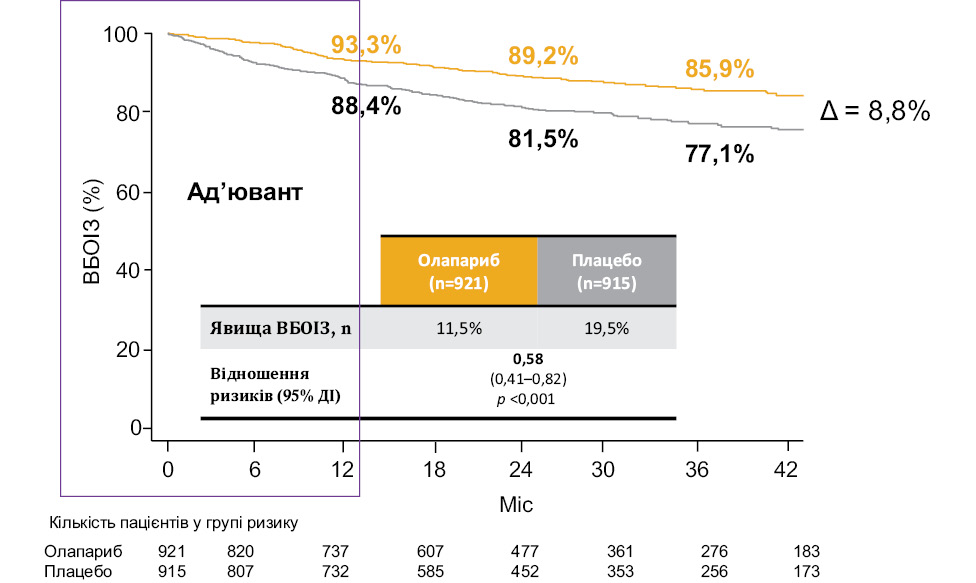
Рисунок. Показники ВБОІЗ в ITT-популяції (первинна кінцева точка) у дослідженні OlympiA (адаптовано за Tutt A.N.J. et al., 2021)
Примітки: ДІ — довірчий інтервал; ITT — сукупність усіх рандомізованих пацієнтів згідно з призначеним лікуванням.
Тож, розглядаючи варіанти (нео-) ад’ювантної терапії для раннього ТНРГЗ високого ризику, необхідно враховувати результати тестування на наявність гермінальних мутацій у генах BRCA. У пацієнтів з РГЗ з мутаціями в генах BRCA більш доцільно застосувати стандартну ХТ на основі антрациклінів з таксанами без препаратів платини та олапариб в ад’юванті (якщо пацієнт не досяг pCR), бо BRCA-позитивні пухлини при ТНРГЗ мають високу чутливість до стандартної ХТ порівняно із BRCA-негативними. У деяких випадках, наприклад, за необхідності локального контролю пухлини, при BRCA-мутованих пухлинах можна додавати карбоплатин. Разом із тим у пацієнтів з РГЗ без мутацій у генах BRCA та низьким ризиком (І стадії) рутинне застосування препаратів платини як частини неоад’ювантної терапії ТНРГЗ також не рекомендовано для більшості пацієнтів. Однак у пацієнтів високого ризику (ІІ–ІІІ стадій) за відсутності мутацій у генах BRCA треба розглянути додаткове застосування препаратів платини та пембролізумабу, враховуючи ризики/користь для кожної пацієнтки через високу токсичність цієї комбінації.
Наприкінці доповіді автор акцентував увагу на тому, що на сьогодні при ранньому HER2-негативному РГЗ, якщо лікар не знає статус BRCA-пухлини, він лікує пацієнта «із зав’язаними очима».
Наступною учасники конференції заслухали доповідь Наталі Уржумової, кандидата медичних наук, онкохірурга-мамолога, лікаря вищої категорії, щодо окремого клінічного випадку. У липні 2020 р. на обстеження поступила пацієнтка 46 років зі збереженою менструальною функцією. У результаті проведення ультразвукового дослідження грудних залоз виявлено фіброзно-кістозну мастопатію, рак лівої грудної залози з ознаками набряково-інфільтративного росту, метастаз у пахвовий лімфатичний вузол зліва (T4N1). Також проведено мамографію і у верхньо-зовнішньому квадранті лівої грудної залози виявлено вогнище розміром 3,2×2,0×1,0 см (Т4). 23 липня 2020 р. хворій виконано трепан-біопсію пухлини грудної залози зліва і діагностовано інфільтруючий протоковий рак ІІІ ступеня злоякісності. У висновку імуногістохімічного дослідження зафіксовано ЕR-, PR-, Her2/Neu-РГЗ, рівень Кі-67 — 48%. У результаті трепан-біопсії пахвового лімфатичного вузла зліва на фоні клітин лімфоїдного ряду виявлено групи клітин аденогенного раку (N1).
Пацієнтку обстежено за допомогою комп’ютерної томографії (КТ) з контрастуванням і діагностовано рак лівої грудної залози з метастазами в регіонарні аксилярні лімфовузли. Результатом проведених досліджень став заключний клінічний діагноз: рак лівої грудної залози, набряково-інфільтративна форма, T4NIMOG3, IIIВ стадія. Рекомендована консультація хіміотерапевта з метою проведення курсів неоад’ювантної поліхіміотерапії. Пацієнтка направлена на кафедру онкології та медичної радіології Дніпровського державного медичного університету для оцінки можливості участі в клінічному дослідженні.
У серпні 2020 р. в межах скринінгу в клінічному дослідженні виконано КТ з контрастуванням, за даними якої у пацієнтки виявлено таргетні вогнища — утворення в лівій грудній залозі 26×17 мм; утворення в лівому наднирнику 15×13 мм. Сума таргетних вогнищ становила 31 мм. Також виявлені нетаргетні вогнища: аксилярний лімфовузол зліва 18×10 мм, деструкцію кортикального шару лівої ключиці. Органічної патології та метастатичного ураження головного мозку не зафіксовано. Сканування кісток на той момент виконати було неможливо. У результаті обстеження відбулося рестадіювання: T4N1M1. BRCA-тестування плазми крові методом полімеразної ланцюгової реакції (ПЛР) виявило BRCA1+ та PD-L1+ РГЗ. 3 серпня 2020 р. до квітня 2021 р. в межах міжнародного клінічного дослідження пацієнтка отримала терапію: 12 курсів телетакселу 40 мг 1 р/добу р/о, 1 раз у 21 день; ніволумаб 360 мг в/в крапельно.
У квітні 2021 р. проведено КТ з контрастуванням: згідно з критеріями оцінки RECIST 1.1. зафіксовано часткову відповідь. У лівій грудній залозі навколо основного утворення розміром 11×6 мм встановлено появу вогнищ 3–4 мм. У травні 2021 р. у результаті проведення КТ виявлено: у лівій грудній залозі утворення розміром 26×15 мм, у лівій аксилярній ділянці метаболічно активний лімфатичний вузол 25×13 мм, інших ділянок накопичення метаболічно активної речовини не зафіксовано. Проведено хірургічний етап лікування — виконано двобічну мастектомію та видалено матку з придатками. Визначено, що в лівій грудній залозі пухлина (2×1см) має будову інфільтруючої протокової карциноми (неспецифічного типу), ІІ–ІІІ ступенів злоякісності, з нерівномірно вираженим лікувальним патоморфозом І–ІІ–ІІІ ступенів (за Лавніковою). У краях резекції росту пухлини не виявлено. У правій грудній залозі ознак пухлинного росту не зафіксовано. У всіх лімфатичних вузлах ознаки змішаного лімфаденіту, але ознак пухлинного росту не встановлено (N0 — повний лікувальний патоморфоз). Імуногістохімічний висновок: ER негативний (H=0), PR негативний (H=0), Her2/Neu негативний, рівень Kі-67 — 35%.
3 липня 2021 р. до січня 2022 р. хвора отримала 8 курсів ніволумабу 360 мг в/в крапельно, 1 раз у 21 день. У квітні 2022 р. в результаті проведення КТ ознак прогресування захворювання не виявлено.
У липні 2022 р. проведено ультразвукове дослідження та виявлено ознаки патологічної трансформації лімфатичних вузлів ліворуч, вогнищеві зміни м’яких тканин передньої грудної стінки праворуч. Виконано трепан-біопсію підключичного лімфовузла зліва, в трепан-біоптатах виявлено фіброзно-жирову та лімфоїдну тканину з ростом низькодиференційованої аденокарциноми. Імуногістохімічний висновок: ER негативний (H=0), PR негативний (H=0), Her2/Neu негативний, рівень Ki-67 — 62%. За результатами КТ з контрастуванням визначено лімфатичні вузли — середньояремний справа 9×6 мм, середньояремний зліва 8×7 мм, надключичний зліва 10×7 мм, підключичний зліва 8×5 мм, пекторальні лімфатичні вузли зліва 7×5 мм, 8×5 мм, що активно накопичують контраст. Метастатичного ураження головного мозку не виявлено. За результатами обстеження проведено засідання госпітальної онкокомісії, яка рекомендувала: консультацію променевого терапевта щодо оцінки можливості проведення променевого лікування; призначення PARP-інгібіторів (олапарибу 300 мг 2 р/добу р/о); оцінку ефективності лікування через 12 тиж.
3 липня 2022 р. до теперішнього часу пацієнтка приймає олапариб 300 мг 2 р/добу р/о. Клінічно лімфатичних вузлів не визначено після 2 курсів. Під час терапії встановлено побічні ефекти: лейкопенія ІІ ступеня, дисгевзія.
У результаті КТ, проведеної у вересні 2022 р., виявлено часткову відповідь на терапію. По медичній евакуації у квітні 2023 р. пацієнтка переведена в Данію, де схвалено тактику лікування. У червні 2023 р. за допомогою КТ виявлено повну відповідь. Рекомендовано продовжити прийом олапарибу.
Так, з липня 2020 р. ЗВ хворої становила 35 міс. Лікування олапарибом триває.
Автор доповіді наголосила, що актуальні клінічні рекомендації ESMO з лікування пацієнтів із метастатичним ТНРГЗ полягають у наступному:
- якщо PD-L1 позитивний, ліпшим варіантом є хіміотерапія в комбінації з інгібіторами імунної контрольної точки;
- у разі якщо PD-L1 негативний і гермінальні мутації генів BRCA відсутні, обраний варіант терапії залежить від попереднього лікування, перебігу захворювання, інтервалу без ознак захворювання та побажання пацієнта;
- якщо виявлені гермінальні мутації генів BRCA, a PD-L1 негативний, кращим варіантом є олапариб або талазопариб;
- у разі якщо PD-L1 негативний і мутації генів BRCA відсутні, бажаний варіант терапії залежить від попереднього лікування, перебігу захворювання, інтервалу без ознак захворювання та побажання пацієнта;
- монотерапія таксанами є найпоширенішим варіантом лікування;
- антрацикліни можна приймати у випадку, якщо їх не застосовано раніше або можливе їх повторне призначення;
- за загрози органної недостатності комбінована хіміотерапія є ліпшим варіантом на основі таксану та/або антрацикліну і бевацизумабу (тільки для 1-ї лінії терапії), якщо вона доступна.
Тетяна Тимчук, лікар-онколог, представила на розгляд слухачів 2-й клінічний випадок, який є наочним прикладом втілення теоретичних знань у клінічну онкологічну практику.
Пацієнтка, 37 років, у квітні 2021 р. самостійно виявила 3 утворення в лівій грудній залозі. У травні 2021 р. пройшла мамографічне обстеження, яке встановило мастопатичні зміни, а саме кісти лівої грудної залози. У червні 2021 р. мамолог оглянув пацієнтку в Буковинському клінічному онкологічному центрі. У лівій грудній залозі у верхньому зовнішньому квадранті зафіксовано 3 утворення розміром 2,0; 2,0; 2,5 см. У хворої обтяжений сімейний онкоанамнез — у тітки РГЗ. Пацієнтка мала 4 вагітності, 3 пологи, 1 переривання вагітності.
У червні 2021 р. їй виконано тонкоголкову пункційну біопсію, у результаті якої встановлено попередній діагноз: фіброаденома лівої грудної залози.
У липні 2021 р. пацієнтці виконано лампектомію лівої грудної залози з експрес-біопсією та надано додатковий висновок щодо інвазивної протокової карциноми в 4 видалених новоутвореннях. Інтраопераційно вирішено провести радикальну лівобічну мастектомію за Маденом. Встановлено діагноз — мультицентрична інвазивна протокова карцинома лівої грудної залози.
У підпахвинних, підключичних та підлопаточному лімфовузлах метастазів не виявлено. В імуногістохімічному дослідженні зафіксовано: ER-, PR-, HER2/neu-, рівень Кі-67 — 80%. Висновок КТ стосовно стану після оперативного лікування — рак лівої грудної залози, локальні п/о зміни лівої аксилярної ділянки, дифузні зміни печінки, гепатоспленомегалія, хронічний холецистит без видимих ознак загострення, помірна заочеревинна лімфаденопатія, хронічний аднексит.
Комісією ухвалено рішення розпочати курс ад’ювантної поліхіміотерапії (АПХТ).
У липні 2021 p. хвора почала отримувати 1 курс АПХТ: доксорубіцин, ендоксан.
11.08.2021 р. отримано результат молекулярно-генетичного дослідження і виявлено мутацію гена BRCA1 в гетерозиготному стані.
У серпні–вересні 2021 p. пацієнтка отримала 4 курси АПХТ (доксорубіцин, ендоксан), а в жовтні–грудні 2021 р. — пройшла ще 4 курси АПХТ із застосуванням паклітакселу. У січні–лютому 2022 р. хвора отримала курс променевої терапії на лінійному прискорювачі на ділянку грудної стінки зліва — 50 Гр, на надпідключичну ділянку — 40 Гр.
Заключний діагноз після опромінення: рак лівої грудної залози (мультицентрична форма), рT2NOMO, G3, ER-, PR-, HER2/neu-, рівень Кі-67 — 80%, BRCA1.
3 березня 2022 р. пацієнтка розпочала прийом олапарибу 300 мг 2 р/добу. У червні 2022 р. їй виконано оперативне втручання — відтерміновану реконструкцію лівої грудної залози лоскутом та еспандером, а 15.06.2022 р. — лапароскопічну двобічну тубоваріоектомію. Висновок КТ: фіброзні зміни лівої аксилярної ділянки, одинична аксилярна лімфаденопатія зліва — без динаміки від 31.01.2022 р., післяпроменевий локальний пневмофіброз у сегменті верхньої частки лівої легені, дифузні зміни печінки, дрібні кісти правої частки печінки, хронічний холецистит без видимих ознак загострення, дифузні зміни нирок.
04.01.2023 р. хворій виконано оперативне втручання — правобічну підшкірну мастектомію з одномоментною реконструкцією імплантатом та відтерміновану реконструкцію лівої грудної залози із застосуванням імплантата.
3 березня 2022 р. до березня 2023 р. пацієнтка приймала препарат олапариб. У червні 2023 р. отримано висновок КТ: аксилярний лімфовузол зліва, післяпроменевий пневмофіброз у сегменті верхньої частки лівої легені, дифузні зміни печінки, хронічний холецистит без видимих ознак загострення, спастичний коліт.
Наприкінці автор доповіді підкреслила, що генетичне консультування та тестування показане, якщо пацієнт має ризик спадкового РГЗ або ТНРГЗ (у будь-якому віці), або є кандидатом на ад’ювантну терапію олапарибом.
Євгенія Гончарук














Leave a comment