Особливості перебігу раку грудної залози з низьким рівнем експресії HER2/neu
Бондар М.В., Сивак Л.А., Тарасенко Т.Є., Мартинюк О.М., Лялькін С.А., Шудрак П.А.
Резюме. Рак грудної залози (РГЗ) посідає провідне місце у структурі онкологічних захворювань жіночого населення та є провідною причиною смертності, асоційованої з онкологічною патологією. На сьогодні актуальним є питання виокремлення підтипу РГЗ з низькою експресією HER2/neu для застосування новітніх препаратів — кон’югантів антитіл з цитостатиком. Матеріали і методи. Проведено ретроспективний аналіз впливу клініко-лабораторних та молекулярно-генетичних характеристик РГЗ з низькою експресією HER2/neu на ефективність поліхіміотерапії в 458 пацієнток з РГЗ віком 24–83 років, середній вік — (54±11) років. Усі пацієнтки отримали медикаментозне лікування згідно з міжнародними стандартами залежно від підтипу РГЗ. Результати. Визначено, що РГЗ з низьким рівнем експресії HER2 є гетерогенною групою пухлин. Незалежно від рівня експресії HER2, РГЗ частіше діагностовано на ранніх стадіях захворювання. Визначено вищу частоту рецидивів РГЗ у пацієнток з вищою експресією HER2, проте статистично недостовірною, p>0,05. Висновок. Отримані результати окреслюють загальні уявлення про РГЗ з низькою експресією HER2 та потребують подальшого вивчення.
Одержано 26.04.2023
Прийнято до друку 12.05.2023
DOI: 10.32471/clinicaloncology.2663-466X.50-2.30634
Вступ
Рак грудної залози (РГЗ) посідає провідне місце у структурі онкологічних захворювань жіночого населення та є провідною причиною смертності, асоційованої з онкологічною патологією [1]. РГЗ характеризується гетерогенністю і, відповідно, потребує різних підходів до терапії, при цьому персоніфікований вибір лікування для кожної окремої пацієнтки на сьогодні є пріоритетним завданням для клінічного онколога. Дослідження нових мішеней при лікуванні РГЗ з метою подовження безрецидивної та загальної виживаності пацієнток залишається основним питанням онкології. Зокрема, розробка HER2-таргетних препаратів спричинила революцію в лікуванні HER2-позитивних пухлин, проте вони не показали ефективності при нижчих рівнях експресії рецептора. На сьогодні у світі активно розглядається доцільність виокремлення підтипу РГЗ з низькою експресією HER2 з метою застосування новітніх препаратів — кон’югантів антитіл із цитостатиком [2].
Рецептори естрогену (estrogen receptors — ER), прогестерону (progesterone receptors — PR) та епідермального фактора росту людини (Human Epidermal Growth Factor Receptor-2 — HER2/neu, HER2) є визначальними для вибору тактики ведення та прогнозування перебігу хвороби.
Як відомо, згідно із сурогатною імуногістохімічною класифікацією St. Gallen, залежно від відсутності чи наявності на клітинах пухлини і, відповідно, рівня експресії ER, PR, HER2 та індексу проліферативності Ki-67, виокремлюють 5 основних молекулярних підтипів РГЗ: люмінальний А, люмінальний Б HER2-негативний, люмінальний Б HER2-позитивний, HER2-збагачений та базальний тип, відомий також як тричі негативний РГЗ [3].
За даними авторів [4, 5], HER2/neu є визначальним проонкогеном, який у різній кількості експресується на мембрані онкологічної клітини в різних підтипах РГЗ. Гіперекспресія чи ампліфікація гена HER2/neu відмічається майже у 15–20% пацієнток.
Міжнародні рекомендації ASCO (American Society of Clinical Oncology)/CAP (College of American Pathologists), NCCN (National Comprehensive Cancer Network — USA), ESMO (European Society for Medical Oncology) класифікують РГЗ бінарно: як HER2-позитивний або HER2-негативний [6].
Згідно з настановами ASCO/CAP 2018, РГЗ можна вважати HER2-позитивним у разі підтвердження надмірної експресії HER2 імуногістохімічним методом дослідження (ІГХ) 3+ чи за наявності ампліфікації гена методом флуоресцентної гібридизації in situ (FISH) принаймні в одному зразку пухлинної тканини. Рекомендовано виконувати тестування щодо виявлення надмірної експресії/підтвердження ампліфікації HER2 серед популяції, яка отримає потенційну користь від лікування таргетними препаратами. ІГХ та FISH є стандартизованими методами для визначення HER2-статусу [6].
За останні десятиліття експресія HER2 пухлинними клітинами пройшла еволюцію від прогностично несприятливого до позитивного предиктивного маркера в разі застосування таргетних препаратів, таких як трастузумаб, трастузумаб-емтанзин, пертузумаб, лапатиніб [7–9].
Незважаючи на те що спрямовані на HER2 таргетні препарати значно покращили результати лікування пацієнтів з HER2-позитивним РГЗ (ІГХ 3+ або FISH-позитивним), така користь не виявлена у разі застосування даних молекул для пухлин з нижчими рівнями експресії HER2, що підтверджено в дослідженні L. Fehrenbacher та співавторів (2020) [10].
Останнім часом у літературі обговорюють доцільність виділення РГЗ з низькою експресією HER2 з метою оцінки як потенційно прогностичного та/або предиктивного фактора при різних молекулярних підтипах РГЗ.
Наразі у світі активно досліджується ефективність застосування кон’югантів антитіл з цитостатичним препаратом (antibody-drug conjugates — ADC) порівняно із класичною поліхіміотерапією для лікування хворих на РГЗ з низькою експресією HER2 [11].
Результати останніх клінічних досліджень відкривають можливості використання анти-HER2-таргетних ADC для хворих на РГЗ з низькою експресією HER2. U. Banerji та співавтори (2019) першими опублікували в медичному журналі The Lancet результати І фази клінічного дослідження щодо застосування ADC трастузумабу дуокармазину (trastuzumab duocarmazine) у пацієнток з поширеним або рецидивуючим РГЗ з ІГХ HER2 1+ чи 2+/FISH-негативним, серед яких отримано об’єктивну відповідь (partial response згідно з критеріями RECIST 1.1): у 28% (9/32) випадків при гормонопозитивному РГЗ, а в 40% (6/16) — при гормононегативному РГЗ [12]. Згодом S. Modi та співавтори (2020) висвітлили результати Іб фази клінічного дослідження, в якому вивчалася ефективність ADC трастузумабу дерукстекану (Trastuzumab-deruxtecan — T-Dxd) у пацієнток з поширеним РГЗ з ІГХ HER2 1+ чи 2+/FISH-негативним, та отримано об’єктивну відповідь в 37% (20/54) випадків [13]. На основі означених обнадійливих публікацій робоча група на чолі з P. Tarantino (2020) вперше представила концепцію виокремлення РГЗ з низькою експресією HER2 (HER2-low Breast Cancer — HER2-low BC), до якого віднесли РГЗ з ІГХ HER2 1+ чи 2+/FISH-негативним результатом [14].
20 грудня 2019 р. Управління з контролю за харчовими продуктами та лікарськими засобами США (U.S. Food and Drug Administration — FDA) схвалило анти-HER2-молекулу T-Dxt, яка складається із рекомбінантного моноклонального антитіла трастузумабу та інгібітора топоізомерази І дерукстекану, для лікування пацієнток з нерезектабельним чи метастатичним HER2-позитивним РГЗ, які попередньо отримували дві чи більше ліній таргетних препаратів [15]. Згодом, 5 серпня 2022 р., FDA схвалило T-Dxt як перший таргетний препарат для лікування нерезектабельного чи метастатичного РГЗ з низькою експресією HER2, базуючись на даних рандомізованого мультицентричного клінічного дослідження DESTINY-Breast04, в яке включили 557 пацієнтів з нерезектабельним/метастатичним РГЗ, що попередньо отримували одну чи дві лінії хіміотерапії з цієї причини, чи набули резистентність до гормонотерапії. Серед включених пацієнтів 494 (88,7%) мали гормонопозитивний РГЗ і 63 (11,3%) — гормононегативний РГЗ. У когорті гормонопозитивного РГЗ середня безрецидивна виживаність (БРВ) становила 10,1 міс у групі лікування трастузумабом дерукстеканом та 5,4 міс — у групі лікування на вибір клінічного онколога (hazard ratio (HR) для прогресування хвороби або смерті 0,51; р<0,001), загальна виживаність (ЗВ) становила 23,9 і 17,5 міс відповідно (HR для смерті 0,64; р=0,003). Серед усіх пацієнтів середня БРВ становила 9,9 міс в групі трастузумабу дерукстекану і 5,1 міс — в групі вибору клінічного онколога (HR для прогресування чи смерті 0,50; р<0,001), ЗВ становила 23,4 і 16,8 міс відповідно (HR для смерті 0,64; р=0,001) [16, 17]. Варто відзначити, що наразі РГЗ з низькою експресією HER2 не становить окремого підтипу пухлини, а є лише мішенню для новітніх молекул.
Дослідження перебігу захворювання у пацієнток з низькою експресією HER2 є актуальним. Тому у відділенні хіміотерапії солідних пухлин Національного інституту раку (НІР) проаналізовано імуногістохімічні та клінічні особливості даної когорти пацієнток. Виконано ретроспективний аналіз впливу клініко-лабораторних та молекулярно-генетичних характеристик РГЗ з низькою експресією HER2 на ефективність поліхіміотерапії.
Матеріали і методи
Проведено ретроспективний аналіз імуногістохімічних та клінічних даних 458 пацієнток з РГЗ віком 24–83 роки, середній вік — (54±11) років, яких проліковано в період з 01.01.2019 до 31.12.2019 р. в НІР. ІГХ-дослідження виконувалося в лабораторії патологоанатомічного відділення (завідувач к.м.н. М.С. Кротевич), FISH-дослідження — в науково-дослідній лабораторії експериментальної онкології (завідувач д.б.н. Н.М. Храновська). Усі пацієнтки отримали медикаментозне лікування згідно з міжнародними стандартами залежно від підтипу РГЗ. Проаналізовано статистичні дані станом на 25.01.2023 р. щодо прогресування РГЗ у пацієнток, яким встановлено діагноз в період з 01.01.2019 до 31.12.2019 р. (дата встановлення діагнозу відповідає даті заключення патоморфологічного дослідження, середній термін спостереження становив (43±6) міс, проте без урахування того, що частина жіночого населення отримує лікування за кордоном. Виконано математичну обробку даних за допомогою статистичної програми MedStat.
Результати та обговорення
Досліджено, що серед 458 пацієнток з РГЗ, за результатами ІГХ, відсутність експресії HER2/neu (HER2-0) отримано у 211 (46%), HER2-1+ — у 173 (37%), HER2-2+ — у 38 (9%) та HER2-3+ — у 36 (8%) (рис. 1). У хворих з експресією HER2-2+ проведено визначення ампліфікації гена HER2/neu методом FISH та досліджено негативний результат у 12 (3%) пацієнток і позитивний — у 26 (6%). Тобто, за класичним розподілом, із 458 зразків РГЗ 396 (87%) були HER2-негативними та 62 (14%) — HER2-позитивними, які свідчили про можливість призначення таргетної терапії. Досліджено, що серед 396 пацієнток з HER2-негативним РГЗ, HER2-0 статус мали 211 (46%) жінок, тоді як у групу хворих на РГЗ з низькою експресією HER2 потрапили 185 (40%) жінок: 173 з результатом ІГХ HER2-1+ та 12 з результатом ІГХ HER2-2+/FISH-негативні.
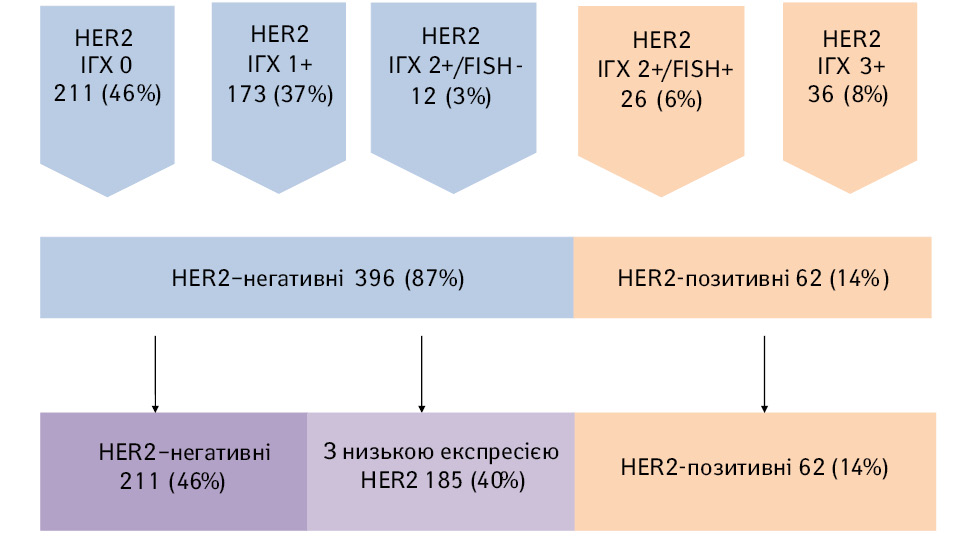
Проведено розподіл пацієнток за молекулярними підтипами РГЗ та досліджено, що в групі РГЗ з низькою експресією HER2 157 (85%) належали до люмінальних підтипів РГЗ (80 — до люмінального А та 77 — до люмінального Б) та 28 (15%) — до тричі негативного РГЗ.
Визначено, що HER2-2+/FISH-негативний варіант РГЗ частіше відмічали при люмінальних підтипах — 8 (67%), ніж при тричі негативному РГЗ — 4 (33%).
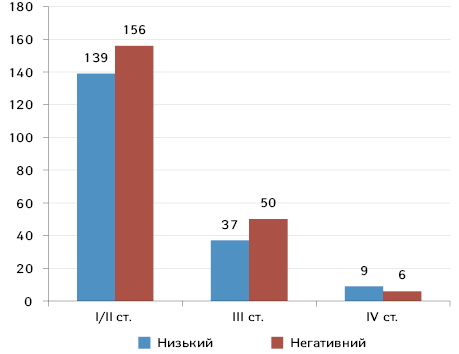
За стадіями TNM пацієнток з РГЗ з низькою експресією HER2 розподілено на три групи: 139 (75%) мали ранній РГЗ (І/ІІ ст.), 37 (20%) — місцево-поширений РГЗ (III ст.) та 9 (5%) — de novo метастатичний РГЗ (IV ст.). У пацієнток з HER2-негативним РГЗ співвідношення за стадіями було наступним: 156 (75%), 50 (23%) та 6 (2%) відповідно (рис. 2). Тобто незалежно від рівня експресії HER2 у більшості хворих РГЗ був діагностований на ранніх стадіях, що також відображено в Бюлетені Національного канцер-реєстру № 21 [18].
Відомо, що індекс проліферативної активності Кі-67 є важливим інструментом при визначенні підтипу РГЗ, а саме — люмінального А чи люмінального Б HER2-негативного [3]. Зокрема, при люмінальному А підтипі маркер проліферативності Кі-67 має бути нижчим за 14–20% (St. Gallen Consensus у 2011 р. пропонував порогове значення низького індексу Ki-67 як <14%, а у 2013 р. — як <20%). При цьому індекс Кі-67 є прогностичним фактором: чим вище значення Кі-67, тим більш агресивними є пухлинні клітини [19, 20]. З урахуванням показників локальної лабораторії для аналізу було обрано порогове значення Кі-67 <20%. При аналізі групи з низькою експресією HER2 встановлено, що для гормонопозитивного РГЗ середнє значення Ki-67 становило (20±10), а для гормононегативного — (29±14), тоді як у групі HER2-негативного РГЗ показники становили (15±9) та (39±19) відповідно, де відзначається тенденція до вищих показників індексу, проте різниця не є достовірною (р>0,05), що узгоджується з даними ретроспективного аналізу, проведеного F.R. Alves та співавторами (2022) [21].
Загалом за час спостереження серед 458 пацієнток достовірні дані щодо прогресії отримано у 79 (17%). У групі HER2-негативних пухлин (N=211) зафіксовано прогресування захворювання у 26 (12%): при люмінальному А — у 8 зі 102 (8%), люмінальному Б — у 12 з 74 (16%), тричі негативному — у 6 з 35 (17%). Серед РГЗ із низькою експресією HER2 (N=185) отримано дані про прогресію у 29 (16%) випадках: люмінальний А — 8/80 (10%), люмінальний Б — 11/77 (14%), тричі негативний — 10/28 (36%). Серед HER2-позитивних пухлин (N=62) — у 24 (39%) випадків, зокрема, пацієнтки з люмінальним В типом мали прогресію в 11 випадках з 32 (34%). Тобто частота рецидивів РГЗ зростала при підвищенні рівня експресії HER2, проте не є статистично достовірною, p>0,05. При цьому середній час до прогресування хвороби в групі HER2-негативних пухлин (1) становив (17±9) міс, у групі з низькою експресією HER2 (2) — (16,9±9) міс, HER2-позитивних (3) — (16,7±8,7) міс, р1>0,05; р2>0,05; р3>0,05 (р1 — між групою 1 і 2, р2 — між групою 2 і 3, р3 — між групою 1 і 3).
Таким чином, отримані результати дають попереднє уявлення про клінічні та молекулярні характеристики РГЗ з низьким рівнем експресії HER2. Згідно з результатами ІГХ/FISH досліджень, РГЗ з низьким рівнем експресії HER2 є гетерогенною групою пухлин. Частка РГЗ з низькою експресією HER2 була більшою у пацієнток з гормонопозитивним РГЗ (85%), порівняно з тричі негативним (15%), p<0,05. Незалежно від рівня експресії HER2 визначено більшу поширеність ранніх стадій РГЗ. Виявлено вищий індекс проліферативної активності Ki-67 при HER2-негативному РГЗ, проте залежність не є достовірною, р>0,05. Попередньо встановлено, що частота рецидивів РГЗ зростає при підвищенні рівня експресії HER2, проте тенденція не є статистично підтвердженою, p>0,05. Отримано клініко-молекулярні характеристики хворих на РГЗ з низькою експресією HER2, які лікувалися у відділенні хіміотерапії солідних пухлин, що узгоджуються з такими самими світовими даними та цілком відображають стан даної когорти пацієнток в Україні, проте проведений нами аналіз потребує подальшого вивчення [22]. Можливість відбору пацієнток для клінічних досліджень та перспектива застосування затверджених новітніх таргетних препаратів у практиці відкривають нові можливості як для пацієнта, так і для лікаря. Результати міжнародних досліджень мотивують аналізувати поширеність та прогностичну значимість низької експресії HER2 при РГЗ.
Висновки
1. Визначено, що РГЗ з низьким рівнем експресії HER2 є гетерогенною групою пухлин: більшість — 157 (85%) належала до гормонопозитивних, 28 (15%) — до тричі негативного РГЗ, p<0,05.
2. Досліджено, що незалежно від рівня експресії HER2 РГЗ частіше діагностовано на ранніх стадіях захворювання.
3. Оцінено, що частота рецидивів РГЗ була вищою у пацієнток з вищою експресією HER2, проте статистично недостовірною, p>0,05.
4. Отримані результати дають попереднє уявлення про клінічні та молекулярні характеристики РГЗ з низьким рівнем експресії HER2 та потребують подальшого вивчення.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Siegel, R. L., Miller, K. D., Fuchs, H. E., & Jemal, A. (2021). Cancer statistics, 2021. Cancer Journal for Clinicians, 71(1), 7–33. doi: 10.3322/caac.21654.
2. Верьовкіна, Н. О., Лялькін, С. А., & Сивак, Л. А. (2022). Рак грудної залози з низьким статусом HER2/neu. Нові можливості та виклики. Український радіологічний та онкологічний журнал, 30(4), 62–74. doi: https://doi.org/10.46879/ukroj.4.2022.62-74.
3. Goldhirsch, A., Wood, W. C., Coates, A. S., Gelber, R. D., Thürlimann, B., & Senn, H. J. (2011). Strategies for subtypes-dealing with the diversity of breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Annals of Oncology, 22(8), 1736–1747. doi: 10.1093/annonc/mdr304.
4. Onsum, M. D., Geretti, E., Paragas, V., Kudla, A. J., Moulis, S. P., Luus, L., … Hendriks, B. S. (2013). Single-cell quantitative HER2 measurement identifies heterogeneity and distinct subgroups within traditionally defined HER2-positive patients. American Journal of Pathology, 183(5), 1446–1460. doi: 10.1016/j.ajpath.2013.07.015.
5. Ross, J. S., Fletcher, J. A., Linette, G. P., Stec, J., Clark, E., Ayers, M., … Bloom, K. J. (2003). The HER-2/neu Gene and Protein in Breast Cancer 2003: Biomarker and Target of Therapy. The Oncologist, 8(4), 307–325. doi: 10.1634/theoncologist.8-4-307.
6. Wolff, A. C., Hammond, M. E. H., Allison, K. H., Harvey, B. E., Mangu, P. B., Bartlett, J. M. S., … Dowsett M. (2018). Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. Journal of Clinical Oncology, 36(20), 2105–2122. doi: 10.1200/JCO.2018.77.8738.
7. Mendes, D., Alves, C., Afonso, N., Cardoso, F., Passos-Coelho, J. L., Costa, L., … Batel-Marques, F. (2015). The benefit of HER2-targeted therapies on overall survival of patients with metastatic HER2-positive breast cancer-a systematic review. Breast Cancer Research, 17, 140. doi: 10.1186/s13058-015-0648-2.
8. Viani, G. A., Afonso, S. L., Stefano, E. J., De Fendi, L. I., & Soares, F. V. (2007). Adjuvant trastuzumab in the treatment of her-2-positive early breast cancer: A meta-analysis of published randomized trials. BMC Cancer, 7, 153. doi: 10.1186/1471-2407-7-153.
9. Swain, S. M., Miles, D., Kim, S. B., Im, Y. H., Im, S. A., Semiglazov, V, … Cortés, J. (2020). Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): End-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study. Lancet Oncology, 21(4), 519–530. doi: 10.1016/S1470-2045(19)30863-0.
10. Fehrenbacher, L., Cecchini, R. S., Geyer, C. E. Jr., Rastogi, P., Costantino, J. P., Atkins, J. N., … Wolmark, N. (2020). NSABP b-47/NRG oncology phase III randomized trial comparing adjuvant chemotherapy with or without trastuzumab in high-risk invasive breast cancer negative for HER2 by FISH and with IHC 1+ or 2. Journal of Clinical Oncology, 38(5), 444–453. doi: 10.1200/JCO.19.01455.
11. Rinnerthaler, G., Gampenrieder, S. P., & Greil, R. (2019). HER2 directed antibody-drug-conjugates beyond T-DM1 in breast cancer. International Journal of Molecular Sciences, 20(5), 1115. doi: 10.3390/ijms20051115.
12. Banerji, U., van Herpen, C. M. L., Saura, C., Thistlethwaite, F., Lord, S., Moreno, V., … Aftimos, P. (2019). Trastuzumab duocarmazine in locally advanced and metastatic solid tumours and HER2-expressing breast cancer: A phase 1 dose-escalation and dose-expansion study. Lancet Oncology, 20(8), 1124–1135. doi: 10.1016/S1470-2045(19)30328-6.
13. Modi, S., Park, H., Murthy, R. K., Iwata, H., Tamura, K., Tsurutani, J., … Takahashi, S. (2020). Antitumor activity and safety of trastuzumab deruxtecan in patients with HER2-low-expressing advanced breast cancer: results from a phase Ib Study. Journal of Clinical Oncology, 38(17), 1887–1896. doi: 10.1200/JCO.19.02318.
14. Tarantino, P., Hamilton, E., Tolaney, S. M., Cortes, J., Morganti, S., Ferraro, E., … Curigliano, G. (2020). HER2-Low Breast Cancer: Pathological and Clinical Landscape. Journal of Clinical Oncology, 38(17), 1951–1962. doi: 10.1200/JCO.19.02488.
15. FDA approves fam-trastuzumab deruxtecan-nxki for unresectable or metastatic HER2-positive breast cancer. Retrived from http://www.fda.gov/drugs/ resources-information-approved-drugs/fda-approves-fam-trastuzumab-deruxtecan-nxki-unresectable-or-metastatic-her2-positive-breast-cancer.
16. FDA approves fam-trastuzumab deruxtecan-nxki for HER2-low breast cancer. Retrived from http://www.fda.gov/drugs/ resources-information-approved-drugs/fda-approves-fam-trastuzumab-deruxtecan-nxki-her2-low-breast-cancer.
17. Modi, S., Jacot, W., Yamashita, T., Sohn, J., Vidal, M., Tokunaga, E., … Cameron, D. A. (2022). Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. New England Journal of Medicine, 387(1), 9–20. doi: 10.1056/NEJMoa2203690.
18. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., Гулак, Л. О., & Куценко, Л. Б. (2022). Рак в Україні, 2020–2021. Захворюваність, смертність, показники діяльності онкологічної служби. А. Ф. Шипко (Ред.), Бюлетень Національного канцер-реєстру України, 23, 129. http://www.ncru.inf.ua/publications/BULL_23/index.htm.
19. Bustreo, S., Osella-Abate, S., Cassoni, P., Donadio, M., Airoldi, M., Pedani, F., … Castellano, I. (2016). Optimal Ki67 cut-off for luminal breast cancer prognostic evaluation: a large case series study with a long-term follow-up. Breast Cancer Research and Treatment, 157(2), 363–371. doi: 10.1007/s10549-016-3817-9.
20. Coates, A. S., Winer, E. P., Goldhirsch, A., Gelber, R. D., Gnant, M., Piccart-Gebhart, M., … Senn, H. J. (2015). Tailoring therapies-improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Annals of Oncology, 26, 1533–1546. doi: 10.1093/annonc/mdv221.
21. Alves, F. R., Gil, L., Vasconcelos de Matos, L., Baleiras, A., Vasques, C., Neves, M. T., … Martins, A. (2022). Impact of Human Epidermal Growth Factor Receptor 2 (HER2) Low Status in Response to Neoadjuvant Chemotherapy in Early Breast Cancer. Cureus, 14(2), e22330. doi: 10.7759/cureus.22330.
22. Schettini, F., Chic, N., Brasó-Maristany, F., Paré, L., Pascual, T., Conte, B., … Prat, A. (2021). Clinical, pathological, and PAM50 gene expression features of HER2-low breast cancer. NPJ Breast Cancer, 7(1), 1. doi: 10.1038/s41523-020-00208-2.
Адреса для листування:
Бондар Марина В’ячеславівна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: marinabondar110@gmail.com
Сorrespondence:
Maryna Bondar
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: marinabondar110@gmail.com














Leave a comment