Рівень плазмових міРНК у хворих на рак молочної залози та їх кореляція з клінічною картиною пацієнтів як показник для індивідуалізованого лікування
Резюме. Вступ. Рак молочної залози (РМЗ) є найпоширенішим онкологічним захворюванням серед жінок. Рівень експресії малих інтерферуючих РНК (міРНК) та зміни їх кореляції в динаміці лікування розглядається як потенційний прогностичний маркер патології. Мета. Вивчити рівні міРНК у плазмі крові хворих на РМЗ, кореляцію між міРНК, зв’язок із віком, стадією та молекулярним типом захворювання. Матеріали та методи. Досліджено рівні 10 міРНК (міРНК-25, -27, -30, -139, -155, -200, -205, -335, -497, -663) у плазмі крові 70 пацієнтів з РМЗ та 18 здорових осіб, оцінено фактор віку (<45 і >45 років), молекулярний тип раку, виявлено кореляційні зв’язки між парами міРНК. Результати. Рівень міРНК-25, -205, -335, -497 і -663 був достовірно вищим у хворих на РМЗ, встановлено залежність зниженого рівня міРНК-27 і міРНК-335 у пацієнтів <45 років і підвищеного рівня міРНК-27 і міРНК-205 у хворих >45 років, а достовірно підвищений рівень міРНК-205 у обох вікових категоріях. Тенденцію залежності підвищеного рівня міРНК-200 і міРНК-497 виявлено у осіб з РМЗ ІІІ-ІV стадій, а міРНК-335 з люмінальним А типом РМЗ. Встановлено множинні позитивні та негативні кореляції в парах міРНК з міРНК-25 у хворих на РМЗ (7 проти 3 у здорових осіб). Після неоад’ювантної хіміотерапії встановлено зниження рівнів міРНК-25 і міРНК-335. Висновки. У результатах зафіксовано, що міРНК-25, -27, -335, -497 і -663 заслуговують на увагу як прогностичний показник РМЗ, а міРНК-25 є найбільш перспективною з 10 щодо чутливості до поліхіміотерапії (ПХТ). Проведене дослідження відкриває перспективи використання даних аналізу експресії зазначених міРНК з метою оцінки ефективності лікування та прогнозу клінічного перебігу патології у хворих на РМЗ.
Одержано 19.01.2024
Прийнято до друку 01.02.2024
DOI: 10.32471/clinicaloncology.2663-466X.53-1.31750
ВСТУП
РМЗ є найпоширенішим онкозахворюванням серед жінок, яке стало причиною 6–20% усіх смертей жінок через онкологічні захворювання [1]. Незважаючи на те що останнім часом кількість діагнозів РМЗ зросла, досягнуто певної стабілізації показників смертності, а прогноз захворювання значно покращився завдяки впровадженню сучасних методів лікування [2].
Великий інтерес становить вивчення ролі міРНК в онкогенезі та їх оцінка як потенційного прогностичного маркера перебігу захворювання [3]. Це некодуючі короткі послідовності РНК, які мають складну структуру і залучені до регуляції експресії генів [4]. міРНК можуть впливати на процеси інвазії та метастазування ракових клітин різними способами. Наприклад, вони можуть регулювати виділення факторів, таких як TGF-β, який впливає на зростання та проліферацію пухлинних клітин на ранніх стадіях і сприяє епітеліально-мезенхімальній трансформації (ЕМТ). Також вони можуть взаємодіяти зі шляхом Wnt/β-catenin, що пригнічує експресію білка E-кадгерин, втрата якого пов’язана з онкогенезом [5]. Деякі мікроРНК, які сприяють цим процесам, включають міРНК-21 і міРНК-191 (через TGF-β та EGF), міРНК-10b (за підтримки TGF-β1, який підвищує експресію E-кадгерину), міРНК-155 (спрямовує RhoA) [5].
Деякі міРНК ідентифіковано як достовірні біомаркери РМЗ, зокрема міРНК-30a, -27a, -193b та -361-5p [4]. Велика кількість міРНК, такі як міРНК-17, -20b, -21, -23, -24, -27, -199, -200, -342, -484, -638, пов’язані з хіміорезистентністю [1, 6]. Розглядається потенційний зв’язок між рівнем експресії міРНК та віком хворих з урахуванням молекулярного типу РМЗ, інвазивності пухлин та здатності до метастазування [4, 7]. Тобто міРНК відкривають новий напрямок досліджень, який може доповнити використання традиційних біомаркерів РМЗ, підвищуючи точність і специфічність діагностики, особливо їх поєднані панелі [5]. Проте, щоб з’ясувати зв’язок між змінами експресії міРНК при РМЗ, необхідно провести мультиточкові і багаторазові дослідження.
Мета. Вивчити рівні міРНК у плазмі крові хворих на РМЗ, кореляцію між міРНК, залежність від віку, стадії та молекулярного типу захворювання.
МАТЕРІАЛИ ТА МЕТОДИ
Дослідження базується на результатах оцінки рівнів 10 міРНК (міРНК-25, -27, -30, -139, -155, -200, -205, -335, -497, -663) у хворих на РМЗ та виявленні кореляційних зв’язків між міРНК, їх залежності від клінічної характеристики захворювання.
Досліджено серії з 10 міРНК у 18 здорових осіб та 70 пацієнтів з РМЗ. Середній вік на час встановлення діагнозу — 48 років. Хворі пройшли від 4 до 6 курсів ПХТ (40 неоад’ювантної та 30 ад’ювантної ПХТ). Здійснено розподіл жінок за віком до 45 років (пременопаузальний вік) та 45 і старше (постменопаузальний вік).
Молекулярний тип РМЗ встановлювали за результатами імуногістохімічного дослідження. У здорових та хворих осіб одержували зразки крові й одержували РНК для дослідження. Екстракцію РНК проводили згідно з інструкцією виробника Zymo Research (США) Quick-RNA Miniprep Kit (кат. № R1055). Екзогенний внутрішній контроль А035 «Набір реагентів для визначення кількісного вмісту РНК», ТОВ «Укргентех» (Україна); ендогенний внутрішній контроль — фрагменти гена TBP та YWHAZ, що охоплюють діапазон від найменшого до найдовшого фрагментів.
Однокроковий мікс з ревертазою та полімеразою — М 08 «Однокроковий мікс ЗТ з інтеркалюючим барвником SYBR Green», ТОВ «Укргентех» (Україна). Ампліфікація згідно з інструкцією виробника. Для аналізу використовувався ампліфікатор Bio-Rad CFX-96 (Сінгапур). Програма аналізу та кількісної оцінки Bio-Rad CFX Maestro. Калібратори кількісної оцінки внутрішніх контролів:
1 – TCCTTTGCTTGCATCCCACAGACTATTTCCCTCATCCTATTTACTGCAGCAAATCTCTCC — 60 п.о.
2 – TGCACAGGAGCCAAGAGTGAAGAACAGTCCAGACTGGCAGCAAGAAAATATGCTAGAGTTGTACAGAAGTTGGGTTTTCCAGCTAAGTTCTTGGACTTCAAGATTCAGAATATGGTGGGGAGCTGTGATGTG — 132 п.о.
Методика оцінки кількості:
1. Для оцінки рівня екстракції використовували екзогенний (доданий у зразок перед екстракцією у відомій концентрації) синтетичний внутрішній контроль А035 шляхом зіставлення внесеної концентрації та концентрації після проходження екстракції в кількісних показниках, розрахованих за допомогою програмного забезпечення Bio-Rad CFX Maestro. У підсумку визначали коефіцієнт, він становив від 0,7 до 0,9, а зразки, де коефіцієнт екстракції був нижчим за 0,7, підлягали повторній екстракції.
2. Для кількісної оцінки в якості позитивних контролів використовували синтетичні калібратори для кожної групи реакцій окремо в дублях та 2 розведеннях з різницею у 2 порядки 100 і 10 000 копій відповідно і за допомогою програмного забезпечення Bio-Rad CFX Maestro отримана копійність на реакцію (дубль, зразки ставилися в дублях).
3. Для визначення копійності на мілілітр: копії/мл = кількість міРНК у реакції (дані приладу в копіях/реакціях)/коефіцієнт екстракції • кількість реакцій з одного елюату • кількість екстракцій з одного мл — фрагмента гена.
Статистичні дослідження проводили за допомогою програмного пакета StatPlus (7.0) (AnalystSoft Inc.). Для перевірки гіпотези нормального розподілу даних використано критерій Шапіро — Уїлка, значущості міжгрупових відмінностей застосовано непараметричний критерій Манна — Уїтні (Mann — Whitney U-test), непараметричний критерій Вілкоксона, однофакторний дисперсійний аналіз (ANOVA, Bonferroni post hoc test, апостеріальний критерій Фішера LSD).
Дані середнього рівня міРНК представлені як середнє ± SEM. Низький та високий рівень експресії міРНК трактували на основі аналізу квартильного розподілу даних у варіативних рядах. Визначали 4 квартилі у групі здорових осіб, де Q1–Q2 оцінювали як низький, а Q3–Q4 — як високий рівень експресії. Межі квартилів обрали як контрольні значення для групи хворих на РМЗ. Кореляції між парними наборами міРНК у пацієнтів визначали за допомогою лінійної кореляції Пірсона (r) та рангового коефіцієнта кореляції Спірмена (Rho). Відмінності вважалися статистично значущими при р<0,05.
РЕЗУЛЬТАТИ
Рівень міРНК залежно від віку
Проведено аналіз плазмових рівнів міРНК у здорових жінок та хворих на РМЗ (табл. 1). Ми не виявили статистично значущої різниці рівнів кожної з 10 міРНК між групами здорових та хворих на РМЗ жінок. Разом з тим, врахування фактора віку встановило деякі залежності та різницю між групами.
| Тип міРНК | Здорові (n=18) | Хворі (n=70) | ||||
| пременопауза
(n=12) |
постменопауза
(n=6) |
усього
(n=18) |
пременопауза
(n=25) |
постменопауза
(n=45) |
усього
(n=70) |
|
| міРНК-25 | 1,2 (0,3) | 6,7 (6,7)* | 3,0 (2,2) | 11,0 (4,3) | 35,2 (22,9) | 26,2 (14,4) |
| міРНК-27 | 2310,0 (2306,5) | 1,4 (0,5) | 1540,0 (1537,7) | 105,1 (72,3)** | 321,5 (298,3)* | 237,5 (187,7) |
| міРНК-30 | 100,8 (97,8) | 2,8 (2,3) | 68,1 (65,2) | 233,0 (136,5) | 41,4 (17,0) | 113,3 (52,8) |
| міРНК-139 | 474,2 (465,7) | 4,2 (1,2) | 317,6 (310,5) | 30,9 (11,6) | 93,1 (33,3) | 69,7 (21,5) |
| міРНК-155 | 72,4 (37,9) | 3,2 (2,2) | 49,3 (26,1) | 33,3 (22,0) | 62,2 (35,8) | 51,3 (23,8) |
| міРНК-200 | 88,5 (50,7) | 55,4 (31,0) | 77,5 (34,9) | 172,6 (56,9) | 311,9 (169,7) | 259,6 (108,0) |
| міРНК-205 | 617,4 (487,9) | 18,4 (18,2)* | 417,7 (327,7) | 325,1 (172,3) | 273,1 (141,3)** | 292,6 (108,7) |
| міРНК-335 | 895,3 (823,3) | 17,9 (16,6) | 602,8 (550,0) | 10 899,0 (10 814,0)** | 233,0 (136,5)* | 6937,3 (6757,6) |
| міРНК-497 | 3,0 (1,2) | 7,8 (3,2) | 4,6 (1,4) | 112,0 (52,1)** | 44,8 (24,3) | 70,0 (24,8) |
| міРНК-663 | 736,3 (491,7) | 68,4 (43,9) | 513,7 (332,1) | 136,8 (54,6) | 1617,6 (1011,5)** | 1062,3 (635,6) |
*p<0,05 щодо категорії жінок пременопаузального віку за критерієм Манна — Уїтні; **p<0,05 щодо здорових жінок за критерієм Манна — Уїтні.
У здорових жінок виявлено наступний зв’язок: плазмовий рівень у 9 з 10 міРНК мав тенденцію до зниження у жінок у період постменопаузи, а рівень міРНК-205 достовірно був вищим у жінок у період пременопаузи, та тільки міРНК-25 зростала з віком.
У жінок з РМЗ виявлено дещо інші тенденції: достовірно зростав рівень міРНК-27, -205, -335 і -663 під час постменопаузи, тенденцію до росту відмічено щодо міРНК-139, -155, -200 і -663. При цьому рівень міРНК-335 у хворих у період пременопаузи був істотно вищим порівняно із таким у здорових жінок, а міРНК-663 — навпаки під час постменопаузи.
Ми зробили спробу виявити залежність між рівнем міРНК, тактикою лікування та фактором віку (табл. 2). Так, зафіксована в загальній вибірці хворих зміна рівня міРНК-27 між здоровими та хворими жінками була підтверджена, враховуючи лікування ад’ювантною ПХТ (АПХТ) і неоад’ювантною (НПХТ), хоча у останньої у жінок у період пременопаузи; збільшення кількості міРНК-205 виявлено у жінок у період постменопаузи з НПХТ; кількість міРНК-205 була більшою під час постменопаузи у пацієнток з НПХТ; міРНК-497 була більшою у хворих у період пременопаузи щодо контрольної групи. Фактор віку гіпотетично мав значення щодо зміни експресії міРНК-27 та міРНК-497 рівною мірою як для групи, яка проходила АПХТ, так і після НПХТ. При цьому експресія цих 2 міРНК мала протилежну залежність, міРНК-27 достовірно була меншою у жінок під час пременопаузи і зростала з віком, а міРНК-497 була достовірно більшою незалежно від віку.
| Тип міРНК | Здорові (n=18) | Схема лікування (n=70) | ||||
| АПХТ (n=23) | НПХТ (n=47) | |||||
| пременопауза
(n=12) |
постменопауза
(n=6) |
пременопауза
(n=9) |
постменопауза
(n=14) |
пременопауза
(n=16) |
постменопауза
(n=31) |
|
| міРНК-25 | 1,2 (0,3) | 6,7 (6,7)* | 1,6 (1,4) | 3,0 (3,5) | 17,4 (28,1) | 49,8 (184,5) |
| міРНК-27 | 2310,0 (2306,5) | 1,4 (0,5) | 196,4 (581,0)** | 959,9 (3588,4)* | 53,8 (145,7)** | 33,2 (133,6) |
| міРНК-30 | 100,8 (97,8) | 2,8 (2,3) | 396,3 (1128,3) | 12,6 (30,0) | 167,0 (409,3) | 54,4 (134,7) |
| міРНК-139 | 474,2 (465,7) | 4,2 (1,2) | 16,8 (43,1) | 12,9 (20,8) | 41,8 (70,8) | 129,3 (262,8) |
| міРНК-155 | 72,4 (37,9) | 3,2 (2,2) | 1,0 (0,6) | 50,6 (101,0) | 36,7 (131,2) | 67,4 (283,1) |
| міРНК-200 | 88,5 (50,7) | 55,4 (31,0) | 45,7 (75,1) | 128,9 (288,5) | 265,4 (355,0) | 394,5 (1357,3) |
| міРНК-205 | 617,4 (487,9) | 18,4 (18,2)* | 226,7 (679,7) | 58,5 (100,1)† | 386,6 (1062,7) | 370,0 (1132,6)** |
| міРНК-335 | 895,3 (823,3) | 17,9 (16,6) | 577,1 (1136,3) | 121,0 (377,3) | 145,2 (369,5) | 15 766,4 (87 404,0) |
| міРНК-497 | 3,0 (1,2) | 7,8 (3,2) | 11,3 (19,2)** | 34,9 (116,0)* | 176,7 (340,3)** | 49,2 (182,2)* |
| міРНК-663 | 736,3 (491,7) | 68,4 (43,9) | 174,8 (309,6) | 107,9 (201,2) | 132,1 (292,0) | 2299,5 (8122,6)† |
*p<0,05 щодо категорії жінок пременопаузального віку за критерієм Манна — Уїтні; **p<0,05 щодо здорових жінок за критерієм Манна — Уїтні; †p=0,06 щодо категорії жінок контрольної групи за критерієм Манна — Уїтні.
Рівень міРНК залежно від стадії РМЗ
Проведено аналіз плазмового рівня 10 міРНК з урахуванням стадії РМЗ (Grade) (рис. 1). Зважаючи на інформацію, представлену в графіках, можна відмітити деякі залежності. Наприклад, порівняно зі здоровими жінками у пацієнтів з РМЗ є тенденція до зростання міРНК-497 при ІІІА–ІV стадіях і міРНК-200 при IV стадії, або зменшення міРНК-27 при ІІВ–IV стадіях. Але виявлені тенденції для деяких стадій патології не мали достовірної різниці щодо контролю, тому аналіз тільки на основі фактора стадії не був чутливим щодо поставленої задачі в роботі.
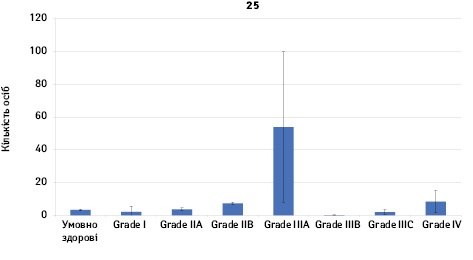
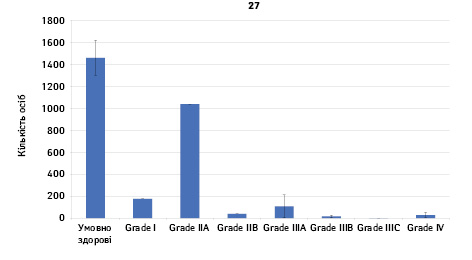
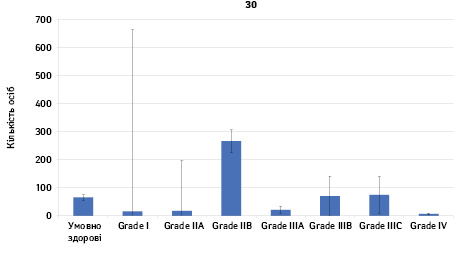
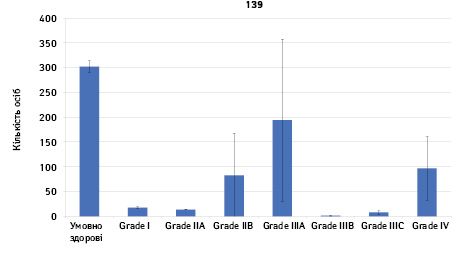
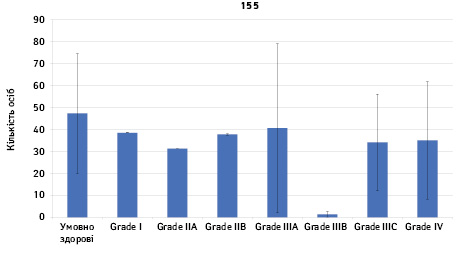
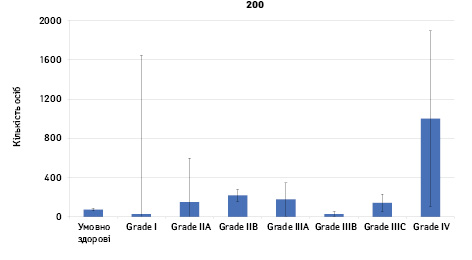
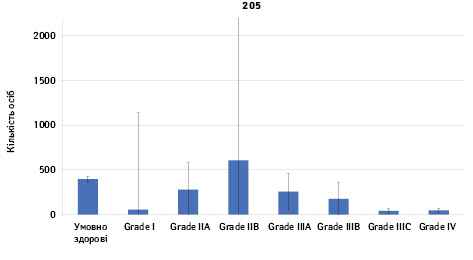
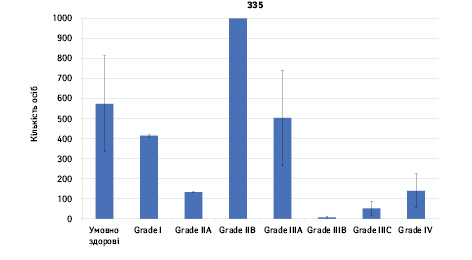
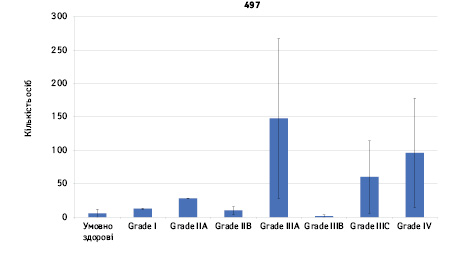
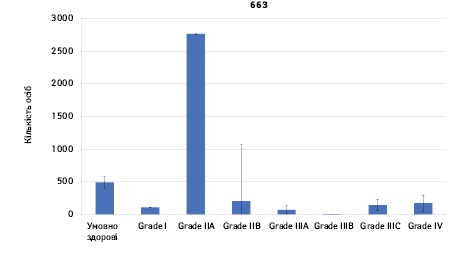
Кореляція між міРНК у здорових та хворих на РМЗ
З огляду на виявлену різницю плазмового рівня міРНК-25, -27 та -497 між здоровими особами та жінками із захворюванням і деяку залежність від віку хворих проведено аналіз кореляції між досліджуваними 10 міРНК (табл. 3, 4).
| n=18 | Критерій | міРНК-25 | міРНК-27 | міРНК-30 | міРНК-139 | міРНК-155 | міРНК-200 | міРНК-205 | міРНК-335 | міРНК-497 | міРНК-663 |
| міРНК-25 | Rho | 1,0 | |||||||||
| r | 1,0 | ||||||||||
| міРНК-27 | Rho | 0,09 | 1,0 | ||||||||
| r | −0,03 | 1,0 | |||||||||
| міРНК-30 | Rho | 0,43 | 0,35 | 1,0 | |||||||
| r | 0,00 | −0,06 | 1,0 | ||||||||
| міРНК-139 | Rho | −0,25 | 0,24 | 0,18 | 1,0 | ||||||
| r | 0,01 | −0,06 | −0,06 | 1,0 | |||||||
| міРНК-155 | Rho | 0,02 | −0,37 | −0,10 | −0,02 | 1,0 | |||||
| r | −0,09 | −0,11 | −0,10 | −0,11 | 1,0 | ||||||
| міРНК-200 | Rho | −0,38 | −0,40 | −0,53 | 0,40 | 0,18 | 1,0 | ||||
| r | −0,09 | −0,13 | −0,13 | 0,88 | −0,01 | 1,0 | |||||
| міРНК-205 | Rho | 0,69 | 0,27 | 0,28 | −0,41 | 0,28 | −0,52 | 1,0 | |||
| r | −0,06 | −0,01 | 0,05 | −0,08 | −0,08 | −0,15 | 1,0 | ||||
| міРНК-335 | Rho | 0,35 | 0,20 | 0,28 | −0,70 | −0,33 | −0,48 | 0,44 | 1,0 | ||
| r | −0,07 | 0,00 | −0,06 | −0,07 | −0,12 | −0,14 | 0,99 | 1,0 | |||
| міРНК-497 | Rho | −0,06 | 0,33 | 0,20 | −0,19 | −0,14 | −0,40 | −0,01 | 0,40 | 1,0 | |
| r | 0,59 | −0,01 | −0,17 | −0,18 | −0,20 | −0,33 | 0,45 | 0,47 | 1,0 | ||
| міРНК-663 | Rho | 0,51 | 0,33 | 0,30 | 0,07 | −0,08 | −0,13 | 0,61 | 0,29 | 0,05 | 1,0 |
| r | −0,05 | 0,13 | −0,08 | 0,10 | −0,09 | 0,00 | 0,96 | 0,97 | 0,44 | 1,0 |
| n=70 | Критерій | міРНК-25 | міРНК-27 | міРНК-30 | міРНК-139 | міРНК-155 | міРНК-200 | міРНК-205 | міРНК-335 | міРНК-497 | міРНК-663 |
| міРНК-25 | Rho | 1,0 | |||||||||
| r | 1,0 | ||||||||||
| міРНК-27 | Rho | 0,32 | 1,0 | ||||||||
| r | −0,02 | 1,0 | |||||||||
| міРНК-30 | Rho | 0,31 | 0,40 | 1,0 | |||||||
| r | 0,09 | −0,03 | 1,0 | ||||||||
| міРНК-139 | Rho | 0,07 | 0,31 | 0,16 | 1,0 | ||||||
| r | 0,31 | 0,00 | −0,02 | 1,0 | |||||||
| міРНК-155 | Rho | 0,30 | 0,08 | 0,24 | 0,20 | 1,0 | |||||
| r | 0,05 | −0,01 | −0,03 | 0,03 | 1,0 | ||||||
| міРНК-200 | Rho | −0,19 | 0,13 | −0,26 | 0,35 | −0,01 | 1,0 | ||||
| r | −0,03 | 0,08 | −0,06 | −0,04 | −0,04 | 1,0 | |||||
| міРНК-205 | Rho | 0,39 | 0,32 | 0,65 | −0,03 | 0,60 | −0,39 | 1,0 | |||
| r | 0,02 | −0,03 | 0,36 | 0,10 | −0,02 | −0,09 | 1,0 | ||||
| міРНК-335 | Rho | 0,36 | 0,20 | 0,19 | 0,16 | 0,10 | −0,03 | 0,06 | 1,0 | ||
| r | −0,03 | −0,02 | −0,03 | 0,19 | −0,03 | 0,07 | −0,04 | 1,0 | |||
| міРНК-497 | Rho | 0,49 | 0,22 | 0,20 | 0,31 | 0,24 | −0,02 | 0,20 | 0,43 | 1,0 | |
| r | 0,54 | −0,04 | 0,01 | 0,24 | −0,03 | 0,01 | −0,04 | −0,04 | 1,0 | ||
| міРНК-663 | Rho | 0,34 | 0,21 | 0,45 | 0,17 | 0,39 | −0,23 | 0,50 | 0,07 | 0,31 | 1,0 |
| r | −0,03 | −0,03 | −0,04 | 0,11 | −0,04 | −0,05 | 0,12 | −0,02 | −0,04 | 1,0 |
Згідно з результатами визначення критерію Шапіро — Уїлка варіаційні ряди міРНК у здорових та хворих осіб мали розподіл, відмінний від нормального. Для визначення коефіцієнта кореляції проведено аналіз 44 пар досліджуваних міРНК у здорових та хворих пацієнтів. У 3,4% (24 з 700 даних) пар порівнюваних міРНК хворих РМЗ мали викиди, де один з показників у парі був рівний 0 [8]. За цими умовами застосовано критерій рангової кореляції Спірмена, який частіше за інші використовується при роботі з непараметричними вибірками, але коефіцієнт Пірсона додатково використано як частий спосіб вивчення лінійного взаємозв’язку 2 змінних.
У здорових жінок встановлено кореляції за критерієм Спірмена (Rho) між деякими показниками, і тому ми їх виділили у кластери:
- Кластер І: позитивна кореляція між міРНК-25 та міРНК-205, міРНК-25 та міРНК-663, міРНК-205 та міРНК-663 (рис. 2);
- Кластер ІІ: негативна кореляція між міРНК-335 і міРНК-139, міРНК-335 і міРНК-200, міРНК-200 і міРНК-205, міРНК-200 і міРНК-30.
За критерієм Пірсона (r), у здорових жінок виявлено тільки кореляції позитивного напрямку: міРНК-25 і міРНК-497, зв’язок між міРНК-205 і міРНК-335, міРНК-497 і міРНК-335, міРНК-663 і міРНК-335, міРНК-139 і міРНК-200 був достовірним, тоді як Rho-коефіцієнт не був статистично значущим, а r-коефіцієнт міРНК-205 і міРНК-663 був достовірним, як і Rho-коефіцієнт.
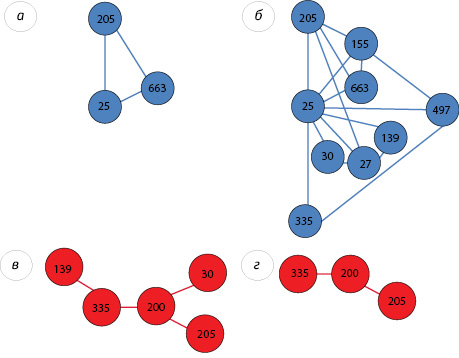
Тобто у здорових осіб заслуговують на увагу міРНК-25, -205 і -663, так як обидва методи виявлення кореляційних зв’язків встановили позитивні залежності з іншими парами міРНК або між собою.
У хворих на РМЗ кластер І був подібним і кореляційні зв’язки за критерієм Спірмена між зазначеними міРНК були позитивними. При цьому кластер ІІ змінився: відсутня залежність у парах міРНК-335 та міРНК-139, -335 та -200, але розвинулися інші залежності.
У хворих з РМЗ встановлено появу множинних позитивних кореляцій за критерієм Спірмена між багатьма міРНК:
1) додатково з кластером І мали позитивну кореляцію ще 6 міРНК;
2) до міРНК-205 доєдналися кореляції з міРНК-27 і міРНК-155;
3) з міРНК-25 встановлено додаткову кореляцію з міРНК-30, -139, -335, -155, -497, -27;
4) щодо міРНК-30 виникли позитивні зв’язки з міРНК-155, -205;
5) щодо міРНК-497 виникли позитивні зв’язки з міРНК-155;
6) виникли позитивні зв’язки між міРНК-155 щодо міРНК-497 та міРНК-663;
7) натомість встановлено втрату негативної залежності між міРНК-139 та міРНК-335, -30 та -200.
При цьому r-коефіцієнт Пірсона виявився менш чутливим в аналізі зв’язків між парами міРНК: міРНК-497 мала зв’язки з міРНК-139, -25, а міРНК-205 — з міРНК-30; при цьому встановлено позитивний зв’язок у парі міРНК-139 та міРНК-25, тоді як зв’язок за Rho-коефіцієнтом не був статистично значущим.
Тобто у хворих з РМЗ обидва статистичні методи повторили залежність пари міРНК-30 та міРНК-205, міРНК-497 та міРНК-25 і міРНК-497 та міРНК-139, а додаткові залежності зафіксовано методом рангової кореляції Спірмена.
На основі цих залежностей можна розглядати гіпотезу виникнення онкопроцесу як наслідку втрати негативного зв’язку між міРНК-335, -139 і -200, а натомість появу множинної позитивної залежності експресії між іншими міРНК, як, наприклад, це було виявлено для міРНК-25, -27 і -497. Зміни плазмового рівня цих 3 міРНК на вищий наведено в табл. 1 і 2. Тобто міРНК-25, -27, -497 та, можливо, міРНК-205 і -139 (як суміжна з ними в кореляційних зв’язках) потенційно можуть бути залучені в розвиток РМЗ.
Залежність рівня міРНК від молекулярного типу РМЗ
З метою виявлення ймовірної залежності зміни експресії міРНК у хворих із встановленим молекулярним типом раку проведено аналіз рівнів у 4 категоріях пацієнтів. Здійснено порівняння показників здорових осіб і з РМЗ між молекулярними типами РМЗ. Результати середніх значень показників представлені в табл. 5.
| Тип міРНК | Здорові (n=18) | РМЗ (n=70) | |||
| Люмінальний А (n=13) | Люмінальний Б (n=35) | HER2new (n=4) | Тричі негативний (n=18) | ||
| міРНК-25 | 3,0 (2,2) | 2,4 (0,9) | 15,0 (9,0) | 0,5 (0,3) | 10,1 (4,9) |
| міРНК-27 | 1540,0 (1537,7) | 1221,9 (1220,5) | 857,6 (788,7) | 1,1 (0,7) | 39,5 (26,7) |
| міРНК-30 | 68,1 (65,2) | 310,1 (309,2) | 45,5 (21,5) | 47,5 (46,8) | 105,0 (71,3) |
| міРНК-139 | 317,6 (310,5) | 43,3 (32,3) | 54,4 (31,2) | 8,7 (6,9) | 56,9 (25,8) |
| міРНК-155 | 49,3 (26,1) | 28,9 (27,3) | 19,0 (9,1) | 140,8 (109,8) | 37,8 (24,5) |
| міРНК-200 | 77,5 (34,9) | 175,0 (102,7) | 387,1 (199,8) | 5,2 (4,1) | 123,4 (48,1) |
| міРНК-205 | 417,7 (327,7) | 206,8 (186,3) | 600,8 (404,6) | 167,6 (101,9) | 437,2 (279,1) |
| міРНК-335 | 602,8 (550,0) | 44 312,1 (44 240,1) | 447,2 (199,2) | 0,6 (0,2) | 76,6 (63,8) |
| міРНК-497 | 4,6 (1,4) | 19,3 (14,7) | 49,0 (24,9) | 0,06 (0,03) | 86,9 (53,3) |
| міРНК-663 | 513,7 (332,1) | 9,8 (4,3) | 1058,2 (930,4) | 92,5 (86,7) | 255,1 (126,0) |
Ми не виявили достовірної різниці між підгрупами за жодною з 10 міРНК. Відмічено тенденцію до підвищення рівня міРНК-335 у хворих з люмінальним А типом РМЗ (щодо здорових осіб — за критерієм Манна — Уїтні, р=0,29, апостеріальний критерій Фішера LSD, p=0,02).
На рис. 3 наведено графіки розподілу хворих (емпірична частота) залежно від рівня досліджуваних показників.
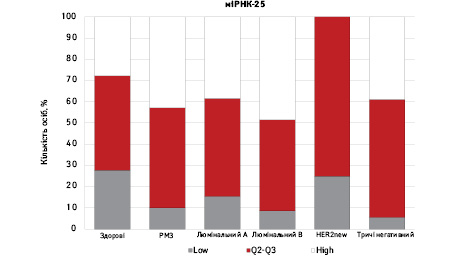
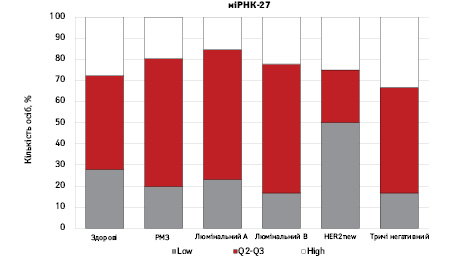
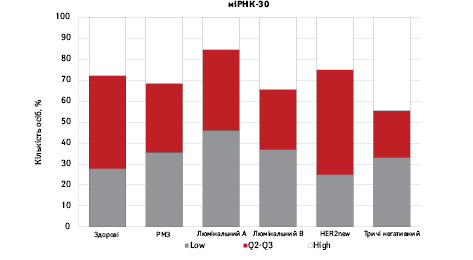
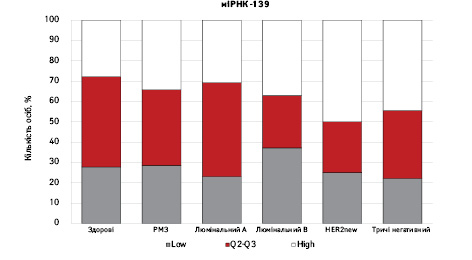
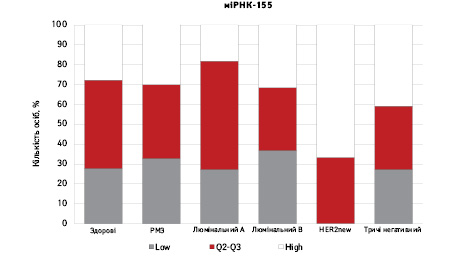
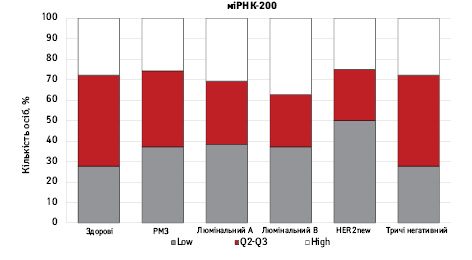
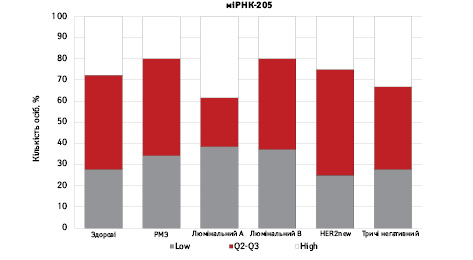
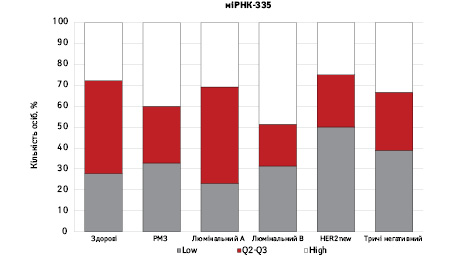
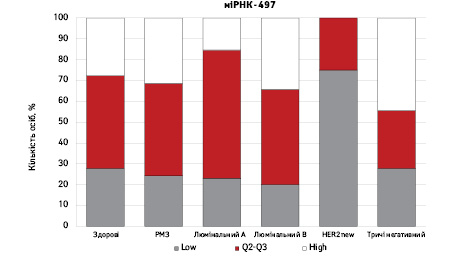
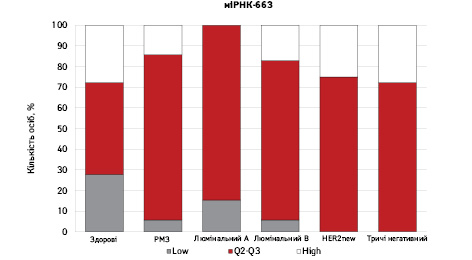
Зважаючи на те що зміни рівня міРНК у хворих на РМЗ базувалися на аналізі характеристики рівнів 10 міРНК у здорових осіб, то медіану і середній квартильний розподіл обрано за емпіричну точку відліку. За таким алгоритмом розраховано частоти розподілу здорових осіб і хворих на РМЗ і виявлено деякі закономірності. Так, встановлено більшу кількість хворих, у яких рівень міРНК-25 було оцінено як підвищений порівняно до контролю і зменшення кількості осіб з низьким рівнем міРНК-25. Частота розподілу хворих на РМЗ характеризувалася зміщенням показника міРНК-27 у бік середніх значень, тобто тенденцію до зменшення високоекспресуючих випадків, що співпадає з концепцією зменшення кількості міРНК-27 у хворих під час пременопаузи. Показник рівня міРНК-497 виявився неоднозначним, оскільки мав тенденцію до збільшення частки хворих із середнім її рівнем, хоча достовірно підвищився загальний рівень і мав тенденцію до росту у пацієнтів з ІІІА–IV стадіями. Цікавими виявили результати аналізу міРНК-663: частота виявлення хворих з низьким рівнем наближалася до 0, а якщо за критерій розподілу брати медіану варіаційного ряду, то частота виявлення зміщується в бік домінування випадків з високою експресією. Узагальнюючі результати щодо аналізу цих 4 міРНК, висновки наведено в табл. 6.
| Тип міРНК | Показник залежності | ||
| Зв’язок з клінічною картиною РМЗ | Зв’язок зі стадією РМЗ | Зв’язок з іншими міРНК у хворих | |
| міРНК-25 | Збільшення випадків з підвищеним рівнем | Підвищені показники у пацієнтів з ІІІА стадією | Виникнення множинних позитивних кореляцій, міРНК-155, -497, -139, -27, -30, -335 |
| міРНК-27 | Тенденція до зменшення у період пременопаузи | Підвищення рівня у хворих з І–ІV стадіями, крім ІІА | Виникнення позитивних кореляцій з міРНК-30, -139, -25, -205 |
| міРНК-497 | Достовірно зростає у хворих | Тенденція до підвищення у хворих з ІІІА–IV стадіями | Виникнення позитивних кореляцій з міРНК-155, -25, -335 |
| міРНК-663 | Тенденція до збільшення, в постменопаузі зростає достовірно | Тенденція до збільшення у хворих з ІІА стадією | Виникнення позитивної кореляції з міРНК-155 |
Результати оцінки рівнів міРНК після проведення НПХТ
Зроблено спробу оцінити зміни міРНК після курсів НПХТ як показник ефективності або чутливості до хіміотерапії. Повторні дослідження рівнів міРНК було досліджено у 18 з 47 пацієнтів. У табл. 7 наведено результати 1-го та 2-го вимірювання, статистичну різницю розраховано на основі непараметричного критерію Вілкоксона. Виявлено статистично значуще зниження рівня міРНК-25 після лікування за критерієм Вілкоксона і тенденцію до зниження рівня міРНК-335 (за критерієм Фішера LSD різниця була достовірною, p<0,05). Показники міРНК-25 і міРНК-335 були вищими до лікування порівняно з показником у здорових осіб (тенденція або достовірно відмінні). У 7 з 18 встановлено розвиток метастазів (у 5 осіб — люмінальний В і у 2 пацієнтів — тричі негативний рак), зафіксовано 1 летальний випадок, у 2 — негативну динаміку, у 1 — рецидив, у 14 оцінено стан як стабілізований.
| Тип міРНК | Здорові (n=18) | Хворі на РМЗ | |
| Дослідження І (n=18) | Дослідження ІІ (n=18) | ||
| міРНК-25 | 3,0 (2,2) | 61,1 (54,5) | 1,6 (0,4)* |
| міРНК-27 | 1540,0 (1537,7) | 12,7 (7,1) | 3083,6 (2121,0) |
| міРНК-30 | 68,1 (65,2) | 168,0 (93,4) | 6,9 (2,7) |
| міРНК-139 | 317,6 (310,5) | 120,0 (50,3) | 46,7 (21,9) |
| міРНК-155 | 49,3 (26,1) | 94,3 (86,7) | 21,5 (12,6) |
| міРНК-200 | 77,5 (34,9) | 239,1 (144,0) | 243,1 (162,6) |
| міРНК-205 | 417,7 (327,7) | 390,3 (235,1) | 965,5 (825,5) |
| міРНК-335 | 602,8 (550,0) | 27 123,3 (27 034,6) | 466,4 (385,1)† |
| міРНК-497 | 4,6 (1,4) | 79,6 (55,8) | 35,0 (23,8) |
| міРНК-663 | 513,7 (332,1) | 177,2 (116,1) | 34,2 (16,0) |
*р<0,05 до дослідження І за критерієм Вілкоксона; †р<0,05 до дослідження І за критерієм Фішера LSD.
ОБГОВОРЕННЯ
Роль міРНК у розвитку РМЗ стає все більш очевидною, і цей зв’язок відкриває можливості для розробки нових діагностичних методів, прогностичних факторів і терапій, що зможуть поліпшити результати лікування та якість життя пацієнтів. міРНК модулюють стволовість ембріональних стовбурових клітин, зокрема й ракових. Наприклад, міРНК-139-5p оцінено як інгібітор метастазування РМЗ [9]. Підвищена експресія міРНК-29b має зв’язок з такими параметрами, як інвазивний лобулярний рак, IV стадія, наявність метастазів, рецидив [10]. Знижений рівень міРНК-139 може бути пов’язаний з експресією HER2 [11]. Відомо про кореляцію між деякими міРНК (міРНК-9, -21, -126, -200, -205, -335) та підвищеним ризиком метастазування та найбільш несприятливим прогнозом [11–13]. Для підвищення ефективності лікування РМЗ слід активно досліджувати множинні зміни міРНК, розробляти діагностичні панелі найбільш значущих міРНК щодо молекулярного типу РМЗ та їх потенційного зв’язку з чутливістю пухлин до хіміотерапії [14]. Загалом молекулярні дослідження і виявлення кореляцій між експресією міРНК та клінічною картиною РМЗ вказує на важливість цього напрямку в лікуванні хворих онкологічного профілю, особливо у молодих жінок. За результатами власних досліджень на увагу заслуговують кореляції між міРНК-25, -30, -139, -205, -335 і -663.
ВИСНОВКИ
На основі аналізу середнього рівня 10 міРНК, частоти розподілу пацієнтів за рівнем міРНК і кореляційних зв’язків можна зробити наступні висновки.
Фактор віку гіпотетично мав значення щодо зміни експресії міРНК-27 та міРНК-497 в рівній мірі як для групи осіб, яким проводили АПХТ, так і після НПХТ. При цьому експресія цих 2 міРНК мала протилежну залежність, у міРНК-27 достовірно була нижчою у жінок у пременопаузальний період і зростала з віком, а у міРНК-497 була достовірно вищою незалежно від віку.
Порівняно зі здоровими жінками у хворих на РМЗ є тенденція до зростання міРНК-497 при ІІІА–ІV стадіях і міРНК-200 при IV стадії, або зниження міРНК-27 при ІІВ–IV стадіях. Виявлено статистично значуще зниження рівня міРНК-25 після лікування за критерієм Вілкоксона і тенденцію до зниження рівня міРНК-335.
Також слід зазначити, що міРНК-25, -27, -335, -497 і -663 заслуговують на увагу щодо вивчення їх ролі в розвитку РМЗ та оцінки як потенційних показників ефективності або чутливості до лікування. За такого підходу міРНК-25 є найбільш перспективною з 10, оскільки має тенденцію до зростання у хворих, особливо при стадії ІІІА.
Проведене дослідження відкриває перспективи використання даних аналізу експресії зазначених міРНК з метою оцінки ефективності терапії та прогнозу клінічного перебігу патології у осіб з РМЗ.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Singh, S., Saini, H., Sharma, A., Gupta, S., Huddar, V. G., & Tripathi, R. (2023). Breast cancer: miRNAs monitoring chemoresistance and systemic therapy. Frontiers in Oncology, 13, 1155254. doi: 10.3389/fonc.2023.1155254.
2. Walsh, E. M., Smith, K. L., & Stearns, V. (2020). Management of hormone receptor-positive, HER2-negative early breast cancer. Seminars in Oncology, 47(4), 187–200. doi: 10.1053/j.seminoncol.2020.05.010.
3. Kravets, О., Burtyn, O., Borikun, T., & Rossylna, O. (2023). The study of prognostic value of microRNAs (miR-10b and -155) and CDKN2A/P16INK4A in oral squamous cell carcinoma. Experimental Oncology, 45(2), 187–194. doi.org/10.15407/exp-oncology.2023.02.187.
4. Wu, X., Ding, M., & Lin, J. (2020). Three-microRNA expression signature predicts survival in triple-negative breast cancer. Oncology Letters, 19(1), 301–308. doi: 10.3892/ol.2019.11118.
5. Garrido-Palacios, A., Rojas Carvajal, A. M., Núñez-Negrillo, A. M., Cortés-Martín, J., Sánchez-García, J. C., & Aguilar-Cordero, M. J. (2023). MicroRNA dysregulation in early breast cancer diagnosis: a systematic review and meta-analysis. International Journal of Molecular Sciences, 24(9), 8270. doi: 10.3390/ijms24098270.
6. Hu, Z., Dong, J., Wang, L. E., Ma, H., Liu, J., Zhao, Y., … Shen, H. (2012). Serum microRNA profiling and breast cancer risk: the use of miR-484/191 as endogenous controls. Carcinogenesis, 33(4), 828–834. doi: 10.1093/carcin/bgs030.
7. Sun, H., Dai, J., Chen, M., Chen, Q., Xie, Q., Zhang, W., … Yan, M. (2022). miR-139-5p was identified as biomarker of different molecular subtypes of breast carcinoma. Frontiers in Oncology, 12, 857714. doi: 10.3389/fonc.2022.857714.
8. Гур’янов, В. Г., Лях, Ю. Є., Парій, В. Д., Короткий, О. В., Чалий, О. В., Чалий, К. О., & Цехмістер, Я. В. (2018). Посібник з біостатистики. Аналіз результатів медичних досліджень у пакеті EZR (R–statistics): навчальний посібник. Київ: Вістка.
9. Krishnan, K., Steptoe, A. L., Martin, H. C., Pattabiraman, D. R., Nones, K., Waddell, N., … Cloonan, N. (2013). miR-139-5p is a regulator of metastatic pathways in breast cancer. RNA, 19(12), 1767–1780. doi: 10.1261/rna.042143.113.
10. Abbas, M. A., El Sayed, I. E. T., Kamel Abdu-Allah, A. M., Kalam, A., Al-Sehemi, A. G., Al-Hartomy, O. A., & Salah Abd El-Rahman, M. (2022). Expression of MiRNA-29b and MiRNA-31 and their diagnostic and prognostic values in Egyptian females with breast cancer. Noncoding RNA Research, 7(4), 248–257. doi: 10.1016/j.ncrna.2022.09.003.
11. Peña-Chilet, M., Martínez, M. T., Pérez-Fidalgo, J. A., Peiró-Chova, L., Oltra, S. S., Tormo, E., …, Ribas, G. (2014). MicroRNA profile in very young women with breast cancer. BMC Cancer, 14, 529. doi: 10.1186/1471-2407-14-529.
12. Zhang, J., & Ma, L. (2012). MicroRNA control of epithelial-mesenchymal transition and metastasis. Cancer and Metastasis Reviews, 31(3–4), 653–662. doi: 10.1007/s10555-012-9368-6.
13. Gomarasca, M., Maroni, P., Banfi, G., & Lombardi, G. (2020). microRNAs in the antitumor immune response and in bone metastasis of breast cancer: from biological mechanisms to therapeutics. International Journal of Molecular Sciences, 21(8), 2805. doi: 10.3390/ijms21082805.
14. Bertoli, G., Cava, C., & Castiglioni, I. (2015). MicroRNAs: new biomarkers for diagnosis, prognosis, therapy prediction and therapeutic tools for breast cancer. Theranostics, 5(10), 1122–1143. doi: 10.7150/thno.11543.
Адреса для листування:
Гаращенко Оксана
03022, Київ, вул. Васильківська, 45
Інститут експериментальної патології,
онкології та радіобіології ім. Р.Є. Кавецького НАН України
E-mail: harashchenko@gmail.com, oksanaclinic@gmail.com
Correspondence:
Оksana Harashchenko
45 Vasylkivska str., Kyiv, 03022
R.E. Kavetsky Institute of Experimental Pathology,
Oncology and Radiobiology of National Academy of Science of Ukraine
E-mail: harashchenko@gmail.com, oksanaclinic@gmail.com














Leave a comment