Безрецидивна виживаність як предиктор загальної виживаності при локалізованій нирково-клітинній карциномі після ініціальної нефректомії: результати ретроспективного обсерваційного дослідження з використанням даних SEER-Medicare
Резюме. Мета. Оцінити, чи може безрецидивна виживаність (БВ) слугувати предиктором тривалої виживаності у пацієнтів із нирково-клітинною карциномою (НКК) помірно підвищеного або підвищеного ризику після нефректомії, якщо дані про загальну виживаність (ЗВ) недоступні. Методи. Базу даних SEER (Surveillance, Epidemiology and End Results)-Medicare (2007–2016) використовували для виявлення пацієнтів із неметастатичною НКК помірно підвищеного або підвищеного ризику після нефректомії. Для оцінки кореляції між БВ і ЗВ використовували ландмарк-аналіз і коефіцієнт кореляції Кендала. Багатофакторний регресійний аналіз використовували для кількісної оцінки підвищення ЗВ після нефректомії, пов’язаної зі збільшенням часу до розвитку рецидиву серед пацієнтів із ним, з поправкою на вихідні коваріати. Результати. Загалом проаналізовано 643 пацієнтів; середній вік становив 75 років; >95% осіб мали помірно підвищений ризик НКК на момент встановлення діагнозу; у 269 пацієнтів після нефректомії стався рецидив. Для пацієнтів із рецидивом проти пацієнтів з ним в орієнтирні точки через 1, 3 та 5 років після нефректомії 5-річна ЗВ становила 37,0% проти 70,1%, 42,3% проти 72,8% та 53,2% проти 78,6% відповідно. Коефіцієнт кореляції Кендала між БВ та ЗВ після нефректомії становив 0,70 (95% довірчий інтервал (ДІ) 0,65–0,74; p<0,001). Після поправки на вихідні коваріати кожен додатковий рік БВ у пацієнтів був пов’язаний з 0,73 додатковими роками ЗВ після нефректомії (95% ДІ 0,40–1,05; p<0,001). Висновок. Значний позитивний зв’язок між БВ та ЗВ у пацієнтів із помірно підвищеним та підвищеним ризиком розвитку НКК після нефректомії, встановлений у цьому дослідженні, підтверджує використання БВ як потенційного предиктора ЗВ для цих пацієнтів у випадках, коли дані щодо ЗВ неповні.
DOI: 10.32471/clinicaloncology.2663-466X.53-1.32064
Вступ
НКК — найпоширеніший тип раку нирки, на який припадає близько 90% випадків [1]. За оцінками експертів, у 2020 р. у США зареєстровано 73 750 нових випадків новоутворень нирки та 14 830 випадків смерті від цієї онкопатології [2]. Прогноз для пацієнтів із НКК змінюється залежно від низки факторів, таких як стадія захворювання, саркоматоїдні ознаки, ступінь ядерної атипії і некроз [3, 4]. Для пацієнтів із вперше діагностованим локалізованим регіонарним або метастатичним захворюванням 5-річна ЗВ становить 93, 70 і 13% відповідно [1].
Раніше стандартом лікування осіб із НКК була хірургічна резекція (нефректомія) [5], однак результати значною мірою залежали від стадії та ступеня онкопатології. 5-річна ЗВ після нефректомії VI стадії НКК становила 29,1%, з 10-річною ЗВ — 0%, тоді як 5- та 10-річна ЗВ на ранній стадії захворювання — близько 100% [6]. Протягом останнього десятиріччя варіанти терапії прогресуючого НКК розширилися після впровадження інгібіторів імунних контрольних точок і нових таргетних методів лікування [7]. Сприятливі відповіді, пов’язані із застосуванням цих препаратів, суттєво покращили схему терапії осіб з прогресуючим НКК [8].
Після успіху таргетної терапії при прогресуючому НКК проведено декілька клінічних досліджень для оцінки її ефективності у первинно резектованих пацієнтів [9–13]. Загальні кінцеві точки ефективності, які використовували при оцінці ад’ювантного лікування НКК, зосереджені на ЗВ та БВ. Хоча ЗВ є кращою кінцевою точкою в онкології, через тривале виживання після нефректомії серед пацієнтів з локалізованим НКК [14] повні дані про ЗВ не завжди доступні для осіб, які ухвалюють рішення в галузі охорони здоров’я, під час оцінки нових методів терапії НКК у первинно резектованих пацієнтів [15].
Проміжні кінцеві точки, зокрема БВ, розглядаються регуляторними органами як предиктор довгострокової виживаності у випадках, коли дані щодо ЗВ неповні [16, 17]. Наприклад, сунітиніб схвалений Управлінням з контролю за продуктами та ліками США (US Food and Drug Administration — FDA) у 2017 р. у якості ад’ювантної терапії НКК у пацієнтів із підвищеним ризиком [15] на основі статистично значущої користі щодо БВ, пов’язаної з його застосуванням порівняно з плацебо (6,8 проти 5,6 року відповідно; p=0,03) у дослідженні S-TRAC за відсутності повних даних про ЗВ [10]. Докази, що базуються на проміжних кінцевих точках, також використовувалися платниками при ухваленні рішень щодо страхового покриття та відшкодування витрат [18]. Правильно встановлена кореляція між проміжною кінцевою точкою та довгостроковою виживаністю на основі індивідуальних даних пацієнтів (ІДП) може допомогти в подальшій підтримці використання проміжних кінцевих точок для прогнозування ЗВ особами, які ухвалюють рішення в галузі охорони здоров’я, що, зі свого боку, може прискорити впровадження інноваційних методів лікування [19].
Наскільки відомо, у жодному дослідженні не вивчали кореляцію між БВ та ЗВ у пацієнтів з НКК після нефректомії з використанням реальних ІДП. Щоб усунути цю прогалину в знаннях, проведено ретроспективне обсерваційне дослідження з використанням даних спостереження, епідеміології та кінцевих результатів SEER-Medicare для оцінки кореляції між БВ та ЗВ у осіб із НКК помірно підвищеного та підвищеного ризику після нефректомії.
Об’єкт і методи дослідження
У цьому ретроспективному обсерваційному дослідженні використовували базу даних SEER-Medicare (2007–2016 рр.) з аналізом відомостей про пацієнтів віком >65 років із вперше діагностованою неметастатичною НКК середнього або підвищеного ризику після нефректомії. Дані реєстру SEER включали демографічні, клінічні дані та дані про смертність пацієнтів із онкопатологією, а пов’язані дані Medicare включали заявки Medicare на медичні послуги, що покривалися, з моменту отримання бенефіціаром права на участь у програмі Medicare до смерті. У цьому дослідженні використовували пов’язані дані SEER-Medicare, доступні станом на листопад 2018 р., які включали усіх пацієнтів, що мали право на участь у програмі Medicare, у реєстрі SEER, у яких діагностовано новоутворення до 2015 р. Дані охоплювали заявки Medicare до 2016 р., а дані частини D програми Medicare були доступні з 2007 р. Усі дані, використані в цьому дослідженні, деідентифіковані та відповідали Закону про переносимість та підзвітність медичного страхування (Health Insurance Portability and Accountability Act — HIPAA) і Гельсінській декларації. 13 січня 2020 р. Незалежна ревізійна рада Нової Англії (New England Independent Review Board) виключила це дослідження з перевірки інституційною радою.
Пацієнти мали право на включення, якщо їм встановлено діагноз НКК у період 2007–2015 рр. (Міжнародна класифікація онкологічних захворювань, 3-тє видання: C649 з НКК зі світлоклітинним компонентом: «8310»). Пацієнти з неметастатичною НКК повинні були належати до групи помірно підвищеного (T2, ступінь 4, N0, M0 та T3, будь-який ступінь, N0, M0) або підвищеного ризику (T4, будь-який ступінь, N0, M0 та T будь-якої стадії, будь-який ступінь, N+, M0) зі встановленням діагнозу за системою TNM (tumor-node-metastasis — пухлина, вузол, метастазування) і ядерним ступенем. На момент встановлення діагнозу пацієнти повинні були бути віком ≥66 років, отримати часткову або радикальну нефректомію після діагностування НКК, не мати доказів метастатичного захворювання на момент встановлення діагнозу, а також інших видів нениркового раку до нефректомії. У пацієнтів не можна було діагностувати вторинне злоякісне новоутворення до або протягом 30 днів після ініціальної нефректомії. Пацієнтам не можна було діагностувати НКК під час аутопсії, у будинку престарілих або за свідоцтвом про смерть. На рис. 1 підсумовано вибірку на основі встановлених критеріїв.
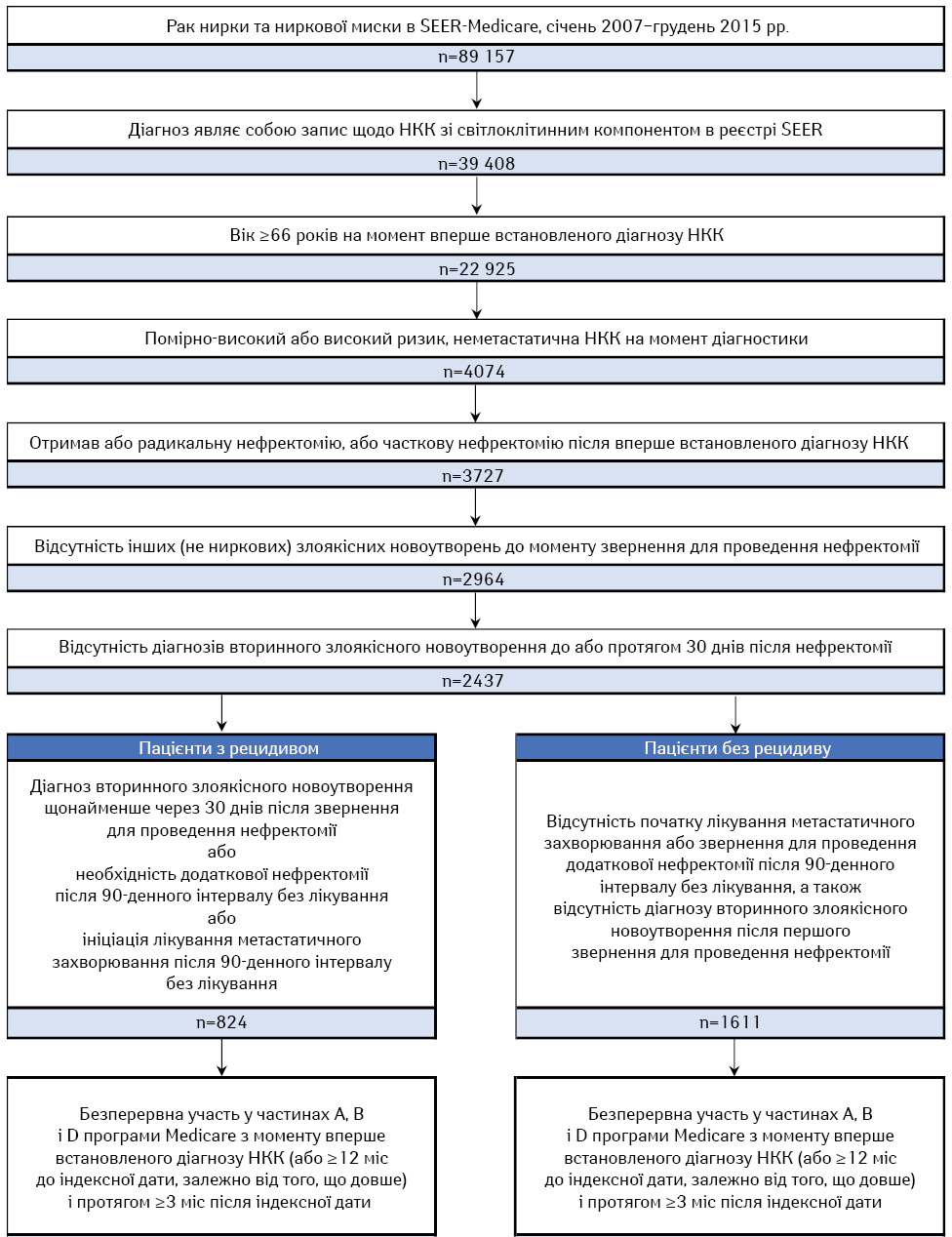
Після цього виявлені пацієнти, у яких відмічали розвиток рецидиву, зокрама локорегіонарний рецидив (ЛР) і віддалені метастази (ВМ). ЛР визначений як перший діагноз вторинного захворювання внутрішньочеревних лімфатичних вузлів або нирок і ниркової миски щонайменше через 30 днів після першого звернення для проведення нефректомії або як додаткова нефректомія (радикальна або часткова) після періоду без первинного лікування. ВМ визначені як перший діагноз метастатичного захворювання щонайменше через 30 днів після першого звернення для проведення нефректомії або початку лікування метастатичної НКК після первинного періоду без лікування. Активне лікування метастатичної НКК включало комерційно доступні методи терапії прогресуючої НКК, схвалені FDA або рекомендовані Національною комплексною онкологічною мережею (National Comprehensive Cancer Network — NCCN). Для пацієнтів із рецидивом був необхідний інтервал без нефректомії тривалістю щонайменше 90 днів після початкової нефректомії, щоб вказувати на закінчення первинного лікування та служити проміжним показником стану без захворювання [20, 21]. Ад’ювантну терапію дозволено протягом періоду без нефректомії. Для пацієнтів із рецидивом індексну дату визначали як дату за 30 днів до ознак рецидиву, щоб відобразити претензії, які, ймовірно, пов’язані з розвитком рецидиву, але виникли до нього [22, 23]. Для пацієнтів без рецидиву індексну дату визначали випадковим чином на основі логарифмічно нормального розподілу часу між першою нефректомією і рецидивом для пацієнтів із рецидивом (див. рис. 1).
Пацієнти повинні були бути постійно зареєстровані в частинах A, B і D програми Medicare з моменту вперше встановленого діагнозу НКК або принаймні за 12 міс до індексної дати залежно від того, що було довше, і протягом щонайменше 3 міс після індексної дати. Базовий період визначений як 12 міс до індексної дати.
Контрольні точки включали ВМ, час до розвитку рецидиву та ЗВ. ВМ визначали як час від початкової нефректомії до розвитку рецидиву або смерті залежно від того, що сталося раніше. ЗВ визначали як час від початкової нефректомії або іншої визначеної контрольної точки до смерті. Як для ВМ, так і для ЗВ пацієнти підлягали цензурі при першій втраті можливості спостереження та припиненні доступності даних. Серед хворих із рецидивом час до розвитку рецидиву визначали як час від початкової нефректомії до розвитку рецидиву.
Результати
Загалом 643 пацієнти (269 з рецидивом і 374 — без) відповідали всім критеріям включення (див. рис. 1). Середня (±SD) тривалість спостереження від індексної дати становила 25,0 (±23,0) міс для осіб із рецидивом і 35,2 (±26,0) міс — для пацієнтів без нього. Середній вік залучених у дослідження становив 75 років, 86% були європеоїдної раси, 61% — чоловіки (табл. 1). Серед пацієнтів із рецидивом 10,8% мали ЛР і 89,2% — ВМ. >95% осіб мали захворювання помірного та підвищеного ризику на момент встановлення діагнозу НКК. Серед пацієнтів із НКК помірного та підвищеного ризику на момент встановлення діагнозу >97% мали захворювання Т3, N0, M0.
| Вихідні характеристики | Пацієнти з рецидивом (n=269) | Пацієнти без рецидиву (n=374) | р |
| Демографічні характеристики | |||
| Вік (роки) станом на індексну дату, середнє±SD | 75,2±6,1 | 75,7±6,0 | 0,383 |
| Чоловіки, n (%) | 174 (64,7%) | 216 (57,8%) | 0,076 |
| Європеоїди, n (%) | 231 (85,9%) | 323 (86,4%) | 0,991 |
| Характеристики захворювання, n (%) | |||
| Рік індексної дати | 0,387 | ||
| 2008–2011 | 86 (32,0%) | 116 (31,0%) | |
| 2012–2015 | 148 (55,0%) | 195 (52,1%) | |
| 2016–2017 | 35 (13,0%) | 63 (16,8%) | |
| Стадія TNM під час діагностики | 0,126 | ||
| Помірно підвищений ризик | >258 (>95,9%) | >363 (>97,0%) | |
| Підвищений ризик | <11 (<4,1%) | <11 (<3,0%) | |
| Тип рецидиву | – | ||
| Локорегіональний | 29 (10,8%) | – | |
| Метастатичний | 240 (89,2%) | – | |
| Коморбідність | |||
| Індекс коморбідності Чарльсона, середнє±SD | 3,9±1,7 | 3,7±1,7 | 0,242 |
| Супутні захворювання, n (%) | |||
| Артеріальна гіпертензія | 245 (91,1%) | 333 (89,0%) | 0,397 |
| Захворювання нирок | 136 (50,6%) | 176 (47,1%) | 0,381 |
| Цукровий діабет | 135 (50,2%) | 159 (42,5%) | 0,054 |
| Хронічне захворювання легень | 84 (31,2%) | 120 (32,1%) | 0,817 |
| Захворювання периферичних судин | 81 (30,1%) | 103 (27,5%) | 0,477 |
| Щомісячне використання ресурсів охорони здоров’я з усіх причин, середнє±SD | |||
| Стаціонарні прийоми | 0,097±0,098 | 0,082±0,108 | 0,068 |
| Відвідування відділення невідкладної допомоги | 0,064±0,117 | 0,055±0,115 | 0,356 |
| Амбулаторні відвідування | 2,303±1,499 | 2,052±1,212 | 0,024 |
| Перебування в закладі кваліфікованого сестринського догляду | 0,014±0,046 | 0,019±0,118 | 0,450 |
Статистичні порівняння проводили з використанням t-тестів для неперервних змінних і тестів χ2 для категоріальних змінних.
Етапний і кореляційний аналіз
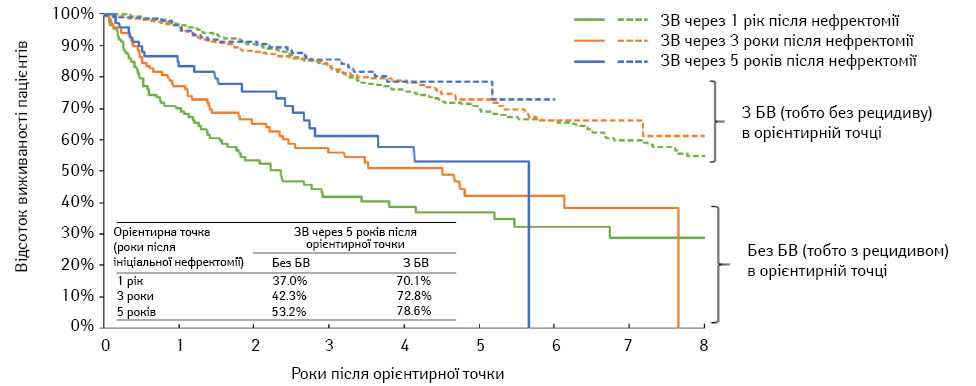
Пацієнти з рецидивом у кожній орієнтирній точці мали більш коротку наступну ЗВ порівняно з пацієнтами без рецидиву. Для хворих із рецидивом порівняно з відсутністю рецидиву через 1, 3 та 5 років після нефректомії та без рецидиву середня ЗВ після кожної орієнтирної точки становила 2,4 проти 9,7 року, 4,5 проти недосягнутого (НД) та 5,7 проти НД відповідно (усі p<0,001) (табл. 2). Для пацієнтів із рецидивом та без рецидиву 5-річна ЗВ через 1, 3 та 5 років після нефректомії становила 37,0 проти 70,1%; 42,3 проти 72,8% та 53,2 проти 78,6% відповідно (рис. 2). Пацієнти з рецидивом у кожній орієнтирній точці мали значно підвищений ризик смерті після орієнтирної точки: 1 рік після нефректомії — скориговане відношення ризиків (ВР) 3,5 (95% ДІ 2,6–4,6), 3 роки — 3,0 (95% ДІ 2,1–4,3), 5 років — 2,7 (95% ДІ 1,5–4,7); усі р<0,001 (див. табл. 2). Послідовні результати відмічали при подальшій стратифікації пацієнтів з рецидивом за типом рецидиву та окремою оцінкою пов’язаних ВР. Кореляція τ Кендала між БВ та ЗВ після початкової нефректомії становила 0,70 (95% ДІ 0,65–0,74; p<0,001), що вказує на значний позитивний зв’язок між БВ та ЗВ.
| Орієнтир (роки після ініціальної нефректомії) | Медіана ЗВ після орієнтирної точки, років | Скориговане ВР (95% ДІ) | р | |
| Без БВ (тобто з рецидивом) | З БВ (тобто без рецидиву) | |||
| 1 рік | 2,4 | 9,7 | 3,5 (2,6–4,6) | <0,001 |
| 3 роки | 4,5 | НД | 3,0 (2,1–4,3) | <0,001 |
| 5 років | 5,7 | НД | 2,7 (1,5–4,7) | <0,001 |
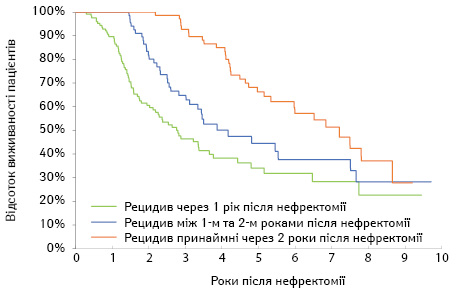
Багатофакторний регресійний аналіз додаткової ЗВ після нефректомії, пов’язаної зі збільшенням часу до рецидиву
Серед пацієнтів із рецидивом ті, у кого було більше часу до його розвитку, мали вищу ЗВ (рис. 3). У скоригованому аналізі зафіксовано, що кожен додатковий рік БВ був пов’язаний з 0,73 додатковими роками ЗВ після нефректомії (95% ДІ 0,40–1,05 року; p<0,001) (табл. 3). За подібними результатами спостерігали, коли у якості коваріат був включений більш деталізований тип рецидиву.
| Коефіцієнт (95% ДІ) | р | |
| Нескоригована модель | 0,69 (0,40–0,99) | <0,001 |
| Скоригована модель (основний аналіз)а | 0,73 (0,40–1,05) | <0,001 |
| Скоригована модель (аналіз чутливості)б | 0,85 (0,52–1,18) | <0,001 |
аВ основному аналізі модель скоригована за типом рецидиву (метастази або ЛР), роком рецидиву, віком на момент проведення нефректомії, її типом (радикальна або часткова), статтю, расою, індексом коморбідності Чарльсона, стадією онкопатології при встановленні діагнозу (стадія TNM), кількістю відвідувань стаціонару з усіх причин на 1 пацієнта на місяць протягом базового періоду та кількістю амбулаторних відвідувань на 1 пацієнта на місяць протягом базового періоду.
бВ аналізі чутливості модель скориговано з урахуванням віку розвитку рецидиву замість віку на момент проведення нефректомії; усі інші коваріати, скориговані в основному аналізі, також були скориговані.
При коригуванні віку виникнення рецидиву замість віку на момент проведення нефректомії додаткова ЗВ зросла з 0,73 до 0,85 року на 1 додатковий рік часу до розвитку рецидиву (95% ДІ 0,52–1,18 року; p<0,001) (див. табл. 3), що відображає негативний непрямий вплив від часу до рецидиву до пострецидивного виживання, опосередкований віком.
Заключення
У результатах цього дослідження встановлено значний позитивний зв’язок між БВ та ЗВ серед пацієнтів з НКК після нефректомії, а також те, що пацієнти з рецидивом після нефректомії мали близько в 3 рази вищий ризик смерті порівняно з пацієнтами без рецидиву в той самий момент часу. Ці результати свідчать про те, що в групі пацієнтів із НКК із помірно підвищеним і підвищеним ризиком після нефректомії довша БВ є прогностичною ознакою більш тривалої ЗВ, що допомагає підтримувати використання БВ як потенційного предиктора ЗВ у пацієнтів із первинно видаленою НКК, у разі якщо дані щодо ЗВ неповні. Наскільки відомо, це дослідження є першим, у якому оцінено зв’язок між БВ та ЗВ у пацієнтів із помірно підвищеним і підвищеним ризиком після нефректомії з приводу НКК з використанням реальних ІДП.
У дослідженні підкреслюється потенційне використання БВ як предиктора ЗВ, коли дані щодо ЗВ неповні; однак дані за роки, проаналізовані в цьому дослідженні (2007–2016 рр.), не охоплюють повної картини лікування НКК на сьогодні. Незважаючи на те, що з 2004 р. проведено кілька клінічних випробувань ад’ювантної терапії серед пацієнтів з НКК, лише у 2017 р. FDA схвалило перше ад’ювантне лікування НКК. Так, результати поточного дослідження не відображають зв’язку між БВ та ЗВ після нефректомії в епоху ад’ювантної терапії. Майбутні дослідження з використанням більш актуальних реальних даних можуть доповнити поточні висновки, оскільки реальні докази щодо застосування ад’ювантної терапії при НКК накопичуються. Так само протягом періоду дослідження нові методи лікування метастатичної НКК (наприклад імуноонкологічна терапія) не стали стандартним лікуванням для осіб із пізньою стадією захворювання. Отже, результати поточного дослідження не можуть бути застосовані до пацієнтів, які наразі отримують такі нові методи терапії.
Адаптований переклад за Haas, N. B., Song, Y., Willemann Rogerio, J., Zhang, S., Carley, C., Zhu, J., … Sundaram M. (2023). Disease-free survival as a predictor of overall survival in localized renal cell carcinoma following initial nephrectomy: A retrospective analysis of Surveillance, Epidemiology and End Results-Medicare data. Int. J. Urol., 30(3), 272–279. doi: 10.1111/iju.15104.
Список використаної літератури знаходиться в редакції.














Leave a comment