Від теорії до практики. Мистецтво лікування раку легень
Резюме. На науково-практичній конференції «Від теорії до практики. Мистецтво лікування раку легень» представлено доповідь, присвячену сучасним підходам до лікування недрібноклітинного раку легень (НДКРЛ) з акцентом на результати клінічних досліджень, що були представлені на щорічному онкологічному Конгресі ASCO 2024. Окрему увагу приділено ролі таргетної терапії, зокрема препарату осимертиніб, у лікуванні пацієнтів з EGFR-мутаціями. Доповідач представив результати клінічних досліджень, які підтверджують ефективність осимертинібу у підвищенні виживаності без прогресування (ВБП) та загальної виживаності (ЗВ) у хворих з НДКРЛ III стадії. Також розглянуто питання проведення імунотерапії в лікуванні осіб з НДКРЛ.
DOI: 10.32471/clinicaloncology.2663-466X.55-3.33402
У межах науково-практичної конференції «Від теорії до практики. Мистецтво лікування раку легень», що проходила 6–7 вересня 2024 р., учасники заслухали вкрай актуальну за проблематикою та насичену за змістом доповідь завідувача відділення хімієтерапії Комунального некомерційного підприємства Львівської обласної ради «Львівський онкологічний регіональний лікувально-діагностичний центр» (КНП ЛОРЦ), кандидата медичних наук Ярослава Васильовича Шпарика на тему «Перспективи розвитку лікування раку легені» (за матеріалами ASCO 2024).
 На початку автор поділився досвідом та враженнями, отриманими під час участі в щорічному онкологічному Конгресі ASCO, що відбувся 31 травня — 4 червня 2024 р. у Чикаго, штат Іллінойс, США. Зокрема, доповідач представив цікаву інформацію щодо так званої ієрархії сесій у конгресах ASCO, яка надає уявлення про спрямованість, багатовекторність та масштаб досліджень у галузі сучасної клінічної онкології. Так, на сесії висвітлено найновіші та найголовніші, з точки зору експертів, результати минулого року. Зміст доповідей залишався невідомим безпосередньо до проведення сесії (тези, а часто і статті публікують у найавторитетніших журналах лише після оприлюднення доповіді). Кожна доповідь супроводжується виступом дискутанта. Зазвичай це урочистий захід, що відбувається в окремий день конференції. Цього року він включав 5 доповідей. Сесії з усним повідомленням результатів (25 сесій) містять 9 доповідей тривалістю по 12 хв, розподілених за тематикою на 3 триплети, кожен з яких завершується аналізом експерта. Традиційно тези усіх найважливіших результатів також публікуються лише в день доповіді. Поза тим учасники конференції мали можливість заслухати почесні та навчальні доповіді (цього року їх 85) і ознайомитися із кількома тисячами стендових.
На початку автор поділився досвідом та враженнями, отриманими під час участі в щорічному онкологічному Конгресі ASCO, що відбувся 31 травня — 4 червня 2024 р. у Чикаго, штат Іллінойс, США. Зокрема, доповідач представив цікаву інформацію щодо так званої ієрархії сесій у конгресах ASCO, яка надає уявлення про спрямованість, багатовекторність та масштаб досліджень у галузі сучасної клінічної онкології. Так, на сесії висвітлено найновіші та найголовніші, з точки зору експертів, результати минулого року. Зміст доповідей залишався невідомим безпосередньо до проведення сесії (тези, а часто і статті публікують у найавторитетніших журналах лише після оприлюднення доповіді). Кожна доповідь супроводжується виступом дискутанта. Зазвичай це урочистий захід, що відбувається в окремий день конференції. Цього року він включав 5 доповідей. Сесії з усним повідомленням результатів (25 сесій) містять 9 доповідей тривалістю по 12 хв, розподілених за тематикою на 3 триплети, кожен з яких завершується аналізом експерта. Традиційно тези усіх найважливіших результатів також публікуються лише в день доповіді. Поза тим учасники конференції мали можливість заслухати почесні та навчальні доповіді (цього року їх 85) і ознайомитися із кількома тисячами стендових.
Надалі, ґрунтуючись на матеріалах Конгресу ASCO 2024, автор представив систематизовані та узагальнені дані щодо досягнень, викликів, досліджень і перспектив у лікуванні НДКРЛ.
Відомо, що таргетна терапія дотепер не застосовувалася при неоперабельній III стадії НДКРЛ. Дослідження анти-EGFR таргетної терапії осимертинібом розпочалися для метастатичного НДКРЛ. У дослідженні FLAURA доведено переваги цього препарату над інгібіторами тирозинкінази (ІТК) першого покоління (ерлотинібом та гефатинібом) у першій лінії терапії. Згодом за результатами дослідження FLAURA2 з’ясувалося, що комбінація осимертинібу з хімієтерапією дає можливість покращити результати. У дослідженні ADAURA доведено, що доповнення стандартного для резектабельних І, ІІ, та III стадій НДКРЛ лікування (хірургічне втручання з наступною хімієтерапією) осимертинібом суттєво покращує результати лікування. Проте донедавна не зафіксовано даних щодо застосування таргетної терапії при неоперабельній III стадії НДКРЛ з мутацією EGFR. Розв’язанню цієї проблеми присвячене дослідження LAURA.
Обґрунтуванням для проведення клінічного дослідження LAURA стали дані, що були отримані в ретроспективному аналізі підгруп у дослідженні PACIFIC за участю пацієнтів з мутацією EGFR, в якому виявлено незадоволені потреби в лікуванні нерезектабельного НДКРЛ III стадії. Зокрема, при нерезектабельному НДКРЛ III стадії після хімієпроменевої терапії (ХПТ) без прогресування стандартом лікування є консолідована терапія дурвалумабом, але результати ретроспективного аналізу підгруп y дослідженні РАCIFIC не підтверджують переваги консолідованої терапії дурвалумабом при НДКРЛ з мутацією EGFR. Ефективність ІТК при НДКРЛ з мутацією EGFR підтверджується в дослідженні ІІ фази RECEL та даними, отриманими в умовах реальної клінічної практики, але існує необхідність у проспективних даних досліджень ІІІ фази. У первинних результатах клінічного дослідження LAURA ІІІ фази із застосуванням осимертинібу після радикальної ХПТ у пацієнтів з нерезектабельним НДКРЛ III стадії з мутацією EGFR зафіксоване статистично та клінічно значуще підвищення показника ВБП [1].
Доповідачем представлено дизайн подвійного сліпого дослідження ІІІ фази LAURA, що охоплювало пацієнтів з місцево-поширеним нерезектабельним НДКРЛ III стадії з мутацією EGFR без прогресування під час / після радикальної ХПТ. Основними критеріями залучення був вік ≥18 років (Японія: ≥20), функціональний статус (ФС) за шкалою Всесвітньої організації охорони здоров’я (ВООЗ) 0/1, підтверджений місцево-поширений нерезектабельний НДКРЛ ІІІ стадії, наявність мутацій Ex19del / L858R та максимальний інтервал між останньою дозою ХПТ і рандомізацією у 6 тиж. Осимертиніб застосовували в дозі 80 мг 1 р/добу. Тривалість лікування до прогресування визначалася за критеріями RECIST 1.1 щодо виникнення токсичних ефектів або інших критеріїв для припинення лікування. Осимертиніб у відкритому режимі після прогресування, підтвердженого сліпим незалежним центральним оглядом (Blinded Independent Central Review — BICR) за критеріями RECIST 1.1, могли застосовувати в обох групах лікування. За первинну кінцеву точку дослідження прийнято ВБП за оцінкою дослідника за критеріями RECIST 1.1 (рис. 1). Вторинні кінцеві точки охоплювали ЗВ, ВБП, метастази в центральну нервову систему (ЦНС) та профіль безпеки. За основними вихідними характеристиками пацієнтів розподілено наступним чином: осимертиніб отримували 143 пацієнти, плацебо — 73; чоловіки становили 42%, жінки — 58%; середній вік пацієнтів — 63 роки; стадія захворювання в контрольній групі, та 37% — чоловіки і 63% — жінки в групі осимертинібу за класифікацією Американського об’єднаного комітету з боротьби проти раку (American Joint Committee on Cancer — АЈСС) / Міжнародного союзу боротьби з раком (Union for International Cancer Control — UICC) (8-ме видання) на момент встановлення діагнозу — IIIA / IIIB / ІІІС — 33, 52 та 15% відповідно; мутація EGFR на момент рандомізації — Ex19del / 1858R — 59 і 41% в контрольній групі та 92 і 8% в групі осимертинібу; тип ХПТ — паралельна / послідовна — 85 і 15% в контрольній групі та 52 і 48% в групі осимертинібу відповідно.
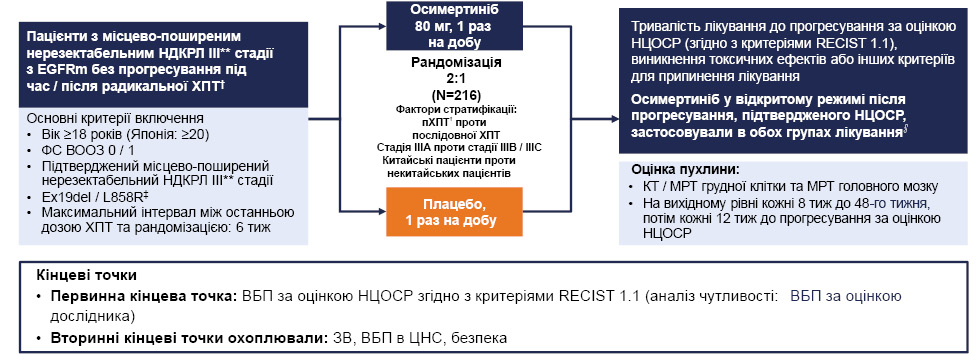
Рис. 1. Дизайн подвійного сліпого дослідження III фази LAURA* [1].
Примітки: НЦОСР — незалежна центральна оцінка в сліпому режимі; EGFRm — мутація рецептора епідермального фактора росту; Ex19del — делеція екзона 19.
*Інформація відсутня в локальній Інструкції для медичного застосування осимертинібу в Україні.
**Відповідно до спільної класифікації стадій AJCC / UICC (8-ме видання).
†пХПТ або послідовна ХПТ, що включає ≥2 цикли хімієтерапії препаратами платини (або 5 доз щотижневої хімієтерапії препаратами платини) та загальну дозу опромінення 60 Гр ± 10%.
‡Аналіз тканини проводився в центральній або схваленій FDA місцевій лабораторії, акредитованій згідно з CLIA (поправками до закону щодо вдосконалення клінічних лабораторій), або в акредитованій місцевій лабораторії для дослідницьких центрів за межами США.
§У разі отримання клінічної користі (група осимертинібу); на думку лікуючого лікаря (група плацебо).
У результатах дослідження встановлено, що медіана ВБП, оціненої BICR за критеріями RECIST 1.1., при застосуванні осимертинібу становила 39,1 міс проти 5,6 міс у групі плацебо (рис. 2); за оцінкою дослідника — 38,9 міс при застосуванні осимертинібу проти 7,3 міс у групі плацебо.
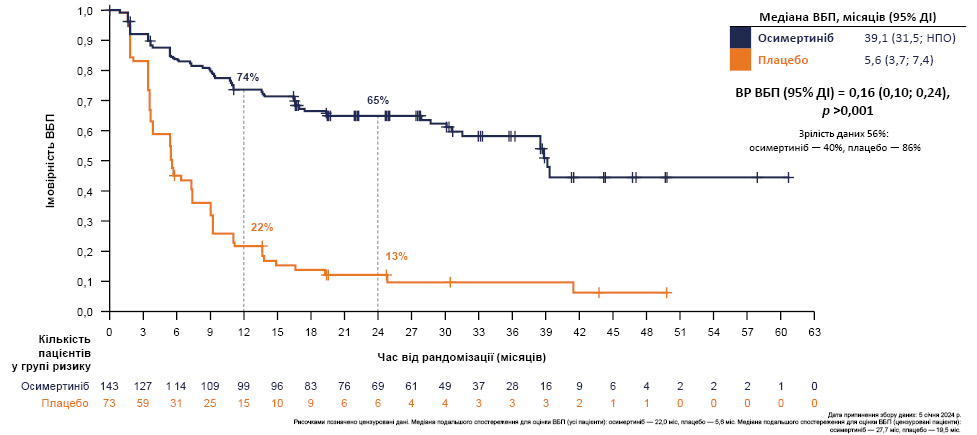
Рис. 2. ВБП за оцінкою НЦОСР* [1]
*Інформація відсутня в локальній Інструкції для медичного застосування осимертинібу в Україні.
Виявлено переваги застосування осимертинібу щодо відповіді з боку пухлини, оціненого BICR за критеріями RECIST 1.1. Так, частота об’єктивної відповіді (ЧОВ) в групі осимертинібу становила 57%, тоді як у групі плацебо лише 33%, частота контролю захворювання — 89 та 79%, медіана тривалості відповіді — 36,9 та 6,5 міс відповідно.
У ході дослідження нові пухлинні вогнища (оцінені BICR за критеріями RECIST 1.1) виявлено у 68% усіх пацієнтів групи плацебо, серед них 29% становили метастатичні ураження головного мозку та 29% — ураження легень. Наведені показники у пацієнтів, які отримували осимертиніб, становили лише 22, 8 і 6% відповідно. Натомість у проміжному аналізі результатів дослідження зафіксовано, що ЗВ на 36-й міс після рандомізації для групи осимертинібу визначена на рівні 84%, для групи плацебо — 74%. Відмічено, що у групі плацебо 81% усіх хворих з прогресуванням, оціненим BICR за критеріями RECIST 1.1, перейшли на осимертиніб.
В аналізі побічних явищ виявлено, що в обох групах найпоширенішим побічним явищем був променевий пневмоніт (рис. 3), більшість випадків були низького ступеня тяжкості (нижче ступеня IV–V), несерйозні та контрольовані. Випадки інтерстиціального захворювання легень зареєстровані у 11 (8%) пацієнтів у групі лікування осимертинібом. Більшість з них були I–II ступеня тяжкості; зареєстровано 1 випадок V ступеня.
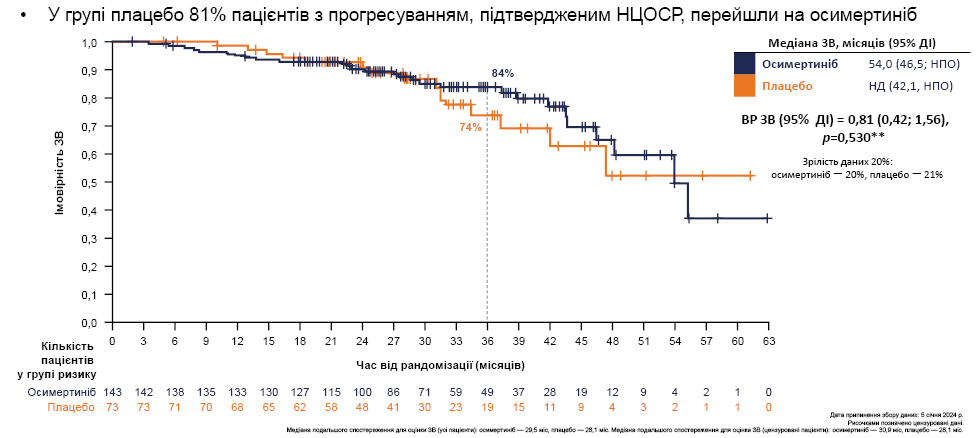
Примітка: НД — не досягнуто.
*Інформація відсутня в локальній Інструкції для медичного застосування осимертинібу в Україні.
**Для статистичної значущості в цьому проміжному аналізі необхідне р-значення <0,00036.
У підсумку в дослідженні LAURA осимертиніб продемонстрував статистично та клінічно значуще підвищення ВБП порівняно з плацебо (за критеріями RECIST 1.1) при нерезектабельному НДКРЛ III стадії з мутаціями EGFR після проведення радикальної ХПТ: медіана ВБП становила 39,1 міс при застосуванні осимертинібу та 5,6 міс при прийомі плацебо. При проведенні підгрупового аналізу переваги застосування осимертинібу щодо ВБП були подібними у всіх підгрупах. У даних проміжного аналізу ЗВ зафіксовано позитивну тенденцію на користь осимертинібу, попри велику частку пацієнтів, які перейшли на осимертиніб у групі плацебо (81%). Загалом профіль безпеки осимертинібу після ХПТ був очікуваним і контрольованим.
Так, визначення мутації EGFR має вирішальне значення при III стадії захворювання для забезпечення кращих результатів лікування пацієнтів з НДКРЛ, тож осимертиніб стає новим стандартом лікування осіб з нерезектабельним НДКРЛ III стадії з мутацією EGFR, у яких не відмічається прогресування після радикальної ХПТ. Показники переваги у ВБП (2-річна виживаність 65% проти 13%, відношення ризиків (Hazard ratio — HR) = 0,16), що були досягнуті в дослідженні LAURA, стали підставою для схвалення Управлінням з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA) 25 вересня 2024 р. за цим показанням і впровадження в клінічну практику.
Надалі доповідач розглянув дослідження ADRIATIC, яке включало консолідуючу терапію дурвалумабом у пацієнтів з дрібноклітинним раком легень на локалізованій стадії (ДКРЛ-ЛС).
Раніше зафіксовано, що застосування дурвалумабу сприяло статистично та клінічно значущому підвищенню ЗВ та ВБП порівняно з плацебо в якості консолідованої терапії при ДКРЛ-ЛС. Але загалом протягом кількох десятиріч не досягнуто значних успіхів у системному лікуванні ДКРЛ-ЛС. Сучасний стандарт лікування — паралельна хімієпроменева терапія (пХПТ), за якої медіана ВБП становить 38 (25–30) міс, а 5-річна виживаність — 29–34%.
У дослідженні PACIFIC представлені докази щодо доцільності консолідованої терапії дурвалумабом з перевагами для ВБП та ЗВ при нерезектабельному НДКРЛ III стадії, а дослідження CASPIAN підтвердило доцільність застосування дурвалумабу в лікуванні ДКРЛ. Наразі відомо, що дурвалумаб, застосований разом з комбінацією препарату платини та етопозидом, значно підвищує ЗВ порівняно із застосуванням лише комбінації препарату платини та етопозиду в першій лінії терапії ДКРЛ-ЛС (ВР 0,73 (95% довірчий інтервал (ДІ) 0,59–0,91)). Дослідження ADRIATIC свого часу розроблене для оцінки застосування дурвалумабу (антитіла до PD-L1), а також тремелімумабу (антитіла до CTLA-4) як консолідованої терапії для пацієнтів з ДКРЛ-ЛС, у яких не виявлено прогресування після проведення пХПТ.
Доповідачем представлено огляд результатів порівняння ефективності дурвалумабу з плацебо в межах першого запланованого проміжного аналізу дослідження ADRIATIC (рис. 4). Насамперед розглянуто дизайн дослідження — рандомізованого подвійного сліпого плацебо-контрольованого, багатоцентрового, міжнародного клінічного дослідження ІІІ фази (NCT03703297). Основними критеріями залучення є ДКРЛ-ЛС І–ІІІ стадій (неоперабельної ІІІ стадії), ФС ВООЗ 0/1, відсутність прогресування після пХПТ та профілактичного опромінення головного мозку (ПОГМ), дозволений до рандомізацій. Дурвалумаб у складі пХПТ застосований у дозі 1500 мг кожні 4 тиж (N=264), плацебо — кожні 4 тиж (N=266). 3-тя група хворих отримувала в якості компонентів пХПТ дурвалумаб (1500 мг кожні 4 тиж) та тремелімумаб (75 мг кожні 4 тиж), потім лише дурвалумаб (1500 мг кожні 4 тиж) (N=200).
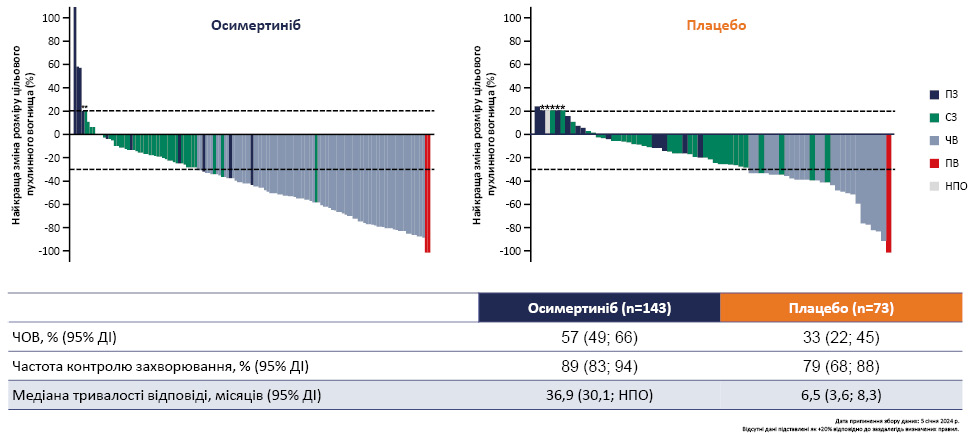
Рис. 4. Відповіді з боку пухлини за оцінкою НЦОСР* [1]
Примітки: ПВ — повна відповідь; ПЗ — прогресування захворювання; ЧВ — часткова відповідь; СЗ — стабілізація захворювання.
*Інформація відсутня в локальній Інструкції для медичного застосування осимертинібу в Україні.
Усі хворі отримували хімієтерапевтичне лікування комбінацією препаратів платини та етопозиду (4 цикли, 3 — дозволені). Проводилася променева терапія (ПТ) 60–66 Гр 1 раз протягом 6 тиж або 45 Гр 2 рази протягом 3 тиж (розпочинали не пізніше завершення 2-го циклу хімієтерапії). Лікування проводили до визначеного дослідником прогресування / виражених токсичних ефектів або протягом максимум 24 міс (рис. 5).
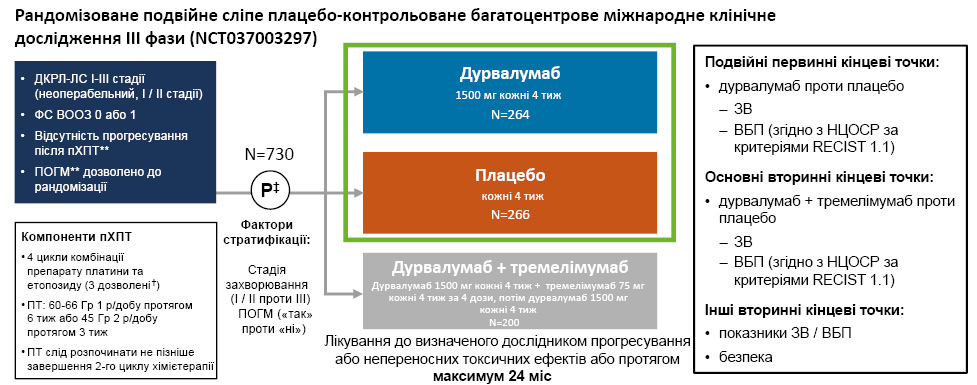
Рис. 5. Дизайн дослідження ADRIATIC* [2]
*Інформація відсутня в локальній Інструкції для медичного застосування осимертинібу в Україні.
**пХПТ та ПОГМ, якщо вони проводилися згідно з місцевими стандартами лікування, мають бути завершені протягом 1–42 днів до рандомізації.
†Якщо контроль захворювання був досягнутий і, на думку дослідника, не очікувалося додаткової користі від додаткового циклу хімієтерапії.
‡Перших 600 пацієнтів рандомізовано у співвідношенні 1:1:1 до 3 груп лікування; наступних пацієнтів рандомізовано у співвідношенні 1:1 до груп дурвалумабу або плацебо.
Оцінка перебігу захворювання враховувала подвійні первинні кінцеві точки, а саме дурвалумаб проти плацебо — ЗВ та ВБП (згідно з BICR за RECIST 1.1-критеріями) та основні вторинні кінцеві точки: дурвалумаб+тремелімумаб порівняно з плацебо — ЗВ та ВБП (згідно з BICR за критеріями RECIST 1.1). Іншими вторинними кінцевими точками були показники ЗВ / ВБП та профіль безпеки.
Щодо розподілу пацієнтів важливо відмітити, що серед них пройшли максимальний 24-місячний курс лікування 88 (33,5%) та 70 (26,4%), мали прогресування захворювання — 121 (46,0%) та 154 (58,1%), припинили досліджуване лікування — 175 (66,5%) та 195 (73,6%) у групах застосування дурвалумабу та плацебо відповідно.
Медіана тривалості подальшого спостереження у цензурованих пацієнтів становила 37,2 міс (діапазон 0,1–60,9). У результатах дослідження встановлено, що вірогідна ЗВ (основна первинна кінцева точка) на 24-му міс після рандомізації для групи дурвалумабу становила 68,0%, для плацебо — 58,5%; на 36-му міс після рандомізації — 56,5 та 47,6% відповідно. Медіана ЗВ (мЗВ) при застосуванні дурвалумабу (115 випадків (43,5%)) досягла 55,9 (37,3-НПО) міс, тоді як при застосуванні плацебо (146 випадків (54,9%)) — лише 33,4 (25,5–39,9) міс за достовірної різниці (р=0,0104). В аналізі первинної кінцевої точки при медіані тривалості подальшого спостереження у цензурованих пацієнтів, яка становила 27,6 міс (діапазон 0,0–55,8 міс), виявлено, що на 24-му міс після рандомізації ВБП у групі дурвалумабу зареєстровано на рівні 46,2 міс, у групі плацебо — на рівні 34,2 міс. Відповідно, медіана ВБП у цих групах становила 16,6 міс (139 випадків (52,7%)) порівняно з 9,2 міс (169 випадків (63,5%)) за достовірної різниці (р=0,0161).
За профілем безпеки серед найчастіших побічних явищ в обох порівнюваних групах очікувано превалювали радіаційний пневмоніт, зниження апетиту, кашель, нудота (рис. 6). В обох групах зафіксовано випадки радіаційного пневмоніту, пневмоніту, пневмонії максимального ступеня. Загалом застосування дурвалумабу у складі пХПТ спричиняло побічні явища будь-якого ступеня з усіх причин у 94,3% усіх пацієнтів, застосування плацебо — у 88,3%: серйозні побічні явища зареєстровано у 29,8 та 24,2%, побічні явища, що призвели до припинення застосування, — у 16,4 та 10,6%, побічні явища, що спричинили летальний наслідок, — у 2,7 та 1,9% відповідно.
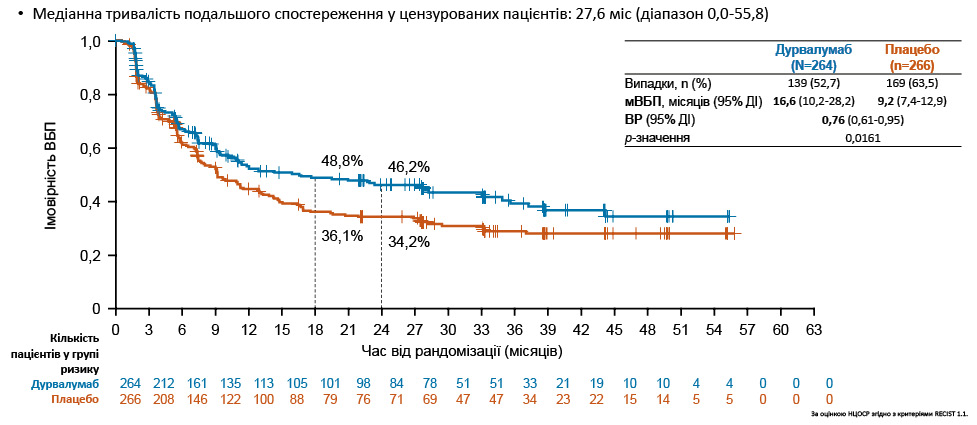
Рис. 6. Виживаність без прогресування* (первинна подвійна кінцева точка) [2]
Примітка: мВБП — медіана ВБП.
*Інформація відсутня в локальній Інструкції для медичного застосування осимертинібу в Україні.
ВБП проаналізовано за допомогою стратифікованого логрангового критерію, скоригованого за стадією захворювання (I / II проти III) та отриманням ПОГМ («так» проти «ні»). Рівень значущості для перевірки ВБП у цьому проміжному аналізі становив 0,00184 (2-сторонній) на рівні 0,5%, а також 0,02805 (2-сторонній) на загальному 5% рівні. Статистичної значущості для ВБП досягнуто за допомогою процедури повторної багаторазової перевірки та перевірки на рівні альфа 5% (2-сторонній) (з поправкою на проміжний та остаточний аналізи).
Окремої уваги потребують такі побічні явища, як пневмоніт / радіаційний пневмоніт (згруповані терміни переважного використання), будь-який ступінь яких виявляли у 38,2% усіх хворих, що отримували дурвалумаб, та у 30,2% тих, хто отримував плацебо; серед них максимальний (III–IV) ступінь — у 3,1 та 2,6%; а також ті, що призвели до смерті, — у 0,4 та 3,0% випадків відповідно.
Загалом консолідована терапія дурвалумабом у складі пХПТ зумовила статистично та клінічно значуще підвищення ЗВ та ВБП порівняно з плацебо у пацієнтів з ДКРЛ-ЛС. Показники відносного ризику (BP) ЗВ становили 0,73; р=0,0104; мЗВ — 55,9 проти 33,4 міс; ВР ВБП — 0,76; медіани ВБП — 16,6 проти 9,2 міс. Переваги лікування були загалом подібними в заздалегідь визначених підгрупах хворих як щодо ЗВ, так і щодо ВБП. Важливо відмітити, що консолідована терапія дурвалумабом протягом <2 років добре переносилася, а дані щодо профілю безпеки відповідали відомому профілю безпеки монотерапії дурвалумабом у пацієнтів, які перенесли пХПТ. У підсумку зазначено, що консолідована терапія дурвалумабом стає новим стандартом лікування для пацієнтів з ДКРЛ-ЛС, у яких не зафіксовано прогресування після пХПТ.
 Окремої уваги заслуговує доповідь О.В. Герасименко, керівниці Центру хіміотерапії Клінічної лікарні «Феофанія», м. Київ, щодо практичного застосування у клінічній практиці таргетної терапії НДКРЛ з мутаціями EGFR у пацієнтів з метастазами в головний мозок. Доповідачкою розглянуто клінічний випадок з реальної практики в контексті проблем та нових підходів у сучасній протипухлинній терапії. На консультацію до онколога звернулася жінка віком 60 років, з необтяженим сімейним анамнезом, яка на момент звернення хворіла близько 2–3 міс. Пацієнтка скаржилася на виражену задуху (сатурація без інсуфляції зволоженого кисню близько 80%), загальну слабкість, запаморочення, періодичний сухий кашель, зниження апетиту та зменшення маси тіла. При огляді самостійно не пересувалася, лише на візку.
Окремої уваги заслуговує доповідь О.В. Герасименко, керівниці Центру хіміотерапії Клінічної лікарні «Феофанія», м. Київ, щодо практичного застосування у клінічній практиці таргетної терапії НДКРЛ з мутаціями EGFR у пацієнтів з метастазами в головний мозок. Доповідачкою розглянуто клінічний випадок з реальної практики в контексті проблем та нових підходів у сучасній протипухлинній терапії. На консультацію до онколога звернулася жінка віком 60 років, з необтяженим сімейним анамнезом, яка на момент звернення хворіла близько 2–3 міс. Пацієнтка скаржилася на виражену задуху (сатурація без інсуфляції зволоженого кисню близько 80%), загальну слабкість, запаморочення, періодичний сухий кашель, зниження апетиту та зменшення маси тіла. При огляді самостійно не пересувалася, лише на візку.
За результатами проведеного клінічного обстеження (магнітно-резонансної томорафії (МРТ) головного мозку з в/в контрастуванням, комп’ютерну томографію (КТ) органів грудної, черевної порожнини і малого таза з в/в контрастуванням, фібротрахеобронхоскопії) діагностовано наявність множинного метастатичного ураження головного мозку, мозочку, мікроаденоми гіпофіза, ознаки пухлини у верхній частці правої легені з метастатичним ураженням обох легень та плеври, лімфаденопатію середостіння, двобічний ексудативний плеврит, утворення SB 3 справа з переходом на головний бронх. У результаті біопсії (від 18.09.2023 р.) пухлину визначено як аденокарциному ацинарної та папілярної будови. Хворій встановлено діагноз аденокарциноми ацинарної та папілярної будови верхньої частки правої легені СТ3N1-2М1б (головний мозок, легені) IVB стадії (рис. 7).
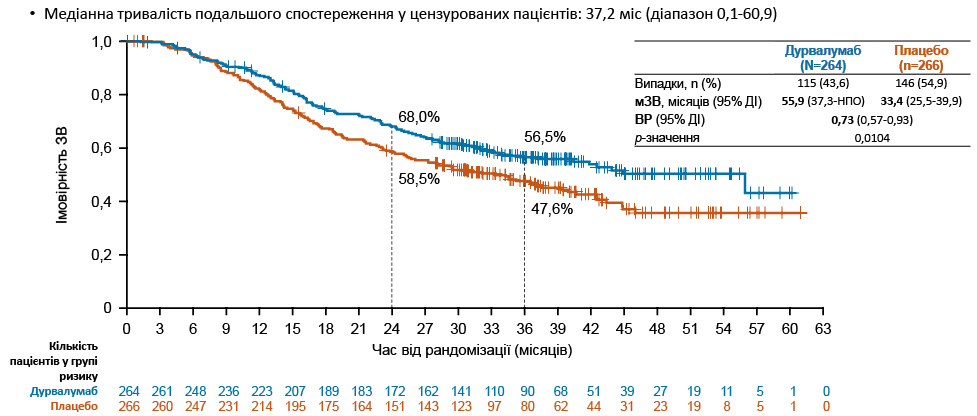
Рис. 7. ЗВ* (основна первинна кінцева точка) [2]
*Інформація відсутня в локальній Інструкції для медичного застосування осимертинібу в Україні.
ЗВ проаналізовано за допомогою стратифікованого логрангового критерію, скоригованого за отриманням ПОГМ («так» проти «ні»). Рівень значущості для перевірки ЗВ у цьому проміжному аналізі становив 0,01679 (2-сторонній) при загальному рівні 4,5%, що дозволяє забезпечити сильний альфа-контроль у часових точках проміжного та остаточного аналізу.
27.09.2023 р. рішенням мультидисциплінарного онкологічного консиліуму (МДК) призначено молекулярно-генетичне тестування (NGS My action lung + PD-L1, WBRT та проведення ПХТ: карбоплатин ± паклітаксел). В якості опції вважали можливою таргетну терапію або імунотерапію після отримання результатів молекулярного тестування. Призначено контроль ефективності лікування (КТ органів грудної, черевної порожнини і малого таза з в/в контрастуванням, МРТ головного мозку з в/в контрастуванням через 3 міс після початку терапії. У результатах молекулярно-генетичного тестування щодо мутаційного статусу пухлини виявлено, що вона має мутації EGFR (del 19ex), PD-L1-негативна (рис. 8). Хворій проведено курс ПТ усього головного мозку (Whole brain radiotherapy — WBRT) сумарною осередковою дозою (СОД) 33 Гр, разовою осередковою дозою (РОД) — 3,0 Гр.
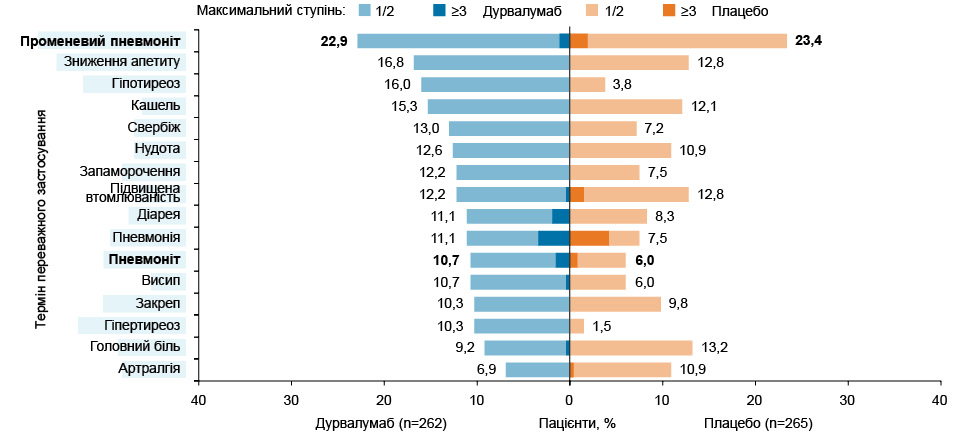
Рис. 8. Найчастіші побічні ефекти (виникли у ≥10% пацієнтів в обох групах лікування)* [2]
*Інформація відсутня в локальній Інструкції для медичного застосування осимертинібу в Україні.
У зв’язку з клінічним випадком доповідачка звернула увагу слухачів на результати дослідження FLAURA (неазійська популяція), в якому зафіксовано переваги застосування осимертинібу порівняно із застосуванням ерлотинібу / гефітинібу, а саме в групі осимертинібу виявлено достовірне подовження мЗВ на 19 міс проти ІТК EGFR І покоління. Медіана ВБП при застосуванні ерлотинібу / гефітинібу становила 10,2 міс, тоді як при застосуванні осимертинібу — 18,9 міс (ВР=0,46 (95% ДІ 0,37–0,57; р <0,001) (рис. 9). Зниження відносного ризику (ЗВР) у групі осимертинібу визначалася на рівні 54%, а у загальній популяції сягала 66% . Щодо метастазування в ЦНС у дослідженні FLAURA виявлено, що для хворих з наявними метастазами в ЦНС (n=116) медіана ВБП у групі осимертинібу становила 15,2 міс (12,1–24,4) проти 9,6 міс (7,0–12,4) у групі ІТК I–II покоління (р <0,0009). Для пацієнтів без метастазів у ЦНС (n=440) медіана ВБП у групі осимертинібу становила 19,1 міс (15,2–23,5) проти 10,9 міс (9,6–12,3) у групі ІТК I–II покоління (р <0,0001).
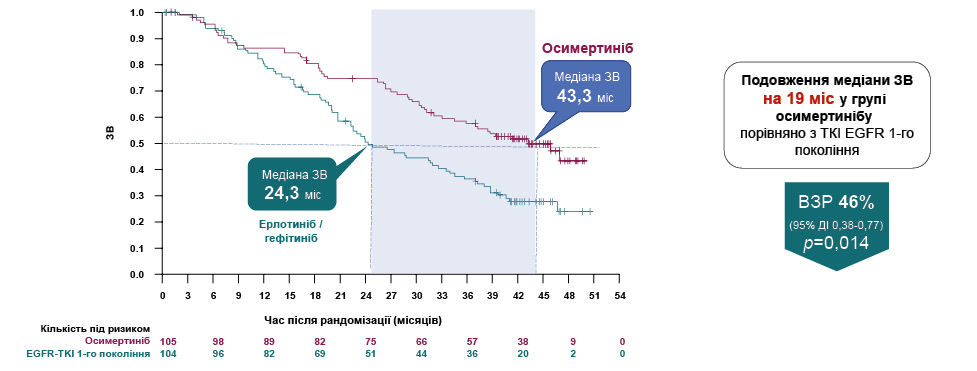
Рис. 9. FLAURA: ЗВ (неазійська популяція)* [3]
Примітка: ВЗР — відносне зниження ризику.
*Інформація відсутня в локальній Інструкції для медичного застосування осимертинібу в Україні.
Надалі доповідачка зупинилася на порівняльній оцінці показників безпеки застосованих препаратів. Для обох когорт пацієнтів дослідження FLAURA найбільш поширеними побічними явищами були діарея, шкірні висипи, зміни з боку нігтів, сухість шкіри, але частоту таких побічних явищ, як шкірні висипи, підвищення рівнів аспартатамінотрансферази / аланінамінотрансферази (АСТ / АЛТ) при застосуванні осимертинібу реєстрували на значно нижчому рівні (59, 10, 7% відповідно), ніж при застосуванні ерлотинібу / гефітинібу (79, 25, 27% відповідно). Безумовно, перевага осимертинібу перед ІТК EGFR І покоління щодо профілю безпеки безпосередньо впливає на показники якості життя пацієнтів, які були у 2–6 разів вищими в групі осимертинібу порівняно з групою ерлотинібу / гефітинібу, а саме оцінка різниці загального стану здоров’я становила 2,06, фізичного стану — 2,43, повсякденного функціонування — 2,91, емоційного статусу — 3,88, когнітивних функцій — 3,94, соціального функціонування — 5,92.
Повертаючись до клінічного випадку, доповідачка зазначила, що хвора розпочала прийом осимертинібу в дозі 80 мг/добу з 15.10.2023 р. (сумарно 3 міс). Під час терапії у пацієнтки відмічені почервоніння пальців на долонях, нудота, але вже через місяць від початку лікування хвора почала самостійно пересуватися, маса тіла збільшилася на 4 кг, сатурація досягла рівня 90% (без інсуфляції зволоженого кисню).
Через 3 міс прийому осимертинібу пацієнтка прийшла на контрольні дообстеження самостійно. На цей момент сатурація досягла 98%.
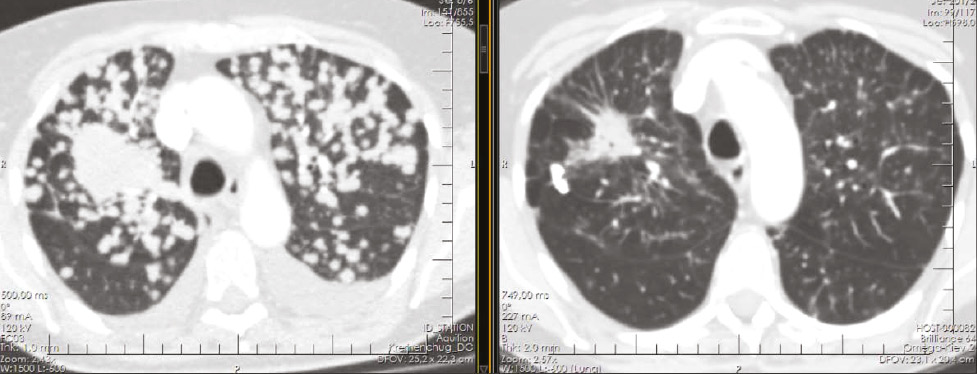
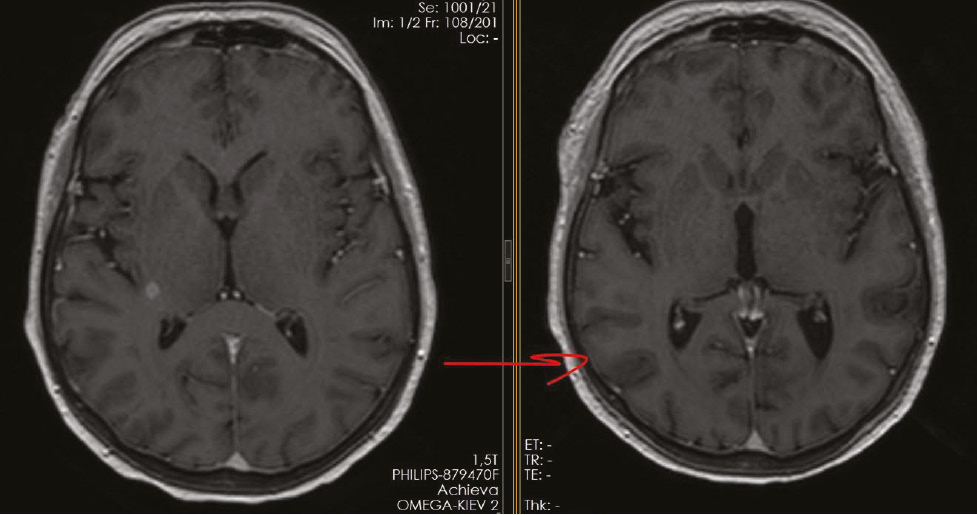
24.01.2024 р. на КТ органів грудної, черевної порожнини і малого таза з в/в контрастуванням зафіксовано зменшення розмірів пухлинної маси та розмірів метастатичних вогнищ у легенях і плеврі на 49%, що свідчить про часткову відповідь пухлини на лікування (рис. 10). Окремо відмічено, що на МРТ головного мозку виявлено виражену позитивну динаміку у вигляді відсутності пухлинного навантаження та неоангіогенезу, тобто повну інтракраніальну відповідь на терапію (рис. 11).
Які ж перспективи у пацієнтки? Зважаючи на раніше наведені дані дослідження FLAURA щодо ВБП (медіана для осимертинібу становила 18,9 міс, для ерлотинібу / гефітинібу — 10,2 міс) та на представлені показники часу до відміни терапії або смерті (медіана для осимертинібу становила 20,8 міс, для ерлотинібу / гефітинібу — 11,5 міс), при прогресуванні захворювання застосування осимертинібу надає 1,9 міс додатково до початку першої наступної терапії, тоді як застосування ІТК EGFR І покоління — лише 1,3 міс.
Отже, переваги таргетної терапії осимертинібом, доведені в дослідженні FLAURA, та висновки з клінічного досвіду дають підґрунтя для надії хворим на НДКРЛ з мутаціями EGFR та метастазами в головний мозок.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Lu, S., Kato, T., Dong, X., Ahn, M. J., Quang, L. V., Soparattanapaisarn, N., … Ramalingam, S. S. (2024). LAURA Trial Investigators. Osimertinib after Chemoradiotherapy in Stage III EGFR-Mutated NSCLC. N. Engl. J. Med., 391(7), 585–597.
2. Senan, S., Okamoto, I., Lee, G. W., Chen, Y., Niho, S., Mak, G., … Cho, B. C. (2020). Design and Rationale for a Phase III, Randomized, Placebo-controlled Trial of Durvalumab With or Without Tremelimumab After Concurrent Chemoradiotherapy for Patients With Limited-stage Small-cell Lung Cancer: The ADRIATIC Study. Clin. Lung Cancer, 21(2), e84–e88.
3. Ramalingam, S. S. (2017). Osimertinib Improves Progression-free Survival in Patients with EGFR Mutated Lung Cancer Presented at: ESMO Congress. Retrieved from http://www.esmo.org/meeting-calendar/ past-meetings/esmo-2017-congress/Press-Media/Press-Releases/osimertinib-improves-progression-free-survival-in-patients-with-egfr-mutated-lung-cancer.
Євгенія Лук’янчук














Leave a comment