ЕКСПРЕСІЯ ГЛІКОПРОТЕЇНУ PGP-170 ГЕМОПОЕТИЧНИМИ КЛІТИНАМИ ПЕРИФЕРИЧНОЇ КРОВІ ТА КІСТКОВОГО МОЗКУ У ХВОРИХ НА ХРОНІЧНУ МІЄЛОЇДНУ ЛЕЙКЕМІЮ З РІЗНОЮ ВІДПОВІДДЮ НА ТЕРАПІЮ ІНГІБІТОРАМИ ТИРОЗИНКІНАЗИ
Перехрестенко Т.П.1, Гордієнко А.І.1, Третяк Н.М.1, Дягіль І.С.2, Шороп Є.В.1
- 1ДУ «Інститут гематології та трансфузіології НАМН України», Київ
- 2ДУ «Національний науковий центр радіаційної медицини НАМН України», Київ
Резюме. Мета дослідження: визначити особливості експресії мембранного глікопротеїну Pgp-170 на CD33+-мієлоїдних клітинах та CD34+-гемопоетичних клітинах-попередниках периферичної крові та кісткового мозку у хворих на хронічну мієлоїдну лейкемію (ХМЛ) з різною відповіддю на терапію інгібіторами тирозинкінази (TKI). Обстежено 37 хворих на ХМЛ, які отримують лікування препаратами таргетної дії. У статті наведено результати досліджень, які свідчать, що у хворих на ХМЛ з резистентністю до терапії TKI в периферичній крові підвищувалася кількість CD33+-гемопоетичних клітин, які коекспресували білок Pgp-170 у порівнянні з пацієнтами з оптимальною відповіддю. Порівняльний аналіз у групах показав, що у хворих на ХМЛ з резистентністю до терапії в кістковому мозку та периферичній крові підвищувався вміст CD34+Pgp-170+ -гемопоетичних клітин. Висновки роботи: у пацієнтів з резистентністю до лікування TKI встановлено достовірне збільшення кількості CD33+, CD34+-клітин, що експресують трансмембранний глікопротеїн Pgp-170; у хворих на ХМЛ з резистентністю до терапії відзначено прямий кореляційний зв’язок між кількістю CD33+Pgp-170+ та Ph+-клітин кісткового мозку.
 Хронічна мієлоїдна лейкемія (ХМЛ) є поширеним видом гемобластозів, його частка серед всіх злоякісних захворювань крові становить близько 15–20%. ХМЛ за розповсюдженістю посідає 3-тє місце після гострих лейкемій та хронічної лімфоїдної лейкемії у країнах Європи та Північної Америки. Щорічна захворюваність на ХМЛ становить 1–1,5 на 100 000 населення у всіх країнах. Виникнення ХМЛ пов’язано з утворенням філадельфійської хромосоми (Ph-хромосоми) внаслідок реципрокної транслокації між хромосомами 9 та 22. Результатом такої аберації є утворення химерного гена BCR-ABL, який продукує білок з вираженою тирозинкіназною активністю, що обумовлює послідовність подій у клітинах, які призводять до збільшення клітинної проліферації та, як наслідок, розвитку ХМЛ.
Хронічна мієлоїдна лейкемія (ХМЛ) є поширеним видом гемобластозів, його частка серед всіх злоякісних захворювань крові становить близько 15–20%. ХМЛ за розповсюдженістю посідає 3-тє місце після гострих лейкемій та хронічної лімфоїдної лейкемії у країнах Європи та Північної Америки. Щорічна захворюваність на ХМЛ становить 1–1,5 на 100 000 населення у всіх країнах. Виникнення ХМЛ пов’язано з утворенням філадельфійської хромосоми (Ph-хромосоми) внаслідок реципрокної транслокації між хромосомами 9 та 22. Результатом такої аберації є утворення химерного гена BCR-ABL, який продукує білок з вираженою тирозинкіназною активністю, що обумовлює послідовність подій у клітинах, які призводять до збільшення клітинної проліферації та, як наслідок, розвитку ХМЛ.
Поява якісно нового класу препаратів — інгібіторів BCR-ABL-тирозинкінази відкрило новий етап у лікуванні ХМЛ. Іматиніб мезилат став першим препаратом, застосування якого дозволило відновити нормальний гемопоез та отримати повну цитогенетичну ремісію у 65–85% хворих [1, 2]. Більш того, у частини з них отримано велику та повну молекулярну відповіді, що дало можливість підвищити показники виживаності без прогресії до 93%. Однак, незважаючи на успіхи при лікуванні іматинібом хворих на ХМЛ, частина пацієнтів відповідає на терапію незадовільно. У дослідженнях the International Randomized Study of Interferon vs STI571 (IRIS) показано, що приблизно 30% пацієнтів у хронічній фазі захворювання, котрі отримували іматиніб в якості 1-ї лінії терапії, не досягли повної цитогенетичної відповіді (ПЦВ) протягом 1 року лікування. Крім того, приблизно у 10% хворих виникає рецидив у 5-річний період спостереження, включаючи 10% пацієнтів з ПЦВ [3, 4]. Поява інгібіторів тирозинкінази (TKI) 2-го покоління — нілотинібу та дазатинібу, які перевищують за ефективністю іматиніб та мають більш виражену активність проти мутантних форм BCR-ABL-кінази, — до кінця не вирішує проблеми резистентності до TKI. На сьогоднішній день провідними фахівцями усього світу проводяться дослідження з вивчення механізмів первинної та вторинної резистентності до іматинібу. Наразі вони до кінця не з’ясовані. Однією із значущих причин розвитку стійкості до терапії вважається мутація гена BCR-ABL, що призводить до неможливості здійснення повноцінних міжмолекулярних взаємодій іматинібу та ABL-кінази і, як наслідок, до втрати чутливості клітин, що експресують мутантні гени BCR-ABL, до препарату [5, 6]. Іншою причиною резистентності є клональна еволюція з активацією додаткових онкогенних механізмів. Треба звернути увагу на те, що лише 50% випадків ХМЛ з резистентністю пов’язані з цими порушеннями. Решта залежить від інших механізмів. У теперішній час приділяють велику увагу вивченню феномена множинної медикаментозної стійкості (ММС). У розвитку ММС особливу роль відіграють білки, що входять у родину АВС-транспортерів (ATP Binding Cassette transporters), функція яких полягає у зв’язуванні АТФ для транспортування різних молекул через клітинні мембрани. У цьому плані заслуговує уваги один із трансмембранних білків-транспортерів, а саме Pgp-170, гіперекспресія якого супроводжується активним зниженням внутрішньоклітинного накопичення лікарських препаратів [7]. Pgp-170 кодується геном MDR-1, що розташований на довгому плечі хромосоми 7 (7q21). Його функцією є енергозалежний транспорт (еффлюкс) за межі клітини та зменшення внутрішньоклітинної концентрації багатьох лікарських засобів. Даний білок вважається маркером ММС ряду солідних пухлин людини, його експресія в пухлинних клітинах корелює з поганим прогнозом та низькою чутливістю до хіміотерапії. Pgp-170 демонструє широку специфічність до речовин з різною структурою та відповідно визначає стійкість клітин до значної кількості лікарських засобів. Досліджувалась участь даного білка у виникненні стійкості до лікування при ряді злоякісних захворювань крові. Було показано, що пацієнти з ХМЛ в стадії бластної кризи, чиї клітини експресували Pgp-170, мали гірший прогноз у порівнянні з Pgp-негативними випадками. При дослідженні крові хворих у хронічній фазі, фазах акселерації та бластної кризи було продемонстровано, що перехід хронічної фази у прогресуючі супроводжується розвитком ММС, яка пов’язана з високим синтезом у клітинах білка Pgp-170 [8, 9]. Підвищена експресія Pgp на лейкемічних лімфоцитах при хронічному лімфолейкозі співпадає з медикаментозною стійкістю клітин до дексаметазону, вінкристину [10]. При гострій мієлоїдній лейкемії гіперекспресія Pgp-170, за даними різних авторів, спостерігається у 20–50% первинних хворих. Деякі дослідники вважають Pgp-170 незалежним фактором прогнозу у хворих з нормальним каріотипом, оскільки існуючі дані переконливо показують необхідність віднесення хворих з гіперекспресією Pgp-170 та нормальним каріотипом до групи несприятливого прогнозу [11, 12]. Таким чином, при пошуку специфічних засобів лікування та застосуванні їх для лікування пацієнтів із системною патологією крові, важливо відслідковувати концентрацію у клітинах білка Pgp-170 [13, 14].
Оскільки зниження концентрації лікарської речовини в малігнізованих клітинах є однією з головних причин резистентності до терапії, вивчення ролі Pgp-170 як транспортного білка, що безпосередньо відповідає за нейтралізацію й виведення препарату з пухлинних клітин, в механізмах формування резистентності до терапії TKI становить значний інтерес.
У зв’язку з вищезазначеним, метою дослідження було визначення особливостей експресії мембранного глікопротеїну Pgp-170 на CD33-мієлоїдних клітинах та CD34-гемопоетичних клітинах попередниках периферичної крові (ПК) та кісткового мозку (КМ) у хворих на ХМЛ з різною відповіддю на терапію TKI.
Матеріали і методи
Обстежено 37 хворих на ХМЛ, які отримували лікування TKI. Серед обстежених було 24 жінки та 13 чоловіків (рис. 1) віком від 19 до 71 року, середній вік становив 45,6±3,8 року.
Співвідношення жінок та чоловіків становило 1,85 : 1. Кількість хворих, молодших 60 років, становила 32 (86,5%), хворих літнього віку (старших 60 років) — 5 осіб (13,5%). Демографічні дані пацієнтів наведено в табл. 1.
Таблиця 1. Розподіл хворих на ХМЛ за статтю та віком
| Вік, роки | До 19 | 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | >70 | Всього n (%) |
|---|---|---|---|---|---|---|---|---|
| Стать | ||||||||
| Чоловіки, n | 1 | 1 | 7 | 2 | 0 | 1 | 1 | 13 (35) |
| Жінки, n | 0 | 5 | 3 | 4 | 9 | 3 | 0 | 24 (65) |
| Всього, n (%) | 1 (2,7) | 6 (16,2) | 10 (27,0) | 6 (16,2) | 9 (24,3) | 4 (10,8) | 1 (2,7) | 37 (100) |
Більшість пацієнтів перебували у хронічній фазі захворювання (7 — у ранній хронічній фазі, решта — у пізній хронічній фазі), 2 — у фазі акселерації.
На терапії іматинібом (TKI 1-го покоління) перебували 27 пацієнтів, нілотинібом (TKI 2-го покоління) — 10. Двоє пацієнтів приймали TKI 2-го покоління в якості 1-ї лінії терапії, інші — після невдач лікування іматинібом.
Пацієнти з субоптимальною відповіддю впродовж 12 міс лікування та неефективністю терапії TKI були віднесені до групи резистентних хворих.
Для встановлення та підтвердження діагнозу хворих на ХМЛ застосовувалися загальноклінічні методи: оцінювання розмірів селезінки, печінки; дослідження ПК із визначенням кількості лейкоцитів, тромбоцитів, еритроцитів, рівня гемоглобіну та підрахунком лейкоцитарної формули; дослідження КМ з визначенням каріотипу, процентного вмісту Ph-клітин, за необхідністю проведення FISH-аналізу; цитохімічні дослідження при підвищеному вмісті недиференційованих клітин; молекулярно-генетичний метод (якісний та кількісний) полімеразної ланцюгової реакції (ПЛР) для визначення типів BCR-ABL транскриптів та їх рівнів.
Кожні 6 міс хворі на ХМЛ проходили цитогенетичні та молекулярно-генетичні обстеження для проведення оцінки ефективності лікування препаратами TKI.
Критерієм цитогенетичної відповіді (ЦВ) була кількість залишкових Ph-позитивних клітин (згідно з рекомендаціями ELN — the European LeukemiaNet, 2010): ПЦВ — 0%, часткова цитогенетична відповідь (ЧЦВ) — 1–35%, велика ЦВ (повна+часткова) — 0–34%, мала ЦВ — 36–65%, мінімальна цитогенетична відповідь (МЦВ) — 66–95%, відсутність ЦВ — більше 95%.
Використовували критерії відповіді на терапію згідно з рекомендаціями ELN, 2010 (табл. 2).
Таблиця 2. Визначення рівня відповіді на терапію TKI
| Тривалість терапії TKI | Оптимальна відповідь | Субоптимальна відповідь | Відсутність відповіді |
|---|---|---|---|
| 3 місяці | Повна гематологічна відповідь, мінімум мала ЦВ | Немає ЦВ | Менше ніж повна гематологічна відповідь |
| 6 місяців | Мінімум ЧЦВ | Менше ніж ЧЦВ | Немає ЦВ |
| 12 місяців | ПЦВ | ЧЦВ | Менше ніж ЧЦВ |
| 18 місяців | Повна молекулярна відповідь | Менше ніж ПмолВ | Менше ніж ПЦВ |
Досягнення повної гематологічної відповіді підтверджували наступні критерії: лейкоцити нижче 10×10/л, тромбоцити нижче 450×10/л, відсутність незрілих гранулоцитів, менше ніж 5% базофілів у ПК, нормальні розміри селезінки.
У зразках КМ та ПК вивчали коекспресію білка Pgp-170 на CD33, CD34-гемопоетичних клітинах. Для цього клітини фарбували моноклональними антитілами (Becton Dickinson, USA) за методикою фірми-виробника. Цитофлуориметричні дослідження проводили на проточному лазерному цитометрі FACScan (Becton Dickinson, USA) з аргоновим лазером з довжиною хвилі 488 нм. Даний прилад дозволяє враховувати 5 параметрів для кожної клітини: 2 параметри світлорозсіювання — пряме світлорозсіювання (FSC), що відображає розмір клітини, і бічне світлорозсіювання (SSC), що характеризує внутрішньоклітинну структуру клітини, а також 3 параметри флуоресценції (у залежності від застосовуваних флуорохромів) [15].
Збір даних проточної цитометрії проводили за допомогою програмного забезпечення LYSYS-II Ver. 1.1 (Becton Dickinson). Для аналізу результатів використовували программу WinMDI 2.8 (Joseph Trotter, Scripps Institute, La Jolla, CA).
Статистичну обробку отриманих даних проводили за допомогою програм Microsoft Excel 2003 з пакету Microsoft Office 2003 та Statistica v. 6.0. Для кожного досліджуваного показника було визначено: його середнє значення, стандартне відхилення від середнього значення в межах однієї групи. Достовірність відмінностей значення даного показника визначали за t-критерієм Стьюдента для малих вибірок. Наявність кореляції між досліджуваними показниками оцінювали за допомогою непараметричного критерію Спірмана.
Результати та їх обговорення
Відповідь на терапію пацієнтів з ХМЛ оцінювали після 12 міс прийому TKI (табл. 3).
Таблиця 3. Характеристика пацієнтів за рівнем відповіді після 12 міс прийому TKI
| Загальна кількість хворих | Хворі, що лікуються TKI | |
|---|---|---|
| Оптимальна відповідь | Резистентні до терапії | |
| n=37 | n=18 | n=19 |
Як видно з табл. 3, 51,5% хворих віднесено до групи резистентних хворих, 48,5% — до групи пацієнтів з оптимальною відповіддю на лікування.
Проблема резистентності до патогенетичної терапії TKI у хворих на ХМЛ являє особливий інтерес. Це пов’язано з тим, що такий вид терапії безпосередньо впливає на зниження експресії транскрипту гена BCR-Abl, сприяючи у хворих на ХМЛ досягненню повної молекулярної відповіді. Однак, незважаючи на очікувану ефективність, у пацієнтів з ХМЛ не завжди вдається досягнути повної цитогенетичної та молекулярно-генетичної відповіді, у зв’язку з чим продовжується пошук причин, що призводять до неефективності терапії TKI. Зокрема, відомо, що ефективність протипухлинної терапії залежить від внутрішньоклітинної концентрації в пухлинних клітинах лікувальних препаратів. Так, їх зменшення може бути однією з причин резистентності до терапії.
Одним із перспективних підходів до вирішення даної проблеми є вивчення особливостей експресії пухлинними клітинами Pgp-170, який є продуктом ABCB1 (MDR1) гена. Гіперекспресія Pgp-170-пухлинними клітинами асоційована з резистентністю до терапії TKI за рахунок активного внутрішньоклітинного зниження концентрації медикаментозних препаратів.
У хворих на ХМЛ з оптимальною відповіддю і резистентностю до терапії TKI вивчали особливості експресії мембранного білка-транспортера Pgp-170 на CD33-мієлоїдних клітинах та CD34-гемопоетичних клітинах-попередниках КМ і ПК. Результати проведених досліджень узагальнено в табл. 4 у вигляді усереднених значень, отриманих на підставі визначення відсотка позитивних клітин, що експресували досліджувані маркери.
Таблиця 4. Коекспресія білка Pgp-170 на CD33-, CD34-гемопоетичних клітинах ПК і КМ хворих на ХМЛ з оптимальною відповіддю і резистентністю до терапії TKI (відсоток позитивних клітин, M±m)
| Імунофенотипові маркери | Хворі на ХМЛ з оптимальною відповіддю | Хворі на ХМЛ з резистентністю до терапії | ||
|---|---|---|---|---|
| ПК | КМ | ПК | КМ | |
| CD33- | 65,0±5,5 | 49,0±5,7 | 48,7±6,2 | 27,7±5,3 |
| CD33Pgp-170- | 2,7±0,5 | 2,9±0,6 | 20,6±4,9 | 3,9±1,5 |
| CD34- | 0,46±0,17 | 2,1±0,6 | 5,9±3,6 | 3,5±1,1 |
| CD34Pgp-170- | 0,55±0,20 | 0,69±0,20 | 2,0±0,8 | 1,8±0,7 |
Порівняльний аналіз між групами показав, що в ПК кількість CD33-позитивних клітин, які не експресували антиген Pgp-170, була статистично вірогідно вища у хворих на ХМЛ з оптимальною відповіддю (у 1,3 раза, p+Pgp-170-гемопоетичних клітин також була вірогідно вища (у 1,8 раза, p+ Pgp-170-гемопоетичних клітин імовірно перевищує аналогічне значення в КМ (у 1,3 раза, p+ Pgp-170–гемопоетичних клітин перевищує аналогічне значення в КМ (у 1,8 раза, p+ Pqp-170 — гемопоетичних клітин імовірно перевищує аналогічне значення в КМ (у 1,3 раза, р+ Pqp-170—гемопоетичних клітин перевищує аналогічне значення в КМ (у 1,8 раза, р
Водночас аналіз результатів по групах показав достовірне зростання в ПК хворих на ХМЛ з резистентністю до терапії TKI кількості CD33-мієлоїдних клітин, які коекспресують білок Pgp-170 (у 7,6 раза, p+Pgp-170-гемопоетичних клітин, однак показники не досягли статистичної значущості. З отриманих даних випливає, що в ПК хворих на ХМЛ із резистентністю до терапії спостерігається статистично достовірне (у 5,3 раза, p+Pgp-170-клітин у порівнянні з КМ на відміну від хворих з оптимальною відповіддю, в яких не виявлено достовірних розбіжностей за кількістю CD33-клітин, які коекспресують Pgp-170 у КМ і ПК.
Слід зазначити, що в ПК хворих на ХМЛ із резистентністю до терапії кількість CD34-гемопоетичних клітин-попередників з високим ступенем вірогідності перевищувала аналогічне значення у пацієнтів з оптимальною відповіддю (у 12,8 раза, p+-клітин ПК вірогідно перевищувала аналогічне значення в КМ (у 1,7 раза, p
Порівняльний аналіз між групами показав, що кількість у ПК CD34- клітин-попередників, коекспресуючих білок Pgp-170, у хворих на ХМЛ із резистентністю до терапії є статистично вірогідно вищою (у 3,6 раза, p+Pgp-170-клітин була також вірогідно вищою (у 2,6 рази, p+Pgp-170-гемопоетичних клітин у ПК і КМ.
Отже, результати досліджень свідчать, що у хворих на ХМЛ із резистентністю до терапії TKI в ПК збільшувалася кількість CD33-мієлоїдних клітин, які коекспресують білок Pgp-170, у порівнянні з пацієнтами з оптимальною відповіддю.
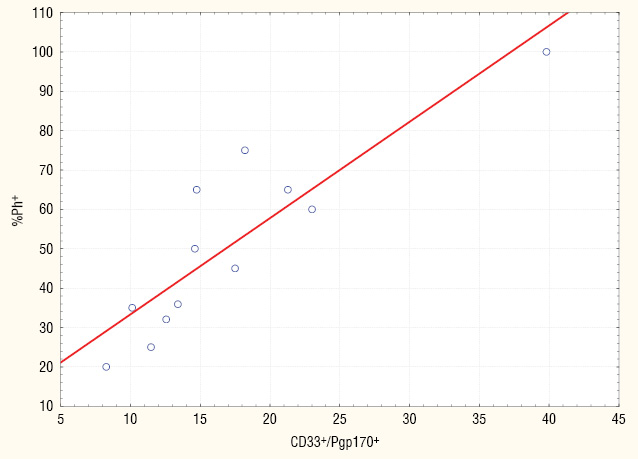
Проведений кореляційний аналіз (рис. 2) показав, що збільшення кількості гемопоетичних клітин в КМ, які експресують Pgp-170, пов’язане зі зростанням Ph-позитивних клітин (r=0,893, p
Таким чином, у групі хворих на ХМЛ, які були резистентними до терапії TKI, в ПК та КМ спостерігалося збільшення кількості CD33 та CD34-клітин, що коекспресують білок Pgp-170, у порівнянні з пацієнтами, у яких визначалась оптимальна відповідь. Порівняння одержаних результатів з клініко-гематологічними та цитогенетичними даними підтверджує участь Pgp-170 в формуванні резистентності до терапії TKI. Отримані результати узгоджуються з даними інших дослідників відносно значення Pgp-170 в розвитку резистентності до протипухлинної терапії у хворих на злоякісні захворювання крові, у тому числі ХМЛ [7, 9, 11, 12].
Висновки
1) У групі хворих на ХМЛ, у яких відзначалася резистентність до терапії TKI, встановлено достовірне збільшення кількості CD33-мієлоїдних клітин та CD34-гемопоетичних клітин-попередників, що експресують трансмембранний глікопротеїн Pgp-170.
2) Відзначався прямий кореляційний взаємозв’язок між кількістю CD33Pgp- 170 та Ph-клітин КМ.
Література
1. Druker B.J., Guilhot F., OBrien S.G. et al. (2006) Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N.Engl.J.Med., 355(11): 2408–2417.
2. Kantarjian H.M., Cortes J., Guilhot F. et al. (2007) Diagnosis and management of chronic myeloid leukemia: a survey of American and European practice patterns. Cancer, 109(7): 1365–1375.
3. Zhang W.W., Cortes J.E., Yao H. et al. (2009) Predictors of primary imatinib resistance in chronic myelogenous leukemia are distinct from those in secondary imatinib resistance. J Clin Oncol, 27(22): 3642–3649.
4. Jabbour E., Cortes J.E., Kantarjian H.M. et al. (2009) Suboptimal response to or failure of imatinib treatment for chronic myeloid leukemia: what is the optimal strategy? Mayo Clin Proc, 84(2): 161–169.
5. Дягиль И.С. (2009) Субоптимальный ответ при лечении иматинибом ХМЛ как критерий риска развития резистентности. Укр. журнал гематології та трансфузіології, 4(9): 27–29.
6. Hughes T., Hochhaus A. (2009) Clinical strategies to achieve an early and successful response to tyrosine kinase inhibitor therapy. Semin Hematol., 46(2 Suppl 3): 111–115.
7. Legrand O., Zompi S., Perrot J.Y. et al. (2004) P-glycoprotein and multidrug resistance associated protein-1 activity in 132 acute myeloid leukemias according to FAB subtypes and cytogenetics risk groups. Haematologica, 89(1): 34–41.
8. Schinkel A.H., Arceci R.J., Smit J.J. et al. (1993) Binding properties of monoclonal antibodies recognizing external epitopes of the human MDR1 P-glycoprotein. Int. J. Cancer, 55: 478–484.
9. Schrenk D., Baus P.R., Ermel N. et al. (2001) Up-regulation of transporters of the MRP family by drugs and toxins. Toxicol Lett, 120(1–3): 51–57.
10. Свирновский А.И., Сергиенко Т.Ф., Шман Т.В. и др. (2009) Влияние єкспрессии и функции транспортных белков множественной лекарственной устойчивости Р-гликопротеина и BCRP на лекарственную чувствительность in vitro при хроническом лимфоцитарном лейкозе. Гематология и трансфузиология, 1(54): 10–14
11. Damiani D., Tiribelli M., Calistri E. et al. (2006) The prognostic value of P-glycoprotein (ABCB) and breast cancer resistance protein (ABCG2) in adults with de novo acute myeloid leukemia with normal karyotype. Haematologica, 825(91): 8.
12. Захаров О.Д., Рыбалкина Е.Ю., Волкова М.А. и др. (2006) Маркеры множественной лекарственной устойчивости при острых лейкозах. Онкогематология, 1(1–2): 9–15.
13. Beck W.T., Grogan T.M., Willman C.L. et al. (1996) Methods to detect P-glycoprotein-associated multidrug resistance in patients’ tumors: consensus recommendations. Cancer Research, 56: 3010–3020.
14. Borst P., Evers R., Kool M. et al. (2000) A family of drug transporters: the multidrug resistance-associated proteins. J Natl Cancer Inst., 92(16): 1295–1302.
15. Пожарисский К.М., Леенман Е.Е. (2000) Значение иммунологических методик для определения характера лечения и прогноза опухолевых заболеваний. Арх. Патологии, (5): 3–11.
Экспрессия гликопротеина Pgp-170 гемопоэтическими клетками периферической крови и костного мозга у больных хронической миелоидной лейкемией с различным ответом на терапию ингибиторами тирозинкиназы
ГУ «Институт гематологии и трансфузиологии НАМН Украины», Киев
ГУ «Национальный Научный центр радиационной медицины НАМН Украины», Киев
Резюме. Цель исследования — определить особенности экспрессии мембранного гликопротеина Pgp-170 на CD33+-миелоидных клетках и CD34+-гемопоэтических клетках-предшественниках периферической крови и костного мозга у больных хроническим миелолейкозом (ХМЛ) с различным ответом на терапию ингибиторами тирозинкиназы (TKI). Обследовано 37 пациентов, лечившихся препаратами таргетного действия. В статье приведены результаты исследований, свидетельствующие, что у больных ХМЛ с резистентностью к терапии TKI в периферической крови повышалось количество CD33+-гемопоэтических клеток, коэкспрессирующих белок Pgp-170, по сравнению с пациентами с оптимальным ответом. Сравнительный анализ в группах показал, что у больных ХМЛ с резистентностью к терапии в костном мозге и периферической крови повышалось содержание CD34+Pgp-170+-гемопоэтических клеток. Выводы работы: у пациентов с резистентностью к лечению TKI установлено достоверное увеличение количества CD33+, CD34+-клеток, несущих трансмембранный гликопротеин Pgp-170; у больных ХМЛ с устойчивостью к терапии отмечалась прямая корреляционная связь между количеством CD33+Pgp-170+ и Ph+-клеток костного мозга.
хроническая миелоидная лейкемия, ингибиторы тирозинкиназы, медикаментозная резистентность, гликопротеин Pgp-170, CD33+, CD34+-гемопоэтические клетки.














Leave a comment