Вплив терапії множинної мієломи на відновлення функціонального стану нирок
Савуляк Г.Р.1, Максимець Т.А.2
- 1Державна установа «Інститут патології крові та трансфузійної медицини НАМН України», Львів, Україна
- 2Державне некомерційне підприємство «Львівський національний медичний університет ім. Данила Галицького», Львів, Україна
Резюме. Мета. Дослідити функціональний стан нирок у пацієнтів із вперше діагностованою множинною мієломою (ММ) та порівняти з хворими, які отримали лікування. Об’єкт та методи дослідження. Дослідження охоплювало 95 пацієнтів з ММ, розподілених на 2 групи: 27 осіб із вперше діагностованою ММ (1-ша група) та 68 хворих, які отримали лікування (2-га група). Проводили загальноклінічні та лабораторні дослідження, зокрема на рівень ліпокалін, асоційований з желатиназою нейтрофілів (neutrophil gelatinase-associated lipocalin — NGAL) та фактор росту фібробластів-23 (FGF-23) у сироватці крові методом імуноферментного аналізу (ІФА). ШКФ розраховували за формулою Співробітництва з епідеміології хронічних захворювань нирок (Chronic Kidney Disease Epidemiology Collaboration — CKD-EPI) згідно з рекомендаціями «Хвороби нирок: поліпшення глобальних результатів» (Kidney Disease: Improving Global Outcomes — KDIGO), 2024 р. Для статистичної обробки даних використовували t-тест Стьюдента, U-тест Манна — Уїтні та точний критерій Фішера. Результати. У пацієнтів, які отримали лікування (2-га група), зафіксовано значне зниження пухлинного навантаження, що підтверджується достовірно нижчими рівнями М-протеїну та β₂-мікроглобуліну. Це сприяло ефективній корекції анемічного синдрому та зменшенню вираженості системного запалення. Стосовно функціонального стану нирок, у цій групі відмічалося достовірне зниження сироваткового креатиніну (p=0,0191) та прискорення швидкості клубочкової фільтрації (ШКФ) (p=0,0261). Особливо важливим є виявлене достовірне зниження сироваткової концентрації ліпокаліну, асоційованого із NGAL (p=0,0025), у пацієнтів після лікування (178,33 пг/мл) порівняно з особами із вперше діагностованою ММ (197,72 пг/мл). Це свідчить про відновлення не лише клубочкової, а й канальцевої функції нирок. Щодо FGF-23, то була помітна тенденція до його зниження в групі після лікування, хоча не було досягнуто статистичної значущості. Висновки. Сучасна протимієломна терапія ефективно знижує пухлинне навантаження та сприяє відновленню функції нирок. Зниження рівня NGAL підтверджує, що терапевтичний ефект поширюється не лише на клубочковий апарат, а й на відновлення функції ниркових канальців. Використання NGAL поєднано з традиційними маркерами дозволяє отримати повнішу картину стану нирок при ММ.
Одержано 8.08.2025
Підписано до друку 21.08.2025
DOI: 10.32471/clinicaloncology.2663-466X.34821
ВСТУП
ММ є злоякісним плазмоклітинним захворюванням, що характеризується проліферацією аномальних плазматичних клітин у кістковому мозку та виробленням моноклонального білка [1].
Ниркова дисфункція (НД) є одним із найпоширеніших та клінічно значущих ускладнень / проявів ММ, що виникає у близько 20–50% пацієнтів на момент діагностики ММ, а в деяких випадках може бути першим клінічним проявом захворювання [2]. Наявність НД значно погіршує прогноз захворювання, підвищує ризик розвитку інфекційних ускладнень, серцево-судинних подій та смертності, а також є одним з найважливіших предикторів виживаності [3, 4].
Протягом останнього десятиліття відбулися значні успіхи в лікуванні ММ, пов’язані з впровадженням нових класів препаратів, таких як імуномодулювальні препарати, інгібітори протеасом, моноклональні антитіла та біспецифічні антитіла [5–8]. Ці терапевтичні стратегії дозволили значно підвищити показники відповіді на лікування, тривалості виживаності без прогресування та загальної виживаності у пацієнтів з ММ. Однак, незважаючи на ці досягнення, питання впливу сучасної протимієломної терапії на відновлення функціонального стану нирок залишається предметом активних досліджень та дискусій.
Традиційні маркери ниркової функції, такі як рівень креатиніну в сироватці крові та швидкість клубочкової фільтрації (ШКФ), є надійними показниками, але вони відображають переважно стан клубочкового апарату нирок [9]. При ММ основним механізмом ураження нирок, що призводить до гострого ниркового пошкодження та хронічної хвороби нирок (ХХН), є так звана мієломна нирка, або каст-нефропатія, яка характеризується відкладенням моноклональних легких ланцюгів у просвіті ниркових канальців, що призводить до їх обструкції, запалення та тубулоінтерстиціального ураження [10, 11].
Так, ШКФ, що є показником клубочкової фільтрації, може не повною мірою відображати ступінь тубулярного ураження, що є критичним при ММ [12].
У цьому контексті біомаркер раннього ураження ниркових канальців, такий як ліпокалін, асоційований з желатиназою нейтрофілів (NGAL), набуває все більшого значення [13, 14].
NGAL є білком гострої фази, що експресується та секретується нирковими тубулярними клітинами у відповідь на ішемічне або токсичне пошкодження [15, 16]. Його рівень швидко зростає в плазмі крові та сечі вже через 2–4 год після ураження, значно раніше, ніж зміни рівня креатиніну, що робить його надзвичайно чутливим індикатором ураження нирок та предиктором прогресування НД [17, 18].
Тому визначення рівня NGAL може надати цінну інформацію про відновлення тубулярної функції та ефективність лікування при ММ.
МЕТА ДОСЛІДЖЕННЯ
Дослідити функціональний стан нирок у пацієнтів із вперше діагностованою ММ та порівняти з хворими, які отримали лікування.
МАТЕРІАЛИ ТА МЕТОДИ дослідження
Дослідження проведено відповідно до Гельсінської декларації, Конвенції про захист прав людини та біомедицини, законодавства України та схвалено Етичним комітетом наукових досліджень Львівського національного медичного університету ім. Данила Галицького: протокол від 23 січня 2023 р. № 1. Усі пацієнти підписали форму інформованої згоди перед початком дослідження.
У дослідження залучено 95 пацієнтів з ММ, які перебували на лікуванні в ДУ «Інститут патології крові та трансфузійної медицини НАМН України». Хворих розподілили на 2 групи: 1-ша група — пацієнти із вперше діагностованою ММ (n=27) та 2-га група — хворі, які отримали лікування ММ з досягненням часткової чи повної відповіді (n=68).
Усім пацієнтам проводили ретельний збір анамнезу захворювання та життя, загально-клінічні обстеження та лабораторні дослідження: загальний аналіз крові, біохімічний аналіз крові, електрофорез білків крові, визначали співвідношення альбумін / креатинін (САК) в сечі. Гематологічне і біохімічне дослідження крові та коагулограми проводили загальноприйнятими методами.
Рівень NGAL та FGF-23 у сироватці крові визначали методом імуноферментного аналізу (ІФА) з використанням комерційного набору реагентів Human Lipocalin-2 та Human FGF-23 ELISA Kit виробництва FineTest® (Китай). Референтні показники для сироватки крові здорових осіб становили NGAL: 29–184 нг/мл; FGF-23: 0–25 пг/мл.
Для оцінки функціонального стану нирок розраховували ШКФ за допомогою онлайн-калькулятора, використовуючи формулу CKD-EPI (формула модифікована у 2021 р.), згідно з рекомендаціями KDIGO 2024 р. [19].
Статистичну обробку даних здійснювали з використанням мови програмування R (версія 4.5.1) та середовища RStudio. Для перевірки нормальності розподілу кількісних показників використовували критерій Шапіро — Вілка. Величини з нормальним розподілом представлені як середнє арифметичне ± стандартне відхилення (M ± SD), а величини, розподіл яких суттєво відрізнявся від нормального, — як медіана та інтерквартильний розмах (25%; 75% перцентилі). Якісні показники представлені у вигляді абсолютних показників та відсотків (%), для яких розраховували 95% довірчі інтервали (ДІ) за точним методом Клопера — Пірсона.
Для порівняння 2 незалежних груп за кількісними показниками використовували t-тест Стьюдента (для нормального розподілу) або U-тест Манна — Уїтні (для ненормального розподілу). Порівняння груп за якісними показниками проводили за допомогою точного критерію Фішера. Рівень достовірності приймали при р <0,05.
РЕЗУЛЬТАТИ
Загалом обстежено 95 пацієнтів віком 57,2 (48,0; 66,4) року. Під час аналізу ми брали до уваги гематологічні показники та маркери НД.
Як представлено в табл. 1, у хворих, які отримали лікування згідно з протоколом, з досягненням часткової чи повної відповіді достовірно нижча частота виявлення таких симптомів, як біль у кістках, зменшення маси тіла, задишка і загальна слабкість. Проте відмічаємо достовірно вищу частоту нейропатії та інфекцій, що є побічними діями препаратів, які входять до схеми лікування. Найчастіше нейропатія є наслідком застосування бортезомібу у схемі лікування ММ, а інфекції, зокрема активація Herpes Zoster, — наслідок імуносупресивного впливу хімієпрепаратів.
| Прояви | Група 1, n=27 | Група 2, n=68 | p |
| Біль у кістках | 92,6% (75,7–99,1) | 64,7% (52,2–75,9) | 0,0052 |
| Втрата ваги | 29,6% (13,8–50,2) | 2,9% (0,4–10,2) | 0,0005 |
| Задишка | 63,0% (42,4–80,6) | 26,5% (16,5–38,6) | 0,0018 |
| Слабкість | 96,3% (81,0–99,9) | 51,5% (39,0–63,8) | <0,0001 |
| Нейропатія | 11,1% (2,4–29,2) | 51,5% (39,0–63,8) | 0,0004 |
| Інфекції | 7,4% (0,9–24,3) | 48,5% (36,2–61,0) | 0,0001 |
| Діарея | 11,1% (2,4–29,2) | 30,9% (20,2–43,3) | NS |
| Закреп | 14,8% (4,2–33,7) | 13,2% (6,2–23,6) | NS |
| Диспепсія | 40,7% (22,4–61,2) | 55,9% (43,3–67,9) | NS |
Примітка: NS — no significant (недостовірно, р >0,05).
Далі проводили порівняння лабораторних показників (табл. 2). У пацієнтів після лікування у гемограмі фіксували підвищення рівня гемоглобіну та еритроцитів, зниження швидкості осідання еритроцитів (ШОЕ), кількість лейкоцитів та тромбоцитів достовірно не відрізнялась. Це свідчить про успішну корекцію анемії, яка є частим ускладненням мієломи, та зниження запальної активності. Достовірно вища сатурація кисню в крові у 2-й групі, ймовірно, є результатом підвищення рівня гемоглобіну.
| Показник | Група 1, n=27 | Група 2, n=68 | p |
| SpO2 | 95,89 (93,86; 97,92)1 | 98,00 (96,00; 99,00)2 | 0,0079 |
| Лейкоцити, 109/л | 5,45 (3,0; 7,9)1 | 4,52 (3,44; 5,83)2 | NS |
| Еритроцити, 1012/л | 3,43 (2,81; 4,05)1 | 3,85 (3,18; 4,52)1 | 0,0053 |
| Гемоглобін, г/л | 107,85 (88,1; 127,59)1 | 127,00 (116,75; 134,00)2 | 0,0002 |
| Тромбоцити, 109/л | 213,00 (139,50; 242,50)2 | 201,00 (148,25; 241,50)2 | NS |
| ШОЕ | 45,00 (21,53; 68,47)1 | 21,00 (9,75; 35,00)2 | 0,0002 |
| Загальний білок, г/л | 87,00 (75,50; 107,50)2 | 76,50 (73,50; 82,00)2 | 0,0023 |
| Кальцій, ммоль/л | 2,38 (2,11; 2,65)1 | 2,35 (2,25; 2,44)2 | NS |
| Сечова кислота, мкмоль/л | 317,52 (196,8; 438,24)1 | 268,21 (280,68; 355,74)1 | NS |
| Сечовина, ммоль/л | 6,70 (4,72; 7,80)2 | 5,35 (4,00; 6,90)2 | NS |
| Креатинін, мкмоль/л | 90,70 (80,50; 122,95)2 | 74,16 (57,51; 93,65)2 | 0,0191 |
| ШКФ | 68,78 (43,52; 94,04)1 | 89,00 (63,50; 102,00)1 | 0,0261 |
| Альбумін, г/л | 41,30 (37,90; 43,45)2 | 42,70 (42,05; 43,80)2 | 0,0016 |
| М-протеїн, г/л | 14,40 (5,30; 42,85)2 | 0,00 (0,00; 0,56)2 | <0,0001 |
| β-мікроглобулін, мг/л | 3,98 (1,99; 5,97)1 | 2,43 (2,12; 3,19)1 | 0,0151 |
| Альбумін у сечі, мг/л | 30,00 (10,00; 30,00)2 | 10,00 (10,00; 30,00)2 | NS |
| Креатинін у сечі, ммоль/л | 8,80 (2,20; 8,80)2 | 8,80 (2,20; 17,70)2 | 0,0194 |
| САК, мг/ммоль | 34,10 (11,40; 136,20)2 | 30,10 (5,60; 45,40)2 | 0,0267 |
Примітки: 1Величини з нормальним розподілом, M (М−CI; М+СІ).
2Величини, розподіл яких суттєво відрізнявся від нормального, Me (25%; 75%). NS — no significant (недостовірно, р >0,05).
Достовірно нижчий рівень ключового маркера ММ, М-протеїну та β₂-мікроглобуліну, вміст якого корелює з пухлинною масою, свідчить про успішне пригнічення пухлинних клітин. Завдяки зниженню М-протеїну у 2-й групі рівень загального білка є нижчим, тоді як вміст альбуміну є достовірно вищим.
Стосовно показників, що відображають ниркову функцію, то сироваткова концентрація креатиніну достовірно нижча у 2-й групі порівняно з 1-ю групою, що, своєю чергою, зумовлює вищу ШКФ. Хоча медіана САК незначно відрізняється, статистично значуща різниця та вужчий діапазон показників у 2-й групі вказують на стабілізацію та зменшення вираженості ураження нирок.
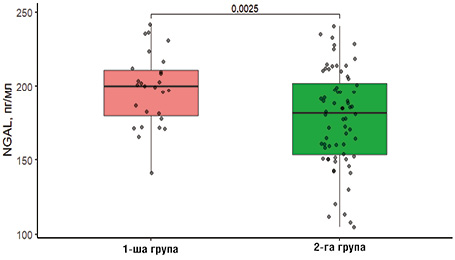
Окрім традиційних показників для оцінки функції нирок, проводили визначення рівня NGAL, який вважається одним з найбільш чутливих та ранніх індикаторів ураження нирок. Крім того, його рівень може відображати загальне пухлинне навантаження та активність хвороби. Тож, провівши порівняння між досліджуваними групами, ми виявили, що у хворих 1-ї групи він становив 197,72 (173,23; 221,21) пг/мл, тоді як у пацієнтів 2-ї групи — 178,33 (145,71; 210,95) пг/мл, p=0,0025 (рис. 1).
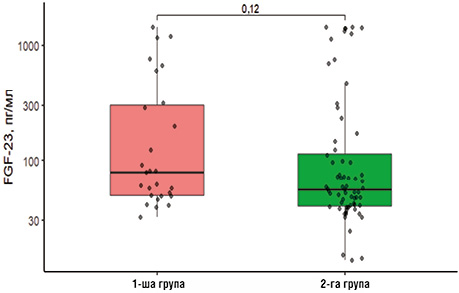
Ще одним маркером активності, прогресування та прогнозування відповіді на лікування та індикатором ураження нирок при ММ є FGF-23. Незважаючи на відсутність достовірної різниці (p=0,12) між концентрацією FGF-23 у групах, ми виявили очевидну тенденцію: рівень FGF-23 у 1-й групі становив 79,69 (49,18; 301,95) пг/мл і зафіксований у діапазоні від 2 до 10 ВМН (верхня межа норми) для цього показника, тоді як у пацієнтів, які отримали лікування, — 55,89 (40,25; 114,20) пг/мл і встановлений у діапазоні 1,5–2,5 ВМН (рис. 2).
Лабораторні дані чітко свідчать про ефективність проведеного лікування у пацієнтів з 2-ї групи. Відмічається значне зменшення пухлинної маси (зниження М-протеїну та β₂-мікроглобуліну), корекція анемії, зменшення вираженості системного запалення та, що дуже важливо, покращення й відновлення функції нирок.
ОБГОВОРЕННЯ
Отримані нами дані свідчать, що сучасна протимієломна терапія ефективно коригує пухлинне навантаження, що підтверджується зниженням рівнів М-протеїну й β₂-мікроглобуліну та сприяє значному поліпшенню ниркової функції. Ключовим результатом є не лише підвищення розрахункової ШКФ, а й достовірне зниження сироваткового рівня NGAL у пацієнтів після лікування. Отже, терапевтичний ефект поширюється не тільки на клубочковий апарат, але й на відновлення функції ниркових канальців, що є патогенетичною основою мієломної нефропатії.
Наші результати узгоджуються з дослідженням A. Gaspari та співавт. (2020), в яких зазначено, що швидке зниження концентрації вільних легких ланцюгів на тлі терапії інгібіторами протеасом є ключовим фактором ренального відновлення [20]. Важливо, що наше дослідження доповнює ці дані, використовуючи NGAL як чутливий індикатор саме тубулярного здоров’я. Робота Y. He та співавт. (2021) також підтвердила, що рівень NGAL є динамічним біомаркером, що корелює зі ступенем ниркового пошкодження при ММ і знижується у відповідь на ефективне лікування, випереджаючи зміни креатиніну [21].
Цікавою є тенденція до зниження FGF-23, хоча вона і не досягла статистичної значущості. Це може бути пов’язано з багатофакторним впливом на його метаболізм, що не обмежується лише нирковою функцією. Дослідження S. Lipari та співавт. (2022) вказують на складний зв’язок FGF-23 з кістковим метаболізмом та запаленням при ММ, що може пояснювати менш чітку динаміку порівняно з NGAL [22].
Так, застосування NGAL поєднано з традиційними маркерами дозволяє отримати більш повну картину відновлення нирок, підкреслюючи важливість моніторингу тубулярної функції у пацієнтів з ММ.
ВИСНОВКИ
1. Сучасна протимієломна терапія призводить до ефективної гематологічної відповіді у хворих на ММ, що підтверджується достовірним зниженням пухлинних маркерів (М-протеїну, β₂-мікроглобуліну) та супроводжується корекцією анемічного синдрому.
2. Успішне лікування ММ асоціюється зі значним покращенням функціонального стану нирок, що відображається у статистично значущому зниженні сироваткового креатиніну та підвищенні розрахункової ШКФ у пацієнтів, які досягли терапевтичної відповіді.
3. NGAL є чутливим індикатором тубулярного ураження при ММ. Його сироваткова концентрація є достовірно нижчою — 178,33(145,71;210,95) пг/мл проти 197,72 (173,23; 221,21) пг/мл (p=0,0025) у пацієнтів після проведеного лікування, що свідчить про відновлення не лише клубочкової, а й канальцевої функції нирок.
4. Зафіксовано тенденцію до зниження рівня FGF-23 у групі пацієнтів після лікування, однак різниця не досягла статистичної значущості (p=0,12). Це може вказувати на більш складні механізми регуляції FGF-23 при ММ, що потребує подальшого вивчення.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Albagoush, S. A., Shumway, C., & Azevedo, A. M. (2023). Multiple Myeloma. In StatPearls. StatPearls Publishing.
2. Dimopoulos, M. A., Terpos, E., Chanan-Khan, A., Leung, N., Ludwig, H., Jagannath, S., … San Miguel, J. (2010). Renal impairment in patients with multiple myeloma: a consensus statement on behalf of the International Myeloma Working Group. Journal of Clinical Oncology, 28(33), 4976–4984. doi.org/10.1200/JCO.2010.30.8791.
3. Yadav, P., Cook, M., & Cockwell, P. (2016). Current Trends of Renal Impairment in Multiple Myeloma. Kidney Diseases (Basel), 1(4), 241–257. doi.org/10.1159/000442511.
4. Zhang, Y., Pan, J., Kang, H., Peng, S., Tung, T. H., & Shen, B. (2024). Prognosis of concurrent renal impairment at diagnosis of multiple myeloma: a systematic review. Annals of Medicine, 56(1), 2380301. doi.org/10.1080/07853890.2024.2380301.
5. Rajkumar, S. V. (2020). Multiple myeloma: 2020 update on diagnosis, risk-stratification and management. American Journal of Hematology, 95(5), 548–567. doi.org/10.1002/ajh.25791.
6. Dimopoulos, M., Quach, H., Mateos, M. V., Landgren, O., Leleu, X., Siegel, D., … Usmani, S. Z. (2020). Carfilzomib, dexamethasone, and daratumumab versus carfilzomib and dexamethasone for patients with relapsed or refractory multiple myeloma (CANDOR): results from a randomised, multicentre, open-label, phase 3 study. The Lancet, 396(10245), 186–197. doi.org/10.1016/S0140-6736(20)30734-0.
7. Gay, F., Mina, R., & Maisnar, V. (2021). Carfilzomib with or without dexamethasone for newly diagnosed multiple myeloma: a phase 2 study. The Lancet Oncology, 22(8), 1076–1087.
8. Mateos, M. V., Ailawadhi, S., Costa, L. J., Beksac, M., Cavo, M., Dytfeld, D., … Gay, F. (2023). Global disparities in patients with multiple myeloma: a rapid evidence assessment. Blood Cancer Journal, 13, 109. doi.org/10.1038/s41408-023-00877-9.
9. Stevens, L. A., & Levey, A. S. (2009). Measured GFR as a confirmatory test for estimated GFR. Journal of the American Society of Nephrology, 20(11), 2305–2313. doi.org/10.1681/ASN.2009020171.
10. Leung, N., & Rajkumar, S. V. (2023). Multiple myeloma with acute light chain cast nephropathy. Blood Cancer Journal, 13(1), 46. doi.org/10.1038/s41408-023-00806-w.
11. Rüsing, L. Z., Kozakowski, N., Jeryczynski, G., Vospernik, L., Riedl, J., Reiter, T., … Krauth, M. T. (2024). Renal outcome in multiple myeloma patients with cast nephropathy: a retrospective analysis of potential predictive values on clinical and renal outcome. Hematology, 29(1), 2311600. doi.org/10.1080/16078454.2024.2311600.
12. Levey, A. S., Stevens, L. A., Schmid, C. H., Zhang, Y. L., Castro, A. F., 3rd, Feldman, H. I., & Coresh, J. (2009). A new equation to estimate glomerular filtration rate. Annals of Internal Medicine, 150(9), 604–612. doi.org/10.7326/0003-4819-150-9-200905050-00006.
13. Woziwodzka, K., Vesole, D. H., Małyszko, J., Batko, K., Jurczyszyn, A., Koc-Żórawska, E., … Krzanowska, K. (2020). New Markers of Renal Failure in Multiple Myeloma and Monoclonal Gammopathies. Journal of Clinical Medicine, 9(6), 1652. doi.org/10.3390/jcm9061652.
14. Woziwodzka, K., Małyszko, J., Koc-Żórawska, E., Żórawski, M., Dumnicka, P., Jurczyszyn, A., … Krzanowska, K. (2021). Renal Impairment Detectors: IGFBP-7 and NGAL as Tubular Injury Markers in Multiple Myeloma Patients. Medicina (Kaunas), 57(12), 1348. doi.org/10.3390/medicina57121348.
15. Ostermann, M., Legrand, M., Meersch, M., Prowle, J., Siew, E., Zarbock, A., … Schetz, M. (2024). Biomarkers in acute kidney injury. Annals of Intensive Care, 14, 145. doi.org/10.1186/s13613-024-01360-9.
16. Patel, M. L., Shyam, R., Chaudhary, A., Sachan, R., & Ali, W. (2023). Urinary Neutrophil Gelatinase-associated Lipocalin as a Diagnostic and Prognostic Marker for Acute Kidney Injury in Hospitalized Cirrhotic Patients: A Study from North Indian Population. Indian Journal of Critical Care Medicine, 27(8), 545–551. doi.org/10.5005/jp-journals-10071-24497.
17. Xu, S. Q., Wang, H. W., & Wang, X. (2018). Diagnostic and prognostic value of urinary NGAL in acute kidney injury: a meta-analysis. Journal of Nephrology, 31(5), 683–693.
18. Ghodrati, S., Mirrajei, S. M., Parsamanesh, N., Kamali, K., Esmaeilzadeh, A., & Pezeshgi, A. (2023). Study of plasma neutrophil gelatinase-associated lipocalin as an early marker of acute kidney injury following contrast agents. Journal of Renal Injury Prevention, 12(3), e32110. doi.org/10.34172/jrip.2023.32110.
19. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. (2024). KDIGO 2024 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney International, 105(4), S117–S314. doi.org/10.1016/j.kint.2023.10.018.
20. Gaspari, A., Cosmai, L., & Gallieni, M. (2020). Renal recovery in multiple myeloma: an update on the role of novel therapies. Journal of Nephrology, 33(2), 253–262.
21. He, Y., Liu, W., Chen, Y., & Zhang, B. (2021). Neutrophil Gelatinase-Associated Lipocalin (NGAL) as a Biomarker for Early Prediction of Acute Kidney Injury in Patients with Multiple Myeloma. Medical Science Monitor, 27, e931234.
22. Lipari, S., Bergesio, F., & Anghilieri, M. (2022). The Complex Role of FGF23 in Multiple Myeloma: Beyond Mineral Metabolism. International Journal of Molecular Sciences, 23(15), 8564.
Адреса для листування:
Савуляк Галина
79044, м. Львів, вул. Генерала Чупринки, 45
ДУ «Інститут патології крові та трансфузійної медицини НАМН України»
E-mail: savulyak97@gmail.com
Correspondence:
Galyna Savulyak
45, Gen. Chuprynka str., Lviv, 79044
SI «Institute of Blood Pathology and Transfusion Medicine NAMS of Ukraine»
E-mail: savulyak97@gmail.com














Leave a comment