Зміни CD8+ та IL-8 в пухлинній тканині у пацієнтів з хімієрезистентним місцево-поширеним раком молочної залози на фоні проведення терапії ліпосомальним пегільованим доксорубіцином у різних модифікаціях
Мовчан О.В.1, Ляшенко А.О. 1, Щербіна О.В.2
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Національний університет охорони здоров’я України ім. П.Л. Шупика, Київ, Україна
Резюме. За останні 5 років до 2024 р. рак молочної залози (РМЗ) діагностовано у 7,8 млн жінок, що робить його найпоширенішим видом онкопатології у світі. Асоційовані з пухлиною лімфоцити, наприклад CD8+, можуть експресувати прозлоякісні медіатори, такі як інтерлейкін (IL)-8, а цей запальний цитокін додатково спричиняє експресію факторів підтримки РМЗ, що може призводити до розвитку нечутливості пухлинних клітин до хімієтерапії. У роботу залучено 30 пацієнтів із хімієрезистентним місцево-поширеним (МП) РМЗ IIB–IIIB стадій, люмінальний субтип Б. Для всіх хворих визначали CD8+ та IL-8 в пухлинній тканині. Пацієнтів розподілено на 2 групи: І група (15 хворих) — проводилися введення ліпосомального пегільованого доксорубіцину (ЛПД) та локальна магнітотермія на локус пухлини молочної залози 1 раз на 4 тиж, всього 4 курси; ІІ група (15 осіб) — проводилася терапія ЛПД 1 раз на 4 тиж, всього 4 курси. У І групі — рівень CD8+ підвищився у 2,48 раза в пухлині після проведеної терапії ЛПД на тлі локальної помірної магнітотермії та був достовірно (р ≤0,05) вищим порівняно з цими ж показниками до проведення терапії; показники IL-8 знизилися майже вдвічі, але показник IL-8 статистично достовірно (р <0,05) залишався в 1,21 раза більше порівняно із нормою; у ІІ групі — рівень CD8+ підвищився у 2,37 раза в пухлині після проведеної терапії, показники IL-8 знизилися в 1,31 раза, що є нижчим на 29,41%, ніж у першій групі. Використання ліпосомальних пегільованих форм хімієпрепаратів для лікування раку є новим та дуже перспективним підходом. Найбільш значущі зміни в пухлинній тканині хворих при МП РМЗ за визначеної хімієрезистентності виявлено в показниках IL-8, що були вищими від показників норми в середньому у 2 рази, CD8+ — нижчими від показників норми більше ніж у 2 рази. Після проведення терапії на основі ліпосомальних пегільованих форм доксорубіцину відзначено підвищення рівня CD8+ в пухлинному ложі, що було більш виражене в першій групі та вказує на позитивне прогностичне значення для зниження ризику рецидиву й можливого подолання нечутливості до лікування при РМЗ.
Одержано 3.09.2025
Прийнято до друку 15.09.2025
DOI: 10.32471/clinicaloncology.2663-466X.34904
ВСТУП
РМЗ посідає 1-ше місце у структурі онкопатології у жінок і є основною причиною смерті пацієнток працездатного віку 36–60 років. Станом на кінець 2023 р. за останні 5 років РМЗ діагностовано у 7,8 млн жінок, що робить його найпоширенішим видом онкопатології у світі, за даними Всесвітньої організації охорони здоров’я [1].
Однак завдяки популяційному мамографічному скринінгу та оптимальному лікуванню можна знизити поточну смертність від РМЗ на 25–31% серед жінок, запрошених на скринінг, і на 38–48% серед пацієнток, які фактично пройшли обстеження [2].
Сукупні дані досліджень свідчать, що первинна хімієрезистентність проявляється в близько 30–35% всіх підтверджених випадків РМЗ [3]. Компоненти, наявні в мікрооточенні тумора, стимулюють розвинення МП форми РМЗ, що в подальшому може призводити до нечутливості до стандартних схем поліхімієтерапії та, як наслідок, виникнення ранніх рецидивів та прогресування хвороби після проведеного комбінованого або комплексного лікування [4]. Асоційовані з пухлиною лімфоцити, наприклад CD8+, можуть експресувати прозлоякісні медіатори, такі як IL-8, а цей запальний цитокін додатково спричиняє експресію факторів підтримки пухлини [5]. Підвищена експресія IL-8 пухлинними клітинами викликає додаткове залучення моноцитів [6] і стимуляцію асоційованих з пухлиною лімфоцитів у місці пухлини, а їхня стимуляція може призвести до підвищення рівня експресії прозлоякісних факторів, таких як цитокіни [7] — тобто утворюється замкнуте коло в розвитку та підвищеної інвазивності при РМЗ [8].
IL-8 змінює особливості самих пухлинних клітин через перехід до мезенхімального фенотипу у стан мігрувальних клітин або шляхом сприяння проліферації ракових клітин [9].
Спрямування на передачу сигналів IL-8 безперечне, оскільки зниження передачі сигналів хемокінів може впливати на прогресування захворювання та модулювати відповідь на терапію. Нейтралізувальні антитіла до рецепторів IL-8 та інгібування рецептора IL-8 мають здатність пригнічувати ангіогенез, ріст пухлини та метастазування [10].
Пухлино-інфільтруючі лімфоцити також зумовлюють прогресування клітин МП РМЗ шляхом вивільнення медіаторів інвазії та ангіогенезу, включно з фактором некрозу пухлини (Tumor necrosis factor-alfa — TNF), IL-6, IL-8. У сукупності експресія цих цитокінів значно вище в CD8+ пухлинних інфільтруючих моноцитах хворих на МП РМЗ, ніж у пацієнтів з іншими формами РМЗ [11].
Мета — визначення особливостей змін CD8+ та IL-8 у хворих з хімієрезистентним РМЗ у пухлинній тканині після терапії ЛПД.
МАТЕРІАЛИ ТА МЕТОДИ дослідження
Це дослідження схвалено комісією з питань етики ДНП «Національний інститут раку» 12 грудня 2023 р., № 249/2. Це дослідження проведено відповідно до Гельсінської декларації та Рекомендацій належної клінічної практики (Good Clinical Practice — GСР). Усі пацієнти дали згоду на використання даних про здоров’я для дослідницьких цілей.
Ми обстежили та пролікували 30 пацієнтів із хімієрезистентним МП РМЗ IIB–IIIB стадій, люмінальний субтип Б, віком 41–70 років (середній вік — 55,5 року) із січня 2020 до грудня 2024 р. Для всіх хворих визначали CD8+ та IL-8 в пухлинній тканині.
Хворих розподілено на 2 групи:
- І група (15 хворих) — проводилося введення ЛПД в/в крапельно в дозі 50 мг/м2 протягом 60 хв, через 30 хв після інфузії препарату виконувався сеанс магнітотермії протягом 30 хв на локус пухлини молочної залози 1 раз на 4 тиж, усього 4 курси;
- ІІ група (15 осіб) — проводилася терапія ЛПД в/в крапельно в дозі 50 мг/м2 протягом 60 хв 1 раз на 4 тиж, усього 4 курси.
Після терапії повторно визначали рівні CD8+ та IL-8. Рівень CD8+ та IL-8 визначали методом імуноферментного аналізу (ІФА) із застосуванням стандартних наборів реактивів. Межі норми для IL-8 становили 0–66,10 пкг/мл та для CD8+ — 30,00–60,00%.
Використовувався довірчий інтервал (ДІ) з поправкою на 95% зміщення. Якщо інтервал не містить нуля, то непрямий ефект вважається статистично значущим (p <0,05).
РЕЗУЛЬТАТИ
У цілому відзначено підвищення показника CD8+ та зниження IL-8 в туморозній тканині в обох групах після проведення терапії на основі ЛПД.
Результати змін у всіх групах показників CD8+ наведено у рис. 1 та IL-8 — у рис. 2.
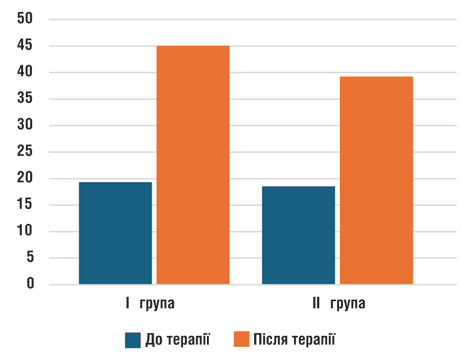
Рис. 1. Зміни у процентному відношені CD8+ у пухлинній тканині у I та II групах до початку та після проведеної терапії
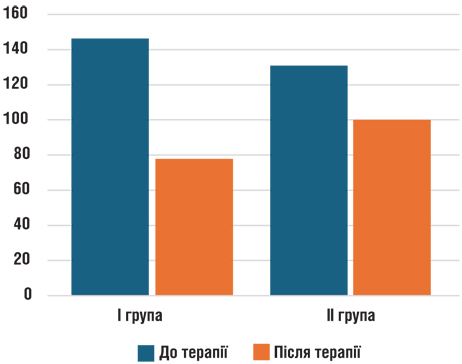
Рис. 2. Зміни показників IL-8 у пухлинній тканині у I та II групах до початку та після проведеної терапії
I група — CD8+; станом на початок лікування показник у середньому по групі дорівнював 19,33±0,43%; після введення ЛПД на тлі локальної помірної магнітотермії показники підвищилися до 45,08±2,52%.
CD8+ підвищився у 2,48 раза в пухлині після проведеної терапії ЛПД на фоні локальної помірної магнітотермії та були достовірно (р≤0,05) вищими при порівнянні з цими ж показниками до проведення терапії.
IL-8 до проведення терапії становили в середньому по групі 146,22±5,14 пкг/мл та після терапії цей показник знизився до 77,83±4,67 пкг/мл.
Показники IL-8 були вищими верхньої межі норми у 2,27 раза в пухлині молочної залози при виявленні резистентності до перших ліній хімієтерапії, а після проведення терапії за комбінацією ЛПД на тлі МТ: показники IL-8 знизилися майже вдвічі, але показник IL-8 статистично достовірно (р <0,05) залишався в 1,21 раза більше порівняно із нормою.
II група — CD8+; на початок лікування показник у середньому по групі становив 18,56±1,34%; після введення ЛПД підвищився до 39,26±2,44%; підвищення рівня у 2,37 раза в пухлині після проведеної терапії та співвідносне з ростом цього рівня та трохи вище, ніж у першій групі, показники були достовірно (р ≤0,05) вищими відповідно при порівнянні з цими ж показниками до проведення терапії при хімієрезистентному МП РМЗ (р <0,05).
IL-8 — до початку терапії становив 130,82±15,64 пкг/мл та після терапії знизився до 100,05±10,28 пкг/мл. Показники IL-8 знизилися в 1,31 раза, що є нижчим на 29,41%, ніж у першій групі. Рівень IL-8 статистично достовірно (р <0,05) був вищим в 1,54 раза порівняно із нормою, що є трохи вищим, ніж у першій групі.
Отже, зміни CD8+ та IL-8 у пухлинній тканині пацієнтів із хімієрезистентним МП РМЗ можуть виступати факторами прогнозу до початку спеціального лікування та бути незалежними маркерами ефективності проведеної терапії.
ОБГОВОРЕННЯ
За результатами своєї роботи M. Kciuk дійшов висновку, що на додаток до цитотоксичного ефекту хімієтерапевтичні препарати можуть також посилювати інфільтрацію CD8+ у пухлині. Основні цитостатичні та цитотоксичні препарати функціонують таким чином, щоб відновити імунореактивне мікрооточення пухлини, що зрештою підвищує сприйнятливість новоутворення до терапії [12]. Багато лікарських засобів, які зараз застосовують, наприклад, у нашій роботі — ліпосомальна пегільована форма доксорубіцину, досліджуються з точки зору їх потенціалу активації імунної системи проти пухлинних клітин або їхньої цінності в комбінаціях з інгібіторами імунних контрольних точок, що може мати право на життя, враховуючи те, що показник CD8+ підвищився у 2,48 раза в пухлині після проведеної терапії ЛПД на тлі локальної помірної магнітотермії та у 2,37 раза після введення самого лише ЛПД.
За даними W. Yang, стимуляція аутологічних CD8+ Т-клітин, а також їх розмноження, викликані стимуляцією за допомогою LPS-RGD-Nb36-DOX. Отримані клітини злиття DC / пухлини мали сильну експресію маркерів, пов’язаних зі зрілістю (MHC II, CD80 і CD86) [13], тобто ліпосомальна оболонка (як система доставки препарату доксорубіцину) має сама собою стимулювальний ефект для розмноження та активації лімфоцитів.
D. Zuccari припускає, що IL-8 може представляти важливий прогностичний маркер РМЗ та вважаємо, що він може допомогти ідентифікувати гени та білки, які диференційовано експресуються в цих пухлинах, та зниження цього показника в самій пухлині може сприяти більшому проникненню хімієпреперату в пухлинну клітину, а отже, мати більш виражений цитостатичний ефект [14], що цілком збігається з результатами нашого дослідження.
Підсумовуючи, наявні дані вказують на те, що лімфоцити та інтерлейкіни пов’язані з РМЗ, проявляють активні та прозапальні властивості на додаток до функцій, що спричиняють розвиток новоутворень. Важливо відзначити, що регуляція IL-8 активує стромальні клітини при хімієрезистентному РМЗ, послаблює бар’єрну протипухлинну функцію у клітин при МП РМЗ та асоціюється з високим потенціалом до прогресування злоякісного процесу через пухлинну лейкоцитарну інфільтрацію з порушенням проникності хімієпрепаратів у пухлинну клітину, а також, відповідно, розвитком хімієрезистентності та чинить негативний прогностичний вплив. А інгібування сигналізації IL-8 нормалізує активні фенотипи цих стромальних клітин. Так, спрямування на пригнічення сигнального шляху IL-8 може підвищити ефективність терапевтичних підходів при РМЗ [15].
ВИСНОВКИ
- Застосування ліпосомальних пегільованих форм хімієпрепаратів для лікування раку є новим та дуже перспективним підходом.
- Найбільш значущі зміни в пухлинній тканині хворих при МП РМЗ за встановленої хімієрезистентності виявлено у показниках IL-8, що були вищими від показників норми в середньому у 2 рази, CD8+ — нижчими від показників норми більш ніж у 2 рази.
- Після проведення терапії на основі ліпосомальних пегільованих форм доксорубіцину відзначено підвищення рівня CD8+ в пухлинному ложі та було більш виражене в I групі, що вказує на позитивне прогностичне значення для зниження ризику рецидиву та можливого подолання нечутливості до лікування при РМЗ.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. World Health Organization. Breast Cancer. (2024). Retrieved from www.who.int/news-room/fact-sheets/detail/breast-cancer.
2. Broeders, M., Moss, S., Nyström, L., Njor, S., Jonsson, H., Paap, E., … Paci, E. (2012). The Impact of Mammographic Screening on Breast Cancer Mortality in Europe: A Review of Observational Studies. Journal of Medical Screening, 19(1), 14–25. doi: 10.1258/jms.2012.012078.
3. Movchan, O., Smolanka, I., Lyashenko, A., Loboda, A., Ivankova, O., & Dosenko I. (2024). Review of Pegylated liposomal drug`s effectiveness for overcoming chemoresistance of breast cancer. International Journal of Applied Engineering & Technology, 6(1), 125–136. romanpub.com/resources/ijaet20v6-1-2024-17.pdf.
4. Zhang, H., Yue, X., Chen, Z., Liu, C., Wu, W., Zhang, N., … Liu, G. (2023). Define cancer-associated fibroblasts (CAFs) in the tumor microenvironment: new opportunities in cancer immunotherapy and advances in clinical trials. Molecular Cancer, 22, 159. doi: 10.1186/s12943-023-01860-5.
5. Habanjar, O., Bingula, R., Decombat, C., Diab-Assaf, M., Caldefie-Chezet, F., & Delort, L. (2023). Crosstalk of Inflammatory Cytokines within the Breast Tumor Microenvironment. International Journal of Molecular Sciences, 24(4), 4002. doi: 10.3390/ijms24044002.
6. Liao, H., Li, H., Song, J., Chen, H., Si, H., Dong, J., … Bai, X. (2023). Expression of the prognostic marker IL-8 correlates with the immune signature and epithelial-mesenchymal transition in breast cancer. Journal of Clinical Laboratory Analysis, 37(3), e24797. doi: 10.1002/jcla.24797.
7. Kartikasari, A., Huertas, C., Mitchell, A., & Plebanski, M. (2021). Tumor-Induced Inflammatory Cytokines and the Emerging Diagnostic Devices for Cancer Detection and Prognosis. Frontiers in Oncology, 11, 692142. doi: 10.3389/fonc.2021.692142.
8. Movchan, O., Smolanka, I., Lyashenko, A., Loboda, A., Dosenko, I., & Ivankova, O. (2024). Tumor infiltrating lymphocytes density as the chemoresistance and relapse factor for advanced breast cancer patients. Academic Journal of Health Sciences, 39(4), 9–16. doi: 10.3306/AJHS.2024.39.04.9.
9. Fousek, K., Horn, L., & Palena, C. (2021). Interleukin-8: A chemokine at the intersection of cancer plasticity, angiogenesis, and immune suppression. Pharmacology & Therapeutics, 219, 107692. doi: 10.1016/j.pharmthera.2020.107692.
10. Todorović-Raković, N., & Milovanović, J. (2013). Interleukin-8 in breast cancer progression. Journal of Interferon & Cytokine Research, 33(10), 563–70. doi: 10.1089/jir.2013.0023.
11. Sun, Y., Li, Y., Shi, S., & Dong, C. (2021). Exploiting a New Approach to Destroy the Barrier of Tumor Microenvironment: Nano-Architecture Delivery Systems. Molecules, 26(9), 2703. doi: 10.3390/molecules26092703.
12. Kciuk, M., Gielecińska, A., Mujwar, S., Kołat, D., Kałuzińska-Kołat, Ż., Celik, I., & Kontek, R. (2023). Doxorubicin-An Agent with Multiple Mechanisms of Anticancer Activity. Cells, 12(4), 659. doi: 10.3390/cells12040659.
13. Yang, W., Sun, Q., Zhang, X., Zheng, L., Yang, X., He, N., … Wang, W. (2024). A novel doxorubicin/CTLA-4 blocker co-loaded drug delivery system improves efficacy and safety in antitumor therapy. Cell Death & Disease, 15, 386. doi. 10.1038/s41419-024-06776-6.
14. Zuccari, D. A., Leonel, C., Castro, R., Gelaleti, G. B., Jardim, B. V., Moscheta, M. G., … Esteves, J. L. (2012). An immunohistochemical study of interleukin-8 (IL-8) in breast cancer. Acta Histochemica, 114(6), 571–576. doi: 10.1016/j.acthis.2011.10.007.
15. Al-Khalaf, H., Al-Harbi, B., Al-Sayed, A., Arafah, M., Tulbah, A., Jarman A., … Aboussekhra, A. (2019). Interleukin-8 Activates Breast Cancer-Associated Adipocytes and Promotes Their Angiogenesis- and Tumorigenesis-Promoting Effects. Molecular and Cellular Biology, 39(2), e00332-18. doi: 10.1128/MCB.00332-18.
Адреса для листування:
Мовчан Олексій Володимирович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: aleexeymed@gmail.com
Correspondence:
Oleksii Volodimirovich Movchan
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: aleexeymed@gmail.com














Leave a comment