Використання спектральної мамографії з контрастуванням у моніторингу неоад’ювантного лікування раку молочних залоз на прикладі клінічного випадку
Карачарова І.Ю.1, Малець М.С.1, Гурандо А.В.2, Старенький В.П.3
- 1Комунальне некомерційне підприємство (КНП) «Київський міський клінічний онкологічний центр», Київ, Україна
- 2Національний університет охорони здоров’я України ім. П.Л. Шупика, Київ, Україна
- 3Державна установа «Інститут медичної радіології та онкології ім. С.П. Григор’єва НАМН України», Харків, Україна
Резюме. Спектральна мамографія з контрастуванням (Contrast-enhanced mammography — CEM) — це новітній метод діагностики молочних залоз (МЗ) у світі. Його унікальність полягає в поєднанні низькоенергетичного дослідження МЗ, ідентичного до стандартної мамографії, з можливістю комбінації із томосинтезом та високоенергетичного дослідження МЗ. Програмне забезпечення формує контрастне зображення, комбінуючи низькоенергетичне та високоенергетичне зображення. За інформативністю воно наближене до магнітно-резонансної томографії (МРТ) МЗ і базується на аналогічному способі фіксації контрасту в тканинах. Саме тому СЕМ має високу цінність та інформативність у діагностиці раку молочних залоз (РМЗ) і широко використовується у світі для локального стадіювання та моніторингу неоад’ювантного лікування РМЗ. Згідно зі статистикою Всесвітньої організації охорони здоров’я (ВООЗ), РМЗ є найбільш поширеним видом онкопатології у світі. В Україні він посідає 1-ше місце серед злоякісних новоутворень (ЗН) у жіночого населення. У цій статті представлено клінічний випадок жінки віком 45 років з мультифокальною формою раку правої МЗ з метастазами в пахвові лімфатичні вузли праворуч. При первинному зверненні на діагностичному етапі їй було виконано СЕМ для уточнення кількості вузлових утворень та їх поширення в МЗ. З метою адекватної оцінки ефективності неоад’ювантного лікування моніторинг контролю після 4 та 8 курсів неоад’ювантної хімієтерапії (НХТ) виконувався за допомогою СЕМ. На прикладі цього клінічного випадку описано алгоритми проведення СЕМ, її переваги, обмеження та певні артефакти, обґрунтовано причини її використання в цьому клінічному випадку, а також проаналізовано результати отриманих зображень, проведена кореляція із даними патоморфологічних досліджень. Також зроблені висновки щодо доцільності використання вищевказаного дослідження як інструменту в локальному стадіюванні РМЗ та на етапі моніторингу неоад’ювантного лікування. Підкреслено важливість мультимодального підходу до діагностики РМЗ з акцентом на пацієнтоорієнтованість та дотримання стандартизованих діагностичних протоколів для досягнення безпечного та ефективного результату з уникненням хибних висновків.
Одержано 7.11.2025
Прийнято до друку 19.11.2025
DOI: 10.32471/clinicaloncology.2663-466X.35000
ВСТУП
РМЗ впевнено тримає пальму першості серед злоякісних захворювань у жіночого населення України та світу. Згідно з даними Національного канцер-реєстру України, у 2023 р. серед 10 основних нозологічних форм ЗН у жінок РМЗ зареєстровано у 22,2% випадках. У статево-віковій структурі захворюваності на ЗН населення України, за винятком немеланомних ЗН шкіри, найвищий показник питомої ваги РМЗ трапляється серед жінок у віковому діапазоні 30–44 років у 29,7% випадках [5]. ВООЗ зазначає, що у 2022 р. РМЗ був найпоширенішим видом раку у жінок у 157 із 185 країн [16]. Лише 24,4% випадків РМЗ в Україні у 2022 р. було виявлено на профілактичних оглядах [5].
Усі вищеперераховані факти вкотре підтверджують важливість вчасної та якісної діагностики МЗ та низький рівень освіченості населення в цьому питанні.
Незважаючи на те що золотим стандартом у дослідженні МЗ є мамографія, важливим аспектом є доступність мультимодальної діагностики. Тобто, поєднання різних діагностичних методів, таких як мамографія, цифровий томосинтез, ультразвукова діагностика (УЗД), МРТ МЗ та СЕМ. Важливо розуміти, що всі ці методи не виключають один одного, а лише доповнюють інформацію про стан МЗ, формуючи цілісну картину для лікаря [2, 9].
Протягом останніх десятиліть у світі широкої популярності та використання набув новий метод дослідження МЗ — CEM. Останніми роками в Україні лікарі все частіше використовують цей метод діагностики.
У зв’язку з підвищенням популярності вищевказаного методу Американський коледж радіології (American College of Radiology) у 2022 р. представив CEM-термінологію в якості додатка до Атласу BI-RADS 2013 (Breast Imaging Report and Data System, 5th Edition [7, 8, 19]. У 2011 р. Управління з контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA) схвалило використання СЕМ як «додаткового засобу після мамографії та/або ультразвукової діагностики для локалізації відомого або підозрілого ураження» [17].
Унікальність СЕМ полягає в поєднанні цифрової мамографії та зображення контрастного дослідження, аналогічного за принципом фіксації контрасту під час МРТ.
Будь-який діагностичний метод має свої обмеження та межі інформативності. Одним із основних обмежувальних факторів для мамографії є висока щільність МЗ, що знижує інформативність у виявленні РМЗ [12, 13].
В одному із досліджень зазначено, що чутливість мамографії становить 87% у жінок із переважно жировмісним типом МЗ, але вона знижується до 62,9% у жінок із екстремально щільними МЗ (динаміка специфічності знижується із 96,9 до 89,1% відповідно) [15].
Під час СЕМ цей фактор нівелюється за допомогою застосування контрастного посилення і особливістю неоангіогенезу в ЗН, а також характерними ознаками фіксації контрасту в них, тим самим значно збільшуючи їх видимість під час дослідження. Саме цей фактор є ключовим для СЕМ при візуалізації ЗН у МЗ на етапі первинного локального стадіювання та під час моніторингу неоад’ювантного лікування РМЗ.
Важливість ранньої діагностики РМЗ не може бути переоцінена, оскільки при ранньому виявленні ЗН доступна більша варіативність схем лікування та доведена вища виживаність пацієнтів [17].
Мета: презентація клінічного випадку для аналізу можливостей СЕМ у моніторингу неоад’ювантного лікування РМЗ.
МАТЕРІАЛИ ТА МЕТОДИ дослідження
У статті представлений детальний опис клінічного випадку застосування СЕМ як діагностичного інструменту оцінки ефективності неоад’ювантного лікування РМЗ у КНП «Київський міський клінічний онкологічний центр» у 2024–2025 рр.
Діагноз підтверджено клінічними даними, гістологічним та імуногістохімічним аналізом біоптату пухлини МЗ на діагностичному та постопераційному етапі, результатами інструментально-діагностичних досліджень: УЗД МЗ і регіонарних лімфатичних вузлів та СЕМ в 3D-форматі, тобто поєднано з томосинтезом. Для оцінки отриманих результатів досліджень використовували систему BI-RADS для категоризації змін у МЗ при мамографії, СЕМ, УЗД та систему Node-RADS для оцінки змін у регіонарних лімфатичних вузлах.
КЛІНІЧНИЙ ВИПАДОК
До мамолога КНП «Київський міський клінічний онкологічний центр» звернулася жінка віком 45 років зі скаргами на ущільнення у верхньовнутрішньому квадранті правої МЗ. За даними клінічного огляду, у верхньовнутрішньому квадранті правої МЗ пальпувалося новоутворення завдовжки 25 мм. Пацієнтка була скерована до відділення променевої діагностики для аналізу наданих мамографічних зображень з діагностичного центру за місцем проживання та для подальшого дообстеження з метою визначення характеру новоутворення та локального поширення процесу.
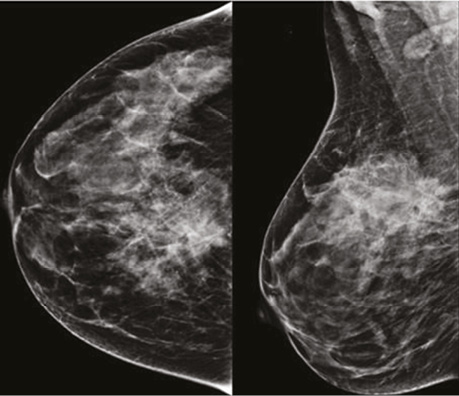
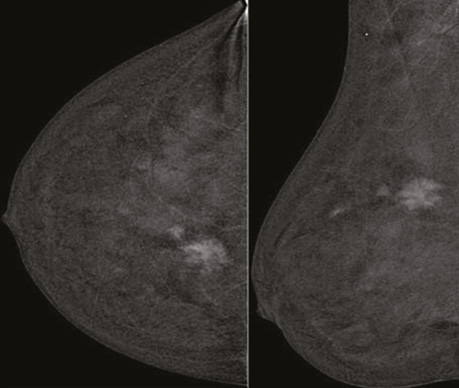
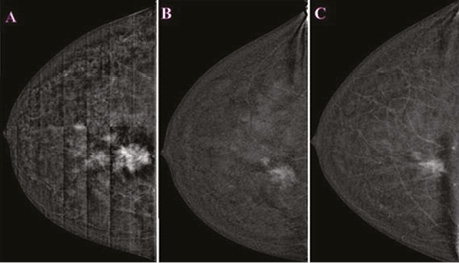
Проаналізувавши надані площинні мамографічні зображення, зазначено високу щільність паренхіми МЗ категорії ACR С з наявністю середньоінтенсивного гетерогенного ущільнення в ретромамарному просторі на 1 год правої МЗ розміром 27×21×22 мм з нечіткими променистими краями. Відзначалася наявність перинодулярної інфільтрації паренхіми, згущення структурного малюнку МЗ навколо вузлового компонента. У правій аксилярній ділянці лімфатичний вузол розміром 32×14 мм, кірково-медулярна диференціація простежується, кірковий шар нерівномірний, потовщений до 5,3 мм (рис. 1).
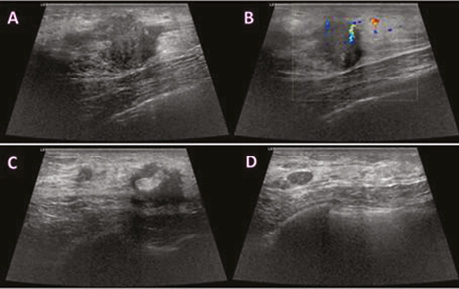
Виконано УЗД МЗ на діагностичному ультразвуковому приладі LOGIQ S7 Expert, GE Ultrasound Korea Ltd, Республіка Корея. У правій МЗ на 1 год визначалося гіпоехогенне гетерогенне новоутворення неправильної форми з нечіткими нерівними контурами, розміром 29×23×18 мм, з ознаками локусів інтранодулярного кровотоку при кольоровому доплерівському картуванні (КДК). Поруч візуалізувалися аналогічної структури: 3 новоутворення розміром 4; 5 та 8 мм, які не виявлялися на площинній мамографії через високу щільність паренхіми (рис. 2). У правій пахвовій ділянці лімфатичні вузли розміром до 23×17 мм, з гіпоехогенним, нерівномірно потовщеним кірковим шаром до 5 мм.
З метою локального стадіювання було ухвалене рішення щодо застосування СЕМ на мамографічному устаткуванні Selenia Demensions, Hologic для визначення кількості вузлових новоутворень та поширення процесу в правій МЗ. За допомогою анкетування пацієнтки було виключено наявність алергії на йод та протипоказань до введення контрастної речовини, у тому числі за допомогою аналізу швидкості клубочкової фільтрації. Усі процедури, що пов’язані з внутрішньовенним контрастуванням, виконуються, дотримуючись рекомендацій, вказаних у гайдлайнах Європейської асоціації урогенітальної радіології (European Society of Urogenital Radiology — ESUR) [14].
У маніпуляційній зоні мамографічного кабінету пацієнтці внутрішньовенно ввели йодовмісний контраст Томогексол 350 за допомогою інжектора із розрахунку 1,5 см3/кг маси тіла зі швидкістю 2 мл/с. Цей етап дослідження проводиться в комфортному для жінки положенні, без компресії МЗ компресійною пластиною до мамографічного столика. Це необхідно для рівномірного поширення контрасту в організмі. Для уникнення хибних результатів від моменту початку введення контрасту до початку першого сканування МЗ повинно пройти 2,5 хв для поширення контрасту в організмі. Усі часові проміжки вказані на екрані робочої станції лаборанта.
Після цього було проведено процедуру спектрального мамографічного сканування в комбінації із томосинтезом обох МЗ в краніо-каудальній (СС) та медіально-латерально-косій (MLO) проєкціях. Цей етап повинен відбутися протягом 6 хв. Після цього за необхідності можливе виконання мамографії в додаткових проєкціях у віддалену фазу, але не пізніше 10-ї хвилини від початку введення контрасту.
Після виконання дослідження відразу привернули увагу сітчастість зображення, тобто видимість ліній сітки — це артефакт, пов’язаний з обладнанням. Проте наявність цього артефакту не вплинула на інформативність дослідження.
У правій МЗ на 1 год ретромамарно візуалізується гетерогенна ділянка гіперфіксації контрасту з нечіткими нерівними краями, високої інтенсивності на тлі фонового розподілу контрасту в МЗ, розміром 26×24×22 мм. Поруч, у напрямку до соска, у тому числі на 12 год у середньому сегменті, визначаються № 4 аналогічні ділянки підвищеної фіксації контрасту розміром 9×6×7 мм, 12×9×8 мм, 16×14×10 мм, 19×12×13 мм, гетерогенної структури, високої щільності та інтенсивності (рис. 3). У правій пахвовій ділянці відзначається слабоінтенсивна фіксація контрасту в лімфатичному вузлі розміром 28×15 мм.
У лівій МЗ та лівій пахвовій ділянці патологічної фіксації контрасту не виявлено.
Методом вибору для діагностики регіонарних лімфатичних вузлів є УЗД.
Висновок: СЕМ-, УЗД-ознаки раку правої МЗ (мультифокальна форма). Метастаз у пахвовий лімфатичний вузол праворуч.
Діагностична категорія: BI-RADS — 5, ACR — C;
Node-RADS 5.
За результатами проведеного патологістологічного дослідження встановлена інвазивна протокова карцинома МЗ G2, NOS. Результати імуногістохімічного дослідження: визначення рецепторів до естрогену (Clone SP1) — 98%, 3+ (8 балів за шкалою Allred). Визначення рецепторів до прогестерону (Clone 16) — 65%, 3+ (7 балів за шкалою Allred). Визначення c-erbB2 (HER2/neu) (Clone SP3) — 2+, сумнівна реакція. Визначення Ki-67 (Clone SP6) –20%.
За результатами консиліуму призначено НХТ.
Після 4 курсів НХТ (доксорубіцин + циклофосфамід) пацієнтці виконали СЕМ, УЗД МЗ та ділянок регіонарного лімфовідтоку з метою моніторингу лікування.
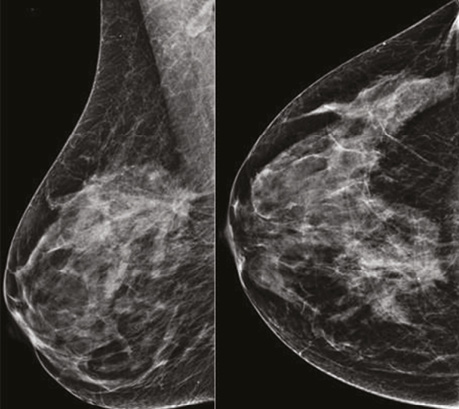
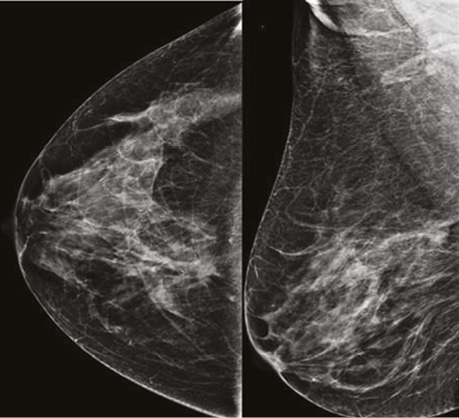
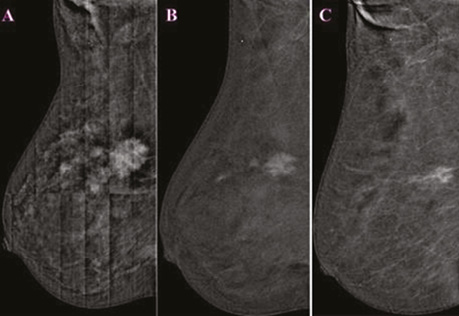
При аналізі низькоенергетичного зображення в динаміці в правій МЗ на 1 год ретромамарно зменшився розмір таргетного вузлового новоутворення до 22×13×18 мм, знизилися його щільність, інтенсивність та інфільтрація паренхіми перинодулярно. Інших вузлових новоутворень на низькоенергетичних сканах не виявлено (рис. 4).
У правій аксилярній ділянці лімфатичний вузол розміром 21×9 мм, кірково-медулярна диференціація простежується, кірковий шар нерівномірний, потовщений до 3,2 мм.
При кореляції з УЗД вузлове гетерогенне новоутворення на 1 год справа ретромамарно розміром 20×16×15 мм зі збереженим локусом васкуляризації по периферії новоутворення при КДК. Поряд візуалізуються аналогічні гіпоехогенні гетерогенні новоутворення завдовжки 5; 7 мм (рис. 5).
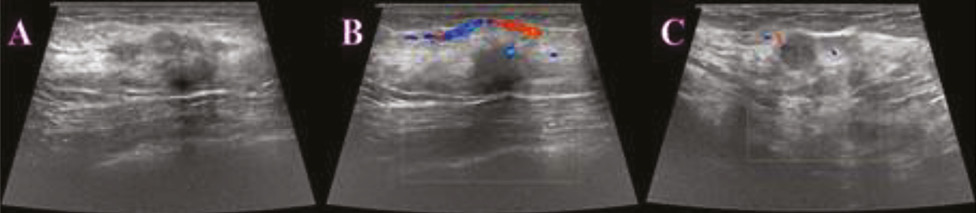
У правій пахвовій ділянці лімфатичні вузли розміром до 21×8 мм, кірковий шар нерівномірний до 2,2 мм.
Проте при УЗД важко зорієнтуватися щодо зменшення розміру кожного конкретного сателітного вузла, оскільки це динамічний метод дослідження на відміну від статичного рентгенівського зображення. А висока щільність паренхіми МЗ знижує чутливість та специфічність мамографії, особливо у виявленні вузлових новоутворень невеликого розміру. У цій ситуації СЕМ дасть відповіді на поставлені нами запитання щодо кількості вузлових новоутворень та динаміки процесу на тлі НХТ.
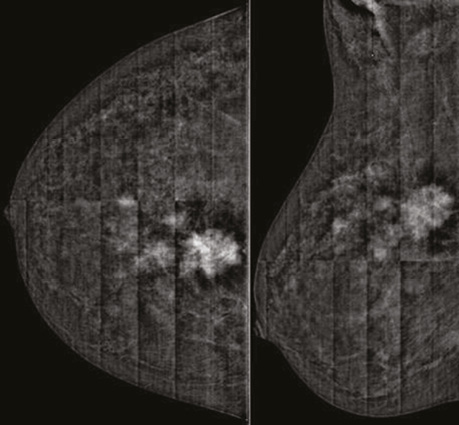
Незважаючи на артефакт розмітки сітки при первинному СЕМ, на представленому контрастованому зображенні відзначаємо позитивну динаміку у вигляді зменшення розміру таргетного пухлинного вузла до 23×19×17 мм. Значно знизилися щільність та інтенсивність депонованого контрасту у вузловому компоненті. Кількість сателітів зменшилася до 2 осередків розмірами 4×3×2; 9×6×6 мм, різко знизилися щільність та інтенсивність контрастування в динаміці (рис. 6).
Пахвовий лімфатичний вузол праворуч розміром 21×8 мм з ознаками мінімальної фіксації контрасту в кірковому шарі.
У лівій МЗ та пахвовій ділянці праворуч патологічних осередків фіксації контрасту не виявлено.
Висновок: СЕМ-, УЗД-ознаки раку правої МЗ (мультифокальна форма). Метастаз у пахвовий лімфатичний вузол праворуч. Стан після 4 курсів НХТ: позитивна динаміка.
Діагностична категорія: BI-RADS — 5, ACR — C;
Node-RADS 5.
Пацієнтка продовжила неоад’ювантне лікування.
Наступне контрольне дослідження було виконане після 8 курсів НХТ (4 курси доцетакселу) в тому ж обсязі.
На низькоенергетичних сканах таргетне вузлове новоутворення в правій МЗ зменшилося до 17×14×13 мм, значно знизилися щільність та інтенсивність новоутворення, зникла перинодулярна інфільтрація паренхіми. Інших об’ємних новоутворень на площинній мамографії не візуалізувалося (рис. 7).
Під час УЗД після 8 курсів НХТ виявлено гіпоехогенне вузлове новоутворення розміром 19×12×9 мм з локусом васкуляризації по периферії на 1 год ретромамарно (рис. 8) та аналогічне гіпоехогенне новоутворення поруч розміром 6×5 мм.
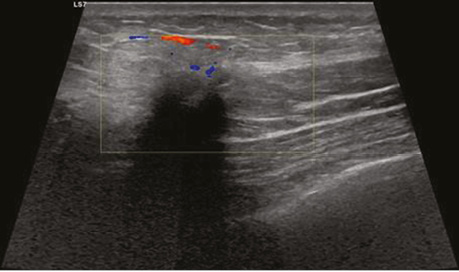
У правій пахвовій ділянці візуалізуються лімфатичні вузли розміром до 15×7 мм з рівномірним кірковим шаром розміром до 2 мм.
При аналізі контрастованого зображення ділянка гіперфіксації контрасту на 1 год ретромамарно в правій МЗ зменшилася до розміру 20×17×13 мм, значно знизилися щільність та інтенсивність ділянки контрастування. Поряд встановлено лише 1 ділянку аналогічної фіксації контрасту розміром 8×7×5 мм (рис. 9).
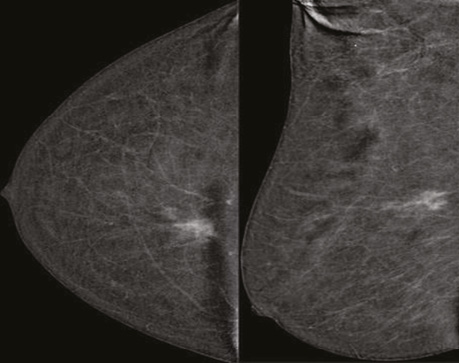
Висновок: СЕМ-, УЗД-ознаки раку правої МЗ (мультифокальна форма). Mетастази в пахвовий лімфатичний вузол справа. Стан після 8 курсів НХТ: позитивна динаміка.
Діагностична категорія: BI-RADS — 5, ACR — C;
Node-RADS 5.
Наступним етапом було хірургічне втручання в обсязі квадрантектомії правої МЗ.
Результати післяопераційного патоморфологічного дослідження: інвазивна протокова Са (G2). Лікувальний патоморфоз II ступеня. У 4 лімфатичних вузлах виявлено метастази пухлини. Краї резекції R0.
Результати імуногістохімічного дослідження: визначення рецепторів до естрогену (Clone SP1) — 100%, 3+ (8 балів за шкалою Allred); рецепторів до прогестерону (Clone 16) — 15%, 1+ (4 бали за шкалою Allred); c-erbB2 (HER2/neu) (Clone SP3) — 2+; Ki-67 (Clone SP6) — 10%.
Післяопераційний період пройшов без ускладнень. Пацієнтка була скерована на консультацію до радіолога для отримання післяопераційного курсу дистанційної променевої терапії (ДПТ) на праву МЗ та на пахвові, підключичні, надключичні лімфатичні вузли праворуч.
Після завершення лікування встановлено діагноз «рак правої МЗ», стан після комплексного лікування — задовільний, клінічна група 3.
Основний діагноз при виписці: стадія 3а pT2N2M0.
РЕЗУЛЬТАТИ
Використавши СЕМ у пацієнтки із високою щільністю МЗ, виявили пухлинний вузол високої щільності та інтенсивності фіксації контрастної речовини та 4 аналогічних додаткових вузлових новоутворення поруч. Сателітні новоутворення не реєструвалися на низькоенергетичному мамографічному дослідженні, що є аналогом стандартної мамографії, та на томосинтетичних сканах, 2 з них не виявлені на УЗД.
У результаті цього було ухвалено рішення щодо доцільності використання СЕМ для локального стадіювання, а надалі — для моніторингу неоад’ювантного лікування, оскільки цей метод візуалізації є найбільш інформативним у цьому клінічному випадку.
Після 4 курсів НХТ зафіксована позитивна динаміка процесу у вигляді зменшення кількості, розмірів пухлинних вузлів, зниження їхньої щільності та інтенсивності фіксації контрасту при аналізі СЕМ. А також зменшення розмірів пахвових лімфатичних вузлів при УЗД.
Після 8 курсів НХТ за допомогою СЕМ візуалізувалися лише 2 з 5 вузлових новоутворень зі зниженою інтенсивністю, щільністю фіксації контрасту в динаміці. За допомогою УЗД відзначалося зменшення розмірів пахвових лімфатичних вузлів (рис. 10, 11).
За результатами проведених досліджень СЕМ встановлено часткову регресію пухлинного процесу на тлі використання НХТ. Післяопераційно це було підтверджено патоморфологічно із визначенням II ступеня лікувального патоморфозу у видалених пухлинних осередках.
Використовуючи СЕМ у вищезазначеному клінічному випадку, ми чітко зафіксували кількість вузлових новоутворень та їх поширення в МЗ. Це дуже важливо для формування схеми лікування та в подальшому для визначення обсягу оперативного втручання.
ОБГОВОРЕННЯ
РМЗ є одним із найважливіших викликів сьогодення не лише в медицині, а й в інших соціальних сферах життя. Незважаючи на всі превентивні, просвітницькі заходи, скринінгові програми та постійне оновлення діагностичних ресурсів, лікувальних алгоритмів, відсоток захворюваності та смертності від цієї хвороби невпинно зростає щороку.
Саме тому діагностика РМЗ потребує мультимодального підходу із застосуванням різних методів візуалізації.
СЕМ — це новітній метод візуалізації, що набуває поширення в Україні.
Він заснований на поєднанні конвенційної мамографії, мамографії з томосинтезом у разі необхідності та контрастного зображення. Згенеровані скани контрастного посилення нівелюють високу щільність паренхіми МЗ, візуалізуючи ділянки посиленої васкуляризації [3, 18].
Цим зумовлена цінність СЕМ при РМЗ, оскільки судини, утворені в процесі неоангіогенезу, наповнюються контрастом. Персистенція контрасту в новоутворених судинах усередині пухлини призводить до зображення, посиленого йодом [1, 4, 15].
У нашому випадку наведено використання СЕМ у пацієнтки із високою щільністю паренхіми МЗ. Це дозволило нам візуалізувати пухлинні осередки, анонімні для стандартної мамографії, томосинтезу та УЗД.
Згідно з оглядом наукової літератури, D. Ugo Tari та співавт. [20] зазначають, що СЕМ проявляє високу чутливість (89–97,7%) та специфічність (50–89%) у виявленні осередків малігнізації в щільних МЗ. Це наближає точність СЕМ до МРТ МЗ поєднано з нижчою вартістю дослідження.
Обравши СЕМ керівним методом для оцінки ефективності лікування РМЗ, у цьому клінічному випадку ми мали змогу адекватно оцінити зміни, що відбуваються в новоутвореннях, які анонімні для інших методів дослідження.
НХТ — це важливий етап в алгоритмі лікування РМЗ. У численних дослідженнях доведено беззаперечну перевагу МРТ МЗ над фізикальними дослідженнями, мамографією та УЗД МЗ в оцінці відповіді РМЗ на НХТ. В останніх дослідженнях вчені припускають, що СЕМ може мати аналогічну цінність у цьому питанні [6, 21].
У своєму дослідженні H. Elkassas та співавт. доводять високу чутливість та специфічність СЕМ у прогнозуванні повної відповіді (complete response) у пацієнток з РМЗ, що отримують НХТ [11]. Вони також зазначають про високий ступінь кореляції між СЕМ та гістопатологічною оцінкою залишкової пухлини.
Використання СЕМ для локального стадіювання РМЗ та на етапі моніторингу неоад’ювантного лікування передбачає чітке визначення локального поширення хвороби та характер її відповіді на лікування. Це дозволяє обрати оптимальний обсяг хірургічного втручання після неоад’ювантного лікування, забезпечивши пацієнтці подальший комфортний психоемоційний та фізичний стан зі зниженням ризиків локального рецидивування [10, 21].
ВИСНОВКИ
СЕМ — дуже інформативний інструмент у процесі передопераційного стадіювання. Під час проведення СЕМ непоодинокими є випадки діагностики невізуалізованого раніше іншими діагностичними методами мультицентричного, мультифокального чи білатерального раку. Це дозволяє обрати найкращу схему лікування та обсяг оперативного втручання для пацієнтки. Своєю чергою, це зменшує кількість рецидивів РМЗ, а відповідно, підвищує якість, тривалість життя пацієнтки, знижує фінансові витрати держави. У передопераційному стадіюванні СЕМ має цінність, наближену до МРТ МЗ.
Представлений клінічний випадок демонструє ефективність СЕМ у діагностиці мультифокального РМЗ, а також при оцінці ефекту неоад’ювантного лікування місцево-поширених форм РМЗ, результати яких корелюють із даними післяопераційного патоморфологічного дослідження. СЕМ дозволяє коректно оцінити відповідь на неоад’ювантне лікування пухлинних новоутворень, які залишаються анонімними для площинної мамографії, томосинтезу та УЗД.
Ключову роль у діагностиці РМЗ відіграє мультимодальний та пацієнтоорієнтований підхід у кожному конкретному клінічному випадку із дотриманням умов стандартизованих протоколів дослідження.
Такий алгоритм може бути використаний у схожих клінічних випадках із дотриманням усіх умов виконання протоколів застосованих досліджень без будь-яких агресивних дій щодо інвазивних втручань.
СПИСОК ВИКОРИСТАНої літератури
1. Галагін, К. О., Скляр, С. Ю., & Денека, Є. Р. (2005). Оцінка ефективності неоад’ювантної протипухлинної терапїі при лікуванні хворих на рак молочної залози. Аспекти ангіо- та морфогенезу. Український хіміотерапевтичний журнал, (3–4), 53–56. [Halahin, K. O., Skliar, S. Yu., & Deneka, Ye. R. (2005). Otsinka efektyvnosti neoad’iuvantnoi protypukhlynnoi terapii pry likuvanni khvorykh na rak molochnoi zalozy. Aspekty anhio- ta morfohenezu. Ukrainian Chemotherapeutic Journal, (3–4), 53–56. Ukrainіan].
2. Гаращенко, О. О., Коноваленко, В. Ф., & Коноваленко, С. В. (2021). Сучасні підходи до діагностики і лікування хворих на рак молочної залози. Онкологія, 23(1–2). doi: 10.32471/oncology.2663-7928.t-23-1-2021-g.9320. [Harashchenko, O. O., Konovalenko, V. F, & Konovalenko, S. V. (2021). Suchasni pidkhody do diahnostyky i likuvannia khvorykh na rak molochnoi zalozy. Oncology, 23(1–2). Ukrainіan].
3. Козаренко, Т. М., Литовченко, Ю. І., Карачарова, І. Ю., & Кондратенко, А. В. (без дати). Імплементація мамографії з внутрішньовенним контрастуванням у клінічній практиці в Україні на прикладі клінічних випадків. Radiation Diagnostics, Radiation Therapy, 14(2), 30–40. doi.org/10.37336/2707-0700-2023-2-4. [Kozarenko,T. M., Lytovchenko, Yu. I., Karacharova, I. Yu., & Kondratenko, A. V. (undated). Implementatsiia mamohrafii z vnutrishnovennym kontrastuvanniam u klinichnii praktytsi v Ukraini na prykladi klinichnykh vypadkiv. Radiation Diagnostics, Radiation Therapy, 14(2), 30–40. Ukrainіan].
4. Новак, О. Є., Лісняк, І. О., & Чехун, В. Ф. (2002). Ангіогенез у розвитку злоякісних пухлин: теоретичні і практичні аспекти. Онкологія, 8, 244–251. [Novak, O. Ye., Lisniak, I. O., & Chekhun, V. F. (2002). Anhiohenez u rozvytku zloiakisnykh pukhlyn: Teoretychni i praktychni aspekty. Oncology, 8, 244–251. Ukrainіan].
5. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2024). Рак в Україні, 2022–2023. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України, 25. Кропивницький: Поліум. [Fedorenko, Z. P., Sumkina, O. V., Horokh, Ye. L., & Hulak, L. O. (2024). Rak v Ukraini, 2022–2023. Zakhvoriuvanist, smertnist, pokaznyky diialnosti onkolohichnoi sluzhby. Biuleten Natsionalnoho kantser-reiestru Ukrainy, 25. Kropyvnytskyi: Polium. Ukrainіan].
6. Ali, K., & Savaridas, S. (без дати). Is a new type of mammogram called contrast-enhanced mammography (CEM) as good as magnetic resonance imaging (MRI) scans for showing how well a cancer has responded to chemotherapy? doi.org/10.1186/ISRCTN12671109.
7. American College of Radiology, D’Orsi, C. J., Sickles, E. A., Mendelson, E. B., & Morris, E. A. (ред.). (2013). ACR BI-RADS atlas: Breast imaging reporting and data system; mammography, ultrasound, magnetic resonance imaging, follow-up and outcome monitoring, data dictionary (5th edition). Reston, Va.: ACR, American College of Radiology.
8. Lee, C. H. , Phillips, J., Sung, J. S., Lewin, J. M., & Newell, M. S. (2022). Contrast enhanced mammography (CEM). В ACR BI-RADS atlas: Breast imaging reporting and data system ; mammography, ultrasound, magnetic resonance imaging, follow-up and outcome monitoring, data dictionary.
9. Chen, J., Pan, T., Zhu, Z., Liu, L., Zhao, N., Feng, X., … Zhou, G. (2025). A deep learning-based multimodal medical imaging model for breast cancer screening. Scientific Reports, 15(1), 14696. doi.org/10.1038/s41598-025-99535-2.
10. Chung, W.-S., Tang, Y.-C., & Cheung, Y.-C. (2024). Contrast-Enhanced Mammography: A Literature Review of Clinical Uses for Cancer Diagnosis and Surgical Oncology. Cancers, 16(24), 4143. doi.org/10.3390/cancers16244143.
11. Elkassas, H., El-Maadawy, S. M., Saad, S. M., Radwan, A. H., & Gareer, S. W. Y. (2022). Role of contrast-enhanced spectral mammography in the assessment of residual disease following neoadjuvant chemotherapy in patients with breast cancer. Egyptian Journal of Radiology and Nuclear Medicine, 53(1), 249. doi.org/10.1186/s43055-022-00935-5.
12. European Society of Radiology (ESR), Barros Alves, F., Baltzer, P. A. T., Baykara Ulusan, M., Clauser, P., Ferrara, F., … European Society of Breast Imaging (EUSOBI). (2024). Modern Radiology eBook: Breast Imaging. European Society of Radiology. doi.org/10.26044/ESR-MODERN-RADIOLOGY-11.
13. Gurando, A. V., Babkina, T. M., Dykan, I. M., Kozarenko, T. M., Gurando, V. R., & Telniy, V. V. (2021). Digital breast tomosynthesis and full-field digital mammography in breast cancer detection associated with four asymmetry types. Wiadomosci Lekarskie, 74(4), 842–848.
14. Thomsen, H. S., Stacul, F., Bellin, M.-F., Bertolotto, M., Bongartz, G., Brismar, T., … Webb, J. A. W. (без дати). ESUR Guidelines on Contrast Agents. http://www.esur.org.
15. Jochelson, M. S., & Lobbes, M. B. I. (2021). Contrast-enhanced Mammography: State of the Art. Radiology, 299(1), 36–48. doi.org/10.1148/radiol.2021201948.
16. Kim, J., Harper, A., McCormack, V., Sung, H., Houssami, N., Morgan, E., … Fidler-Benaoudia, M. M. (2025). Global patterns and trends in breast cancer incidence and mortality across 185 countries. Nature Medicine, 31(4), 1154–1162. doi.org/10.1038/s41591-025-03502-3.
17. Savaria, D., & Kaushik, C. (2024). Brief communication: The current status of contrast-enhanced mammography in breast imaging. Clinical Imaging, 113, 110213. doi.org/10.1016/j.clinimag.2024.110213.
18. Sensakovic, W. F., Carnahan, M. B., Czaplicki, C. D., Fahrenholtz, S., Panda, A., Zhou, Y., … Patel, B. (2021). Contrast-enhanced Mammography: How Does It Work? RadioGraphics, 41(3), 829–839. doi.org/10.1148/rg.2021200167.
19. Spak, D. A., Plaxco, J. S., Santiago, L., Dryden, M. J., & Dogan, B. E. (2017). BI-RADS® 5th edition: A summary of changes. Diagnostic and Interventional Imaging, 98(3), 179–190. doi.org/10.1016/j.diii.2017.01.001.
20. Tari, D. U., Santarsiere, M., De Lucia, D. R., & Santonastaso, R. (2025). Contrast-enhanced mammography in high-dense breasts: A narrative review. Translational Breast Cancer Research: A Journal Focusing on Translational Research in Breast Cancer, 6, 15. doi.org/10.21037/tbcr-24-64.
21. Vidali, S., Irmici, G., Depretto, C., Bellini, C., Pugliese, F., Incardona, L. A., … Nori Cucchiari, J. (2024). Performance of Contrast-Enhanced Mammography (CEM) for Monitoring Neoadjuvant Chemotherapy Response among Different Breast Cancer Subtypes. Cancers, 16(15), 2694. doi.org/10.3390/cancers16152694.
Адреса для листування:
Карачарова Ірина Юріївна
03115, Київ, вул. Верховинна, 69
КНП «Київський міський клінічний онкологічний центр»
E-mail: irakaracharova@gmail.com
Correspondence:
Iryna Karacharova
69 Verkhovynna str., Kyiv, 03115
Kyiv City Clinical Oncology Center
E-mail: irakaracharova@gmail.com














Leave a comment