Протокол NALIRIFOX як новий стандарт лікування метастатичного раку підшлункової залози
Резюме. Лікування метастатичного раку підшлункової залози (РПЗ) залишається складною проблемою сучасної онкології, і протягом тривалого часу прогрес був мінімальним. Поява протоколу NALIRIFOX стала важливим кроком уперед: у дослідженні NAPOLI-3 виявлено його здатність підвищувати результати першої лінії лікування. Стаття присвячена аналізу еволюції системної терапії метастатичного РПЗ та обґрунтуванню ролі протоколу NALIRIFOX як нового стандарту першої лінії лікування. На основі сучасних клінічних досліджень, реальної практики та оновлених міжнародних рекомендацій розглядаються ключові переваги режиму, його ефективність, переносимість та особливості застосування.
DOI: 10.32471/clinicaloncology.2663-466X.35196
Вступ
 РПЗ належить до найагресивніших злоякісних новоутворень шлунково-кишкового тракту. У близько 80–85% пацієнтів його уперше діагностують уже на стадії нерезектабельного або метастатичного процесу, що зумовлює надзвичайно низький рівень виживаності. П’ятирічна загальна виживаність при метастатичному РПЗ не перевищує 3–5%, а медіана тривалості життя за відсутності ефективної терапії становить лише 3–6 міс [1].
РПЗ належить до найагресивніших злоякісних новоутворень шлунково-кишкового тракту. У близько 80–85% пацієнтів його уперше діагностують уже на стадії нерезектабельного або метастатичного процесу, що зумовлює надзвичайно низький рівень виживаності. П’ятирічна загальна виживаність при метастатичному РПЗ не перевищує 3–5%, а медіана тривалості життя за відсутності ефективної терапії становить лише 3–6 міс [1].
Попри певний прогрес у системній хімієтерапії, РПЗ залишається захворюванням із найнижчим показником виживаності серед усіх солідних пухлин. Висока хімієрезистентність, складна біологія пухлини, пізня діагностика та обмежені можливості хірургічного втручання визначають потребу у вдосконаленні системного лікування.
Комбінація гемцитабіну з наб-паклітакселом є одним зі стандартів першої лінії терапії метастатичного РПЗ. Вона дозволяє підвищити загальну виживаність порівняно з монотерапією гемцитабіном (медіана загальної виживаності ≈8,5 міс), однак ефект залишається помірним, а токсичність — значною (мієлосупресія, нейропатія, астенія).
Інший комбінований режим — FOLFIRINOX (іринотекан + оксаліплатин + 5-фторурацил + лейковорин) — забезпечує високу ефективність (медіана загальної виживаності ≈11 міс), проте супроводжується високою частотою тяжких побічних реакцій (нейтропенії, діареї, нейротоксичності), що обмежує його застосування у пацієнтів зі зниженим функціональним статусом [2].
Отже, незважаючи на досягнутий прогрес, потреба в більш ефективному та менш токсичному режимі першої лінії лікування метастатичного РПЗ залишається актуальною. Саме в цьому контексті розглядається поява нового протоколу NALIRIFOX, який поєднує ефективність інтенсивної терапії з потенційно поліпшеним профілем безпеки.
Характеристика протоколу NALIRIFOX
Протокол NALIRIFOX (наноліпосомальний іринотекан, оксаліплатин, лейковорин, 5-фторурацил) є сучасною комбінаційною схемою хімієтерапії, призначеною для лікування метастатичного РПЗ. Його ключовою особливістю є застосування пегильованої ліпосомальної форми іринотекану, зареєстрованої в Україні під назвою ОНІВАЙД® ПЕГИЛЬОВАНИЙ ЛІПОСОМАЛЬНИЙ. Цей лікарський засіб забезпечує цільову доставку активної речовини до пухлинних клітин, покращену стабільність у плазмі крові та знижений рівень системної токсичності порівняно з традиційною формою препарату [3].
Склад протоколу NALIRIFOX включає:
1) пегильований ліпосомальний іринотекан — 50 мг/м² внутрішньовенно;
2) оксаліплатин — 60 мг/м² внутрішньовенно;
3) лейковорин — 400 мг/м² внутрішньовенно;
4) 5-фторурацил — 2400 мг/м² у вигляді 46-годинної інфузії;
цикл повторюється кожні 2 тиж.
Механізм дії цієї комбінації базується на синергічному впливі цитостатиків:
- пегильований ліпосомальний іринотекан інгібує топоізомеразу I, порушуючи реплікацію ДНК;
- оксаліплатин зумовлює міжниткові перехресні зв’язки ДНК;
- 5-фторурацил блокує фермент тимідилатсинтазу, пригнічуючи синтез ДНК;
- лейковорин потенціює цитотоксичний ефект 5-фторурацилу [4].
Клінічні докази ефективності (NAPOLI-3)
Провідним клінічним дослідженням, на основі якого протокол NALIRIFOX був включений до міжнародних рекомендацій з лікування метастатичного РПЗ та схвалений Управлінням з контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA), було дослідження NAPOLI-3.
У міжнародному рандомізованому відкритому дослідженні III фази NAPOLI-3 (Wainberg Z.A. та співавт., 2023) порівнювали ефективність та безпеку NALIRIFOX із комбінацією наб-паклітакселу та гемцитабіну у пацієнтів із метастатичною протоковою аденокарциномою підшлункової залози, які не отримували попереднього системного лікування. У дослідження залучено понад 770 пацієнтів, рандомізованих у співвідношенні 1:1. Основною кінцевою точкою була загальна виживаність, а вторинними — виживаність без прогресування та об’єктивна частота відповіді на лікування (Objective Response Rate — ORR). Результати дослідження NAPOLI-3 свідчать, що NALIRIFOX достовірно підвищував медіану загальної виживаності (11,1 міс проти 9,2 міс; відношення ризиків (Hazard ratio — HR)=0,83; p=0,036) та виживаності без прогресування (7,4 міс проти 5,6 міс; HR=0,69; p<0,001) порівняно з контрольною групою. Профіль токсичності був очікуваним і контрольованим: найчастішими побічними явищами були діарея, нудота, нейтропенія та периферична нейропатія. Отримані дані підтвердили, що NALIRIFOX є новим ефективним стандартом першої лінії терапії метастатичного РПЗ, забезпечуючи підвищення виживаності без істотного зростання токсичності [5].
У результатах NAPOLI-3 вперше представлено статистично значуще підвищення виживаності у пацієнтів з метастатичним РПЗ порівняно з усталеною схемою гемцитабін +наб-паклітаксел, що стало підґрунтям для затвердження NALIRIFOX як нового стандарту першої лінії системної терапії в цій когорті хворих.
Аспекти застосування NALIRIFOX у реальній клінічній практиці
Впровадження режиму NALIRIFOX у лікування метастатичної протокової аденокарциноми підшлункової залози передбачає комплексний підхід, що включає відбір пацієнтів, обґрунтоване дозування, своєчасний менеджмент токсичності та завчасне планування подальших ліній терапії. Дані реальної клінічної практики свідчать, що ефективність та переносимість схеми значною мірою залежать від дотримання цих стратегічних принципів. Так, у дослідженні A. Reichinger та співавт. (2025) представлено результати реальної клінічної практики застосування режиму NALIRIFOX у пацієнтів із метастатичною протоковою аденокарциномою підшлункової залози [6]. Автори проаналізували ефективність, переносимість та ключові прогностичні фактори у невідібраної популяції хворих, що відображає реальні клінічні умови поза рамками контрольованих досліджень. Зокрема, у цьому дослідженні представлено розподіл відповідей на лікування серед пацієнтів, які отримували терапію за режимом NALIRIFOX у реальній клінічній практиці. Часткова відповідь на терапію відмічалася у 37,5% хворих, що становило найбільшу частку пацієнтів у вибірці. Стабілізацію захворювання відзначено у 20% осіб, тоді як прогресування — у 35%. У 7,5% випадків оцінити відповідь було неможливо через відсутність контрольної візуалізації або раннє припинення терапії. Сукупно часткова відповідь на терапію і стабілізація стану забезпечили рівень контролю захворювання 57,5% (рис. 1). Медіана загальної виживаності майже не відрізнялася між пацієнтами, які досягли часткової відповіді (13,18 міс), і тими, у кого зафіксовано стабілізацію патології (12,79 міс; p=0,874). Водночас обидві ці категорії суттєво переважали групу з прогресуванням, де показник загальної виживаності був значно нижчим і становив лише 2,07 міс (p=0,0000035).
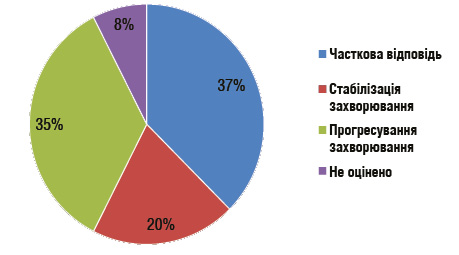
Рис. 1. Розподіл відповідей на лікування серед пацієнтів, які отримували режим NALIRIFOX [6]
Режим NALIRIFOX зумовив значущий рівень контролю захворювання та виживаності, особливо серед пацієнтів із кращим функціональним статусом та нижчими рівнями онкомаркера підшлункової залози (CA 19-9). Отримані дані підтверджують доцільність використання NALIRIFOX як ефективної терапії першої лінії та підкреслюють важливість індивідуалізації підходу, включно з моніторингом токсичності та своєчасною корекцією доз. Це дослідження доповнює наявні доказові дані, фіксуючи реальну ефективність схеми поза межами рандомізованих клінічних досліджень.
Загалом аналіз цілої низки клінічних досліджень підтверджує, що кандидатами для терапії NALIRIFOX є пацієнти з функціональним статусом ECOG 0–2, достатнім резервом печінкової функції та компенсованими супутніми хворобами. Успішність терапії значною мірою залежить від раннього застосування супровідних заходів: належної гідратації, профілактики діареї, антиеметичної підтримки та моніторингу електролітів. Особлива увага приділяється моніторингу можливих проявів нейротоксичності (оксаліплатин) та з боку шлунково-кишкового тракту. Зокрема, наноліпосомальний іринотекан, який є ключовим компонентом NALIRIFOX, метаболізується переважно печінкою, тому необхідно періодично оцінювати рівень білірубіну та трансаміназ [3, 7].
Найпоширенішими побічними ефектами терапії NALIRIFOX, що включає пегильований ліпосомальний іринотекан, є діарея, втома, нудота та блювання, зниження апетиту, біль у животі, зміни слизової оболонки та зменшення маси тіла. У дослідженні NAPOLI-3 серед реакцій III–IV ступеня тяжкості з частотою ≥10% відмічалися діарея та нейтропенія [8, 9]. Додатковий аналіз даних цього дослідження свідчить, що корекція доз ліпосомального іринотекану або оксаліплатину не знижує загальну виживаність, що обґрунтовує можливість адаптації доз у реальній клінічній практиці. Крім того, останні дані підкреслюють, що своєчасне застосування антидіарейних засобів є важливим для зниження токсичності та може позитивно впливати на результати лікування [10].
Якість життя, пов’язана зі здоров’ям (HRQoL), у пацієнтів, які отримували терапію NALIRIFOX (Melisi D. та співавт., 2025) [11]
У дослідженні D. Melisi та співавт. (2025), проведеному в межах III фази дослідження NAPOLI-3, було оцінено вплив терапії NALIRIFOX на показники якості життя, пов’язаної зі здоров’ям (Health-Related Quality of Life — HRQoL), та працездатності (ECOG PS) у пацієнтів із метастатичною аденокарциномою підшлункової залози, які раніше не отримували системного лікування. Автори довели, що, попри вищу ефективність NALIRIFOX порівняно з комбінацією гемцитабін + наб-паклітаксел, цей режим не призводив до зниження HRQoL чи прискорення зниження функціонального статусу. Показники стану здоров’я залишалися стабільними, а час до зниження якості життя та працездатності був довшим у групі NALIRIFOX. Отримані результати підтверджують сприятливий баланс ефективності та переносимості NALIRIFOX як варіанта першої лінії лікування метастатичного РПЗ [11].
Так, встановлено, що лікування за схемою NALIRIFOX забезпечує перевагу щодо загальної та виживаності без прогресування порівняно з комбінацією гемцитабін +наб-паклітаксел, без шкоди для HRQoL. Оцінювання якості життя проводили з використанням опитувальника EORTC QLQ-C30 (опитувальник Європейської організації з досліджень і лікування раку для оцінки якості життя онкологічних хворих, який складається з 30 запитань) у вихідній точці, у 1-й день кожного циклу лікування та після завершення терапії.
Конкретизуючи, у пацієнтів із метастатичною аденокарциномою підшлункової залози, які отримували терапію NALIRIFOX або гемцитабін +наб-паклітаксел у рамках III фази дослідження NAPOLI-3, відмічалося помірне зниження інтегрального показника загального стану (General Health Scale — GHS) здоров’я до 12 тиж. NALIRIFOX: зміна LS-середнього −2,4 (95% довірчий інтервал (ДІ) −5,9 — 1,1) гемцитабін + наб-паклітаксел: −0,7 (95% ДІ −4,2 — 2,9). Після 16-го тижня подальшого погіршення глобального стану не відзначалося в жодній групі. Час до погіршення (Time to Deterioration — TTD) GHS свідчить про перевагу NALIRIFOX: HR=0,74 (95% ДІ 0,53–1,04; номінальне p=0,08), що відповідає 26% зниженню ризику погіршення якості життя порівняно з комбінацією гемцитабін + наб-паклітаксел.
Функціональні домени — фізичне, рольове, емоційне, когнітивне та соціальне функціонування — у пацієнтів, які отримували NALIRIFOX, залишалися стабільними протягом усього періоду лікування. У симптоматичних шкалах фіксувалося очікуване та кероване підвищення частоти шлунково-кишкових проявів, включно з нудотою та діареєю, що відповідає відомому профілю токсичності компонентів NALIRIFOX (іринотекан та оксаліплатин). Показники болю мали тенденцію до стабілізації або помірного зменшення вираженості, що пояснюється ефективним контролем проявів захворювання.
Показники часу до зниження працездатності (Performance Status — PS) за шкалою Східної кооперативної онкологічної групи (Eastern Cooperative Oncology Group — ECOG) були статистично значуще довшими у групі NALIRIFOX: HR=0,72 (95% ДІ 0,55–0,92; p=0,009). Цей результат підтверджує, що підвищення виживаності, досягнуте завдяки NALIRIFOX, не супроводжується пришвидшеним погіршенням функціонального стану пацієнтів.
Поєднано з результатами основного дослідження NAPOLI-3 дані, отримані D. Melisi та співавт. (2025), свідчать, що терапія першої лінії NALIRIFOX забезпечує клінічно значущі переваги щодо ефективності без негативного впливу на показники HRQoL та функціонального статусу порівняно з комбінацією гемцитабін + наб-паклітаксел. Сукупність доказів підтверджує доцільність застосування NALIRIFOX як нового режиму першої лінії для лікування пацієнтів із метастатичним РПЗ.
Міжнародні рекомендації та регуляторний статус FDA і EMA (2024). Відображення в настановах NCCN, ESMO. Впровадження в Україні
У 2024 р. протокол NALIRIFOX (ліпосомальний іринотекан + оксаліплатин + 5-фторурацил + фолінова кислота) отримав офіційне схвалення провідних регуляторних органів США та Європи для застосування в першій лінії лікування метастатичної аденокарциноми підшлункової залози.
13 лютого 2024 р. FDA схвалило використання ліпосомального іринотекану (Onivyde) у складі комбінації NALIRIFOX на підставі результатів багатоцентрового рандомізованого дослідження NAPOLI-3, яке зафіксувало достовірне підвищення загальної та виживаності без прогресування порівняно з режимом гемцитабін + наб-паклітаксел [12].
EMA у першій половині 2024 р. ухвалило позитивне рішення щодо розширення показань препарату Onivyde (ліпосомальний іринотекан), включивши його застосування у складі NALIRIFOX як варіант першої лінії терапії метастатичної аденокарциноми підшлункової залози. Так, обидва регулятори — FDA та EMA — визнали NALIRIFOX новим стандартом першої лінії лікування метастатичного РПЗ [13].
Після публікації результатів дослідження NAPOLI-3 та регуляторних рішень Національна мережа багатопрофільних онкологічних закладів (National Comprehensive Cancer Network — NCCN) включила комбінацію NALIRIFOX до своїх оновлених рекомендацій 2024 р. як опцію першої лінії для пацієнтів із метастатичним РПЗ із рівнем доказовості Category 1 [14].
Європейське товариство медичної онкології (European Society for Medical Oncology — ESMO) також відобразило цей режим у своїх оновленнях клінічних рекомендацій та Express Update щодо лікування РПЗ, визнавши його доцільним для пацієнтів із задовільним функціональним статусом (PS 0–1) (рис. 2) [15].
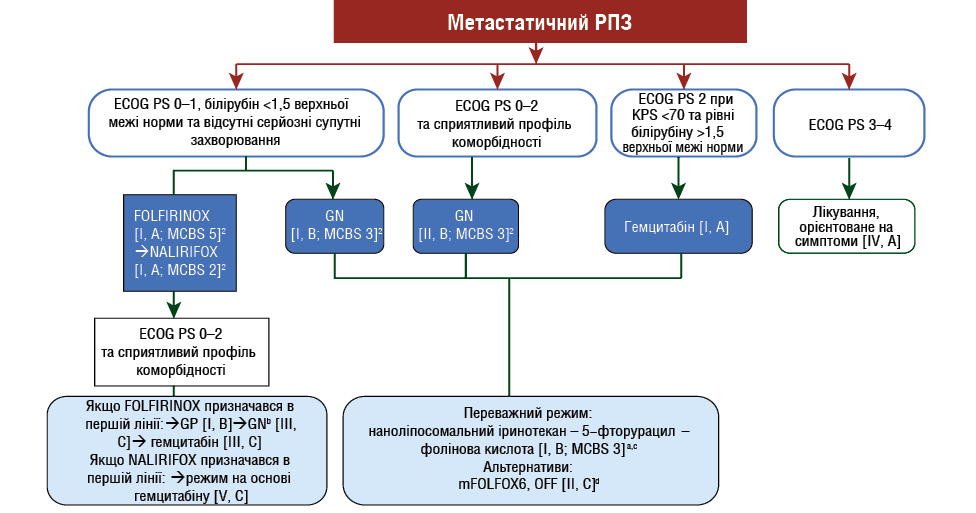
Рис. 2. Оновлений алгоритм ведення хворих з метастатичним раком підшлункової залози [15]
Примітки: GN (gemcitabine + nab-paclitaxel) — гемцитабін + наб-паклітаксел; GP (gemcitabine + paclitaxel) — гемцитабін + паклітаксел; KPS (Karnofsky performance status) — Шкала функціонального стану Карновського (індекс працездатності Карновського).
aДля оцінки нових варіантів терапії, схвалених Європейським агентством з лікарських засобів (European Medicines Agency — EMA) або FDA, використано ESMO-MCBS v1.16.
bНе схвалено EMA або FDA як терапію другої лінії.
cЗастосовується лише у пацієнтів із ECOG PS 0–1 або після відновлення до цього рівня.
dЯкщо не застосовувалося раніше.
Рішення FDA та EMA спираються на дані дослідження NAPOLI-3, в яких встановлено статистично значуще підвищення виживаності порівняно з режимом гемцитабін + наб-паклітаксел [12, 13].
Так, режим NALIRIFOX характеризується прогнозованим профілем токсичності — переважно нейтропенією, діареєю та периферичною нейропатією — та потребує ретельного відбору пацієнтів і відповідних протоколів підтримувальної терапії. Рекомендації з дозування та управління побічними ефектами наведені в офіційній інструкції для медичних працівників Onivyde [16].
У вітчизняному Стандарті медичної допомоги «Рак підшлункової залози» (далі — Стандарт), затвердженому наказом Міністерства охорони здоров’я (МОЗ) України від 15 жовтня 2025 р. № 1573, режим NALIRIFOX визначено як рекомендований варіант першої лінії системної терапії у пацієнтів із метастатичною аденокарциномою підшлункової залози [17]. Згідно з положеннями Стандарту, цей режим рекомендований для хворих з функціональним статусом ECOG 0–2, для яких його застосування забезпечує оптимальний баланс між ефективністю та контрольованим профілем токсичності.
Важливо відзначити, що Cтандарт також допускає використання NALIRIFOX у пацієнтів із помірним зниженням функціонального стану (ECOG 2). У таких випадках рішення про призначення терапії слід ухвалювати на підставі комплексної оцінки загального стану пацієнта, коморбідностей. Особливу увагу необхідно приділяти ранньому менеджменту токсичності, корекції доз та підтримувальній терапії, що дозволяє забезпечити контроль захворювання і підтримку якості життя навіть у хворих із ECOG 2.
Так, NALIRIFOX у Стандарті МОЗ України розглядається як універсальний варіант першої лінії системної терапії для широкого спектра пацієнтів із метастатичним РПЗ, включно з тими, хто має помірне зниження функціонального статусу, із можливістю індивідуальної адаптації лікування для забезпечення максимальної ефективності та безпеки.
Висновки
1. NALIRIFOX є новим ефективним стандартом першої лінії терапії метастатичного РПЗ, що поєднує високу ефективність із контрольованим профілем токсичності.
2. Ключовою інновацією протоколу є застосування пегильованого ліпосомального іринотекану, який забезпечує цільову доставку препарату, тривалішу циркуляцію в плазмі крові та знижує системну токсичність.
3. Реальна клінічна практика підтверджує, що NALIRIFOX є ефективним та добре керованим режимом першої лінії для лікування метастатичної аденокарциноми підшлункової залози. Режим забезпечує високий рівень контролю захворювання, особливо у пацієнтів із кращим функціональним статусом. Успіх терапії значною мірою залежить від правильного відбору пацієнтів, раннього менеджменту токсичності та супровідної підтримки. Зібрані дані демонструють, що NALIRIFOX має сприятливий баланс ефективності та переносимості.
4. Результати оцінки якості життя в межах дослідження NAPOLI-3 свідчать, що терапія NALIRIFOX забезпечує не лише кращу протипухлинну ефективність, а й збереження показників HRQoL та функціонального статусу пацієнтів із метастатичним РПЗ.
5. У 2024 р. FDA та EMA офіційно схвалили комбінацію NALIRIFOX для першої лінії лікування метастатичного РПЗ. Режим внесений до міжнародних настанов NCCN (Category 1) та ESMO (Express Update 2025) як рекомендований варіант терапії.
6. Згідно з наказом МОЗ України від 15.10.2025 р. № 1573, режим NALIRIFOX включено до національного Стандарту як рекомендований варіант першої лінії у пацієнтів з функціональним статусом ECOG 0–2.
7. Режим NALIRIFOX розширює можливості системного лікування РПЗ, забезпечуючи оптимальний баланс між ефективністю та переносимістю.
список використаної Літератури
1. Takumoto, Y., Sasahara, Y., Narimatsu, H., & Akazawa, M. (2022). Comparative outcomes of first-line chemotherapy for metastatic pancreatic cancer among the regimens used in Japan: A systematic review and network meta-analysis. JAMA Network Open, 5(1), e2145515. doi: 10.1001/jamanetworkopen.2021.45515.
2. Nichetti, F., Rota, S., Ambrosini, P., Pircher, C., Gusmaroli, E., Droz Dit Busset, M., … Niger, M. (2024). NALIRIFOX, FOLFIRINOX, and gemcitabine with nab-paclitaxel as first-line chemotherapy for metastatic pancreatic cancer: A systematic review and meta-analysis. JAMA Network Open, 7(1), e2350756. doi.org/10.1001/jamanetworkopen.2023.50756.
3. Ipsen (2023). Ipsen presents Phase III NAPOLI 3 trial of Onivyde® regimen demonstrating positive survival results in previously untreated metastatic pancreatic ductal adenocarcinoma at ASCO GI [Press release]. http://www.ipsen.com/ websites/Ipsen_Online/wp-content/uploads/ 2023/ 01/20140534/Ipsen-NAPOLI-3- Phase-III- Press-Release-01-2023.pd.
4. Tempero, M. A., Pelzer, U., O’Reilly, E. M., Winter, J., Oh, D. Y., Li, C. P., Tortora, G., … Reni, M. (2023). Adjuvant nab-paclitaxel + gemcitabine in resected pancreatic ductal adenocarcinoma: Results from a randomized, open-label, phase III trial. Journal of Clinical Oncology, 41(11), 2007–2019. doi: 10.1200/JCO.22.01134.
5. Wainberg, Z. A., Melisi, D., Macarulla, T., Pazo Cid, R., Chandana, S. R., De La Fouchardière, C., … O’Reilly, E. M. (2023). NALIRIFOX versus nab-paclitaxel and gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): A randomised, open-label, phase 3 trial. The Lancet, 402(10409), 1272–1281. doi: 10.1016/S0140-6736(23)01366-1.
6. Reichinger, A., Friedrich, A., Lentner, T., Taghizadeh, H., Reimann, P., Nothdurfter, D., … Prager, G. W. (2025). NALIRIFOX in the treatment of metastatic pancreatic ductal adenocarcinoma: An exploratory analysis of real-world data. ESMO Open, 10(10), 105827. doi.org/10.1016/j.esmoop.2025.105827.
7. Wainberg, Z. A., Bekaii-Saab, T., Boland, P. M., Dayyani, F., Macarulla, T., Mody, K., … Dean, A. (2021). First-line liposomal irinotecan with oxaliplatin, 5-fluorouracil and leucovorin (NALIRIFOX) in pancreatic ductal adenocarcinoma: A phase I/II study. European Journal of Cancer, 151, 14–24. doi.org/10.1016/j.ejca.2021.03.028.
8. Smith, C. J., Bekaii-Saab, T. S., Cook, K. D., Eiring, R. A., Halfdanarson, T. R., Hanna, M., … Jatoi, A. (2021). Nanoliposomal irinotecan (Nal-IRI)-based chemotherapy after irinotecan-based chemotherapy in patients with pancreas cancer. Pancreatology, 21(2), 379–383. doi.org/10.1016/j.pan.2020.10.042.
9. Wainberg, Z. A., Melisi, D., Macarulla, T., Pazo Cid, R., Chandana, S. R., De La Fouchardière, C., … O’Reilly, E. M. (2025). A plain language summary of NALIRIFOX compared with nab-paclitaxel and gemcitabine for patients with metastatic pancreatic cancer (NAPOLI 3). Future Oncology, 21(7), 765–774. doi.org/10.1080/14796694.2025.2458458.
10. Chung, V., Kochenderfer, M., Natarajan, N., Williams, G. R., Laursen, A. A., Cockrum, P., … Zervoudakis, A. (2025). Characteristics of long‑term survivors and impact of dose adjustments in first-line NALIRIFOX treatment for metastatic pancreatic ductal adenocarcinoma: post hoc analyses of NAPOLI‑3. J. Clin. Oncol., 43(17), LBA4175. doi: 10.1200/JCO.2025.43.17_suppl.LBA4175.
11. Melisi, D., Macarulla, T., De La Fouchardière, C., Pazo Cid, R. A., Chandana, S. R., Kiss, I., … Wainberg, Z. A. (2025). Health-related quality of life and performance status with NALIRIFOX versus nab-paclitaxel + gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma: Results from the NAPOLI 3 trial. ESMO Open, 10(8), 105534. doi.org/10.1016/j.esmoop.2025.105534.
12. Urooj, W., Ahmed, B., Shahzad, Y., Siddiqui, A., Un Nisa Mughal, Z., & Abbasher Hussien Mohamed Ahmed, K. (2024). FDA endorses NALIRIFOX for metastatic pancreatic adenocarcinoma: An editorial. Annals of Medicine and Surgery, 86(10), 5685–5687. doi: 10.1097/MS9.0000000000002564.
13. European Medicines Agency (2024). Onivyde pegylated liposomal (previously Onivyde). http://www.ema.europa.eu/en/medicines/human/EPAR/onivyde-pegylated-liposomal.
14. National Comprehensive Cancer Network (2025). NCCN Guidelines for Patients: Pancreatic Cancer [PDF]. http://www.nccn.org/patients/guidelines/
content/PDF/pancreatic-patient.pdf.
15. Conroy, T., Ducreux, M., & ESMO Guidelines Committee (2025). ESMO Clinical Practice Guideline Express update on the management of metastatic pancreatic cancer. ESMO Open, 10(4), 104528. doi.org/10.1016/j.esmoop.2025.104528.
16. European Medicines Agency (2024). Onivyde pegylated liposomal: EPAR — Product information [PDF]. http://www.ema.europa.eu/en/documents/
product-information/onivyde-pegylated- liposomal-epar-product-information_en.pdf.
17. Міністерство охорони здоров’я України (2025). Наказ від 15.10.2025 р. № 1573 «Стандарт медичної допомоги. Рак підшлункової залози» [PDF]. moz.gov.ua/storage/uploads/72237259-51a8-4b9c-8694- bc0a63a4246d/dn_1573_15102025_dod.pdf.
Адреса для листування:
Лялькін Сергій Анатолійович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: slyalkin@yahoo.com
Correspondence:
Sergiі Lyalkin
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: slyalkin@yahoo.com
На замовлення ТОВ «Серв’є Україна».
В Україні ліпосомальний іринотекан зареєстрований під торговельною назвою ОНІВАЙД® пегильований ліпосомальний. Інструкція для медичного застосування лікарського засобу ОНІВАЙД® пегильований ліпосомальний.
РП № UA/18775/01/01, Наказ МОЗ України від 20.08.2021 р. № 1768.
Дата останнього перегляду 18.08.2025 ONY-С1-2 (2025–2027, 2 years)-57














Leave a comment