Мета виправдовує засіб — органозберігальне хірургічне лікування у хворих на рак шийки матки із застосуванням неоад’ювантної хімієтерапії
Дерменжи Т.В.1, Свінціцький В.С.1, Свінціцька А.В.1, Таран Л.М.1, Климова В.В.2, Степаненко С.В.1
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Національний університет охорони здоров’я України ім. П.Л. Шупика, Київ, Україна
Резюме. Рак шийки матки (РШМ) є складною патологією, що потребує індивідуального підходу з урахуванням онкологічної безпеки матері, стану плода та можливостей збереження репродуктивної функції. Мета. Представити клінічний випадок РШМ з аналізом лікувально-діагностичної тактики із застосуванням неоад’ювантної хімієтерапії (НАХТ) та органозберігального хірургічного лікування. Клінічний випадок. Описано випадок 24-річної жінки з інвазивною плоскоклітинною HPV-асоційованою карциномою шийки матки низького ступеня злоякісності. Лікування та результати. Проведено 2 курси НАХТ з подальшим органозберігальним хірургічним лікуванням. Ознак рецидиву не виявлено. Висновки. Індивідуальний мультидисциплінарний підхід дозволяє досягти задовільних онкологічних результатів зі збереженням репродуктивного потенціалу.
Одержано 4.11.2025
Прийнято до друку 14.11.2025
DOI: 10.32471/clinicaloncology.2663-466X.35246
ВСТУП
РШМ є 4-м найпоширенішим видом онкопатології у жінок у світі. Його часто діагностують у осіб віком 35–44 років, і це 2-га провідна причина смерті від раку у жінок віком 20–39 років [30]. Стандартним лікуванням для пацієнток з ранньою стадією захворювання (стадія IA2–IB1) є / була радикальна гістеректомія з дисекцією тазових лімфатичних вузлів, тоді як пацієнток з місцево-поширеним та метастатичним захворюванням лікують первинною променевою терапією (ПТ) +/− системним лікуванням [7].
Оскільки 37% пацієнток із вперше діагностованим РШМ молодші за 45 років, часто бажаними є варіанти лікування для збереження фертильності. Хірургічні методи терапії включають радикальну та просту трахелектомію, а також конізацію шийки матки. У деяких випадках місцево-поширеного захворювання, коли збереження матки не є можливим, збереження фертильності можна підтримувати за допомогою допоміжних репродуктивних технологій (ДРТ) та транспозиції яєчників, які також мають перевагу у збереженні гормональної функції яєчників [32, 39].
РШМ є одним з найпоширеніших гінекологічних новоутворень під час вагітності. РШМ під час вагітності не має явних специфічних симптомів, таких як вагінальні кровотечі та вагінальні виділення, що не мають специфічності, їх легко сплутати із загрозою викидня та передчасних пологів, що може вплинути на діагноз [5].
Вплив на рівень виявлення РШМ під час вагітності, ймовірно, можна розподілити на 2 основні аспекти:
- недостатня обізнаність про скринінг РШМ;
- аномальні результати пренатального скринінгу на РШМ.
Наразі діагностика та лікування РШМ під час вагітності повинні базуватися на патологічному дослідженні, стадії захворювання та розвитку плода (чи є аномалії при ультразвуковому дослідженні (УЗД) та чи є нормальним каріотип хромосом), а також на бажанні вагітної та членів її сім’ї щодо продовження вагітності тощо, на основі чого встановлюються діагноз та план лікування.
Першочергово, залежно від рішення вагітної та її родини продовжувати вагітність, у будь-який час можна провести операцію з переривання вагітності або хімієрадіотерапію. Загалом слід рекомендувати переривання вагітності та рутинну операцію з приводу РШМ. Пацієнткам з РШМ на ранній стадії, яким необхідно зберегти репродуктивну функцію, після переривання вагітності може бути проведена операція зі збереження репродуктивної функції. Якщо пацієнтка бажає продовжити вагітність, то, відповідно, необхідно ухвалити рішення щодо діагнозу та плану лікування до патологічної стадії та терміну вагітності.
При IA2–IB1, пухлинах діаметром <2 см та відсутності ураження лімфатичних вузлів може бути проведена проста цервікектомія або велика конізація. Радикальна цервікектомія під час вагітності не рекомендується. Для РШМ більш високого ступеня НАХТ є єдиним методом лікування, який дозволяє зберегти плід до терміну [40].
C. Kohler та співавт. спостерігали пацієнтку на 22-му тижні вагітності, в якої було виявлено стадію IB3. Хворій було проведено 3 курси НАХТ, після чого — дозрівання легень плода, а потім ще 1 курс НАХТ, потім — покращене передопераційне обстеження та хірургічне лікування на 36-му тижні вагітності. Швидкість проходження плацентарних препаратів на основі платини була низькою [17]. НАХТ зазвичай використовує або схему на основі платини, або на основі таксанів, або комбіновану. У цьому разі було проведено внутрішньовенну хімієтерапію паклітакселом, зв’язаним з альбуміном, у комбінації з цисплатином.
РШМ, діагностований під час вагітності, залишається великим викликом для клініцистів, які мають справу з цією патологією. Відносно невисока частота захворювання, етичні проблеми при проведенні рандомізованих досліджень, недооцінка невдалих випадків та відмінності в лікуванні в кожному конкретному випадку — все це є причинами, через які наші знання з цієї теми все ще є обмеженими. Нашою метою, коли це можливо, має бути забезпечення найкращого онкологічного результату, зберігаючи при цьому вагітність і народжуючи здорове немовля.
РШМ, діагностований на пізніх стадіях, пов’язаний з менш сприятливим результатом для пацієнтки. Хоча РШМ на ранній стадії, діагностований під час вагітності, має кращий прогноз і менший розмір пухлини, що дозволяє проводити хірургічні втручання зі збереженням вагітності (лімфаденектомія для оцінки лімфатичних вузлів, конізація або трахелектомія) або відстрочку лікування до терміну, така терапія не є можливою на пізніх стадіях [2]. Згідно з рекомендаціями, радикальна трахелектомія більше не повинна розглядатися під час вагітності, особливо при місцево-поширеному захворюванні, через частоту передчасних пологів, що досягає 60% [36].
Переривання вагітності, пов’язане з місцево-поширеним РШМ, і подальше стандартне лікування можуть бути простим виходом із ситуації. Зі зростанням успішності онкологічних методів лікування зараз ще більш важливо впроваджувати процедури, спрямовані на збереження фертильності та вагітності. Враховуючи нові дані про застосування неоад’ювантної хімієтерапії при РШМ та безпеку хімієтерапії під час вагітності, постає питання, чи слід у всіх випадках переривати вагітність, ускладнену місцево-поширеним РШМ. У вагітних з місцево-поширеним РШМ, які мають сильне бажання продовжити вагітність, НАХТ може бути безпечним способом продовжити вагітність до дозрівання плода, контролюючи при цьому онкопатологію.
Радикальна трахелектомія з оцінкою лімфатичних вузлів
Окремим пацієнткам з ранньою стадією РШМ, які бажають зберегти фертильність, можна виконати трахелектомію [41]. Радикальна трахелектомія була вперше описана Д. Даргентом (D. Dargent) у 1987 р. [11] і полягає у видаленні шийки матки, країв піхви та параметріїв. Історичні показання до трахелектомії включали стадію IA1 з інвазією лімфоваскулярного простору, стадію IA2–IB1 (розмір пухлини ≤2 см), негативне метастазування у вузли та відсутність глибокої стромальної інвазії [1, 19]. Виключення захворювання вузлів перед лікуванням для збереження фертильності має вирішальне значення, оскільки позитивні лімфатичні вузли є несприятливим прогностичним фактором і можуть визначити відповідне лікування. Можливість картування сторожових лімфатичних вузлів призвела до зміни парадигми в оцінці лімфатичних вузлів при РШМ. Згідно з рекомендаціями Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN), біопсія сторожових лімфатичних вузлів може замінити дисекцію тазових лімфатичних вузлів на стадії IA1 за класифікацією Міжнародної федерації гінекології та акушерства (The International Federation of Gynecology and Obstetrics — FIGO) 2018 р. з інвазією лімфоваскулярного простору та стадією IA2–IB1 [16], тоді як у рекомендаціях Європейського товариства гінекологічної онкології (European Society of Gynaecological Oncology — ESGO) 2023 р. дисекцію тазових лімфатичних вузлів слід проводити на стадії IB1 з негативними сторожовими лімфатичними вузлами, що заморожені [7]. Хоча дані проспективних досліджень SENTICOL I та SENTICOL II свідчать, що відсутність повної тазової лімфаденектомії у пацієнтів зі стадією IA–IIA із двосторонніми негативними сторожовими лімфатичними вузлами, здається, не пов’язана з підвищенням частоти рецидивів, докази точності та онкологічної безпеки біопсії сторожових лімфатичних вузлів при РШМ все ще розробляються, і необхідні додаткові проспективні дані [4]. A. Nica та співавт. оцінили результати лікування пацієнтів з ранньою стадією РШМ (розмір пухлини ≤2 см), які перенесли конізацію шийки матки з лапароскопічною оцінкою сторожових лімфатичних вузлів [23]. З 44 пацієнток, залучених до аналізу, у 93% були негативні сторожові лімфатичні вузли та вони не потребували подальших процедур на лімфатичних вузлах, тоді як у 6,8% жінок були виявлені мікрометастази в сторожових лімфатичних вузлах та їм було проведено іпсилатеральну лімфаденектомію. Усі решта несторожових лімфатичних вузлів були негативними. Після медіанного періоду спостереження 44 міс — рецидивів не задокументовано.
Іншим ретроспективним дослідженням охоплено 36 пацієнток з РШМ IA2–IBI стадії [12]. Усім пацієнтам було проведено лапароскопічну дисекцію сторожових лімфатичних вузлів. З них 50% перенесли лише дисекцію сторожового лімфатичного вузла, а 50% — дисекцію сторожового лімфатичного вузла з подальшою повною дисекцією тазових лімфатичних вузлів. Загалом зафіксовано 4 рецидиви: 2 в групі сторожової та 2 в групах тазової лімфаденектомії. Результати цих досліджень є багатонадійними, але для аналізу точності дисекції сторожових лімфатичних вузлів при ранній стадії РШМ та оцінки безпеки мінімально інвазивних операцій з метою вивчення стану лімфатичних вузлів потрібні масштабніші проспективні дослідження.
З моменту публікації дослідження лапароскопічного підходу до РШМ [26] безпека малоінвазивної хірургії (МІХ) для радикальної трахелектомії викликала певні занепокоєння. Дослідження LACC було рандомізованим контрольованим дослідженням, яке оцінювало виживаність без захворювання у пацієнток, які перенесли МІХ, порівняно з відкритою радикальною гістеректомією з приводу РШМ на ранній стадії. У результатах зафіксовано підвищені показники рецидивів та смертності у хворих, які перенесли радикальну гістеректомію за допомогою підходу МІХ у пацієнток зі стадією IB2, оскільки вони становили більшість досліджуваної когорти. Проспективні дані щодо МІХ порівняно з відкритими операціями при РШМ IA2 / IB1 стадії обмежені, як і безпека МІХ для оцінки лімфатичних вузлів у цих пацієнток.
Подальше порівняння МІХ та відкритої радикальної трахелектомії було опубліковано Міжнародною оцінкою радикальної трахелектомії (International Radical Trachelectomy Assessment — IRTA) [28]. У цьому ретроспективному дослідженні до аналізу залучено 646 пацієнтів. 358 перенесли відкриту операцію, а 288 — МІХ. Через 4,5 року у 4,8% відмічався рецидив при відкритій операції та у 6,3% — при МІХ, але це не було статистично значущим. Крім того, не було різниці в загальній виживаності між групами (99,2% при відкритій операції проти 99,0% при МІХ). Оскільки це не є поширеною процедурою, можливість проведення рандомізованого клінічного дослідження для оцінки результатів виживання при МІХ порівняно з відкритою трахелектомією є малоймовірною, і клінічна практика буде базуватися на найкращих доступних доказах.
Незалежно від хірургічного підходу, радикальність процедури постійно уточнюється для більш консервативних операцій. Залежно від пухлинних факторів, пацієнтам може бути проведена проста трахелектомія або конізація шийки матки, а не радикальна трахелектомія з подібними онкологічними результатами [35].
Проста трахелектомія та конусна біопсія
Обґрунтування проведення більш консервативних хірургічних втручань підтверджується результатами кількох досліджень, що оцінюють ризик ураження параметрія у пацієнток з ранньою стадією РШМ, які мають сприятливі патологічні ознаки (пухлина розміром ≤2 см, глибина інвазії ≤10 мм та негативні тазові лімфатичні вузли) [8, 31]. У цій чітко визначеній когорті пацієнток ризик ураження параметрія нижчий за <1%, що ставить під сумнів користь від видалення параметрія. Хоча конізація шийки матки зазвичай проводиться для лікування високодиференційованих передракових уражень шийки матки [21], вищезазначені дані зумовили проведення досліджень, що оцінюють ефективність конічної біопсії як методу лікування РШМ.
Дослідження ConCerv було першим проспективним дослідженням, яке оцінило доцільність та онкологічні результати конізації окремо або простої гістеректомії при ранній стадії РШМ низького ризику [29]. У це дослідження залучено пацієнток з РШМ стадії IA2–IB1 за класифікацією FIGO (2009), які відповідали наступним критеріям: плоскоклітинний рак або аденокарцинома, розмір пухлини ≤2 см, відсутність інвазії лімфоваскулярного простору, глибина інвазії ≤10 мм, негативні результати візуалізації на метастатичне захворювання та негативні краї конізації. Пацієнткам дозволялося проводити повторну конізацію, якщо перша конізація мала позитивні краї. Жінкам, які бажали зберегти фертильність, проводили 2-гу конізацію з оцінкою тазових лімфатичних вузлів, а тим, хто не бажав зберегти фертильність, проводили просту гістеректомію з оцінкою тазових лімфатичних вузлів. Загалом 44 пацієнтки були залучені до групи збереження фертильності. З них у 2 хворих були позитивні лімфатичні вузли, а в однієї пацієнтки — рецидив захворювання. В однієї пацієнтки з рецидивом патології відмічалася стромальна інвазія на 13 мм під час першої конізації з позитивними краями. Повторна конізація була негативною на рак, але краї були позитивними на дисплазію високого ступеня. Це спонукало дослідників внести зміни до протоколу та виключити пацієнток з позитивними краями не лише на інвазивний рак, але й на внутрішньоепітеліальну неоплазію.
Систематичний огляд, присвячений акушерству та онкологічним результатам лікування раннього РШМ для збереження фертильності, охоплював 347 випадків, для яких проведено конізацію [42]. У цій групі рівень рецидивів становив 0,4%, а рівень вагітності — 36,1% без летальних наслідків. У більш пізньому систематичному огляді оцінювалися репродуктивні та онкологічні результати після операції зі збереження фертильності для пацієнтів стадії IA1–IB1 [22]. До нього залучали пацієнток, яким проведено конізацію / просту трахелектомію або радикальну трахелектомію за допомогою різних хірургічних підходів. З 3044 залучених пацієнток рівень вагітності становив 55,4% у жінок, які намагалися завагітніти, з найвищим клінічним рівнем вагітності після вагінальної трахелектомії (67,5%). Після медіанного періоду спостереження 39,7 міс середній рівень рецидивів раку становив 3,2%, а рівень смертності від нього — 0,6%. Ці дані свідчать про відмінний онкологічний результат та безпеку проведення таких процедур у цих пацієнток.
Ще один аспект, який слід враховувати при виборі методу лікування, — це вплив такого лікування на якість життя. Група гінекологічної онкології (Gynecologic Oncology Group (GOG)-0278 — це дослідження фази I/II, що оцінює фізичну функцію та якість життя у пацієнток з РШМ IA1 стадії з лімфоваскулярною інвазією та IA2–IB1 (≤2 см), яким проведено просту гістеректомію або конусну біопсію з тазовою лімфаденектомією (ClinicalTrials.gov/NCT01649089). Це дослідження розглядатиме сечовивідну, шлунково-кишкову та статеву функції після нерадикальної операції. Набір даних у дослідженні завершено, і очікується, що результати будуть представлені в майбутньому.
НАХТ
НАХТ є альтернативним варіантом для пацієнток з об’ємним РШМ (розмір пухлини >2 см), які бажають зберегти фертильність. Обґрунтуванням призначення хімієтерапії є зменшення пухлини та забезпечення можливості проведення фіксованої супресивної фіксації. Різні схеми хімієтерапії вивчалися в невеликих серіях випадків, включно з паклітакселом / цисплатином / іфосфамідом [25], паклітакселом / цисплатином [38] та карбоплатином / паклітакселом [33], з різною кількістю циклів.
Результати кількох серій випадків, що досліджували онкологічні та акушерські результати НАХТ з подальшим хірургічним втручанням для збереження фертильності у пацієнток з розмірами пухлини 2–4 см, були узагальнені в систематичному огляді [14]. Усі хворі, залучені до цього огляду (n=114), мали РШМ стадії IB2 за шкалою FIGO–2018. Найпоширенішим режимом хімієтерапії була TIP (паклітаксел — (T)axol, іфосфамід — (I)fosfamide, цисплатин — (P)latinum) (89,5% пацієнток). Тазову лімфаденектомію проведено 49% пацієнток до початку НАХТ, тоді як 51% пройшли НАХТ без оцінки лімфатичних вузлів. Лікування, що зберігає фертильність, проведено 99,1% жінок. Найпоширенішою процедурою, що проводилася, була радикальна вагінальна трахелектомія (40,7%). Відповідь на лікування була високою, з повною патологічною відповіддю, повідомленою у 39,5%, та частковою відповіддю — у 45,6%. Що стосується акушерських результатів, то у 69,4% були доношені пологи, у 9,7% — передчасні, а у 16,1% — викидні. Хоча ці дані отримані з невеликих ретроспективних досліджень, ці висновки є багатонадійними. Як згадувалося раніше, використовувалися різні схеми хімієтерапії, і незрозуміло, чи є одна з них кращою за іншу. Крім того, між дослідженнями не було узгодженості щодо часу проведення дисекції лімфатичних вузлів. Хоча в деяких дослідженнях дисекцію лімфатичних вузлів проводили після НАХТ, можна стверджувати, що її слід проводити до початку НАХТ, оскільки позитивні лімфатичні вузли пов’язані з несприятливим прогнозом, і цим пацієнтам знадобиться ад’ювантне лікування хімієтерапією та ПТ [24].
НАХТ при РШМ
На сьогодні стандартом лікування РШМ на пізній стадії є супутня хімієпроменева терапія [7]. Крім того, незважаючи на майже 20 років досліджень у цій галузі, роль НАХТ у лікуванні РШМ на пізній стадії все ще залишається спірною і є предметом поточних досліджень. Більшість досліджень, проведених за ці роки, були спрямовані на вивчення ефективності НАХТ з подальшим стандартним лікуванням (ПТ або хірургічне втручання) та його можливої переваги над стандартним лікуванням.
У рандомізованому дослідженні вчені порівняли виживаність пацієнтів з LACC, де пацієнти в групі хімієрадіації мали вищу виживаність без рецидиву, ніж пацієнти в групі НАХТ + хірургія, але із застереженням, що у хворих з об’ємними пухлинами (IB2 / IIA) НАХТ може мати перевагу, проте через обмежену кількість пацієнтів у цій групі результати не досягли значно вищої виживаності без рецидиву. Також автори вказують на групу осіб без відповіді або з прогресуванням, які мали найгірші результати [13].
Крім того, НАХТ з подальшою хірургічною операцією значно зменшила необхідність в ад’ювантній радіотерапії порівняно з хірургічною операцією окремо при ранніх стадіях об’ємного РШМ за рахунок зменшення розміру пухлини, зниження частоти лімфоваскулярної інвазії, глибокої інвазії строми, метастазування в лімфатичні вузли та віддалених метастазів [18]. Реакція на НАХТ є незалежним прогностичним фактором і може надати важливу інформацію про агресивність пухлини та резистентність незабаром після початку лікування [15].
НАХТ і вагітність
Неясні переваги НАХТ при місцево-поширеному РШМ під час вагітності, здається, роблять його застосування ще більш експериментальним. Однак НАХТ під час вагітності відіграє більш важливу роль, ніж поза вагітністю, що ще більше виправдовує його застосування під час вагітності. Мета НАХТ у лікуванні місцево-поширеного РШМ під час вагітності:
1. Лікувати, стабілізувати та запобігати подальшому поширенню захворювання до терміну.
2. Зменшити об’єм і поширення пухлини, зробивши її більш операбельною або радіочутливою після пологів.
3. Обмежити метастазування в лімфатичні вузли та віддалені мікрометастази під час вагітності [27].
З 1948 р., коли вперше було застосовано хімієтерапевтичний препарат під час вагітності [9], значна кількість пацієнток отримували хімієтерапію під час вагітності. Проте вплив на розвиток плода залишається нашою найбільшою проблемою. Відомо, що органогенез, який відбувається між 6-м і 10-м тижнями вагітності, є найбільш вразливим періодом вагітності для зовнішніх чинників, включно з цитотоксичними препаратами, які можуть спричинити вроджені вади розвитку та викидень, якщо застосовуються протягом цього періоду. Оцінений тератогенний ризик для плода в I семестр становить від 7,5 до 17% при застосуванні 1 хімієтерапевтичного препарату порівняно з 25% при застосуванні ≥2 хімієтерапевтичних препаратів [20]. Згідно із загальними рекомендаціями, хімієтерапію не слід застосовувати до 10-го, а краще 14-го тижня вагітності. Застосування хімієтерапії після I триместру не пов’язане зі збільшенням кількості вроджених вад розвитку або деяких конкретних вад. При застосуванні у II або III триместр хімієтерапія пов’язана з обмеженням росту плода, низькою масою тіла при народженні та передчасними пологами [6].
З огляду на це рекомендується регулярне акушерське спостереження під час вагітності з особливою увагою до розвитку плода, внутрішньоутробної затримки росту та передчасних пологів. Оскільки головний мозок і статеві залози все ще розвиваються на пізніх термінах вагітності, майбутній вплив на когнітивні функції, канцерогенез, фертильність та наступне покоління у дітей, які піддавалися хімієтерапії в утробі матері, є сумнівним.
Небагато досліджень вивчали вплив на подальший розвиток, когнітивні та серцеві функції, а також загальні результати у дітей, які піддавалися хімієтерапії в утробі матері. Усі ці дослідження свідчать, що ці діти мали такі ж хороші результати, як і загальна популяція, зокрема в одному з них було зафіксовано високий відсоток передчасних пологів у вибірці з 70 дітей, які піддавалися хімієтерапії в утробі матері. Протягом 22 міс спостереження недоношені діти мали значно більше порушень когнітивних функцій порівняно з дітьми, народженими у строк [2, 3].
Такі питання, як фармакокінетика та трансплацентарний прохід хімієтерапевтичних препаратів під час вагітності, також були предметом нашого інтересу. Трансплацентарний перенос цитотоксичних препаратів відбувається переважно шляхом пасивної дифузії. Транспорт через плаценту залежить від характеристик препарату, таких як ліпідна розчинність, іонізація, молекулярна маса та перенос білків [37].
Найбільш широко використовуваними хімієтерапевтичними препаратами в неоад’ювантному лікуванні РШМ є похідні платини разом з іфосфамідом і таксанами. C. Kohler та співавт. [17] провели in vivo вимірювання вмісту платини в амніотичній рідині та пуповинній крові і спостерігали концентрації, що становили відповідно 11–42% та 23–65% від концентрації в крові матері.
У зв’язку з тенденцією до збільшення середнього віку, в якому жінки вперше вагітніють, підвищується ризик того, що вагітність буде супроводжуватися раком. Це підкреслює важливість розширення медичних знань про пухлини під час вагітності, оскільки як лікарі ми будемо все частіше стикатися з цією проблемою. Рішення часто бувають непростими і повинні ухвалюватися з урахуванням делікатного балансу між онкологічною безпекою матері, її правом і бажанням зберегти вагітність та безпекою плода.
У лікуванні місцево-поширеного РШМ під час вагітності варіанти обмежені. Ухвалення рішення є ще складнішим, ніж у випадку негінекологічних видів онкопатології під час вагітності, з огляду на те, що плід розвивається в тому самому органі, який уражений місцево-поширеним новоутворенням. Крім того, у разі переривання вагітності подальше стандартне лікування місцево-поширеного РШМ унеможливить наступні вагітності, оскільки пацієнтка стане хірургічно або радіологічно безплідною. Ця ситуація «зараз або ніколи» може ще більше мотивувати пацієнток до збереження вагітності. Які є варіанти збереження вагітності при місцево-поширеному РШМ? Як уже згадувалося, радикальна хірургія та радіотерапія за наявності плода в утробі чинять очевидний негативний вплив на його здоров’я та фертильність. Відкладення лікування до терміну і пологи без лікування під час вагітності несуть великий онкологічний ризик. З іншого боку, індукція передчасних пологів з метою своєчасного початку лікування без плода в утробі матері призводить до ятрогенної передчасності пологів і її наслідків для здоров’я плода. Менш радикальні хірургічні процедури з метою збереження вагітності, такі як конізація або трахелектомія, не є варіантом лікування місцево-поширеного РШМ.
У пацієнток з РШМ, діагностованим під час вагітності, можливим варіантом може бути НАХТ, але оскільки дані щодо безпеки та ефективності цього методу все ще обмежені та базуються на низькому рівні доказовості, цей метод лікування повинен залишатися експериментальним і використовуватися лише у високомотивованих пацієнток, які бажають зберегти вагітність. Для остаточних висновків щодо онкологічної безпеки та безпеки плода при застосуванні НАХТ під час вагітності необхідні подальші дослідження з більш тривалим спостереженням.
Мета роботи — представити клінічний випадок РШМ з аналізом індивідуальної лікувально-діагностичної тактики із застосуванням НАХТ та органозберігального хірургічного лікування.
Клінічний випадок. Хвора М., 1998 року народження, звернулася до Національного інституту раку через підозру на РШМ. Хвора оглянута лікарем-гінекологом-онкологом. Цитоморфологічне дослідження — запальний тип мазка.
Взято біопсію шийки матки. Патогістологічний висновок: у матеріалі біопсії з урахуванням результатів морфологічного та ІГХ дослідження серед крові визначаються фрагменти тканини шийки матки, інфільтровані елементами інвазивної плоскоклітинної HPV-асоційованої карциноми G1 (low grade) (рис. 1).
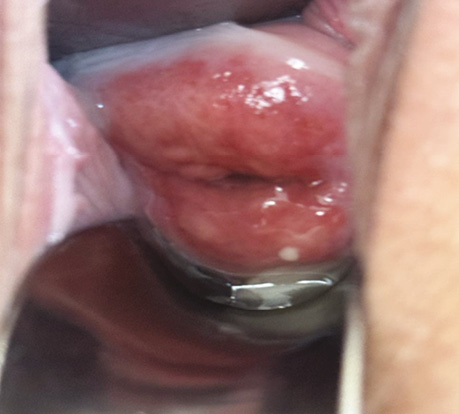
Рис. 1. Рак шийки матки — інвазивна плоскоклітинна HPV-асоційована карцинома G1 (low grade)
Фрагмент тканини шийки матки переважно заміщений розростаннями злоякісних епітеліальних клітин, диспластичний багатошаровий плоский епітелій через базальну мембрану поширюється в прилеглу волокнисту сполучну тканину без прикріплення до поверхні, клітини пухлини з вогнищевим плеоморфізмом, наявні фігури мітозів, некрози відсутні, клітини пухлини з крупними гіперхромними базофільними ядрами та переважно скудною еозинофільною цитоплазмою, з наявністю внутрішньоклітинних містків, пухлина солідно-гніздового типу росту, без ознак ороговіння, без формування кератинових мас (рис. 2).
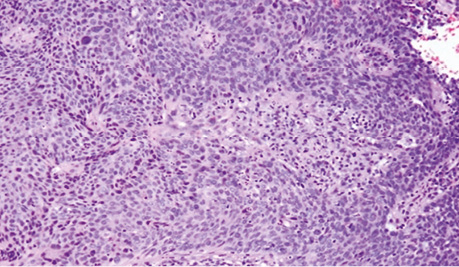
Рис. 2. Тканини шийки матки після біопсії. Збільшення ×200, забарвлення гематоксиліном / еозином
Збережена строма шийки матки представлена еозинофільною волокнистою сполучною тканиною у вигляді острівців з помірно вираженою лімфоплазмоцитарною інфільтрацією, по краю препарату визначається крововилив у вигляді скупчення еритроцитів. Пухлина інфільтрує на всю товщу дослідженого зрізу. Отримано позитивне «блокове» фарбування, сильна ядерна та цитоплазматична експресія у всіх клітинах інвазивної плоскоклітинної карциноми, надмірна експресія корелює з онкогенною ВПЛ-інфекцією (рис. 3).
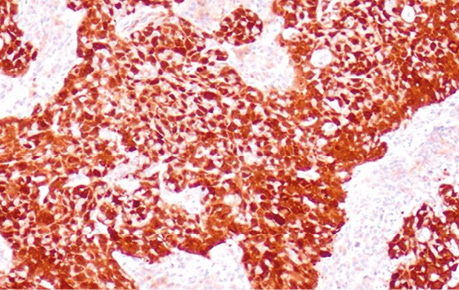
Рис. 3. Тканини шийки матки після біопсії. Збільшення ×200, ІГХ-забарвлення з маркером р16, використано антитіло Polyclonal Rabbit Antibody p16 (CDKN2A, Thermo scientific PA1-16662) з коричневим хромогеном
При виконанні магнітно-резонансної томографії (МРТ) органів черевної порожнини та малого таза від 15.03.2023 р. виявлено, що заочеревинні лімфатичні вузли не збільшені. Тіло матки розміром 45×46×47 мм. Зональна структура збережена, відповідно віку. Зовнішній контур тіла матки чіткий та рівний. Шийка матки — структурна, розміром 25×20×30 мм. Цервікальний канал рівний та чіткий. У проєкції входу в шийку матки по правій стінці на 5 год умовного циферблату виявлено екзофітний інфільтрат розміром 12×12 мм. Параметральна клітковина не змінена.
Вагіна візуально не змінена. Яєчники в яєчникових ямках, структурні, не збільшені, візуально не змінені. Правий яєчник розміром 30×12×35 мм, лівий яєчник розміром 18×20×20 мм. У товщі лівого яєчника тонкостінна функціональна кіста 16 мм у діаметрі. У Дугласовому просторі сліди вільної рідини (рис. 4).
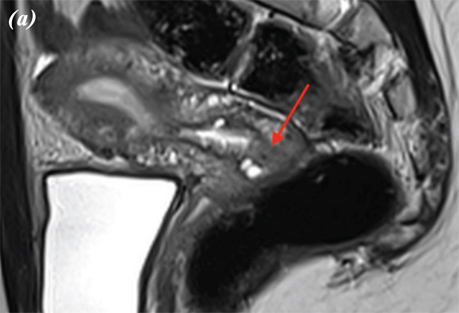
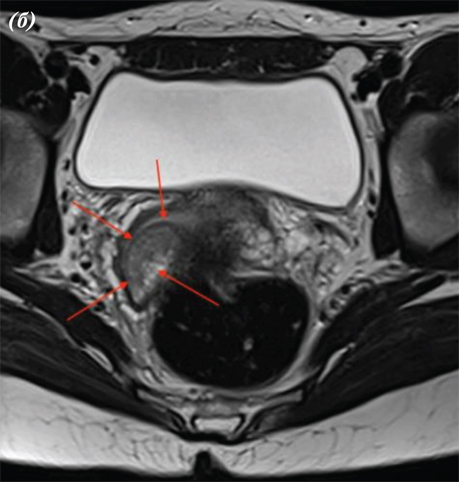
Рис. 4. МРТ органів черевної порожнини пацієнтки. МРТ-ознаки РШМ, без поширення на суміжні органи: a — сагітальна проєкція; b — фронтальна проєкція
Випадок хворої розглянуто на мультидисциплінарному консиліумі у складі гінекологів-онкологів, онкологів, променевих терапевтів, після чого було рекомендовано декілька етапів лікування:
1-й етап — проведення 2 курсів НАХТ за схемою: паклітаксел 175 мг/м2; цисплатин 70 мг/м2 з інтервалом 21 день.
2-й етап — органозберігальне хірургічне лікування (проста вагінальна трахелектомія (ПВТ) + двобічна заочеревинна лімфодисекція.
17.03–6.04.2023 р. — хворій проведено 2 курси НАХТ: паклітаксел, цисплатин у стандартних дозах.
УЗД органів малого таза від 19.04.2023 р.: матка в anteflexion, розмір 45×39×50 см; вузлової патології не виявлено. Ендометрій — 8 мм, періовуляторного типа. Шийка матки розміром 25×20×35 мм, у структурі губи залишковий процес 5×3 мм, при кольоровому доплерівському картографуванні (КДК) — помірний кровотік. Правий яєчник розміром 43×28 мм, у структурі — кісти жовтого тіла 24×22 мм, 17×19 мм. Лівий яєчник розміром 31×24 мм, кіста жовтого тіла — 24×22 мм, персистивний фолікул — 15 мм. Вільна рідина в тазу — визначається мінімальна кількість. Висновок: РШМ. Стан після НАХТ: ознак prolongatio morbi не виявлено.
8.05.2023 р. виконано хірургічно лікування в наступному обсязі: ПВТ; двобічна заочеревинна тазова лімфодисекція; дренування заочеревинного простору з обох сторін.
Патогістологічний висновок операційного матеріалу. Макроскопічний опис: матеріал видаленої тканини шийки матки представлено фрагментами тканини сіро-червоного кольору розміром 2×1×0,8 см, весь взятий у дослідження без залишку, краї резекції марковано фарбою. Тазові лімфовузли зліва та справа по 5 од., з ліпоматозом, м’які, <1 см у діаметрі.
Патогістологічний висновок. З урахуванням морфологічного та попереднього ІГХ-дослідження має місце інвазивна плоскоклітинна HPV-асоційована карцинома шийки матки (low grade) після лікування з явищами вираженого лікувального патоморфозу, пухлина представлена поодинокими дистрофічно-зміненими групами клітин з вираженою лімфоїдноклітинною інфільтрацією, з максимальною глибиною інвазії 2,5 мм (мікроінвазивна карцинома), максимальне горизонтальне поширення — 3 мм, пухлина поширюється цервікальними залозами; лімфоваскулярної, венозної та периневральної інвазії не виявлено. Краї резекції без ознак пухлинного росту. У 10 досліджених тазових регіонарних лімфатичних вузлах справа та зліва метастази пухлини відсутні. Фрагмент тканини шийки матки з вогнищевими розростаннями елементів інвазивної плоскоклітинної HPV-acoційованої карциноми з явищами вираженого лікувального патоморфозу. Компонент інвазивної карциноми представлений окремими поодинокими гніздами пухлинних клітин з вираженими некробіотичними змінами. Реакція на неоад’ювантну терапію відмічається як у клітинах пухлини, так і в навколишній стромі, ядра клітин карциноми звужені, вакуолізовані, визначаються вогнища апоптозу і некрозу, у стромі довкола пухлини відмічаємо виражену хронічну запальну реакцію, виражений фіброз зі склерозом. У нижньому куті праворуч виявлено скупчення збережених ендоцервікальних залоз, деякі кістозно розширені (рис. 5).
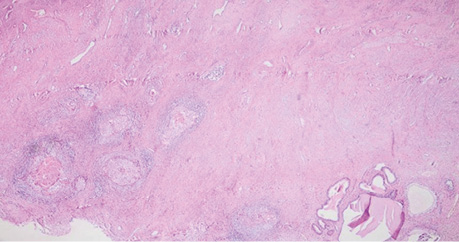
Рис. 5. Фрагмент видаленої тканини шийки матки після ПВТ. Збільшення ×40, забарвлення гематоксиліном / еозином
При значному збільшенні у гніздах росту інвазивої карциноми помітні масивні вогнища некрозів у центрі гнізд, збережені клітини пухлини з вираженою вакуолізацією ядер, виражена десмопластична реакція строми довкола зон росту інвазивої карциноми, збережена строма шийки матки з фіброзом та склерозом (рис. 6).
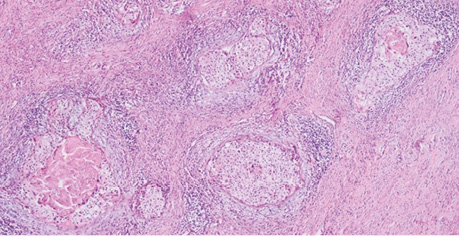
Рис. 6. Фрагмент видаленої тканини шийки матки після ПВТ. Збільшення ×100, забарвлення гематоксиліном / еозином
При такому збільшенні цієї ж ділянки фіксуємо дистрофічні зміни клітин пухлини у гніздах росту інвазивої карциноми, зміни форми та розмірів ядер свідчать про апоптоз, каріолізис та каріорексис, мітотична активність відсутня, значна кількість некротизованих пухлинних клітин. У збереженій стромі шийки матки довкола пухлини ангіоматоз, виражена запальна інфільтрація (рис. 7).
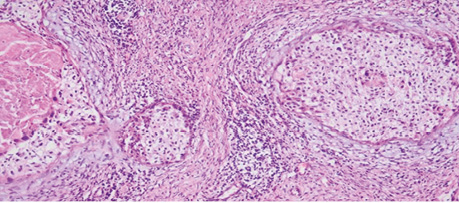
Рис. 7. Фрагмент видаленої тканини шийки матки після ПВТ. Збільшення ×200, забарвлення гематоксиліном / еозином
При значному збільшенні цієї ділянки в центрі наявні збережні елементи інвазивної плоскоклітинної карциноми з вищеописаними некробіотичними та некротичними змінами, добре видно вакуолізацію ядер, запальний перитуморальний інфільтрат представлений лімфоцитами, плазматичними клітинами, з наявністю великої кількості гістіоцитів (рис. 8).

Рис. 8. Фрагмент видаленої тканини шийки матки після ПВТ. Збільшення ×400, забарвлення гематоксиліном / еозином
УЗД органів малого таза від 24.07.2023 р.: тіло матки розміром 42×35×53 мм. Ендометрій — 8 мм з кістозними включеннями. Шийка матки розміром 31×27 мм, структура однорідна, об’ємної патології не виявлено, цервікальний канал деформований. Правий яєчник — 30×20 мм, містить до 10 фолікулів, лівий яєчник — 30×20 мм, містить до 10 фолікулів, в правій здухвинній ділянці визначається лімфатична кіста 43×33 мм. Сечовий міхур без особливостей. Вільна рідина в тазу не визначається. Висновок: УЗД-ознаки фолікулярної кісти правого яєчника, лімфатична кіста правої здухвинної ділянки. Даних за pprolongatio morbi не виявлено.
Проведено вагінальне дослідження. Цитологічний висновок від 13.07.2023 р. № 4735/23 — тип II. Запальний тип мазка (рис. 9).
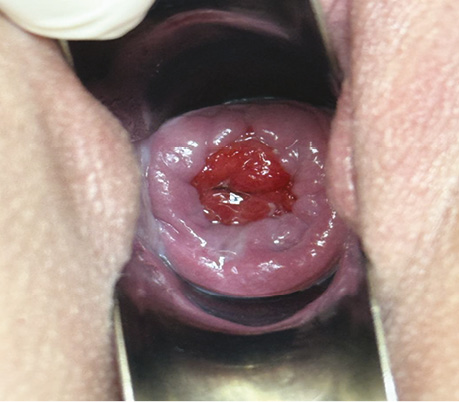
Рис. 9. Шийково-матковий анастомоз після ПВТ
УЗД органів малого таза від 17.10.2023 р.: тіло матки розміром 41×31×48 мм. Ендометрій — 8 мм, однорідний. Шийка матки — 29×21 мм, структура однорідна, об’ємної патології не виявлено. Правий яєчник розміром 31×22 мм, структура не змінена; лівий яєчник — 29×26 мм, структура не змінена. У правій здухвинній ділянці визначається лімфатична кіста розміром 24×18 мм. Сечовий міхур без особливостей. Вільна рідина в тазу не візуалізується. Висновок: стан після ПВТ, двобічної заочеревинної лімфодисекції. Лімфатична кіста правої здухвинної ділянки в динаміці зменшилася.
УЗД органів малого таза від 13.03.2024 р.: матка в anteflexion, розміром 49×41×58 см; структура однорідна, ендометрій — децидуальний, порожнина матки містить плідне яйце — 15 мм, КТР ембріона 9 (серцебиття+). Шийка матки розміром 28×27×33 мм, структура однорідна, ехографічно об’ємної патології та атипового кровотоку не виявлено. Правий яєчник — 32×20 мм, лівий яєчник — 28×20 мм, структурні. Сечовий міхур без особливостей. Вільна рідина в тазу не фіксується.
Висновок: вагітність 7 тиж, прогресуюча, об’ємної патології не виявлено.
Вагітність 12 тиж — виконано накладання цервікального серкляжа (рис. 10).
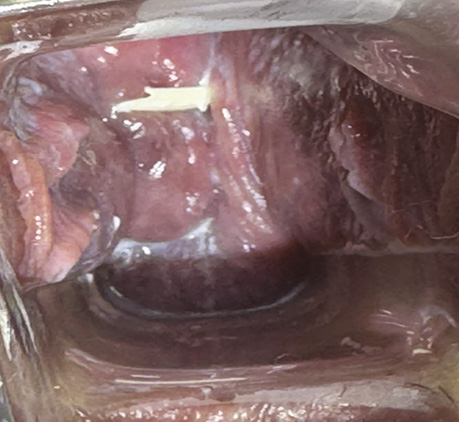
Рис. 10. Вагітність 12 тиж — цервікальний серкляж шийки матки
Вагітність 32 тиж, прогресуюча, об’ємної патології не виявлено (рис. 11).

Рис. 11. Вагітність 32 тиж
36 тиж — кесарів розтин. Народилася дитина: маса тіла — 2,9 кг; зріст — 50 см.
На рис. 12 представлено дитину відповідно в 9 міс та 1,5 року.


Рис. 12. Фото дитини віком 9 міс (a) та 1,5 року (b)
Пацієнтка надала письмову інформовану згоду на публікацію клінічного випадку. Дослідження виконано з дотриманням принципів Гельсінської декларації.
Дискусія
РШМ, незважаючи на прогрес у виявленні та лікуванні, залишається значною проблемою в галузі охорони здоров’я, особливо серед молодих жінок репродуктивного віку [10]. РШМ посідає 3-тє місце за частотою виникнення раку серед жінок віком до 40 років [30], майже 40% випадків РШМ на ранній стадії трапляються у молодих жінок, які бажають зберегти свою фертильність і можуть розглянути хірургічне втручання для збереження фертильності як варіант. Крім того, зі збільшенням середнього віку 1-ї вагітності в західних країнах ризик діагностування новоутворення шийки матки до досягнення репродуктивних цілей прогресивно зростає [25]. Лікування, що зберігає фертильність, стало цінним варіантом для збереження репродуктивної здатності в цій популяції, особливо для тих, хто має ранню стадію захворювання [34].
ВисновКИ
Наведений клінічний випадок свідчить про можливість використання індивідуального мультидисциплінарного підходу до лікування РШМ. За ретельного відбору пацієнток використання НАХТ з подальшим органозберігальним хірургічним втручанням може забезпечити задовільні онкологічні результати з одночасним збереженням репродуктивного потенціалу.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Abu-Rustum, N. R., Yashar, C. M., Bean, S., Bradley, K., Campos, S. M., Chon, H. S., … Gremel, G. (2020). NCCN Guidelines Insights: Cervical Cancer, Version 1.2020. Journal of the National Comprehensive Cancer Network, 18(6), 660–666. doi.org/10.6004/jnccn.2020.0027.
2. Amant, F., Halaska, M. J., Fumagalli, M., Dahl Steffensen, K., Gziri, M., & Han, S. N. (2014). Gynecologic cancers in pregnancy: Guidelines of a second international consensus meeting. International Journal of Gynecological Cancer, 24(3), 394–403. doi.org/10.1097/IGC.0000000000000062.
3. Amant, F., Van Calsteren, K., Halaska, M. J., Gziri, M. M., Hui, W., Lagae, L., … Ottevanger, P. B. (2012). Long-term cognitive and cardiac outcomes after prenatal exposure to chemotherapy in children aged 18 months or older: An observational study. The Lancet Oncology, 13(3), 256–264. doi.org/10.1016/S1470-2045(11)70363-1.
4. Balaya, V., Guani, B., Morice, P., Querleu, D., Fourchotte, V., & Leblanc, E. (2022). Long-term oncological safety of sentinel lymph node biopsy in early-stage cervical cancer: A post-hoc analysis of SENTICOL I and SENTICOL II cohorts. Gynecologic Oncology, 164(1), 53–61. doi.org/10.1016/j.ygyno.2021.10.074.
5. Beharee, N., Shi, Z., Wu, D., & Wang, J. (2019). Diagnosis and treatment of cervical cancer in pregnant women. Cancer Medicine, 8(12), 5425–5430. doi.org/10.1002/cam4.2443.
6. Cardonick, E. H., Gringlas, M. B., Hunter, K., & Greenspan, J. (2015). Development of children born to mothers with cancer during pregnancy: Comparing in utero chemotherapy-exposed children with nonexposed controls. American Journal of Obstetrics and Gynecology, 212(5), 658.e1–658.e8. doi.org/10.1016/j.ajog.2014.12.007.
7. Cibula, D., Raspollini, M. R., Planchamp, F., Centeno, C., Chargari, C., Felix, A., … Querleu, D. (2023). ESGO/ESTRO/ESP Guidelines for the management of patients with cervical cancer — Update 2023. Radiotherapy and Oncology, 184, Article 109682. doi.org/10.1016/j.radonc.2023.109682.
8. Covens, A., Rosen, B., Murphy, J., Laframboise, S., DePetrillo, A. D., Lickrish, G., … Shaw, P. (2002). How important is removal of the parametrium at surgery for carcinoma of the cervix? Gynecologic Oncology, 84(1), 145–149. doi.org/10.1006/gyno.2001.6493.
9. Creskoff, A. J., Fitz-Hugh, T., Jr., & Frost, J. W. (1948). Urethane therapy in leukemia. Blood, 3(8), 896–910.
10. D’Amato, A., Riemma, G., Agrifoglio, V., Chiantera, V., Laganà, A. S., Mikuš, M., … Etrusco, A. (2024). Reproductive outcomes in young women with early-stage cervical cancer greater than 2 cm undergoing fertility-sparing treatment: A systematic review. Medicina, 60(4), 608. doi.org/10.3390/medicina60040608.
11. Dargent, D., Martin, X., Sacchetoni, A., & Mathevet, P. (2000). Laparoscopic vaginal radical trachelectomy: A treatment to preserve the fertility of cervical carcinoma patients. Cancer, 88(8), 1877–1882.
12. Gil-Ibanez, B., Glickman, A., Del Pino, M., Boada, D., Fuste, P., Diaz-Feijoo, B., … Torne, A. (2020). Vaginal fertility-sparing surgery and laparoscopic sentinel lymph node detection in early cervical cancer: Retrospective study with 15 years of follow-up. European Journal of Obstetrics & Gynecology and Reproductive Biology, 251, 23–27. doi.org/10.1016/j.ejogrb.2020.05.039.
13. Gupta, S., Maheshwari, A., Parab, P., Mahantshetty, U., Hawaldar, R., Chopra, S., … Badwe, R. (2018). Neoadjuvant chemotherapy followed by radical surgery versus concomitant chemotherapy and radiotherapy in patients with stage IB2, IIA, or IIB squamous cervical cancer: A randomized controlled trial. Journal of Clinical Oncology, 36(16), 1548–1555. doi.org/10.1200/JCO.2017.75.9985.
14. Gwacham, N. I., McKenzie, N. D., Fitzgerald, E. R., Ahmad, S., & Holloway, R. W. (2021). Neoadjuvant chemotherapy followed by fertility sparing surgery in cervical cancers size 2–4 cm; emerging data and future perspectives. Gynecologic Oncology, 162(3), 809–815. doi.org/10.1016/j.ygyno.2021.06.006.
15. Kim, H. S., Sardi, J. E., Katsumata, N., Levy, T., Suneja, G., & Nam, J. H. (2013). Efficacy of neoadjuvant chemotherapy in patients with FIGO stage IB1 to IIA cervical cancer: An international collaborative meta-analysis. European Journal of Surgical Oncology, 39(2), 115–124. doi.org/10.1016/j.ejso.2012.09.003.
16. Koh, W. J., Abu-Rustum, N. R., Bean, S., Bradley, K., Campos, S. M., Cho, K. R., … Greer, B. E. (2019). Cervical cancer, version 3.2019, NCCN clinical practice guidelines in oncology. Journal of the National Comprehensive Cancer Network, 17(1), 64–84. doi.org/10.6004/jnccn.2019.0001.
17. Köhler, C., Oppelt, P., Favero, G., Morgenstern, B., Mueller, M., Hasenbein, K., … Schneider, A. (2015). How much platinum passes the placental barrier? Analysis of platinum applications in 21 patients with cervical cancer during pregnancy. American Journal of Obstetrics and Gynecology, 213(2), 206.e1–206.e5. doi.org/10.1016/j.ajog.2015.03.044.
18. Li, R., Lu, S., Si, J., Yu, H., Wang, Z., Gaarenstroom, K. N., … Trimbos, J. B. (2013). Prognostic value of responsiveness of neoadjuvant chemotherapy before surgery for patients with stage IB(2)/IIA(2) cervical cancer. Gynecologic Oncology, 128(3), 524–529. doi.org/10.1016/j.ygyno.2012.11.033.
19. Machida, H., Iwata, T., Okugawa, K., Matsuo, K., Saito, T., Tanaka, K., … Mikami, M. (2020). Fertility-sparing trachelectomy for early-stage cervical cancer: A proposal of an ideal candidate. Gynecologic Oncology, 156(2), 341–348. doi.org/10.1016/j.ygyno.2019.11.021.
20. Marnitz, S., Schmittel, A., Bolbrinker, J., Vercellino, G., Dowdy, S. C., Schneider, A., … Köhler, C. (2009). The therapeutic management of a twin pregnancy complicated by the presence of cervical cancer, following laparoscopic staging and chemotherapy, with an emphasis on cisplatin concentrations in the fetomaternal compartments amnion fluid, umbilical cord, and maternal serum. Fertility and Sterility, 92(5), 1748.e1–1748.e4. doi.org/10.1016/j.fertnstert.2009.05.043.
21. Mosseri, J., Hocquemiller, R., Mergui, J. L., Uzan, C., & Canlorbe, G. (2022). Laser conization for cervical intraepithelial neoplasia: Effectiveness and obstetric outcomes. Journal of Gynecology Obstetrics and Human Reproduction, 51(6), Article 102341. doi.org/10.1016/j.jogoh.2022.102341.
22. Nezhat, C., Roman, R. A., Rambhatla, A., & Nezhat, F. (2020). Reproductive and oncologic outcomes after fertility-sparing surgery for early stage cervical cancer: A systematic review. Fertility and Sterility, 113(4), 685–703. doi.org/10.1016/j.fertnstert.2020.02.003.
23. Nica, A., Marchocki, Z., Gien, L. T., Kupets, R., Vicus, D., & Covens, A. (2021). Cervical conization and lymph node assessment for early stage low-risk cervical cancer. International Journal of Gynecological Cancer, 31(3), 447–451. doi.org/10.1136/ijgc-2020-001785.
24. Peters, W. A., III, Liu, P. Y., Barrett, R. J., II, Stock, R. J., Monk, B. J., Berek, J. S., … Alberts, D. S. (2000). Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix. Journal of Clinical Oncology, 18(8), 1606–1613. doi.org/10.1200/JCO.2000.18.8.1606.
25. Plante, M. (2013). Evolution in fertility-preserving options for early-stage cervical cancer: Radical trachelectomy, simple trachelectomy, neoadjuvant chemotherapy. International Journal of Gynecological Cancer, 23(6), 982–989. doi.org/10.1097/IGC.0b013e318295906b.
26. Ramirez, P. T., Frumovitz, M., Pareja, R., Lopez, A., Vieira, M., Ribeiro, R., … Obermair, A. (2018). Minimally invasive versus abdominal radical hysterectomy for cervical cancer. New England Journal of Medicine, 379(20), 1895–1904. doi.org/10.1056/NEJMoa1806395.
27. Rydzewska, L., Tierney, J., Vale, C. L., & Symonds, P. R. (2012). Neoadjuvant chemotherapy plus surgery versus surgery for cervical cancer. Cochrane Database of Systematic Reviews, 2012(12), Article CD007406. doi.org/10.1002/14651858.CD007406.pub3.
28. Salvo, G., Ramirez, P. T., Leitao, M. M., Cibula, D., Wu, X., Falconer, H., … Franchi, M. (2022). Open vs minimally invasive radical trachelectomy in early-stage cervical cancer: International Radical Trachelectomy Assessment Study. American Journal of Obstetrics and Gynecology, 226(1), 97.e1–97.e16. doi.org/10.1016/j.ajog.2021.08.029.
29. Schmeler, K. M., Pareja, R., Lopez Blanco, A., Humberto Fregnani, J., Lopes, A., Perrotta, M., … Ramirez, P. T. (2021). ConCerv: A prospective trial of conservative surgery for low-risk early-stage cervical cancer. International Journal of Gynecological Cancer, 31(10), 1317–1325. doi.org/10.1136/ijgc-2021-002921.
30. Siegel, R. L., Miller, K. D., Wagle, N. S., & Jemal, A. (2023). Cancer statistics, 2023. CA: A Cancer Journal for Clinicians, 73(1), 17–48. doi.org/10.3322/caac.21763.
31. Stegeman, M., Louwen, M., van der Velden, J., ten Kate, F. J., den Bakker, M. A., Burger, C. W., & Ansink, A. C. (2007). The incidence of parametrial tumor involvement in select patients with early cervix cancer is too low to justify parametrectomy. Gynecologic Oncology, 105(2), 475–480. doi.org/10.1016/j.ygyno.2007.01.016.
32. Taylan, E., & Oktay, K. (2019). Fertility preservation in gynecologic cancers. Gynecologic Oncology, 155(3), 522–529. doi.org/10.1016/j.ygyno.2019.09.012.
33. Tesfai, F. M., Kroep, J. R., Gaarenstroom, K., De Kroon, C., Van Loenhout, R., Smit, V., … Beltman, J. J. (2020). Fertility-sparing surgery of cervical cancer >2 cm (International Federation of Gynecology and Obstetrics 2009 stage IB1-IIA) after neoadjuvant chemotherapy. International Journal of Gynecological Cancer, 30(1), 115–121. doi.org/10.1136/ijgc-2019-000647.
34. Theofanakis, C., Koulakmanidis, A. M., Prodromidou, A., Haidopoulos, D., Rodolakis, A., & Thomakos, N. (2022). Fertility-sparing treatment for young patients with early-stage cervical cancer: A dawn of a new era. Frontiers in Surgery, 9, Article 867993. doi.org/10.3389/fsurg.2022.867993.
35. Tseng, J. H., Aloisi, A., Sonoda, Y., Gardner, G. J., Zivanovic, O., Abu-Rustum, N. R., & Leitao, M. M., Jr. (2018). Less versus more radical surgery in stage IB1 cervical cancer: A population-based study of long-term survival. Gynecologic Oncology, 150(1), 44–49. doi.org/10.1016/j.ygyno.2018.04.571.
36. Ungár, L., Smith, J. R., Pálfalvi, L., & Del Priore, G. (2006). Abdominal radical trachelectomy during pregnancy to preserve pregnancy and fertility. Obstetrics & Gynecology, 108(3 Pt 2), 811–814. doi.org/10.1097/01.AOG.0000195572.76016.3c.
37. Van Calsteren, K., Verbesselt, R., Devlieger, R., De Catte, L., Chai, D. C., Van Bree, R., … Amant, F. (2010). Transplacental transfer of paclitaxel, docetaxel, carboplatin, and trastuzumab in a baboon model. International Journal of Gynecological Cancer, 20(9), 1456–1464. doi.org/10.1111/IGC.0b013e3181f7cf47.
38. van Gent, M. D., van den Haak, L. W., Gaarenstroom, K. N., Peters, A. A., van Poelgeest, M. I., Trimbos, J. B., & de Kroon, C. D. (2014). Nerve-sparing radical abdominal trachelectomy versus nerve-sparing radical hysterectomy in early-stage (FIGO IA2-IB) cervical cancer: A comparative study on feasibility and outcome. International Journal of Gynecological Cancer, 24(4), 735–743. doi.org/10.1097/IGC.0000000000000114.
39. Viale, P. H. (2020). The American Cancer Society’s facts & figures: 2020 edition. Journal of the Advanced Practitioner in Oncology, 11(2), 135–136. doi.org/10.6004/jadpro.2020.11.2.1.
40. Wei, L., Zhao, Y., Xie, X., You, Z., Bi, H., & Kong, B. (2018). Expert consensus management of cervical cancer during pregnancy in China. Chinese Journal of Clinical Obstetrics and Gynecology, 19(2), 190–192.
41. Zaccarini, F., Sanson, C., Maulard, A., Scherier, S., Leary, A., Pautier, P., … Morice, P. (2021). Cervical cancer and fertility-sparing treatment. Journal of Clinical Medicine, 10(21), Article 4825. doi.org/10.3390/jcm10214825.
42. Zhang, Q., Li, W., Kanis, M. J., Qi, G., Li, M., Yang, X., & Kong, B. (2017). Oncologic and obstetrical outcomes with fertility-sparing treatment of cervical cancer: A systematic review and meta-analysis. Oncotarget, 8(28), 46580–46592. doi.org/10.18632/oncotarget.16233.
Адреса для листування:
Дерменжи Тетяна Володимирівна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: tetyanadermenzhy@gmail.com
Сorrespondence:
Tetyana Dermenzhy
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: tetyanadermenzhy@gmail.com














Leave a comment