Рак мочевого пузыря
Интенсификация внутрипузырной химиотерапии с использованием физических факторов воздействия у больных немышечно-инвазивным раком мочевого пузыря
Б.Я. Алексеев1, М.П. Головащенко1, А.А. Теплов1, Е.В. Филоненко1, К.М. Нюшко1, Ю.Ю. Андреева1, А.В. Пирогов2
1ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
2Аналитический центр химического факультета Московского государственного университета, Россия
Немышечно-инвазивный рак мочевого пузыря (НМИ РМП) ассоциирован с высокой частотой возникновения рецидива и прогрессирования. Таким образом, остается актуальным поиск новых вариантов лечения. Цель нашего исследования состояла в том, чтобы оценить результаты адъювантной внутрипузырной химиотерапии (ВПХТ) с препаратом митомицин С (ММС) в комбинации с фотодинамической терапией (ФДТ) или с низкоинтенсивным лазерным излучением (НИЛИ) после трансуретральной резекции (ТУР).
В 2006–2010 гг. в исследование были включены 131 пациент с НМИ РМП промежуточного риска развития рецидива и прогрессирования. У 27 больных на доклиническом этапе исследования была изучена концентрация MMC в неизмененной слизистой оболочке мочевого пузыря и в опухолевой ткани после стандартной ВПХТ и в комбинации с ФДТ/НИЛИ. Концентрацию оценивали методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Далее всем 27 больным проведена ТУР мочевого пузыря с однократной немедленной ВПХТ. 104 больных в возрасте 60,5±8,5 года (26–80 лет) были включены в клиническую часть исследования (мужчин — 72, женщин — 32). В контрольную группу вошли 54 больных (52 %), которым было проведено стандартное лечение (ТУР + 6 курсов адъювантной ВПХТ). В исследуемую группу А включено 25 больных, которым в адъювантном режиме проведено 6 курсов ВПХТ+ФДТ. В исследуемую группу Б вошли 25 больных, получивших 6 курсов адъювантной ВПХТ+НИЛИ. При ФДТ в качестве фотосенсибилизатора использовали препарат аласенс, длина волны лазера составляла 630 Нм, а энергия излучения 25 Дж/см2. Энергия излучения при НИЛИ составляла 1,6 Дж/см2. Больные во всех группах были сопоставимы по основным факторам прогноза.
Доклиническая часть исследования продемонстрировала, что средняя концентрация MMC в нормальной ткани составляла 197 мкг/г после стандартной ВПХТ, 33,5 после ВПХТ+ФДТ и 67 мкг/г после ВПХТ+НИЛИ. Медиана концентрации ММС в опухолевой ткани — 101 мкг/г после стандартной ВПХТ, 42 мкг/г после ВПХТ+ФДТ и 128 мкг/г — ВПХТ+НИЛИ (p=0,0002). За медиану периода наблюдения 24 мес в исследуемой группе А у 1 (4%) больного отмечен рецидив. Медиана безрецидивной выживаемости (БРВ) составила 23 мес. Медиана периода наблюдения в группе B составила 26 мес. Рецидив выявлен у 1 (4%) больного. БРВ — 26 мес. В контрольной группе медиана периода наблюдения составила 33 мес, за данный период медиана БРВ составила 32,5 мес. Рецидивы отмечены у 28 (52%) больных. Все 3 группы больных, включенных в исследование, сопоставимы по общему числу побочных реакций и по количеству получавших сопутствующую терапию, поскольку различия в группах по вышеперечисленным параметрам статистически недостоверны (р=0,46).
ВПХТ в комбинации с ФДТ и НИЛИ — перспективные методы лечения больных с промежуточным риском НМИ РМП. Комбинированная терапия повышает концентрацию MMC в опухолевой ткани, не приводит к увеличению частоты осложнений и способствует снижению частоты развития рецидивов опухоли.
Случай гранулематозного поражения легких на фоне БЦЖ-иммунотерапии рака мочевого пузыря без мышечной инвазии
С.В. Барсов, Е.С. Белова, Ж.Г. Амеркешов, В.Л. Бисмильда, Л.Т. Чингисова, А.В. Пак
Алматинский онкологический центр, Научный центр проблем туберкулеза МЗРК, Алматы, Казахстан
Современная тактика лечения рака мочевого пузыря без инвазии в мышечный слой включает несколько этапов, среди которых профилактика рецидивов опухоли с помощью внутрипузырного введения БЦЖ в течение как минимум 1 года. БЦЖ-препараты для внутрипузырной иммунотерапии отличаются от БЦЖ-вакцин для профилактики туберкулеза более высоким содержанием живых БЦЖ-бактерий и, соответственно, более высокой вирулентностью, что предопределяет риск системного БЦЖ-инфицирования и развития таких серьезных осложнений, как милиарная пневмония, легочная гранулема и БЦЖ-сепсис.
Под нашим наблюдением находился больной раком мочевого пузыря без мышечной инвазии, у которого в ходе БЦЖ-иммунотерапии развилось двухстороннее гранулематозное поражение легочной ткани, потребовавшее специфического лечения. Больному с уротелиальным раком, подтвержденным гистологически, была проведена трансуретральная резекция мочевого пузыря с последующим назначением внутрипузырной БЦЖ-иммунотерапии в индукционном и поддерживающем режимах. Больной успешно прошел индукционный этап, но после второго введения иммунопрепарата на этапе поддерживающей терапии у пациента повысилась температура тела до 39,3 °С, появился кашель со скудной слизистой мокротой, ухудшилось общее состояние. С помощью компьютерной томографии легких были выявлены многочисленные малоинтенсивные милиарные очаги по всем легочным полям с обеих сторон, а также увеличенные внутригрудные лимфоузлы с обеих сторон. БЦЖ-иммунотерапия была прекращена, а пациент направлен для наблюдения к фтизиатру и начал получать комбинацию противотуберкулезных препаратов. К концу первого месяца лечения состояние пациента нормализовалось, исчезла субфебрильная температура тела, практически исчез кашель и слабость. Через 2 мес микобактерии в мокроте выявлены не были. Компьютерная томография легких после окончания специфического лечения показала полное рассасывание патологических высыпаний и уменьшение размеров внутригрудных лимфатических узлов. Идентификация возбудителя, проведенная с использованием аппарата «Bactec MGIT 960», позволившего сократить время получения результатов посевов мокроты в 3 раза, а также при помощи Хайн-теста, подтвердила, что возбудителем гранулематозного поражения легочной ткани стали БЦЖ-бактерии вакцинного штамма препарата. Данное наблюдение еще раз продемонстрировало возможность генерализации местного иммунного процесса с развитием диссеминированного поражения легких. Это должно нацеливать не только на осторожное отношение к вакцинному препарату, но и на необходимость быстрой диагностики осложнений, ускоренной бактериологической верификации возбудителя и своевременного начала адекватной терапии
Функциональное состояние почек после операции Бриккера у лиц пожилого и старческого возраста
Л.А. Васильев, И.П. Костюк, С.С. Крестьянинов
Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия
Развитие медицинской науки, создание новых хирургических инструментов и антибиотиков, совершенствование анестезиологического пособия привели к бурному развитию реконструктивной урологии, разработке различных методов отведения мочи при функциональной несостоятельности мочевого пузыря или необходимости выполнения цистэктомии при онкологических заболеваниях. Наиболее остро эта проблема касается больных инвазивным раком мочевого пузыря, нуждающихся в радикальном оперативном лечении, так как эта патология является одной из самых распространенных среди онкологических заболеваний мочеполовых органов, и важность решения этой задачи трудно переоценить. Также остро эта проблема касается и больных с местно-распространенными опухолями малого таза, перенесших комбинированные операции, включающие цистэктомию.
Цель — оценить функциональное состояние почек после операции Бриккера у лиц пожилого и старческого возраста.
Проанализированы результаты лечения 103 пациентов пожилого и старческого возраста с заболеваниями, требующими удаления мочевого пузыря. Среди них инвазивный рак и рецидив поверхностного рака мочевого пузыря после проведенного органосохраняющего лечения у 25 (24,3%) пациентов; местно-распространенные опухоли других органов малого таза — у 75 (72,8%); неопухолевые заболевания, вызванные предшествующей лучевой терапией, — у 3 (2,9%). Всем этим больным выполнена цистэктомия или в качестве самостоятельной операции, или как один из этапов операции с последующей инконтинентной деривацией мочи по Бриккеру. Из них мужчин было 18 (17,5%), женщин — 85 (82,5%). Первое контрольное обследование проводили через 3 мес после операции, оно включало исследование крови, физикальный осмотр, УЗИ верхних мочевых путей (ВМП) и почек, УЗИ брюшной полости, экскреторную урографию, рентгенографию легких, МРТ малого таза, заполнение опросников качества жизни.
После деривации мочи с использованием кишечных сегментов необходимо исследование кислотно-основного состояния (КОС) для выявления метаболического ацидоза. У больных после проведенной нами операции Бриккера мы не считаем необходимым регулярное исследование газового состава крови при отсутствии хронической почечной недостаточности (ХПН) и клинических проявлений метаболических расстройств. Нами выборочно проверено КОС у 28 пациентов. Ни у одного из них не выявлено клинических проявлений гиперхлоремического ацидоза, pH крови находился в пределах нормы, ВЕ в пределах -1,5 — -3,2. Кроме того, у пациентов данной группы концентрация хлора, кальция, магния и фосфора в плазме крови также была в пределах нормальных значений. Однако больным с почечной недостаточностью показано регулярное исследование газового состава крови для своевременной коррекции этого осложнения. В нашем исследовании это потребовалось 7 пациентам, у которых в поздний послеоперационный период развилась ХПН.
Операция Бриккера является оптимальным методом деривации мочи у лиц пожилого и старческого возраста при противопоказаниях к ортотопической пластике. При отсутствии нарушения оттока мочи из ВМП динамическое наблюдение за кровью можно ограничить простым клиническим и биохимическим анализом без исследования КОС.
Развитие хронической почечной недостаточности после операции Бриккера у лиц пожилого и старческого возраста
Л.А. Васильев, И.П. Костюк, С.С. Крестьянинов
Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия
После операций, требующих удаления мочевого пузыря, встает вопрос о способе деривации мочи. В связи с тем что пациентам пожилого и старческого возраста тяжело, а иногда невозможно адаптироваться к новым условиям мочеиспускания при континентных методах деривации мочи, большинство хирургов предпочитают выполнять им инконтинентную деривацию мочи. Кроме того, ряд авторов в своих исследованиях показали, что качество жизни у пациентов с илеокондуитом сопоставимо с таковым при континентной реконструкции мочевого пузыря.
Цель — оценить выраженность и динамику развития хронической почечной недостаточности (ХПН) у пациентов пожилого и старческого возраста после операции Бриккера.
Проведен анализ хирургического лечения 103 пациентов пожилого и старческого возраста с заболеваниями, требующими удаления мочевого пузыря. Среди них инвазивный рак мочевого пузыря и рецидив поверхностного рака мочевого пузыря после проведенного органосохраняющего лечения — у 25 (24,3%) пациентов, местно-распространенные опухоли других органов малого таза — у 75 (72,8%) и неопухолевые заболевания, вызванные предшествующей лучевой терапией, — у 3 (2,9%). Всем этим больным выполнена цистэктомия или как самостоятельная операция, или как один из этапов операции с последующей инконтинентной деривацией мочи по Бриккеру. Контрольными точками обследования стали 3, 6 и 12 мес после операции. Они включали исследование крови, физикальный осмотр, УЗИ верхних мочевых путей и почек, брюшной полости, экскреторную урографию, рентгенографию легких, МРТ малого таза.
Через 6 мес после операции у 4 больных (3,8%) выявлен метаболический ацидоз, у 1 из них — выраженный ацидоз. У всех этих пациентов была диагностирована ХПН. Тяжелого ацидоза на тот момент ни у кого из больных после операции Бриккера не выявлено. К 12-му месяцу количество больных ХПН увеличилось до 7 (6,8%), при этом у всех был диагностирован метаболический ацидоз. У 5 пациентов причиной ХПН стало нарушение оттока мочи, у 2 — частые атаки хронического пиелонефрита. Пациент, у которого диагностирован тяжелый метаболический ацидоз, вскоре умер вследствие прогрессирования ХПН. Следует отметить, что у этого больного предоперационно была выполнена чрескожная пункционная нефростомия с двух сторон в связи со сдавлением опухолью нижней трети обоих мочеточников и развитием постренальной острой почечной недостаточности. При исследовании крови на азотемию только у 7 пациентов с ХПН отмечали повышение креатинина и мочевины. У остальных пациентов значение этих показателей оставалось в пределах нормы, среднее значение 89±11,7 мкмоль/л. Со временем выявляли небольшую тенденцию к повышению уровня креатинина в сыворотке крови, однако эта тенденция была статистически незначимой (p>0,05).
Операция Бриккера является безопасным методом деривации мочи у пациентов пожилого и старческого возраста. Количество поздних послеоперационных осложнений, включая ХПН, после операции Бриккера находится на приемлемом уровне. Операция Бриккера — наиболее оправданный метод деривации мочи у пациентов, которым необходимо дальнейшее проведение химиолучевой терапии.
Анализ осложнений комплексного органосохраняющего лечения больных мышечно-инвазивным раком мочевого пузыря
Ю.В. Гуменецкая, А.М. Попов, О.Б. Карякин
ФГБУ Медицинский радиологический научный центр Минздравсоцразвития РФ, Обнинск, Россия
В последние годы большое внимание уделяется не только вопросам повышения эффективности лечения больных раком мочевого пузыря (РМП), но и сохранению качества их жизни.
Цель исследования — анализ лучевых реакций и осложнений, возникающих в процессе и после проведения дистанционной лучевой терапии (ДЛТ) как компонента комплексного лечения больных мышечно-инвазивным РМП.
Комплексное органосохраняющее лечение, предусматривающее выполнение трансуретральной резекции (ТУР) опухоли мочевого пузыря, ДЛТ и химиотерапии, проведено 123 больным мышечно-инвазивным РМП. ДЛТ проводили тормозным излучением линейных ускорителей (Е=6–18 МV); в объем облучения включали мочевой пузырь и паравезикальную клетчатку, суммарная очаговая доза составляла 60–66 Гр. Применяли методику подвижного 2- (с углами ротации по 1200) или 3-секторного (с углами ротации по 600) облучения. При анализе лучевых реакций и поздних осложнений ДЛТ применяли классификации RTOG/EORTC, LENT SOMA.
В процессе проведения лучевой терапии острые лучевые циститы 1–2-й степени тяжести отмечали у 38 (30,9%) больных РМП, острые лучевые реакции (1-й степени) со стороны прямой кишки — у 8 (6,5%). В большинстве случаев умеренная выраженность лучевых реакций не требовала прерывания курса ДЛТ, лишь у 4 (3,3%) пациентов был сделан перерыв в лучевой терапии, средняя длительность которого составляла 10 дней. Поздний лучевой цистит диагностирован у 55 (44,7%) пациентов, при этом цистит 1-й степени тяжести — у 29 (23,6%), 2-й — у 16 (13,0%), 3-й — у 10 (8,1%) больных. Поздний лучевой ректит (1-й степени) выявляли у 4 (3,3%) пациентов. У двух (1,6%) больных через 5 и 9 лет после завершения комплексного лечения были диагностированы внутритазовый фиброз, уменьшение объема мочевого пузыря, радионекроз костей лонного сочленения. Пациенты живы (13,6 и 14,5 года) после комплексного лечения без признаков прогрессирования заболевания и находятся под постоянным наблюдением с проведением необходимых лечебных мероприятий.
В нашем исследовании проведение комплексного лечения не сопровождалось развитием клинически значимых лучевых реакций в процессе проведения ДЛТ, но выявлены поздние осложнения со стороны мочевого пузыря 3-й степени — у 10 (8,1%) больных. При этом у 8 (6,5%) пациентов отмечали образование лучевых язв слизистой оболочки мочевого пузыря, требовавшее консервативного лечения, а у 2 (1,6%) — развитие внутритазового фиброза, уменьшение объема мочевого пузыря (до 130–150 мл) и радионекроза костей лонного сочленения. Ни в одном случае не потребовалось хирургического вмешательства с целью коррекции осложнений комплексного лечения.
Отдаленные результаты комплексного органосохраняющего лечения больных мышечно-инвазивным раком мочевого пузыря
Ю.В. Гуменецкая, А.М. Попов, О.Б. Карякин
ФГБУ Медицинский радиологический научный центр Минздравсоцразвития РФ, Обнинск, Россия
До настоящего времени стандартом лечения мышечно-инвазивного рака мочевого пузыря (РМП) остается цистэктомия. Вместе с тем пожилой возраст пациентов и наличие сопутствующих соматических заболеваний часто ограничивают возможности и объем хирургического вмешательства, а часть больных отказываются от операции. Данное обстоятельство способствует поиску методов лечения, которые могли бы стать альтернативой цистэктомии.
Цель исследования — анализ отдаленных результатов комплексного органосохраняющего лечения больных мышечно-инвазивным РМП.
В 1989–2007 гг. комплексное органосохраняющее лечение проведено 123 больным РМП. Мужчин было 105 (85,4%), женщин — 18 (14,6%); средний возраст пациентов составил 58,2 года. Морфологическое подтверждение диагноза (переходноклеточный рак) получено у всех больных. Степень дифференцировки опухоли соответствовала G1 у 20 (16,3%), G2 — у 40 (32,5%), G3–4 — у 41 (33,3%), Gх — у 22 (17,9%) больных. РМП Т2N0M0 отмечали у 38 (30,9%), Т3N0M0 — у 74 (60,2%), Т4N0M0 — у 7 (5,7%), ТхN0M0 — у 4 (3,3%) пациентов. Размеры опухоли5 см — у 47 (38,2%) больных; мультифокальный рост опухоли — у 38 (30,9%), нарушение функции почек, обусловленное наличием опухоли, — у 23 (18,7%) пациентов. Большинство больных РМП имели соматическую патологию, препятствующую проведению радикальной операции, а часть пациентов отказались от цистпростатэктомии. Комплексное лечение включало проведение органосохраняющего хирургического вмешательства в объеме трансуретральной резекции (ТУР) опухоли, химиотерапии и дистанционной лучевой терапии (ДЛТ). ДЛТ проводили тормозным излучением линейных ускорителей (Е=6–18 МV), применяли методику подвижного (ротационного) облучения, в объем облучения включали мочевой пузырь и паравезикальную клетчатку, суммарная очаговая доза (СОД) составляла 60–66 Гр.
Через 12 мес после лечения локальный контроль отмечен у 89 (72,4%) больных, прогрессирование заболевания — у 14 (11,4%). В последующем по поводу локального рецидива заболевания 24 (19,5%) больным была проведена ТУР рецидивной опухоли; 2 (1,6 %) пациентам выполнена цистэктомия с илеопластикой по Брикеру. У 26 (21,1%) пациентов по поводу прогрессирования заболевания проведены курсы полихимиотерапии. Общая 5- и 10-летняя выживаемость больных РМП после комплексного лечения составила 66,3±4,4 и 46,8±5,2%; скорректированная выживаемость — 69,3±4,3 и 50,3±5,3% соответственно. Средняя продолжительность жизни больных изучаемой группы составила 7,4±0,3 года.
Результаты проведенного исследования свидетельствуют о том, что у больных мышечно-инвазивным РМП с соматическими противопоказаниями к проведению радикального хирургического вмешательства или отказавшихся от операции — возможно проведение комплексного лечения. Включение в объем терапевтических мероприятий эндоскопического хирургического вмешательства, химиотерапии, дистанционной лучевой терапии — способствовало достижению локального контроля в 72,4% случаев. Общая и скорректированная 10-летняя выживаемость больных составила 46,8±5,2 и 50,3±5,3% соответственно. Таким образом, проведение мультимодального лечения может быть альтернативой цистэктомии у ряда больных мышечно-инвазивным РМП.
Применение БЦЖ-терапии у больных неинвазивным раком мочевого пузыря
М.А. Довбыш, А.А. Губарь, С.В. Мерзляк, И.М. Довбыш, С.А. Дюдюн
Запорожский государственный медицинский университет Городская клиническая больница экстренной и скорой медицинской помощи, Запорожье, Украина
Поверхностный рак мочевого пузыря (РМП) является одной из актуальных проблем современной онкоурологии, который отмечают в 80% случаев. Согласно существущим стандартам лечения неинвазивного РМП требуется не только удалить новообразование, но и в обязательном порядке провести адъювантную терапию, которая направлена на профилактику рецидивов. Современными исследованиями доказано, что внутрипузырная химиотерапия уступает по эффективности внутрипузырной БЦЖ-терапии. Последняя способствует как снижению частоты развития рецидивов в среднем на 40%, так и вероятности прогрессирования опухоли.
Цель исследования — оценить ближайшие результаты использования БЦЖ-терапии у больных неинвазивным РМП, перенесших трансуретральную резекцию (ТУР).
Наблюдали 36 пациентов в возрасте 34–69 лет (средний возраст — 51,5 года), из них 27 мужчин и 4 женщины. У 4 больных отмечено рецидивное течение опухолевого процесса, остальным пациентам ТУР, по общепринятым правилам, выполняли впервые. Срок наблюдения составил 24 мес. Обследование больных и стадирование опухоли осуществляли в соответствии с требованиями медицинских стандартов. У 17 пациентов в терапии применяли препарат УРО-БЦЖ (производства МЕДАК Гмбх, Германия), содержащий от 2·108 до 3·109 живых бактерий Кальмета — Герена). Инстилляции проводили через 3 нед после выполнения ТУР опухоли мочевого пузыря еженедельно на 2 ч в течение 6 нед. Во 2-й группе (19 больных) сразу после ТУР в мочевой пузырь вводили 50 мг фарморубицина на 60 мл 0,9% раствора натрия хлорида на 2 ч, через 3 нед проводили БЦЖ-терапию по вышеописанной схеме. 5 пациентам по элективным показаниям было продолжено проведение поддерживающей терапии 1 раз в месяц в течение полугода. В процессе лечения и наблюдения еженедельно осуществляли контроль показателей крови и мочи, а также каждые 2–3 мес проводили цистоскопию, УЗИ и при необходимости — цитологию мочевого осадка.
За время наблюдения у 4 пациентов 1-й группы, по данным клинической картины, УЗИ и цистоскопии, выявлен рецидив опухоли (23,5%), причем у половины из них первоначальное подозрение на рецидив возникло на основании положительных результатов цитологии осадка мочи. У 2 больных 2-й группы из 19 в течение 24 мес выявлен рецидив новообразования мочевого пузыря (10,5%), что в 2,2 раза меньше, чем в 1-й группе. В этой группе больных с рецидивом опухоли положительный результат цитологии был получен во всех случаях.
На фоне проведенной иммунотерапии системных осложнений (БЦЖ-сепсис и аллергические реакции) не отмечали. У 24 пациентов в течение первых 3 дней после осуществления внутрипузырных инстилляций развились дизурические явления, субфебрилитет, которые купировались симптоматической терапией и не требовали прекращения лечения. У 3 пациентов после третьего введения отмечены клинические симптомы геморрагического цистита, который купировали медикаментозно в течение 48 ч, отмены лечения не требовалось.
Следует отметить, что, на наш взгляд, для достижения положительных результатов лечения немаловажным моментом является детальная информированность пациента о БЦЖ-терапии (методика, возможные побочные реакции), альтернативных методах лечения и прогнозе заболевания вообще. В условиях информированного согласия пациента, с установкой четких показаний в каждом индивидуальном случае, возможно использование описанной иммунопрофилактики РМП. Данный специализированный метод следует применять в профильном учреждении с соблюдением принципов преемственности и последовательности для обеспечения больных РМП лечением, отвечающим современным медицинским представлениям и требованиям медико-экономических стандартов.
Существующие подходы к лечению больных неинвазивным РМП (ТУР и БЦЖ-терапия, ТУР и адъювантное послеоперационное внутрипузырное введение химиопрепарата и БЦЖ-терапия) позволяют добиться сокращения числа рецидивов в течение 24 мес наблюдения после начатого комбинированного лечения. Использование методов внутрипузырной иммунопрофилактики и химиотерапии у пациентов с неинвазивным РМП как при первичном течении заболевания, так и при развитии рецидивов, представляются вполне обнадеживающими
Результаты адъювантной полихимиотерапии после радикальной цистэктомии у больных мышечно-инвазивным раком мочевого пузыря
A.Г. Жегалик, С.А. Красный, С.Л. Поляков, О.Г. Суконко, А.И. Ролевич
Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова, Минск, Республика Беларусь
В настоящее время стандартным методом лечения мышечно-инвазивного рака мочевого пузыря (РМП) является радикальная цистэктомия (РЦ). Однако у 50% больных после РЦ развиваются отдаленные метастазы, а у 13–25% — местные рецидивы опухоли в малом тазу. В связи с вышеизложенным нами проводится проспективное рандомизированное исследование по оценке эффективности и токсичности 2 курсов адъювантной полихимиотерапии (АПХТ) по схеме гемцитабин + цисплатин после РЦ у пациентов с высоким риском прогрессирования РМП по сравнению с наблюдением.
В 2008–2012 гг. в исследование включено 77 радикально оперированных больных инвазивным переходно-клеточным РМП (Т2а–Т4аN0–2M0). Возраст больных колебался в диапазоне 37–76 лет (средний возраст 61,6±8,4 года). Мужчин было 70 (90,9%), женщин — 7 (9,1%). Оценены ближайшие результаты лечения: токсичность и переносимость АПХТ и выживаемость до прогрессирования. Побочные эффекты АПХТ оценивали после каждого лечебного курса в соответствии с рекомендациями Национального института рака США (CTC v. 3.0). Выживаемость до прогрессирования вычисляли по методу Каплана — Мейера, достоверность различий оценивали при помощи log rank-теста.
Всего проведено 44 курса АПХТ у 39 больных. Полностью проведено 2 курса у 18 (46%) больных, 1 курс — у 8 (21%) пациентов. Причинами неполного проведения АПХТ стали развитие осложнений (n=4), неявка для проведения лечения (n=5). Ни одного курса не проведено у 7 пациентов (18%): 4 пациента не явились для проведения АПХТ, у 1 больного перед началом АПХТ выявлен синхронный рак легкого, у 1 — развилась почечная недостаточность, и у 1 — прогрессирование процесса до начала лечения. Модификация дозы химиопрепаратов или изменение режима введения потребовались в 9 (21%) из 44 курсов АПХТ. В целом токсичность использованных режимов лечения была умеренной. Выявлены осложнения 3-й степени: лейкопения — у 1 (2,2%), тромбоцитопения у 2 (4,5%), лихорадка — у 1 (2,2%) и рвота — у 2 (4,5%) пациентов. Наиболее частой токсичностью (1–2-й степени) АПХТ по схеме GC была гематологическая. Срок наблюдения пациентов после РЦ колебался от 3 до 37 мес (медиана — 14 мес). Статистически значимых различий в выживаемости до прогрессирования между группами не выявлено (р=0,57).
АПХТ после РЦ по схеме GC сопровождается умеренным количеством осложнений, однако среди включенных в исследование больных отмечают не вполне удовлетворительное согласие с лечением. Существенных различий в выживаемости до прогрессирования не выявлено, однако для получения более достоверных данных требуются более длительный срок наблюдения и большее количество больных.
Допплерографическая оценка опухолей мочевого пузыря
Н.В. Зеляк, А.М. Серна
Ивано-Франковский национальный медицинский университет, Украина
За последние годы в Украине отмечается тенденция к увеличению распространенности и заболеваемости раком мочевого пузыря. Для его своевременного выявления используют разнообразные чувствительные методики.
С помощью цветного допплеровского картирования оценивали опухоли мочевого пузыря, зависимость ультразвукового исследования (УЗИ) от гистологического строения и стадии болезни.
Клинически лабораторными, эндоскопическими и лучевыми методами комплексно исследовали 62 больных с опухолью мочевого пузыря, которые при поступлении жаловались на гематурию и/или дизурию. Среди них мужчин было 60 и 4 женщины в возрасте в среднем 42,1 года (31–62 года). УЗИ почек, паренхиматозных органов брюшной полости и адекватно наполненного мочевого пузыря производили трансабдоминально секторным датчиком 2–5 Мгц и трансректально/трансвагинально датчиком 5–10 Мгц с использованием аппарата Siemens Acusone Antares или Phillips HD II XE. Каждому пациенту производили биопсию опухоли, гистологические препараты обрабатывали по классической методике.
У всех больных диагностированы переходно-клеточный рак мочевого пузыря. Опухоль в стадии Т1 выявлена у 3 пациентов, Т2 — у 15, Т3 — у 21, Т4 — у 3. С помощью УЗИ у 7 больных выявлено образование максимальным размером 1,2–1,5 см, у 33 — 1,6–8,1 см. У 2 пациентов сонографически диагностировать карциному не удалось, у них диагноз верифицирован при цистоскопии с биопсией стенки мочевого пузыря. У 4 из 62 больных отмечено тотальное поражение мочевого пузыря опухолью с его тампонадой кровяными сгустками. Цветное допплеровское картирование показало усиленное кровоснабжение в участке новообразования, если его размер составлял >1,2 см. При меньших опухолях гиперваскуляризации не выявлено.
Сонография заняла надлежащее место в диагностическом арсенале уролога и онколога. Однако для диагностики начальных стадий болезни, по нашим данным, наиболее распространенное трасабдоминальное УЗИ часто уступает другим методам. Использование трансректального/ трансвагинального цветного допплеровского картирования показывает прорастание опухоли сосудами, ее гиперваскуляризацию, то есть малигнизацию. Но для этого нужно, чтобы новообразование достигло 1,2 см. Нельзя быть уверенным, что опухоль, имея диаметр <1,2 см, была доброкачественной.
Для диагностики маленьких опухолей мочевого пузыря трансабдоминальное, и даже трансректальное/вагинальное УЗИ, дополненное цветным допплеровским картированием, недостаточно чувствительное. При его негативном результате следует использовать другие вспомогательные методы.
Лечение местно-распространенного рака мочевого пузыря
О.Б. Карякин
ФГБУ «Медицинский радиологический научный центр» Минздравсоцразвития России, Обнинск, Россия
Радикальная цистэктомия является основным методом лечения инвазивного рака мочевого пузыря. Радикализм этой операции направлен на удаление злокачественной опухоли мочевого пузыря при ее распространении за пределы органа, а также удаление лимфатических узлов. Наиболее успешных результатов можно достичь в стадии Т1–2. Однако большинство опухолей имеет микроскопическое распространение в клетчатку (Т3а), что может служить причиной дальнейшего прогрессирования заболевания.
Радикализм операции значительно снижается в случае местного распространения опухоли (Т3б–4), множественного, при поражении лимфоузлов N2–3, а также отдаленных метастазов. В этих случаях хирургия, лучевая терапия в сочетании с новыми эффективными лекарственными препаратами может увеличить продолжительность жизни больного.
Лечение местно-распространенного рака мочевого пузыря рТ3б–4, рN1 только с помощью хирургии не приносит существенного увеличения продолжительности жизни. Данные литературы показывают, что при обширном выходе в клетчатку, поражении 40% и более лимфоузлов, подозрении на отдаленные метастазы после радикальной цистэктомии 5-летняя выживаемость составляет 26–44%. В случае большого конгломерата лимфоузлов возможности только хирургии также ограничены. 5-летняя выживаемость у таких больных не превышает 30%.
Приведенные данные указывают, что только небольшая часть пациентов может надеяться на удовлетворительный результат от хирургического вмешательства. Большинству же больных необходимо проведение мультимодальной терапии, которая включает хирургию, системную химиотерапию, лучевую терапию.
Частота рецидивов и отдаленных метастазов после радикальной цистэктомии достигает 30–50%. В последние годы для улучшения результатов лечения используют как неоадъювантную, так и адъювантную химиотерапию. В метаанализ рандомизированных исследований по неоадъювантной химиотерапии включено более 3000 больных. Неоадъювантная химиотерапия на базе цисплатина показала абсолютное увеличение 5-летней выживаемости на 5%. Кроме этого, отмечено снижение риска смерти от рака мочевого пузыря на 13%. В ряде исследований также продемонстрированы преимущества адъювантной химиотерапии после цистэктомии. Хотя дебаты в литературе по этому поводу продолжаются. Цель адъювантной терапии — увеличение безрецидивного периода и снижение частоты отдаленных метастазов.
В литературе также имеются сообщения о возможности хирургического лечения у больных местно-распространенным и распространенным раком мочевого пузыря после ряда циклов системной химиотерапии. Значительное уменьшение или полное исчезновение как первичного очага, так и метастазов после проведенного лечения позволяет провести хирургическое вмешательство. Данные литературы показывают, что у 25–30% этих больных можно еще добиться увеличения продолжительности жизни.
Таким образом, основным видом лечения местно-распространенного рака мочевого пузыря остается радикальная цистэктомия. Прогноз заболевания зависит от степени распространения опухоли, ее дифференцировки и ряда клинических и молекулярно-биологических факторов. Химиотерапия заняла прочное место в периоперационный период с целью увеличения безрецидивного периода и снижения частоты метастазирования. Прогресс в лечении местно-распространенного рака мочевого пузыря зависит от разработки новых лекарственных препаратов, радикализма хирургического вмешательства и оптимального сочетания различных видов лечения.
Влияние Тis и плоскоклеточной дифференцировки на выживаемость больных после радикальной цистэктомии
М.И. Коган, О.Н. Васильев, В.В. Иванников
Ростовский государственный медицинский университет, НИИ урологии и нефрологии, Ростов-на-Дону, Россия
По данным отечественных и зарубежных исследователей, 5-летняя канцерспецифическая выживаемость после радикальной цистэктомии (РЦЭ) при стадиях Т1–4 составляет 11–100%. В то же время литературные сведения не продемонстрировали независимой и/или статистически значимой связи между наличием Tis и результатами РЦЭ при стадии рT1, однако худшая выживаемость и больший риск прогрессии и рецидива при инвазивном раке мочевого пузыря (РМП) и наличии Tis доказан достоверно. В проанализированной нами литературе данных о влиянии плоскоклеточной дифференцировки (ПД) опухоли на результаты лечения РМП найдено не было.
Нами проведен анализ выживаемости больных при различных стадиях РМП, пролеченных путем РЦЭ при наличии сопутствующих Tis и ПД для оценки их влияния на выживаемость больных после РЦЭ.
В исследование включены результаты РЦЭ с деривацией мочи по различным методикам у 290 больных раком мочевого пузыря, произведенных в 1995–2011 гг. В 10,0% случаев выявлена стадия Т1, в 43,4% — Т2, в 20,3% — рТ3, в 22,0% — рТ4, в 4,3% — рТ0 соответственно. При этом метастазы в регионарные лимфатические узлы (N) определены при рТ1 в 3,4%, рТ2 — в 8,7%, рТ3 — в 44,0%, рТ4 — в 53,1% случаях, причем при рТ1–2 преобладали N1–2, тогда как при рТ3–4 — N2–3. Проведен анализ выживаемости больных в зависимости от характеристики Т и наличия у больных сопутствующих Tis и ПД РМП. Статистический анализ проведен при помощи программы Statistica 7.0. Расчет показателей выживаемости по годам наблюдения выполняли по методике Kaplan — Meier.
Среди 290 больных сопутствующий Tis отмечен у 49 (16,9%), ПД — у 52 (17,9%) пациентов. 5-летняя канцерспецифическая выживаемость при всех стадиях достоверно различалась при наличии/отсутствии Tis и ПД. Так, при Т1 она составила 98,3%, тогда как при Т1+Tis и Т1+ПД — 90,0 и 68,5% соответственно. Аналогичная зависимость выявлена и при Т2–Т4. Так, при Т2, Т3, Т4 выживаемость составила соответственно 91,7; 72,9 и 54,0%, тогда как при Т2–4+Tis и Т2–4+ПД определена на уровне 69,5; 46,6; 43,3% и 53,7; 33,3; 23,3% соответственно.
Относительно высокие показатели канцерспецифической выживаемости больных после РЦЭ определяют оправданность выполнения радикальной хирургии как при инвазивном, так и при немышечно-инвазивном РМП. Однако сопутствующие Tis и ПД опухоли являются факторами прогноза сниженной канцерспецифической выживаемости у больных после РЦЭ. Данное исследование показало, что в последние годы отмечают значительное снижение послеоперационной летальности у больных, перенесших РЦЭ. Отбор пациентов для РЦЭ, подробное изучение анамнеза и сопутствующей патологии в совокупности с совершенствованием анестезиологического пособия и хирургической техники, а также тщательный контроль ведения послеоперационного периода с соблюдением необходимых стандартных подходов значительно снижает риск развития у больных жизненно опасных осложнений и, как результат, приводит к уменьшению количества летальных исходов.
Результаты надпузырного отведения мочи при радикальной цистэктомии
Б.К. Комяков, А.В. Сергеев, О.А. Кириченко, А.С. Попов
Северо-Западный государственный медицинский университет им. И.И. Мечникова, Россия
В настоящее время радикальная цистэктомия (РЦ) с регионарной лимфаденэктомией являются общепризнанным методом лечения мышечно-инвазивного рака мочевого пузыря (РМП). После удаления мочевого пузыря основной вопрос, который приходится решать хирургу, — выбор способа отведения мочи.
В 1995–2011 гг. нами выполнено 335 РЦ с различными методами деривации мочи у больных РМП. Возраст оперированных составил 22–82 года (57±3,7 года). Мужчин было 270 (80,6%), женщин 65 (19,4%). В качестве деривации мочи были использованы ортотопическая гастроцистопластика (ГЦП) у 22 (6,5%) больных, илеоцистопластика (ИЦП) — у 209 (62,4 %), сигмоцистопластика (СЦП) — у 20 (6,0%); пересадка мочеточников в сигмовидную кишку — у 40 (12,0%); трансуретероуретеронефростомии, уретерокутанеоанастомозы и т.п. — у 36 (10,7 %) пациентов и континентная гетеротопическая ИЦП (с аппендикокутанеорезервуаростомой или инвагинированной илеокутанеорезервуаростомой) — у 8 (2,4 %) больных.
В ранний послеоперационный период умерло 13 (3,8%) больных. Нами было выполнено 209 ортотопических ИЦП. Выявлено 83 ранних осложнения у 71 (33,9%) пациента, из которых 45 связаны и 38 не связаны с методом отведения мочи. Подтекание мочи вследствие несостоятельности швов резервуара (4,8%), резервуароуретрального (3,8%) и резервуароуретерального (4,3%) анастомозов, а также обострение хронического пиелонефрита (6,2%) являлись наиболее частыми осложнениями, связанными с методом отведения мочи. Острая спаечная кишечная непроходимость (8,1%) была наиболее частым ранним осложнением, не связанным с методом деривации мочи.
Отмечали 39 поздних осложнений у 33 (15,7%) больных, из которых 30 связаны и 9 не связаны с методом отведения мочи. Стеноз резервуароуретерального (4,8%) анастомоза был наиболее частым поздним осложнением, связанным с методом отведения мочи, а стриктуры передней уретры (1,9%) — не связанным с методом деривации мочи.
У 22 (6,5%) пациентов нами было выполнено формирование ортотопического резервуара из сегмента желудка. У одного больного ранний послеоперационный период осложнился острым панкреатитом, по поводу чего было успешно проведено консервативное лечение. В поздний послеоперационный период у пациента отмечены стриктура уретерорезервуарного анастомоза и несостоятельность уретерорезервуарного анастомоза с мочевым затеком. В связи с этим было выполнено открытое и малоинвазивное оперативные вмешательства. Синдром гематурии-дизурии выявлен у 2 (9,1%) больных.
Ортотопическая СЦП была выполнена у 20 (6,0%) пациентов. В этой группе отмечено 8 ранних осложнений у 5 (25,0%) больных, 5 поздних осложнений — у 3 (15,0%). Пересадка мочеточников в сигмовидную кишку была нами выполнена у 40 (12,0%) больных. В ранний послеоперационный период у 7 (17,5%) пациентов отмечено 11 осложнений. У 8 (20,0%) пациентов выявлены 14 поздних осложнений. Такие методы отведения мочи, как уретерокутанеостомия, трансуретероуретеронефростомия, выполнялись вследствие запущенности онкологического процесса или когда РЦ проводили по жизненным показаниям. Эти методы отведения мочи были выполнены у 36 (10,7%) пациентов. Гетеротопическое отведение мочи проведено у 8 (2,4%) больных.
Пересадка мочеточников в сигмовидную кишку может быть оправдана при высокой стадии онкологического процесса и ожидаемой непродолжительной жизни пациента. Кожное континентное отведение мочи является методом выбора при наличии противопоказаний или невозможности выполнения ортотопической цистопластики. Ортотопическая реконструкция МП значительно улучшила качество жизни пациентов после РЦ. Ортотопический неоцистис имеет наибольшее сходство с естественным МП как по локализации, так и функционально, обеспечивая функции накопления и эвакуации мочи по уретре.
Комбинированные вмешательства в хирургическом лечении больных местно-распространенным раком мочевого пузыря
И.П. Костюк, А.Ю. Шестаев, Е.Н. Белова, Л.А. Васильев, С.С. Крестьянинов
Ленинградский областной онкологический диспансерВоенно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия
Рак мочевого пузыря в структуре онкологической заболеваемости населения России занимает 8-е место среди мужчин и 18-е среди женщин. Доля мужчин среди всех онкологических больных составляет 4,4 % и женщин — около 1%. Прирост заболеваемости раком мочевого пузыря за последние 10 лет составил 23%. При этом местно-распространенную стадию заболевания (Т3а–Т4в Nх M0) выявляют более чем у трети пациентов.
Оценивали частоту выполнения комбинированных операций и их результаты при хирургическом лечении больных местно-распространенным раком мочевого пузыря.
В течение 5 лет проведено лечение 417 больных с впервые выявленным раком мочевого пузыря. У 118 (28,3%) пациентов необходимым объемом хирургического лечения было удаление мочевого пузыря. У 16 (13,6%) больных вследствие распространения опухоли на соседние органы выполнены комбинированные вмешательства. В 7 случаях отмечено прорастание опухоли в предстательную железу, в 5 — во влагалище и матку, в 3 — опухоль распространялась на переднюю брюшную стенку, и в 1 случае опухоль мочевого пузыря поражала предстательную железу, переднюю брюшную стенку и прямую кишку.
Всем больным проведены хирургические вмешательства в радикальном (R0) объеме. При вторичном поражении предстательной железы (n=7) выполняли расширенную цистпростатэктомию. Распространение опухоли на влагалище и матку (n=5) требовало выполнения передней эвисцерации малого таза. Рост опухоли в структуры передней брюшной стенки (n=3) вызвал необходимость комбинированной с цистэктомией резекции передней брюшной стенки. У одного пациента объем хирургического вмешательства включал комбинированную полную надлеваторную эвисцерацию малого таза с резекцией передней брюшной стенки.
Во всех случаях комбинированных хирургических вмешательств у больных местно-распространенным раком мочевого пузыря выполнена инконтинентная деривация мочи. Для устранения дефекта передней брюшной стенки после ее резекции в 2 из 4 случаев использовали полипропиленовую сетку. Полную надлеваторную эвисцерацию малого таза завершили первичным восстановлением непрерывности толстой кишки. Осложнения в ранний послеоперационный период развились у 5 (31,3%) пациентов, умер один из них.
Комбинированные хирургические вмешательства при местно-распространенном раке мочевого пузыря, включая резекции двух и более смежных органов, оправдано. Их выполнение позволяет добиваться радикальной (R0) опухолевой эрадикации с приемлемыми непосредственными результатами.
Тонкокишечный J-резервуар в ортотопической деривации мочи после хирургических вмешательств на органах малого таза, сопровождающихся цистэктомией
И.П. Костюк, А.Ю. Шестаев, С.С. Крестьянинов, Л.А. Васильев, В.К. Карандашов
Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия
Долгое время радикальную цистэктомию (ЦЭ) рассматривали как инвалидизирующую операцию, сопряженную с высокой летальностью, риском развития тяжелых послеоперационных осложнений и последующим непродолжительным прогнозом в отношении жизни больных. Это было обусловлено несовершенством как техники выполнения ЦЭ, так и методов послеоперационной деривации мочи. Современные методики проведения ЦЭ и тонкокишечной пластики принципиально изменили отношение к данной операции и способствовали ее популяризации. Ортотопическое замещение мочевого пузыря стало стандартной формой его замещения после ЦЭ. Недостатками метода ортотопической цистопластики тонкой кишкой, ограничивающими возможности его применения, являются короткие сосуды брыжейки, ограничивающие его низведение в малый таз без натяжения, а также значительная резорбционная поверхность резервуара при использовании классических технологий Studer и Hautman.
Целью была разработка технологии ортотопической деривации мочи после операций, сопровождающихся ЦЭ, позволяющей беспрепятственно размещать резервуар в полости малого таза и минимизировать послеоперационные метаболические расстройства.
Проанализированы результаты лечения 32 больных, которым после хирургических вмешательств, сопровождающихся ЦЭ, выполнено J-образное моделирование ортотопического мочевого резервуара из тонкой кишки. У 19 больных цистопластика завершала эвисцерации малого таза (ЭМТ). В 14 случаях выполнена полная ЭМТ, в 5 — ее передняя модификация. В 13 наблюдениях ортотопическая J-тонкокишечная пластика выполнена после ЦЭ по поводу рака мочевого пузыря.
При применении методики тонкокишечного J-резервуара случаев несостоятельности резервуара или резервуаро-уретрального анастомоза не отмечено. Емкость неоциста после удаления уретрального катетера составляла 110 мл, через 3 мес — 190 мл, чрез 12 мес — 320 мл. Максимально давление в резервуаре не превышает 40 см водного столба. Дневное удержание мочи составляет 93,7%, ночное — 81,2%. Метаболические расстройства легкой степени отмечены лишь в первые 3 мес наблюдения.
Применение тонкокишечного J-образного мочевого резервуара с целью замещения мочевого пузыря после его удаления может быть рекомендовано к широкому применению. Данный способ прост, надежен и позволяет добиться хорошего качества жизни после операций, сопровождающихся цистэктомией.
Оптимизация техники дренирования брюшной полости после хирургических вмешательств на органах малого таза, сопровождающихся цистэктомией
И.П. Костюк, К.Г. Шостка, С.С. Крестьянинов, Л.А. Васильев, А.Н. Павленко, Э.В. Фокина
Ленинградский областной онкологический диспансерВоенно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия
Длительный и интенсивный послеоперационный болевой синдром в сочетании со сниженной перистальтической активностью кишечника являются обстоятельствами, характерными для ближайшего периода после хирургических вмешательств на органах малого таза, сопровождающихся цистэктомией и расширенной подвздошно-тазовой лимфодиссекцией. Это приводит к задержке активизации пациентов и, как следствие, служит способствующим фактором развития легочных и тромбоэмболических осложнений.
Цель — оценка влияния двухстороннего промежностного дренирования в сочетании с восстановлением париетальной брюшины на течение послеоперационного периода у пациентов, перенесших указанный объем хирургического вмешательства.
Проанализированы ближайшие результаты хирургического лечения 143 пациентов, прооперированных в 2007–2011 гг. в Ленинградском областном онкологическом диспансере и клинике урологии Военно-медицинской академии им. С.М. Кирова. Пациентам была выполнена цистпростатэктомия или передняя надлеваторная эвисцерация малого таза с расширенной подвздошно-тазовой лимфодиссекцией по поводу инвазивного рака мочевого пузыря или местно-распространенного рака шейки матки.
Все пациенты были разделены на 2 группы. В 1-й группе (n=72) после оперативного вмешательства малый таз и брюшную полость дренировали через промежность с двух сторон прямой кишки, а целостность рассеченной париетальной брюшины боковых стенок таза восстанавливали с экстраперитонизацией зоны уретероилеоанастмоза. У пациентов 2-й, контрольной группы (n=71) послеоперационное дренирование осуществляли традиционно — через переднюю брюшную стенку в правой и левой подвздошно-паховых областях.
На 1-е, 3-и, 5-е и 7-е сутки послеоперационного периода оценивали интенсивность болевого синдрома, вызывавшего необходимость продленной перидуральной анестезии и активности кишечной перистальтики. Кроме того, в течение первых 4 нед после операции сравнивали частоту развития легочных, тромбоэмболических и других осложнений в основной и контрольной группах.
В группе пациентов, которым применяли методику двухстороннего промежностного дренирования после операций на органах малого таза, сопровождающихся цистэктомией и расширенной подвздошно-тазовой лимфодиссекцией интенсивность болевого симптома достоверно снизилась в более ранние сроки (p<0,01), что приводило к заметному снижению потребности в перидуральной анестезии (р<0,01). Метеоризм и первый стул как признаки хорошей кишечной перистальтической активности отмечен в более ранние сроки у пациентов данной группы появились в среднем на сутки раньше. Осложнений, зарегистрированных в ранний послеоперационный период, в 1-й группе было достоверно меньше (30 и 56% соответственно) (р<0,001).
Двухстороннее промежностное дренирование после операций на органах малого таза, сопровождающихся цистэктомией и расширенной подвздошно-тазовой лимфодиссекцией в сочетании с восстановлением брюшины боковых стенок таза улучшает послеоперационное восстановление кишечной перистальтики, ведет к снижению интенсивности болевого синдрома и развитию осложнений раннего послеоперационного периода. Установка промежностных дренажей — простая в исполнении и безопасная процедура.
Возможные пути повышения эффективности лечения лучевых повреждений мочевого пузыря
К.Б. Лелявин, В.В. Дворниченко, В.Ф. Онопко
ГБОУ ВПО Иркутский государственный медицинский университет, Россия
Несмотря на создание современной аппаратуры для проведения лучевой терапии (ЛТ), количество пострадиационных осложнений, в том числе лучевых циститов (ЛЦ), остается значительным.
Целью работы была оценка клинического эффекта 40% водного раствора Тизоля в комплексной терапии лучевого цистита.
Оценены результаты лечения 86 пациентов с ЛЦ, получавших внутрипузырную терапию в 2 группах: в 1-й (основной) группе (n=22, 25,6%) использовали композицию двух препаратов: Тизоля и 0,1% раствора диоксидина (общим объемом 50 мл, 1 раз в 3 дня с экспозицией 60 мин). Пациентам 2-й (контрольной) группы (n=64, 74,4%) вводили комбинацию (1 раз в 3 дня) диметилсульфоксида 50% (30–50 мл) в сочетании с кортикостероидами (гидрокортизон 100 мг, кеналог) и гепарином 10 000 ЕД. Характер течения заболевания определяли на основании данных динамического наблюдения. Средний срок наблюдения пациентов составил 24,6±1,4 мес. Количественные данные обработаны статистически с помощью пакетов программ Excel 97, Statistica 7.0. Различия между показателями считали статистически значимыми при р<0,05.
Основными проявлениями ЛЦ у всех исследуемых больных были учащенное и ургентное мочеиспускание, боль внизу живота, в надлонной области, в проекции уретры, гематурия. В основной группе после проведенного комплексного лечения ЛЦ выраженность учащенного мочеиспускания достоверно чаще снижалась относительно исходных показателей после 3 инстилляций, а у больных контрольной группы после 5–6 инстилляций. В ходе лечения у больных 1-й группы уже после первой инстилляции отмечали уменьшение императивных позывов. Комплексная терапия ЛЦ в основной группе позволила добиться уменьшения выраженности воспалительного процесса у всех больных, после 8-разового введения. Включение в программу лечения Тизоля уменьшает выраженность воспаления в мочевом пузыре в 1,75 раза быстрее (р?0,05), чем комбинация с диметилсульфоксидом. Кроме того, проведение инстилляций с Тизолем позволило избежать проведения антибактериальной терапии у 31,2% больных, что подтверждалось посевами мочи.
Внутрипузырное применение Тизоля у больных ЛЦ было патогенетически обосновано, так как Тизоль обладает доказанными противовоспалительными, противоотечными и дезаллергизирующими свойствами, эффективен и хорошо переносим пациентами.
Тактика ведения операционной зоны при релапаротомиях у больных с перитонитами в хирургии рака мочевого пузыря
К.Б. Лелявин, В.В. Дворниченко, В.Ф. Онопко
ГБОУ ВПО Иркутский государственный медицинский университет, Россия
Совершенствование оперативных приемов и способов хирургического лечения, интенсивной терапии и обезболивания, внедрение широкого спектра антибактериальных препаратов не решило проблему лечения послеоперационных осложнений в хирургии рака мочевого пузыря (РМП).
Цель работы — оценить клиническую эффективность различных методов хирургического лечения послеоперационного перитонита у больных РМП.
За последние 10 лет в отделении урологии Иркутского областного онкологического диспансера прооперировано 837 больных РМП с различными стадиями онкологического процесса. По классификации Clavien отмечено 150 (18%) осложнений I степени, 133 (15,8%) — II, 6 (0,7%) — IIIa, 57 (6,8%) — IIIb, 11 (1,3%) — IVa, 13 (1,5%) — IVb и 18 (2,15%) — V. У 46 (5,4%) пациентов возникли осложнения III–V степени (105 случаев). Больных, у которых были проведены аппаратная реинфузия эритроцитов с использованием аппарата Cell Saver и введение аутологичной плазмы, относили ко II степени. Нами проведен анализ 24 больных с разлитым гнойным перитонитом (РГП), возникшим в результате несостоятельности энтероэнтероанастомоза, неоцистоуретероанастомоза, некроза кишечного кондуита. В состав комплексного лечения, наряду с устранением внутрибрюшного источника инфицирования, применяли метод программированных санаций брюшной полости (ПСБП) с интервалом в 24 ч. В 1-ю группу (клинического сравнения) вошли 9 пациентов, которым после каждой ПСБП ЛС закрывалась наложением швов на брюшинно-мышечно-фасциальный слой без сшивания подкожного жирового слоя и кожи. При невозможности восстановления швами фасциально-мышечного слоя (повреждение, диастаз), лапаростомная рана (ЛР) закрывалась кожными швами и дренировалась. 15 пациентов вошли во 2-ю (основную) группу, у которых зона ЛР до выполнения последующей ПСБП отграничивалась от брюшной полости выкроенным листом медицинского силикона (Григорьев Е.Г. и соавт., 2005), помещенным в брюшную полость и заведенным за края ЛР по всему ее периметру. ЛР закрывалась только кожными швами и дренировалась. В дальнейшем, после развития адгезии и фиксации внутренних органов брюшной полости к париетальной брюшине по краям силиконового протектора, последний извлекали, накладывали кожные швы. При формировании постоянной ЛС лист силикона использовали как протектор до гранулирования ЛР.
Использованная тактика позволила достоверно снизить частоту развития гнойно-некротического поражения ЛР с 33,3% в 1-й группе до 6,6% во 2-й группе. Эвентрация осложняла хирургическое течение РГП значимо чаще в 1-й группе (33,3%). Во 2-й группе эвентрации не выявлено.
Применение данного хирургического подхода позволило снизить общую летальность с 44,4 до 13,3 %, уменьшить среднее количество ПСБП с 3,6 до 1,8 и сократить выраженность и длительность инфекционного процесса в брюшной полости.
Новый подход к методике, предупреждающей анальгезию в онкоурологии. Двойное слепое рандомизированное плацебо-контролируемое исследование
И.И. Лесной, Э.А. Стаховский, Л.В. Климчук, Е.Ю. Белка, И.И. Галак
Национальный институт рака, Киев, Украина
Термин «преэмптив анальгезия» (предупреждающая анальгезия) используют для описания методики, при которой анальгетик вводят до начала нанесения операционной травмы, что в последующем значительно снижает интенсивность послеоперационной боли и, возможно, риск ее хронизации. Существуют различные варианты проведения преэмптив анальгезии — введение анальгетика за 30–40 мин до нанесения травмы, после вводного наркоза или непосредственно перед началом зашивания операционной раны. Однако достоверных данных о преимуществе перечисленных подходов в преэмптив анальгезии пока не было получено. Вероятными причинами этого могут быть различия фармакодинамики и фармакокинетики применяемых препаратов, когда их эффект отсутствует или еще недостаточен на момент нанесения операционной травмы, игнорирование процессов послеоперационного воспаления и периферической сенситизации, которые продолжают вызывать боль после операции и не перекрываются однократным предупреждающим введением препарата. В связи с этим целью данного исследования было сравнить эффективность и безопасность применения декскетопрофена и кеторолака за сутки до начала оперативного вмешательства в онкоурологии.
Авторами было проведено рандомизированное двойное слепое плацебо-контролируемое исследование с участием 111 больных, которым предстояло оперативное вмешательство по поводу трансуретральной резекции мочевого пузыря под спинальной анестезией. За сутки до начала оперативного вмешательства больным назначали декскетопрофен в дозе 25 мг 2 раза в сутки, кеторолак 10 мг 2 раза в сутки или плацебо. Определяли уровень простагландина Е2 (PGE2) в плазме и ликворе перед операцией и через сутки после оперативного вмешательства, оценивали болевой синдром по шкале боли (ВАШ), уровень глюкозы в плазме крови, объем кровопотери во время операции.
У больных, получавших декскетопрофен за сутки до начала операции, имели более низкий уровень боли в течение первых 2 сут после операции по сравнению с больными, которые получали кеторолак и плацебо (р=0,001). Уровень PGE2 в плазме (р<0,05) и ликворе (р=0,0001) был ниже у больных, получавших декскетопрофен до начала операции и через сутки после операции, по сравнению с пациентами, получавшими кеторолак и плацебо. Не выявлено достоверных различий по уровню гликемии и объему кровопотери во время операции между пациентами всех групп.
Введение декскетопрофена и кеторолака за сутки до начала операции способствует значительному снижению уровня боли в первые 2 сут послеоперационного периода после оперативных вмешательств в онкоурологии. Анальгетическийй эффект более выражен у больных, получавших декскетопрофен. Более низкий уровень PGE2 и в плазме и в ликворе у больных группы декскетопрофена возможно будет способствовать снижению частоты хронизации боли после операций. Применение такой методики введения нестероидных противовоспалительных препаратов не вызывает увеличения кровопотери во время операции.
Cравнение эффективности общей анестезии и сочетанной общей анестезии с комбинированной спинально-эпидуральной анестезией при оперативных вмешательствах у больных с инвазивным раком мочевого пузыря
И.И. Лесной, Э.А. Стаховский, Л.В. Климчук, О.А. Войленко
Национальный институт рака, Киев, Украина
Цель исследования — оценить эффективность и безопасность применения сочетания комбинированной спинально-эпидуральной анестезии (КСЭА) и общей анестезии при хирургическом лечении больных с инвазивным раком мочевого пузыря.
В исследование было включено 95 пациентов, оперированных по поводу рака мочевого пузыря, которым была проведена радикальная цистэктомия. Больные были рандомизированы на 2 группы. У 60 больных (группа А) — КСЭА с седацией и искусственной вентиляцией легких (ИВЛ). Послеоперационная анальгезия — продленная эпидуральная анальгезия бупивакаином 0,125% 6–8 мл/ч. У 35 пациентов (группа В) — общая анестезия с ИВЛ. Послеоперационная анальгезия омнопоном 2% 1 мл 3–4 раза в сутки. Проводили оценку систолического и диастолического артериального давления, частоты сердечных сокращений, боли по шкале ВАШ, расчет общей дозы анестетиков и мышечных релаксантов, время восстановления сознания после анестезии, уровень глюкозы в плазме крови, объем кровопотери во время операции, появление перистальтики кишечника, начало энтерального питания, активизацию больных в послеоперационный период.
Установлено, что в исследуемой групе А отмечено снижение дозы наркотических анальгетиков на 53% (р=0,001), мышечных релаксантов (р=0,001), сокращение времени восстановления сознания после операции (р=0,005), снижение дозы гипнотиков (р=0,007) по сравнению с больными группы В. Во время анестезии были установлены различия между группами по показателям гемодинамики (умеренная гипотензия и нормокардия в группе А), экстубации трахеи, объему кровопотери во время операции (р=0,002), но не выявлено достоверных различий в уровне гликемии. Интенсивность послеоперационного болевого синдрома у больных группы А была достоверно ниже по сравнению с группой В (р=0,0001).
Проведенным исследованием было показано, что применение КСЭА во время операции вызывает значительное снижение уровня боли в первые 2 сут послеоперационного периода после радикальной цистэктомии. Общая анестезия в сочетании с КСЭА не вызывает увеличения побочных эффектов в периоперационный период, сокращает количество препаратов для анестезии, способствует быстрому пробуждению больных после анестезии, уменьшает объем кровопотери. Учитывая, что в настоящее время отмечают повышение частоты развития постхирургического хронического болевого синдрома, применение КСЭА может способствовать значительному снижению этого показателя.
Результаты радикальной цистэктомии при местно-распространенном раке мочевого пузыря
О.Б. Лоран, И.В. Серёгин
Российская медицинская академия последипломного образования им. С.П. Боткина, Москва, Россия
Радикальная цистэктомия (РЦЭ) с лимфодиссекцией является единственным эффективным хирургическим методом лечения больных с местно-распространенным раком мочевого пузыря (РМП). 5-летняя раковоспецифическая выживаемость после цистэктомии при местно-распространенном РМП варьирует в диапазоне 10–50%. Неоднозначность результатов лечения побудила нас оценить наш опыт лечения местно-распространенного РМП путем радикальной цистэктомии.
Цель исследования — оценить результаты РЦЭ при местно-распространенном РМП.
За 2005–2011 гг. ретроспективно оценены результаты РЦЭ у 81 пациента (63 мужчин, 18 женщин). Средний возраст составил 64,2 года (42–76 лет). РМП диагностирован с помощью трансуретральной резекции. У 61(75,3%) пациента была установлена стадия рТ3 (рТ3а — 40 (49,3%), рТ3в — 21(25,9%)), у 20 (24,7%) — рТ4. У 21 (25,8%) больного отмечали метастазы рака в лимфоузлы. При рТ3а поражение лимфоузлов отмечено у 7(17,5%), при рТ3в у 6(28,6%) и при рТ4 у 8(40%) пациентов. Во всех случаях у женщин выполнена передняя экзентерация, а у мужчин — цистпростатвезикулэктомия.
В результате анализа 5-летняя раковоспецифическая выживаемость составила 57,6% (45,6% у пациентов в возрасте моложе 70 лет, 37,5% — старше 70 лет; р=0,2037). При анализе выживаемости существенных различий между мужчинами и женщинами не выявлено (50,7% против 55,5%, р=0,315). 5-летняя раковоспецифическая выживаемость при стадии pТ3 была выше, чем при pТ4 (р=0,0012). Так, через 1 год после РЦЭ выживаемость составила для рТ3а — 100% для рТ3в — 90%, для рТ4 — 72%, через 3 года — 96; 72; 30%, а через 5 лет — 75; 56; 18% соответственно. Выживаемость при стадии рТ3а достоверно не отличалась от рТ3в (р=0,13). У 21(25,8%) пациента выявлены метастазы в лимфатические узлы по данным морфологического исследования. У этих больных выживаемость была достоверно ниже по сравнению с таковой у пациентов без поражения лимфатических узлов (23,8% против 76,6%; р=0,0011).
Таким образом, стадия и поражение лимфатических узлов являются определяющими неблагоприятными факторами, позволяющими прогнозировать выживаемость. Относительно высокие показатели раковоспецифической выживаемости при местно-распространенном РМП указывают на оправданность и целесообразность применения РЦЭ при местно-распространенном РМП в стадии рТ3.
Альфарекин в профилактике рецидива поверхностного рака мочевого пузыря
А.В. Мальцев1, С.Ю. Паниев2, Е.В. Лампига1
1Донецкий национальный медицинский университет
им. Максима Горького, Украина
2Донецкий областной противоопухолевый центр, Украина
Поверхностный рак мочевого пузыря — одна из самых распространенных форм онкопатологии, которую следует считать заболеванием всей слизистой оболочки органа. По данным ВОЗ, поверхностный рак мочевого пузыря составляет 70% опухолей мочевого тракта и около 3% всех онкологических заболеваний. Экспериментальные и клинические исследования дают основания полагать, что иммунологически активные препараты оказывают как прямое, так и опосредованное воздействие на опухолевые клетки. Использование альфарекина разработанным нами методом занимает особое место в профилактике рецидива поверхностного рака мочевого пузыря.
Целью исследования было улучшение результатов лечения больных с поверхностным раком мочевого пузыря путем применения альфарекина разработанным нами методом.
Мы разработали способ профилактики рецидивов поверхностного рака мочевого пузыря путем внурипузырного и подкожного введения альфарекина.
Проведение иммунотерапии после трансуретральной резекции (ТУР) мочевого пузыря (МП) по разработанной нами схеме показано больным с папилломой мочевого пузыря, поверхностным раком мочевого пузыря Tis, Ta, T1-2, N0M0 G1-2 (первичный и рецидивный).
В исследование включены пациенты, которым в 2009–2011 гг. выполнена ТУР МП с последующей профилактикой рецидивов альфарекином (интерферон человеческий рекомбинантный альфа-2b) согласно вышеуказанной схеме. Больные распределены по полу, возрасту и степени дифференцировки опухоли. Согласно проведенному ретроспективному анализу всего за 3 года пролечено 72 больных, из них 14 — без дополнительного лечения. Мужчин было 47, женщин — 25. Возраст колебался в диапазоне 21–72 года.
Предлагаемая нами схема профилактики рецидива поверхностного рака мочевого пузыря после ТУР МП составляет по 5 млн ЕД альфарекина 2 раза в неделю внутрипузырно и 5 млн ЕД подкожно 2 раза в неделю в течение 3 мес соответственно, с последующим контролем анализа крови, мочи, УЗИ м/п, цистоскопии с биопсией.
По данным контрольной цистоскопии и УЗИ, через 3 мес после операции, у 63 больных рецидивов заболевания не выявлено. Рецидивы отмечены у 9 пациентов, не получавших дополнительного лечения.
Полученные результаты свидетельствуют об эффективности предложенного способа профилактики рецидивов поверхностного рака мочевого пузыря.
Прогнозирование патологической степени местной распространенности рака мочевого пузыря по клиническим данным
Л.В. Мириленко, О.Г. Суконко, А.В. Праворов, А.С. Мавричев, А.И. Ролевич
Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова, Минск, Республика Беларусь
Цель исследования — построение номограммы, прогнозирующей патологическую степень местной распространенности рака мочевого пузыря (РМП) рТ3-рТ4 (рТ3+) по клиническим данным.
Материалом послужили данные 511 пациентов с диагнозом РМП, которым в 1999–2008 гг. в РНПЦ ОМР была выполнена радикальная цистэктомия. Для прогнозирования вероятности наличия pT3+ по дооперационным данным использованы моно- и мультивариантные модели логистической регрессии. Показатели с р<0,1 включены в мультивариантный анализ. Далее к многомерной модели была применена процедура пошагового исключения с целью нахождения наиболее информативного и компактного варианта. Коэффициенты уравнения логистической регрессии использованы для построения номограммы. Точность номограммы оценена индексом конкордации (с-index). Для определения прогностической способности номограммы при разных значениях прогностической вероятности построен калибровочный график. Внутренняя валидизация выполнена методом бутстрэп с использованием 200 вариантов наборов данных. Бутстрэп-скорригированная точность вычислена как среднее значение индексов конкордации, рассчитанных для каждого набора.
Прогнозирование вероятности рТ3+ только по клинической степени местной распространенности дает бутстрэп-скорригированную прогностическую точность 68,8%. Разработана номограмма, включающая предикторы: клиническая степень местной распространенности сТ, степень дифференцировки, характер роста опухоли, наличие уретерогидронефроза, поражение опухолью простатического отдела уретры и/или одной или двух долей предстательной железы, поражение трех и более стенок мочевого пузыря, СОЭ, креатинин (рисунок). Бутстрэп-скорригированная прогностическая точность разработанной номограммы составила 81,4%, что на 12,6% выше точности моновариантной модели.
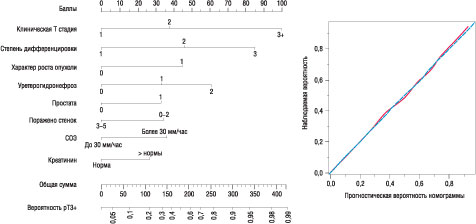
Использование разработанной номограммы, учитывающей комбинацию факторов прогноза местно-распространенного РМП, позволяет существенно повысить точность прогнозирования патологической стадии опухоли, что может быть использовано при отборе пациентов для неоадъювантной терапии.
Значимость фотодинамической диагностики у пациентов с поверхностными опухолями мочевого пузыря
Т.Н. Мусаев
Национальный центр онкологии, Баку, Азербайджанская Республика
Рак мочевого пузыря (РМП) является достаточно частой патологией и составляет около 2–5% всех злокачественных новообразований. В структуре онкологических заболеваний РМП занимает 11-е место в мире и достигает ориентировочно 10–15 случаев на 100 тыс. человек в год. В США и Европе выявляемость РМП в 2–3 раза превышает среднемировые показатели. Мужчины болеют РМП в 2,5–6 раз чаще женщин. Для РМП в большой степени характерно повышение заболеваемости с возрастом. Опухоли мочевого пузыря почти не выявляют у людей в возрасте моложе 35 лет, однако после 65 лет вероятность возникновения РМП резко повышается. При первичном обследовании у 50% больных диагностируют поверхностные опухоли.
Трансуретральная резекция (ТУР) опухоли мочевого пузыря на современном этапе развития онкоурологии считается основным методом лечения неинвазивного РМП. Частота выявления рецидивов в течение первого года наблюдения после ТУР, по данным различных авторов, составляет 30–80% случаев. Важно отметить, что в 20% случаев отмечают инвазивный рост опухоли. Считается, что РМП — болезнь всей слизистой оболочки мочевого пузыря. Одной из причин рецидива служит диффузный характер неопластических изменений (carsinoma in situ), не выявленные и не удаленные во время операции очаги. Традиционная цистоскопия позволяет определить в основном папиллярные образования. Неопределяемые поражения в слизистой оболочке мочевого пузыря при проведении ТУР являются источником рецидива у 40–50% больных. Для установления вышеуказанных образований во время первичной операции применяют фотодинамическую диагностику с применением 5-аминолевуленовой кислоты (5-АЛК).
За 2011 г. в отделении онкоурологии НЦО МЗ АР 43 (100%) пациентам выполнена флуоресцентная диагностика с одномоментной ТУР опухоли и участков с повышенным накоплением 5-АЛК. Из них у 14 (32,5%) пациентов были рецидивные опухоли. У 29 (67,5%) больных с первичными опухолями критерием включения в исследование было наличие небольших опухолей размером до 2 см, выявленных посредством УЗИ, КТ и цистоскопии. Для фотодинамической диагностики использовали препарат «АЛАСЕНС» фирмы NIOPIK, Россия и эндоскопическое оборудование фирмы KARL STORZ со световым источником D-Light. Для визуализации использовали оптику HOPKINS прямого видения 300 с красным цветовым кодом. Препарат вводили внутрипузырно за несколько часов до проведения ТУР. Операция проводилась под спинальной анестезией, реже — под внутривенным наркозом. На начальном этапе при обычном освещении удаляли видимые опухоли, далее проводили флуоресцентную цистоскопию.
Выявленные при флуоресцентной цистоскопии в красном свете очаги активного накопления 5-АЛК резецированы и пронумерованы отдельно у каждого пациента и отправлены на морфологическое исследование.
У 5 (17,2%) больных с первичными опухолями при флуоресцентной диагностике выявлено от 1 до 6 участков морфологически подтвержденного уротелиального рака мочевого пузыря. У пациентов с рецидивными опухолями дополнительные участки поражения посредством флуоресцентной диагностики отмечены у 4 (28,6%) пациентов.
Таким образом, флуоресцентная диагностика позволила у 17,2% пациентов с первичной опухолью установить первично множественную опухоль, а при неинвазивных рецидивах у 28,6% больных удалить неопределяемые в обычном свете морфологически подтвержденные опухоли.
Применение фотодинамической диагностики позволяет более радикально провести эндоскопическое хирургическое вмешательство, способствуя уменьшению количества рецидивов, и влияет на назначение адъювантной терапии при органосохраняющей тактике лечения.
Поздние осложнения после радикальной цистэктомии
Н.С. Нургалиев
Казахский научно-исследовательский институт онкологии и радиологии, Алматы, Республика Казахстан
Одной из наиболее сложных проблем после проведенных радикальных цистэктомий является выбор метода деривации мочи. Такие операции обеспечивают относительно удовлетворительное качество жизни пациентам, однако сопровождаются довольно значительным количеством ранних и поздних осложнений. Летальность, связанную с осложнениями в ранний послеоперационный период, зачастую удается снизить благодаря разработке оптимальной тактики лечения в соответствии с распространенностью процесса, общим состоянием больного и приобретенным опытом хирургов. Это, в свою очередь, согласуется с данными разных авторов, занимающихся этой проблемой.
Комплексная профилактика и лечение поздних послеоперационных осложнений после любых методов деривации мочи остается актуальной проблемой для онкоурологов и хирургов. Проблема лечения больных с кишечной пластикой мочевого пузыря объясняется тяжелым течением инфекционных процессов, нарушением водно-электролитного баланса, риском развития гиперхлоремического метаболического ацидоза, диареи, снижением иммунореактивности организма, остеопороза, камнеобразования.
В нашем отделении в 2006–2011 гг. (включительно) выполнено 170 радикальных цистэктомий. По выбору методов дренирования мочи после проведенных 170 радикальных цистэктомий в 3 случаях применена методика «сухой» уростомы, в 15 — двусторонняя уретерокутанеостомия, в 72 — с созданием илеумкондуита по Бриккеру, в 18 — нами применена методика ортотопического резервуара по Штудеру и в 62 — по методике Хаутмана.
Около 30% больных (51 пациент) наблюдаются в нашем институте, периодически согласно срокам динамического наблюдения проходят весь перечень обследований. Нами выявлены следующие основные поздние осложнения.
После уретерокутанеостомии практически у 100% пациентов развиваются восходящий пиелонефрит, бактериурия. При этом более характерна вялотекущая форма пиелонефрита, без яркой клинической симптоматики, но устойчивая, трудно поддающаяся противовоспалительной терапии и в динамике в сроки от 6 мес до 1,5–2 года прогрессирует в хроническую почечную недостаточность с развитием характерной клинической картины.
У пациентов с илеумкондуитом по Брикеру также отмечен восходящий пиелонефрит, периодически с обострениями, но достаточно хорошо поддающийся противовоспалительной терапии. Кишечные расстройства не столь ярко выражены при соблюдении диеты. Наибольшее количество осложнений здесь обусловлено погрешностями ухода за стомами, развитием различных местных воспалительных реакций в области стом.
Пациенты с ортотопическим мочевым пузырем составили наибольшую группу наблюдения (24 пациента). Частоту воспалительных осложнений с развитием восходящего пиелонефрита отмечали у 95% пациентов, примерно у 25% — периодически ярко выраженные атаки пиелонефрита, что вызывало необходимость назначения мощных антибактериальных препаратов. Кишечные расстройства в виде диареи, нарушения водно-электролитного баланса, картины метаболического ацидоза выявляли примерно в 30% случаев. Около 90% пациентов отмечали дискомфорт в виде недержания мочи по ночам, что вызывает необходимость использования прокладок (1–2 прокладки за ночь). Тем не менее, большинство пациентов удовлетворены наличием у них самостоятельного акта мочеиспускания.
Выбор метода деривации мочи зависит от стадии рака мочевого пузыря, анатомо-физиологических особенностей и функционального состояния желудочно-кишечного тракта, верхних мочевых путей и почек. При любом из вышеперечисленных методов деривации мочи отмечают различные поздние осложнения. Наиболее предпочтительными являются операции с созданием ортотопического мочевого пузыря и илеумкондуита по Брикеру. Правильно выполненная операция и последующие профилактические мероприятия улучшают качество жизни данных пациентов.
Частота мутаций гена FGFR3 у больных раком мочевого пузыря в Республике Беларусь
А.И. Ролевич1, М.П. Смаль2, С.А. Красный1, Р.И. Гончарова2, С.Л. Поляков1, Т.И. Набебина1
1Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова, Республика Беларусь
2Институт генетики и цитологии Национальной академии наук Беларуси, Минск, Беларусь
Открытие высокой частоты мутаций гена FGFR3 у пациентов с раком мочевого пузыря (РМП) и последующее обоснование существования двух альтернативных генетических путей в патогенезе уротелиальной карциномы являются самым значительным достижением молекулярной онтогенетики РМП за последнее время. В ряде работ было показано, что мутации гена FGFR3 представляют ценный прогностический маркер опухолей с низким потенциалом злокачественности и коррелируют с благоприятным прогнозом, в том числе и для больных с мышечно-инвазивными опухолями, позволяя выделить подгруппу пациентов для органосохраняющего лечения.
Поскольку стандартные клинико-патологические характеристики РМП недостаточно точно предсказывают судьбу конкретного пациента, изучению прогностической роли молекулярно-генетических маркеров для определения характера клинического течения РМП уделяется сейчас большое внимание. В данной работе изучен молекулярно-генетический статус гена FGFR3 в проспективной когорте больных РМП.
Мутационный статус гена FGFR3 определен посредством метода SNaPshot у 167 пациентов с первичным РМП, средний возраст которых составил 65,8±10,7 года.
Установлена корреляция между наличием мутаций гена FGFR3 и стадией опухоли. Так, в рТа опухолях мутации отмечали с частотой 64,7%, рТ1 — 51,6%, рТ2 — 38,7%, рТ3 — 8,3% и рТ4 — 6,3% (pFGFR3чаще выявляли в опухолях G1 (66,7%), в то время как в опухолях G2 и G3 этот показатель составлял 38,9 и 15,8% соответственно (р<0,05).
В 43,1% опухолей (72 из 167) выявлены шесть различных мутаций, локализованных в 7-м; 10-м и 15-м экзонах гена FGFR3, причем у 4 пациентов были отмечены двойные мутации. Мутация S249C в кодоне 249 составила 68,4% всех выявленных мутаций, что хорошо согласуется с известными данными о паттерне встречаемости мутаций гена FGFR3 у больных из разных географических регионов.
Полученные результаты свидетельствуют о том, что мутантный статус гена FGFR3 характерен для неинвазивных опухолей с низким потенциалом злокачественности, что может быть использовано в качестве дополнительного прогностического маркера у пациентов с РМП. 7-й экзон гена FGFR3 является «горячей точкой» при возникновении опухолей мочевого пузыря.
Цистэктомия в лечении немышечно-инвазивного рака мочевого пузыря
К.Н. Сафиуллин, А.О. Карякин
ФГБУ «Медицинский радиологический научный центр» Минздравсоцразвития России, Обнинск, Россия
При лечении немышечно-инвазивного рака мочевого пузыря основным методом является трансуретральная резекция (ТУР) опухоли, однако около 50% рецидивов выявляют в течение первых 2 лет наблюдения, риск прогрессии в мышечно-инвазивную форму рака после 5 лет может достигнуть 5–30%. Вопрос о сроках проведения цистэктомии в настоящее время остается нерешенным. Европейская ассоциация урологов (European Association of Urology — EAU) рекомендует выполнять цистэктомию у пациентов с рецидивами после внутрипузырной иммунотерапии через 9 мес.
Исследование базируется на результатах обследования и лечения 34 больных немышечно-инвазивным раком мочевого пузыря, которым выполнена радикальная цистэктомия в 2006–2011 гг. Среди них было 7 (20,6%) женщин и 27 (79,4%) мужчин. Средний возраст больных составил 55,6 года. У 22 (64,7%) больных выявлена первично-множественная опухоль, у 12 (35,3%) — одиночная. У 1 (2,9%) пациента установлена стадия Та, а у 33 (97,1%) — Т1. Сопутствующий рак in situ до операции отмечен у 1 (2,9%) пациента, а у 19 (55,9%) — high grade. В зависимости от сроков выполнения операции все больные были разделены на 2 группы: 1-я группа (n=14) — отсроченная цистэктомия, 2-я группа (n=20) — ранняя цистэктомия. В 1-й группе до цистэктомии однократный рецидив заболевания отмечен только у 1 (7,1%) больного из 14, остальные 13 (92,9%) имели неоднократные рецидивы в анамнезе и получали различные виды адъювантной терапии. Временной интервал до цистэктомии в 1-й группе составил 14–60 мес, в среднем 36,4 мес. У 3 из 14 (21,4%) пациентов до операции выявлена двухсторонняя пиелоэктазия, связанная с рубцовыми изменениями, у 1 (7,1%) — односторонний гидронефроз по той же причине. Неоднократные обострения хронического пиелонефрита отмечены у 2 (14,3%) больных. Ранняя цистэктомия (2-я группа) проведена больным с высокими баллами рецидива и прогрессирования. В этой группе средний срок до операции составил 17 дней.
В течение 60 мес наблюдения в группе отсроченной цистэктомии у 2 из 14 (14,3%) больных развился рецидив заболевания, а в группе ранней цистэктомии у 2 (10,7%) выявлено прогрессирование. У 1 больного 1-й группы(7,2%) в послеоперационный период выявлена односторонняя пиелоэктазия после гетеротопической пластики, а после ортотопической пластики у 1 (7,2%) пациента отмечена умеренная двухсторонняя пиелоэктазия.
Таким образом, своевременно установленные показания к цистэктомии у больных с немышечно-инвазивным раком мочевого пузыря позволило у 30 из 34 (88,2%) пациентов в сроки 60 мес добиться безрецидивной выживаемости.
Лечение поверхностного рака мочевого пузыря
А.У. Саякова, Т.К. Эшалиев, А.Д. Керимов, Б.М. Ибраев, А.Т.Токтомушев
Национальный центр онкологии МЗ Кыргызской Республики, Бишкек
Поверхностный рак мочевого пузыря (ПРМП) характеризуется более благоприятным прогнозом и требует выполнения менее щадящего лечения, однако из этих правил бывают исключения. Существует мнение о необходимости выполнения радикальной цистэктомии лишь у пациентов с раком Т1 и дифференцировкой опухоли GЗ, так как у данной группы больных в 20% случаев рецидивов отмечают врастание опухоли в мышечный слой.
Представлены результаты лечения 90 больных с ПРМП. Всем больным выполнена простая трансвезикальная резекция мочевого пузыря. У 25 из 90 пациентов (27,8%) лечение ограничилось только операцией (контрольная группа).
Комбинированное лечение применено в 3 группах больных: 1-я группа — предоперационная внутрипузырная химиотерапия — 18 (20,0%) больных; 2-я группа — послеоперационная внутрипузырная химиотерапия — 22 (24,4%) пациента и 3-я группа — послеоперационная лучевая терапия — 25 (27,8%) больных.
Диагноз заболевания верифицирован патогистологически, у 89 (98,8%) пациентов выявлена переходно-клеточная карцинома и лишь у одного (1,2%) — плоскоклеточный рак. Степень дифференцировки опухолевой клетки была следующей: G1 — у 23 (25,5%) больных, G 2 — у 21 (24,5%), G З — у 4 (4,5%), у 41 (45,5%) степень дифференцировки опухоли не установлена.
У 21 (23,3%) из 90 больных выявлены множественные опухоли мочевого пузыря, у остальных 69 (76,7%) — одиночные.
У 25 пациентов (1-я группа) из 90 лечение ограничилось только хирургическим вмешательством, результаты лечения этой группы применили для сравнения результатов комбинированной терапии у больных ПРМП.
Использовали следующие химиопрепараты — тиофосфамид — у 31 больного (77,5%), платидиам — у 5 (12,5%), Адриамицин — у 2 (5,0%) и у 2 (5,0%) больных ? доксорубицин (2-я группа).
Химиопрепараты вводили в мочевой пузырь по общеизвестной методике. Разовая доза (РД) химиопрепарата за одно введение составляла для тиофосфамида 30–60 мг с интервалом 3–4 дня, суммарная доза (СД) 120–360 мг, для Адриамицина РД 20–40 мг, СД 100–160 мг, для платидиама РД 30–60 мг, СД 150–300 мг. Внутрипузырную химиотерапию начинали через 2–3 нед после операции, то есть с момента заживления надлобкового свища.
3-я группа: послеоперационную лучевую терапию проводили на 14–20-е сутки после операции на аппарате дистанционной гамма-терапии «Рокус-М» с источником Со60, с 4 полей. Разовая очаговая доза (РОД) 1,8–2 Гр и с суммарной очаговой дозой (СОД) до 35 Гр проведено у 5 (20%) больных и 35–50 Гр — у 20 (80%).
При сравнении результатов лечения ПРМП выявлена существенная разница в показателях 5-летней выживаемости (таблица). Так, в группе комбинированного метода лечения получены лучшие показатели выживаемости — 89,1% по сравнению с 63,0% в группе, где лечение ограничилось только операцией (р<0,05), а различия показателей 3-летней выживаемости в обеих группах незначительны — 87,6 и 91,8% в пользу комбинированного метода лечения (р>0,05).
Таблица Влияние результатов лечения ПРМП на выживаемость
| Характер лечения | Число больных | Выживаемость, % | |
|---|---|---|---|
| З-летняя | 5-летняя | ||
| Хирургический | 25 | 87,6±6,7 | 63,0±5,1 |
| Комбинированный | 65 | 91,8±3,4 | 89,1±4,1 |
| Всего | 90 | p>0,05 | p |
Подводя итог исследования групп больных, получивших хирургическое и комбинированные методы лечения, следует отметить следующее: 3-летняя выживаемость в сравниваемых группах в целом не отличается, но 5-летняя выживаемость достоверно выше у пациентов, получивших комбинированный метод лечения, — почти 90%.
Эпидемиология опухолей мочевого пузыря в Донецкой области
П.С. Серняк, В.Г. Кобец, В.В. Волошин
Донецкий национальный медицинский университет, Украина
Донецкое областное клиническое территориальное объединение, Украина
Рак мочевого пузыря (РМП) до настоящего времени остается одной из актуальнейших проблем онкоурологии и занимает 6-е место в структуре онкологических заболеваний (11,4 на 100 тыс. населения), 3-е место среди урологической и 2-е место среди онкоурологической патологии (50 и 72% соответственно). Заболеваемость мужского населения превышает таковую у женщин в 4 раза. Количество больных РМП во всем мире возрастает каждые 5 лет больше чем на 20% и, по прогнозам, будет увеличиваться в том же темпе. Жители развитых стран, особенно представители европеоидной расы, наиболее подвержены этому заболеванию. Так, в США и Западной Европе заболеваемость РМП в 2–3 раза превышает среднемировые показатели и в 10 раз выше, чем в Восточной Европе и Азии.
В Украине РПМ занимает 3-е место среди урологической (50%) и 2-е место среди онкоурологической патологии (72%). В настоящее время в Украине на учете находится около 29 тыс. больных РМП. Заболеваемость и смертность от РМП высока, ежегодно заболевает 4000–4400 мужчин и 800–900 женщин, умирает до 2500 человек. Несмотря на развернутую специализированную онкоурологическую помощь, заболеваемость в Донецкой обл. находится на 1-м месте (до 500 человек в год). Ежегодно умирает до 270 человек.
Цель — провести анализ заболеваемости, методов лечения и смертности от РМП в Донецкой обл. за период 2005–2010 гг.
По данным отчетов проведен анализ показателей заболеваемости и смертности от РМП в Донецкой обл. за 2005–2010 гг. Проанализированы методы лечения этой патологии.
Данные о заболеваемости РМП в Донецкой представлены в табл. 1.
За 2005–2010 гг. в Донецкой обл. пролечено 5352 пациента. Им выполнено 1325 резекций мочевого пузыря. Из года в год этот показатель уменьшается (от 303 в 2005 г. до 122 в 2010 г.). Благодаря хорошо развитой онкоурологической специализированной помощи и раннему выявлению РМП на смену открытым операциям пришли эндоурологические вмешательства. За этот период выполнено 1800 трансуретральных резекций мочевого пузыря (показатель увеличился с 243 в 2005 г. до 352 в 2010 г.). С целью профилактики рецидивирования РМП стали широко применять методику внутрипузырной иммунотерапии вакциной БЦЖ (более 100 случаев).
Таблица 1 Заболеваемость РПМ в Донецкой обл.
| Годы | Общее число |
Мужчины | На 100 тыс. мужского населения |
Женщины | На 100 тыс. женского населения |
На 100 тыс. населения |
|---|---|---|---|---|---|---|
| 2005 | 500 | 403 | 19,0 | 97 | 3,8 | 10,7 |
| 2006 | 465 | 376 | 17,9 | 89 | 3,5 | 10,1 |
| 2007 | 434 | 365 | 17,6 | 69 | 2,0 | 9,5 |
| 2008 | 452 | 374 | 18,2 | 78 | 3,2 | 10,0 |
| 2009 | 464 | 378 | 19,0 | 86 | 3,8 | 10,7 |
| 2010 | 468 | 371 | 19,0 | 97 | 3,8 | 10,7 |
| Всего | 2783 | 2267 | 516 |
Распределение по стадиям заболевания представлено в табл. 2.
Таблица 2 Распределение пациентов с РМП по стадиям заболевания
| Годы | Стадия Т1–2 | Стадия Т3 | Стадия Т4 |
|---|---|---|---|
| 2005 | 361 | 101 | 38 |
| 2006 | 349 | 84 | 32 |
| 2007 | 286 | 91 | 41 |
| 2008 | 318 | 100 | 34 |
| 2009 | 359 | 76 | 29 |
| 2010 | 35 | 89 | 27 |
| Всего | 2041 | 541 | 201 |
В 2005–2010 гг. выполнено 111 цистэктомий, из них 80 с различными видами кишечной пластики и деривации мочи и 31 уретерокутанеостомия.
От рака мочевого пузыря в Донецкой обл. с 2005 по 2010 г. умерло 1519 человек. Ежегодно число умерших составляет 234–269 больных, причем около половины из них умирает в течение одного года после установления диагноза. Смертность составила 5,432–6,511 на 100 тыс. населения, что несколько выше, чем в целом по Украине (5,008–5,118).
Заболеваемость и смертность от РМП в Украине высока, Донецкая обл. занимает 1-е место по этим показателям. Отмечают незначительную положительную тенденцию по раннему выявлению пациентов с опухолями мочевого пузыря, что позволяет выполнять им трансуретральные оперативные вмешательства и повысить частоту цистэктомий. Использование внутрипузырной иммунотерапии (БЦЖ) оправдано и ее следует шире назначать в клинической практике.
Неоадъювантная химиотерапия в лечении инвазивного рака мочевого пузыря
Э.А. Стаховский, О.А. Войленко, П.С. Вукалович, В.А. Котов, Ю.В. Витрук, А.А. Кононенко
Национальный институт рака, Киев, Украина
Неоадъювантная химиотерапия используется для улучшения результатов лечения пациентов с местно-распространенным инвазивным раком мочевого пузыря (РМП) и с метастатическим поражением лимфатических узлов. Несмотря на уже установленное незначительное преимущество выживания, дальнейшее изучение эффективности неоадъювантной полихимиотерапии (ПХТ) необходимо для определения категории пациентов, которые могут получить положительный результат от мультимодальной терапии.
Цель — повысить эффективность комплексного лечения и качество жизни больных инвазивным РМП путем применения неоадъювантной ПХТ.
Ретроспективному анализу (2008–2011 гг.) подвергнуты 41 больной с инвазивным РМП, которым цистэктомия была противопоказана или они отказались от ее проведения. Всем больным было проведено 3 курса неоадъювантной ПХТ по схеме гемцитабин — цисплатин с последующей оценкой ее эффективности по критериям RECIST. Мужчин — 38 (92,7%), женщин — 3 (7,3%). Возраст пациентов — 61,1+11,1 года.
При проведении ПХТ серьезных побочных эффектов не отмечено. Стабилизация опухоли выявлена у 11 (26,8%) пациентов, прогрессия — у 2 (4,9%), что стало показанием к выполнению цистэктомии. У 24 (58,5%) больных при проведении контрольного обследования отмечена частичная регрессия опухоли, что позволило провести органосохраняющее оперативное лечение. Полная регрессия опухоли диагностирована в 4 (9,8%) случаях.
Прослежена взаимосвязь степени гистопатологической градации опухоли (G) с регрессией опухоли. У 5 (12,2%) больных с высокодифференцированным РМП (G1) степень регрессии по RECIST в среднем составила (84±10,8)%, у 24 (57,1%) пациентов с умеренно дифференцированным РМП (G2) — (55,8±31,7)% и у 12 (28,6%) с низкодифференцированным (G3) — (32,1 ± 35,3)%. Разница достоверна между G1 и G3.
Срок наблюдения 3–39 мес. В течение периода наблюдения в основной группе в разные сроки умерло 6 (14,6%) больных. Общая выживаемость через 2 года составила 75,4%.
Использование неоадъювантной ПХТ у больных инвазивным РМП позволяет получить в 9,8% случаях полную, а в 58,5% — частичную регрессию опухоли с 2-летней общей выживаемостью на уровне 75,4%. Перспективное направление в дальнейшем развитии онкоурологии — определение химиочувствительности РМП, что является необходимым условием при оптимизации отбора пациентов для проведения химиотерапии.
Сравнительная оценка эффективности ректосигмоидного и ортотопического методов отведения мочи
Э.А. Стаховский, О.А. Войленко, А.И. Яцына, В. Битнер, Ю.В. Витрук
Национальный институт рака, Киев, Украина
Для многих пациентов с мышечно-инвазивной формой рака мочевого пузыря (РМП), а также в случаях прогрессирующей неинвазивной его формы, радикальная цистэктомия (РЦ) остается единственным способом лечения. Функциональные проблемы и качество жизни признаны главным недостатком РЦ, что стимулирует научный интерес к усовершенствованию методов деривации мочи.
Цель работы — повысить эффективность лечения больных РМП путем проведения сравнительной оценки осложнений и качества жизни у больных с ректосигмоидной и ортотопической деривацией мочи после РЦ.
Клиническому анализу подвергнуты 178 больных РМП, которым была выполнена РЦ. Все пациенты разделены на 2 группы. В 1-ю группу включены 96 больных с ректосигмоидной деривацией мочи по Maints II, во 2-ю — 82 с ортотопической тонкокишечной пластикой по методике клиники («Dоuble U»). Возраст составил 60,8±14,6 года. У 21 (11,8%) больного ЦЭ выполнена при поверхностном, и у 157 (88,2%) — при инвазивном РМП.
Пациентам проводили комплексное обследование, направленное на установление анатомо-функциональных изменений в мочевыводящей системе и почках, возникших вследствие осложнения деривации. Качество жизни изучали путем анкетирования (опросник QoL).
Уретерогидронефроз (УГН) до операции выявлен у 61 (34,3%) больного (76 мочеточников). Почечная недостаточность диагностирована в 15 (8,4 %) случаях. Анализ изменений в верхних мочевых путях представлен в табл. 1.
Таблица 1 УГН в группах сравнения до операции и через 3 мес после нее
| Способ деривации | До операции, n=178 (%) | Через 3 мес после операции, n=163 (%) |
|---|---|---|
| Maints II | 43 (22,4) | 56 (32,1) |
| Double U | 33 (20,1) | 19 (12,5) |
| Статистическая оценка | c2 = 5,47 (р | |
Представленные данные свидетельствуют об ухудшении уродинамики верхних мочевыводящих путей после проведения ректосигмоидной деривации, что в первую очередь обусловлено развитием рефлюксов. В противовес этому проведение илеонеоцистопластики позволило в большинстве случаев улучшить уродинамику за счет формирования мочевого резервуара емкостью до 600 мл при внутрипузырном давлении, не превышающем 35 см Н2О. Анализ качества жизни представлен в табл. 2.
Таблица 2 Качество жизни больных до операции и через 3 мес после нее
| Показатель | До операции, n=178 | 3 мес после операции, n=163 | |
|---|---|---|---|
| Maints II, n=87 | Double U, n=76 | ||
| Качество жизни QoL, баллы | 3,3±1,2 | 2,5±1,3 | 1,7±0,8 |
| Статистическая оценка | р | ||
Отмечено статистически достоверное повышение качества жизни по сравнению с дооперационным уровнем с лучшими показателями в группе ортотопической деривации. Немаловажную роль в качестве жизни играют осложнения, которые отмечали чаще при ректосигмоидном отведении: пиелонефрит — 39 (44,8%) случаев, стеноз мочеточниково-кишечного анастомоза — 19 (21,8%), метаболический ацидоз — 25 (28,73%). В противовес этому при ортотопической деривации частота пиелонефрита не превышала 15,8%, метаболический ацидоз выявлен у 13,2% больных. В 7 (9,2 %) случаях возник стеноз уретероилеального анастомоза, что было показанием к реанастомозированию. Стеноз уретроилеального анастомоза возник у 6 (7,9%) пациентов, проходимость восстановлена путем проведения оптической уретротомии.
Наиболее оптимальным видом деривации на сегодня остается ортотопическое отведение с формированием резервуара из сегмента тонкой кишки, что подтверждается лучшими показателями качества жизни больных, позволяет восстановить акт мочеиспускания, максимально приближенный к естественному, и вызывает меньшее количество осложнений.
Функция артифициального илеального мочевого пузыря сформированного способом «Double U»
Э.А. Стаховский, А.И. Яцина, О.А. Войленко, О.Н. Гаврилюк, Ю.В. Витрук
Национальный институт рака, Киев, Украина
Из множества предложенных методов деривации мочи наиболее эффективным остается создание артифициального илеального мочевого пузыря. Определение функции артифициального мочевого пузыря, ее влияния на субъективные ощущения, метаболические изменения, уродинамику и контролируемое мочеиспускание позволяют объективизировать качество жизни больных и эффективность данного способа.
Цель — изучение функционального состояния илеального мочевого пузыря (ИМП), сформированного по методике Double U путем изучения качества жизни, уродинамики и урофлоуметрии.
Анализу подверглись 47 больных с инвазивным раком мочевого пузыря (РМП), которым в 2008–2011 гг. проведена радикальная цистэктомия в модификации клиники (Double U), которая предусматривает формирование артифициального ИМП из тонкокишечного трансплантата длиной 40 см. Для оценки функции ИМП использовали данные рентгенологических обследований (обзорная и экскреторная урография, уретроцистография, СКТ или МРТ с использованием методики МР-урографии в режиме гидрографии), урофлоуметрии и цистотонометрии, профилометрии уретры. Качество жизни оценивали с помощью опросника SF-36 (Short-Form 36 Item Helth Survey).
Недержание мочи через 6 мес отмечали у 7 (14,8%) больных. Средняя функциональная емкость ИМП изначально составляла 215±37 мл, через 6 мес — 495±46,6 мл, что совпадало с увеличением времени между мочеиспусканиями с 2 до 4 ч. При проведении восходящей уретроцистограммы сужение уретроилеального анастомоза диагностировано у 3 (6,4 %) больных и было устранено с помощью трансуретральной оптической уретротомии. По данным урофлоуметрии, объем мочеиспускания составлял 517±112 мл, время мочеиспускания не превышало 60 с при средней скорости мочеиспускания 12,1±3,4 мл/с и максимальной — 20,4±3,3 мл/с. При проведении цистотонометрии порог субъективной чувствительности возникал при объеме наполнения 390±46 мл, первый позыв к мочеиспусканию — при объеме 420±45 мл, а императивный — при 612±97 мл и внутрилеальном давлении 16,2±1,4 см вод. ст. Длина зоны максимального давления в уретре составила 21±3 мм, что свидетельствует об удовлетворительной функции удерживающего аппарата. По данным опросника SF-36, физический компонент в течение 6 мес наблюдения увеличился с 43,5±8,9 до 65,1±10,3 балла, тогда как психоэмоциональный — с 49,5±11,8 до 66,4±11,7 балла. Данные показатели отображают высокий уровень качества жизни пациентов.
После цистэктомии артифициальный ИМП в модификации клиники Double U обеспечивает удовлетворительные клинические и функциональные результаты, улучшает качество жизни пациентов.
Варианты деривации мочи после хирургического лечения местно-распространенных и осложненных форм опухолей органов малого таза
М.Н. Тилляшайхов, О.У. Вахабов, Н.Ш. Юлдашева, Д.К. Абдурахмонов
Республиканский онкологический научный центр МЗ Республики Узбекистан, Ташкент
Цель исследования — изучить отдаленные результаты комбинированно-расширенных операций при местно-распространенных и осложненных формах опухолей органов малого таза и определить варианты деривации на качество жизни пациентов.
Проанализированы истории болезни 46 пациентов с опухолями мочевого пузыря, шейки матки и прямой кишки, пролеченных в отделениях РОНЦ. Больные отобраны по принципу прорастания первичной опухоли в соседние органы с формированием пузырно-влагалищного и/или пузырно-ректального свища наличием супра- и инфравезикальной обструкции. Первичные опухоли мочевого пузыря отмечали у 16 (34,8%), шейки матки — у 23 (50%) и прямой кишки — у 7 (15,2%) больных. Ранее этим пациентам проводили химио- и/или лучевую терапию. В связи с развитием осложнений (свищи) лечение было прекращено. Всем больным в 2007–2011 гг. была выполнена эвисцерация органов малого таза с различными вариантами деривации мочи. Из них 14 (30,4%) больным — передняя эвисцерация с созданием самокатетеризируемого мочевого резервуара из восходящей толстой кишки. У 4 (8,7%) пациентов с нефункционирующей одной почкой объем операции ограничился нефрэктомией нефункционирующей почки и с уретерокутанеостомией. 23 (50%) больным выполнена эвисцерация с двухсторонней уретерокутанеостомией, а 5 (10,9%) — отведение мочи по Брикеру. Всем больным с опухолями органов малого таза, осложненными супра- и/или инфравезикальной обструкцией за 3 нед до операции были наложены п.к.нефростомия и/или п.к.цистостомия.
В ранний послеоперационный период 1 (2,2%) больная умерла на 12-е сутки от тромбоэмболии легочной артерии. У 3 (6,5%) пациентов отмечали послеоперационную эвентерацию передней брюшной стенки, что потребовало хирургической коррекции. В поздний послеоперационный период у 1 (2,2%) больной через 5 мес после операции зафиксирована спаечная кишечная непроходимость, что также потребовало хирургического вмешательства. 3-летняя выживаемость составила 78,3% (36 больных). Для улучшения качества жизни пациентов применяли супралеваторные эвисцерации (7 больных — 15,2%). Для прикрытия ложа малого таза применили местные мышцы (патент № IAP03562010).
Эвисцерация органов малого таза при местно-распространенных и осложненных формах характеризуется вполне удовлетворительными ближайшими и отдаленными результатами. Таким образом, у данной категории больных 3-летняя выживаемость составила 78,3%. Применение сухих стом (аппендикостома) намного повышает качество жизни.
Влияние метода деривации мочи на качество жизни больных после радикальной цистэктомии
М.Н. Тилляшайхов, Ш.Т. Хасанов, О.У. Вахабов, М.Г. Абдикаримов, Н.Т. Абдусаматов
Республиканский онкологический научный центр МЗ Республики Узбекистан, Ташкент
Часто дискутируется вопрос о преимуществах и недостатках использования тонкой кишки, а также разных отделов толстой кишки для кишечной цистопластики, но и в этом вопросе нет единого мнения и имеются сторонники как тонко-, так и толстокишечной пластики мочевого пузыря.
Оценена и проанализирована роль различных методов деривации мочи после радикальной цистэктомии (РЦЭ).
180 больным по поводу рака мочевого пузыря (РМП) выполнена РЦЭ. Возраст пациентов составил 40–75 лет. У 57 больных, подвергшихся РЦЭ, в анамнезе органосохраняющее хирургическое лечение по поводу РМП (ТУР, резекция мочевого пузыря).
У 45 (25%) пациентов деривация мочи осуществлена в созданный из толстой кишки самокатетеризируемый мочевой резервуар без детубуляризации. 50 (28%) больным деривация мочи осуществлена в неосигмоцистис из сегмента сигмовидной кишки с использованием сфинктера ануса. У 65 (36,1%) пациентов деривация мочи осуществлена методом 2-сторонней уретерокутанеостомии (УКС). 10 (5,6%) больным осуществлена деривация мочи в подвздошный кондуит (операция Бриккера).
У 4 (8,8%) больных развился метаболической ацидоз после формирования толстокишечного мочевого резервуара, который нормализовался после консервативной терапии. При формировании неосигмоцистиса у 10 (20%) больных развился острый пиелонефрит. Операция с формированием неосигмоцистиса и операции с созданием самокатетеризируемых мочевых резервуаров из толстой кишки позволяют больному оставаться «сухим» и самостоятельно регулировать мочеотведение. К недостаткам РЦЭ с УКС относятся постоянное использование мочевых дренажей в обеих подвздошных областях, хроническое инфицирование верхних мочевых путей, стриктуры УКС. При операции Бриккера отмечают длительное сохранение функции почек, однако необходимо постоянное применение самоклеющихся мочеприемников у больных.
Операции с созданием самокатетеризируемых мочевых резервуаров из толстой кишки без детубуляризации и неосигмоцистиса отвечают современным требованиям качества жизни и должны широко использоваться в хирургическом лечении РМП. РЦЭ с УКС не обеспечивает удовлетворительного качества жизни пациентов.
«Кишечная уростома» при задержке мочи у больных с инфравезикальной обструкцией
А.Т. Токтомушев, А.У. Саякова, Т.К. Эшалиев, Б.М. Ибраев, А.Д. Керимов
Национальный центр онкологии, Бишкек, Кыргызстан
Острая и/или хроническая задержка мочи обусловлена чаще патологией задней части мочеиспускательного канала, известной среди урологов под термином «инфравезикальная обструкция мочевого пузыря». В основном задержку мочи отмечают у мужчин с новообразованиями предстательной железы.
Задержка мочеиспускания может быть и вследствие нейрогенной дисфункции мочевого пузыря, которая занимает важное место при травматических и инфекционных поражениях спинного мозга, врожденной патологии. Острая задержка мочи иногда завершается установлением катетера Петцера в мочевой пузырь. К сожалению, у больных с серьезной сопутствующей патологией (сахарный диабет, сердечно-сосудистые заболевания и др.), а также у лиц в прогностическом плане не имеющих перспективы в лечении основного заболевания (прогрессирование рака предстательной железы, атония мочевого пузыря, спинальные больные), установленная цистостома остается до конца жизни. Надлобковый катетер как инородный материал почти всегда вызывает хроническое воспаление мочевых путей, восходящий пиелонефрит, сморщивание и возникновение камней в мочевом пузыре. Нередко больные умирают от восходящего уросепсиса, а не от основного заболевания.
В настоящее время качество жизни больного является важным компонентом в социальной реабилитации при любых заболеваниях. Особо остро этот вопрос стоит для больных с постоянным надлобковым катетером. Пациент с таким катетером постоянно испытывает дискомфорт, он ограничен в посещении общественных мест, что служит причиной сужения интересов.
С целью устранения недостатков способов отведения мочи (трансуретральных, надлобковых) в урологическом отделении Национального центра онкологии для этой цели разработана новая методика операции — «Кишечная уростома». Методика апробируется с 2004 г.
Операция производится под общим наркозом. Средне- срединная лапаротомия. К ране подводится слепая кишка. Отступив от илеоцекального угла на 15 см, резецируется петля тощей кишки длиной 13–15 см. Непрерывность тощей кишки восстанавливается по типу «конец в конец» или «конец в бок». Дефект в брыжейке ушивается. Отрезок выключенной тощей кишки на питающей ножке переводят в сторону мочевого пузыря забрюшинно. Мобилизуется передне-верхушечная часть мочевого пузыря, гемостаз, цистотомия. Накладывается анастомоз между мочевым пузырем и одним концом отрезка кишки таким образом, чтобы перистальтика кишечника была направлена в сторону мочевого пузыря (для удержания мочи). Другой конец кишечного отрезка выводится по заранее подготовленному туннелю, проходящему через m. rectum abdominalis справа выше подвздошной ямки. Накладывается цистоилеокутанеостомия. Временно устанавливается катетер Фоллея № 18–20.
С использованием этого метода в онкоурологическом отделении прооперировано 10 больных с хронической задержкой мочи, в том число 2 больных с диагнозом «нейрогенный мочевой пузырь; атония мочевого пузыря». Осложнений не выявлено.
Данное сообщение демонстрирует эффективность метода отведения мочи при задержке мочеиспускания различного генеза. Предварительные результаты обнадеживающие и перспективные.
Заболеваемость рака мочевого пузыря в Кыргызстане
А.Т. Токтомушев, А.У. Саякова, Т.К. Эшалиев, А.Д. Керимов
Национальный центр онкологии МЗ Кыргызской Республики, Бишкек
Заболеваемость раком мочевого пузыря (РМП) в Кыргызстане изучена за период с 1956 по 1993 г. на основе извещений о больном онкологического профиля (ф-281), историй болезни, амбулаторных карт и данных отчетов онкологических учреждений республики. Об уровне заболеваемости судили на основании интенсивных показателей, рассчитанных на 100 тыс. населения. Стандартизированные показатели исчисляли по мировым стандартам (таблица).
До 1991 г. заболеваемость повышалась (см. таблицу), а затем начала интенсивно снижаться. Однако и в период роста заболеваемости (1956–1991 гг.) темпы роста и прироста были неоднозначными. Так, за первые 5 лет (1960–1965 гг.) заболеваемость повысилась в 2 раза, а в последующие 5 лет (1965–1970 гг.) — лишь на 10,5%, в 1956–1965 гг. прирост РМП отмечали с интенсивностью 8,8–19,7% в год, а в последующие годы он сократился до 0,7%. Высокий прирост заболеваемости в 1956–1965 гг. принято связывать с интенсивным развитием в республике онкологической службы. Нет сомнения, что это положительно сказывалось на активном выявлении онкологических больных и их учете.
Таблица Показатели заболеваемости РМП в Кыргызстане
| Период наблюдения |
Среднегодовое число больных с впервые установленным диагнозом |
Удельный вес в структуре онкологических больных | Темпы роста | Темпы прироста | Заболеваемость на 100 тыс. населения |
|
|---|---|---|---|---|---|---|
| 1956–1960 | 29,8 | 1,7 | 100,0 | 8,8 | обычн.1,2 | станд.1,4 |
| 1951–1965 | 29,2 | 2,3 | 198,7 | 19,7 | 2,4 | 2,7 |
| 1966–1965 | 61,4 | 1,9 | 206,0, | 0,7 | 2,0 | 2,3 |
| 1971–1975 | 62,4 | 1,9 | 209,4 | 0,3 | 1,9 | 2,1 |
| 1976–1980 | 63,4 | 1,6 | 212,8 | 0,3 | 1,8 | 2,3 |
| 1981–1985 | 77,2 | 1,8 | 259,1 | 4,4 | 2,0 | 2,6 |
| 1986–1990 | 83,0 | 1,6 | 278,5 | 1,5 | 2,0 | 2,6 |
| 1991 | 102,7 | 2,2 | 344,6 | 9,6 | 2,5 | 3,2 |
| 1992 | 96,7 | 2,1 | 324,5 | –5,8 | 2,3 | 3,0 |
| 1993 | 89,0 | 1,6 | 298,7 | –8,0 | 1,6 | 2,1 |
Используя метод компонентного анализа, мы пришли к выводу, что в 1990 г. число больных РМП относительно увеличилось на 178,5%, в том числе на 126,5% за счет увеличения численности населения республики. Иными словами, удельный вес прироста заболеваемости за счет численности населения составляет 70,9%.
Выраженные темпы прироста заболеваемости за счет увеличения численности населения в 1956–1970 гг. объясняется тем, что в эти годы в Кыргызстан переселилась значительная часть взрослого населения из центральных регионов России, которая составила 17,0% общего прироста, тогда как в 1990–1993 гг. отмечено противоположное явление — отток населения.
Выявлены некоторые изменения заболеваемости по национальному составу населения республики. Так, на территории Ошской обл., например, проживают в основном жители местных национальностей: кыргызы, узбеки. Там заболеваемость РМП среди русских в 6–7 раз выше (4,2 на 100 тыс. населения), чем среди кыргызов (0,5) и узбеков (0,7).
Риск заболеть злокачественной опухолью у кыргызов ниже, чем у лиц европейской национальности. Так, усредненный показатель заболеваемости РМП у мужчин среди кыргызов за 1989–1990 гг. составил 0,7%, а среди лиц европейской национальности — 10,8%, в группе женщин — 0,1 и 2,2% соответственно.
Приведенные данные свидетельствуют, что в Кыргызстане в структуре населения с каждым годом увеличивается численность этнических групп с низким уровнем заболеваемости РМП, таким образом, несмотря на увеличение численности населения, не отмечено повышения абсолютного числа больных РМП.
Исходя из этого наблюдения, можно сделать вывод о том, что коренные жители Кыргызстана меньше склонны к развитию РМП, нежели представители европейской национальности. Видимо, этому способствуют местный природный ландшафт и географический горный климат, благодаря которым не нарушается экологический баланс.
Тактика выполнения трансуретральной резекции рака мочевого пузыря
А.С. Федорук, К.А. Владыченко
Буковинский государственный медицинский университет, Черновцы, Украина
В настоящее время трансуретральная резекция (ТУР) стенки мочевого пузыря считается методом выбора в лечении экзофитных форм рака мочевого пузыря (РМП). Высокий уровень смертности после проведения радикальной цистэктомии и результаты после выполнения ТУР мочевого пузыря вызывают интерес к органосохраняющему лечению РМП.
Цель исследования — анализ проведенных трансуретральных операций по поводу РМП, при которых применяли программируемую перфорацию стенки мочевого пузыря для разработки рекомендаций по повышению эффективности лечения больных.
За 1996–2011 гг. наблюдали 311 больных с РМП возрасте 46–83 лет, которым выполнена ТУР мочевого пузыря с запрограммированной перфорацией стенки пузыря.
У 48% пациентов ТУР проведена при Т1 стадии РМП, у 34% — при Т2, у 12% — при Т3. У 6% больных ТУР проведена по жизненным показаниям при Т4 РМП с гемостатической целью. В 35% случаев ТУР проведена при множественных опухолях мочевого пузыря (от 2 до 23 папиллярных опухолей), у 4 больных — при практически тотальном папилломатозе мочевого пузыря (стадия Т1).
По результатам патоморфологических исследований, все опухоли имели эпителиальное происхождение. Переходноклеточный РМП выявлен у 91% больных, недифференцированный РМП — у 5%, плоскоклеточный РМП — у 4%.
Техника выполнения ТУР стенки мочевого пузыря, пораженного опухолью, отличалась от общепринятой только на этапе завершения резекции — проведением запрограммированной перфорации стенки мочевого пузыря. В месте расположения опухолевой ножки ТУР выполняли до паравезикальной жировой клетчатки в пределах непораженных тканей. Дефект стенки мочевого пузыря достигал до 0,5–1,5 см2. Паравезикальную клетчатку в области дефекта, стенку пузыря вокруг дефекта, дно раны и прилегающие ткани тщательно коагулировали. Выполнение данной модификации ТУР является относительно безопасным только на задней, боковых стенках мочевого пузыря и в участках шейки пузыря и треугольника Льето. При расположении опухоли в проекции участков мочевого пузыря, которые контактируют с брюшиной, запрограммированная перфорация нами не использовалась в связи с высокой опасностью повреждения брюшины и риском развития мочевого перитонита.
В послеоперационный период всем больным устанавливали 3-ходовой уретральный катетер Фолея на срок 5–9 сут с ирригацией мочевого пузыря 0,02% раствором фурацилина в течение 1–3 сут.
Рецидивы опухоли выявлены у 25 больных (12,8% общего числа прооперированных), у 1 пациента после ТУР при Т1 стадии РМП, у 7 — при Т2, у 17 — при Т3. Этим больным проведена повторная ТУР. Важно то, что рецидивы опухолей у 19 больных отмечали на ранее не поврежденных участках слизистой оболочки мочевого пузыря, что объясняется мультифокальным характером роста РМП или дальнейшим прогрессированием рака in situ, который было невозможно выявить при обычной цистоскопии.
Полученные результаты позволяют расширить показания к проведению ТУР у больных с РМП. Выполнение ТУР с запрограммированной перфорацией пузыря на ранних стадиях РМП — радикальное оперативное вмешательство. У больных с тяжелым соматическим состоянием и высоким операционным риском ТУР является операцией выбора при РМП.
Результаты хирургического лечения рака мочевого пузыря
С.А. Худяшев1, Г.Г. Бояджан2
1Военно-медицинская служба Управления ФСБ, Кемерово, Россия
2 Московский государственный медико-стоматологический университет, Россия
Рак мочевого пузыря (РМП) занимает 4-е место в структуре европейской онкологической заболеваемости и смертности, составляет 6,6% всей онкологической патологии у мужчин и 2,1% — у женщин.
У нас наблюдались 265 пациентов с диагностированным РМП с достоверным преобладанием мужчин в возрасте 51–60 лет (p<0,05); средний возраст — 64,4±9,74 года. Оперировано 217 человек, динамическое наблюдение в течение 5 лет осуществлено у 168 (77,4%) пациентов. Максимальное количество повторных обследований проведено в первые 1/2 года после операции.
Основная задача контрольных обследований заключалась в оценке качества жизни, особенно у 47 пациентов с оперативными вмешательствами по удалению органов, в установлении и коррекции осложнений на различных этапах послеоперационного наблюдения. После радикальной цистэктомии с формированием ортотопического мочевого пузыря мочеиспускание осуществлялось естественным путем, при этом все пациенты контролировали дневное мочеиспускание. Ночное недержание мочи в малом объеме отмечено у 10,6% пациентов. При контрольных осмотрах по результатам 3 УЗИ оценивали емкость артифицированного мочевого пузыря. Через 12 мес после операции средний объем мочевого пузыря достигал 509±142 мл. Средний объем остаточной мочи по результатам 3 измерений — 49±17 мл. В поздние сроки существенных колебаний емкости артифицированного мочевого пузыря и объема остаточной мочи не выявлено.
Определение возможного рецидива и прогрессирования основного процесса были ведущими задачами у пациентов, перенесших трансуретральную резекцию (ТУР) мочевого пузыря. Методами диагностики рецидива РМП были цистоскопия и УЗИ. При рецидиве основное внимание уделяли поиску признаков прогрессирования, в первую очередь — выявлению регионарных и/или отдаленных метастазов по результатам лучевого обследования (УЗИ и МСКТ).
В течение первого года цистоскопию проводили 1 раз в 3 мес с прицельной биопсией из зоны резекции и участков визуально измененного уротелия. Для уточнения радикальности проведенных операций у 12 пациентов со стадией заболевания рТ2а–рТ2b в течение первых 3 мес после эндоскопического удаления опухоли выполняли повторную ТУР с места предшествующей резекции.
При выполнении периодических осмотров в объеме УЗИ и цистоскопии рецидив основного заболевания диагностирован у 42 больных (19,4% оперированных), у 29 из них рецидив сопровождался прогрессированием процесса.
Среди наблюдавшихся пациентов зафиксировано 16 летальных исходов (7,4%), из них только в одном случае смерть наступила от выраженной кровопотери на фоне продолжительной гематурии через 2 года после оперативного вмешательства. В остальных случаях причиной смерти были сопутствующие заболевания. Повторные оперативные вмешательства выполнены 34 пациентам с рецидивами основного заболевания, у некоторых из них в связи с некупируемым кровотечением операция носила неотложный характер.
Самым ответственным этапом в послеоперационном динамическом наблюдении оказался первый год после операции. Именно на этот период приходилось максимальное количество как поверхностных (17 наблюдений) рецидивов первичной опухоли, так и рецидивов с прогрессированием основного процесса по всем критериям, включая инвазивное рецидивирование, появление регионарных и отдаленных метастазов (15 случаев).
Роль ре-ТУР в диагностике рецидива уротелиального рака мочевого пузыря
С.В. Шкодкин, Ю.Б. Идашкин
Белгородская областная клиническая больница Святителя Иоасафа, Белгород, Россия
Рост частоты опухолей мочевого пузыря, сохраняющийся высокий риск рецидива после органосохраняющего лечения являются причиной продолжающегося поиска мер профилактики и раннего выявления рецидива (Коган М.И., 2008). Ре-трансуретральная резекция (ТУР) или second-look, проводимые в период 2–8 нед от первичного вмешательства, направлены на раннее выявление рецидива (Русаков И.Г., 2009).
За 2006–2012 гг. нами пролечено 23 пациента с первичным поверхностным умеренно-дифференцированным переходноклеточным раком мочевого пузыря. Больные оперированы под эпидуральной анестезией, моно- и биполярным резектоскопом KARL STORZ 27 Ch с постоянной ирригацией. Проведена однократно химиопрофилактика доксирубицином 40 мг непосредственно после ТУР. У 11 пациентов через 4 нед выполнен повторный осмотр мочевого пузыря.
У всех больных в месте первичной резекции отмечена буллезно-отечная слизистая оболочка с усилением сосудистого рисунка по периферии. Всем пациентам выполнена ре-ТУР места резекции. Результаты морфологического заключения — воспалительные изменения у 4 (36,4%) пациентов, подозрение на опухолевый рост с рекомендацией повторной биопсии. Повторное эндоскопическое исследование у всех пациентов выполнено через 3 мес после ре-ТУР. Эндоскопическая картина представлена белесоватым эпителизированным рубцом без экзофитного компонента. Биопсия — отсутствие опухолевого роста.
Таким образом, в период до 1 мес после ТУР отмечают воспалительные изменения слизистой оболочки, которые трудно дифференцировать от рецидива опухоли, что повышает вероятность проведения дополнительного противоракового лечения у данной группы пациентов. Поэтому считаем проведение ре-ТУР в сроки до 4 нед нецелесообразным.
Возможности эндоскопического лечения уротелиальных опухолей мочевого пузыря и ДГПЖ
С.В. Шкодкин, Ю.Б. Идашкин
Белгородская областная клиническая больница Святителя Иоасафа, Россия
Риск рецидива и прогрессии уротелиальной опухоли мочевого пузыря после трансуретральной резекции (ТУР), по данным ряда авторов (Коган М.И., 2008; Лоран О.Б., 2009), превышает 80%. Известно (Матвеев Б.П., 2011), что наличие инфравезикальной обструкции повышает риск возникновения как первичной, так и рецидивной уротелиальной опухоли мочевого пузыря. По данным различных источников, частота сочетания рака мочевого пузыря у мужчин и доброкачественной гиперплазии предстательной железы (ДГПЖ) составляет 17,5–42,7%. В литературе дискутируется вопрос о тактике ведения этих больных, а именно о сроках и необходимости аденомэктомии, выборе оперативного доступа.
За 2002–2012 гг. нами пролечены 41 пациент с симптомной ДГПЖ и переходноклеточным раком мочевого пузыря, которым произведена ТУР ДГПЖ, а затем ТУР опухоли, причем в 14 случаях при подозрении на мышечную инвазию ТУР проведена на глубину всей пузырной стенки. Для контроля использовали 2 группы больных по 10 пациентов в каждой с изолированными ДГПЖ и поверхностной уротелиальной опухолью мочевого пузыря. Группы были сопоставимы по возрасту, сопутствующей патологии и объему предстательной железы.
В основной группе отмечено увеличение продолжительности операции по сравнению со стандартной ТУР по поводу изолированных ДГПЖ или рака мочевого пузыря, что составило 59,1±16,8 мин против 47,2±12,4 и 38±16,8 мин соответственно. Расход ирригационной жидкости также увеличился до 22,5±3,4 л по сравнению с 16,4±4,3 л при ТУР ДГПЖ и 9,8±2,1 л при резекции опухоли соответственно. Статистически достоверной разницы по объему кровопотери и длительности гематурии отмечено не было. Сроки трансуретрального дренирования не отличались от контрольной группы и составили 1,71±0,22 сут. Воспалительные осложнения в виде орхоэпидидимитов отмечены у 1 больного (2,4%) основной группы. В контрольной группе зарегистрирован 1 случай (10%) орхоэпидидимита и 1 (10%) восходящего пиелонефрита.
Симультантное лечение уротелиальных опухолей мочевого пузыря и ДГПЖ достаточно безопасно и патогенетически обосновано. Необходимо дополнительное исследование отдаленных результатов в отношении рисков рецидивирования уротелиального рака мочевого пузыря в зависимости от сроков и методов коррекции инфравезикальной обструкции.
Данные ТУР-биопсии в стадировании опухолей мочевого пузыря
С.В. Шкодкин, Ю.Б. Идашкин
Белгородская областная клиническая больница Святителя Иоасафа, Россия
За последние годы зарегистрировано повышение заболеваемости опухолями мочевого пузыря (Матвеев В.Б., 2009). Несмотря на изобилие методик визуализации, частота изменения стадии после операции превышает 80% (Коган М.И., 2009). ТУР-биопсия, по мнению многих авторов (Мартов А.Г., 2006; Пушкарь Д.Ю., 2008), является завершающим и приоритетным методом стадирования опухоли мочевого пузыря.
За 2002–2012 гг. нами пролечено 53 пациента с первичными переходноклеточными опухолями мочевого пузыря. Производили трансуретральную резекцию (ТУР) опухоли, причем в 19 (27,9%) случаев при подозрении на мышечную инвазию ТУР выполнена на глубину всей пузырной стенки. Больные оперированы под эпидуральной анестезией моно- и биполярным резектоскопами 27 Ch KARL STORZ и OLUMPUS с постоянной ирригацией. После ТУР проводили щипковую биопсию зоны резекции, прилежащей слизистой оболочки и неизмененной слизистой оболочки дна, боковых стенок и шейки мочевого пузыря.
Размер опухоли до 1 см отмечали у 11 (20,8%) пациентов, 1–3 см — у 29 (54,7%) и более 3 см — у 13 (24,5%). Локализация: шейка мочевого пузыря — 29 (54,7%) пациентов, боковые стенки — 14 (26,4%), задняя стенка — 9 (16,9%), у 1 (1,9%) больного опухоль располагалась в области дна мочевого пузыря. Одиночные опухоли отмечены у 31 (58,5%) больного, соответственно, множественность поражения выявлена у 22 (41,5%) пациентов. Доброкачественные образования были выявлены у 4 (7,5%) больных, причем у одного пациента с визуально инфильтративной опухолью. Результат морфологического заключения этого больного подтвержден в ООД и в проведении адъювантного лечения ему было отказано, на second-look через 4 нед буллезный отек (морфология — воспалительные изменения). Через 7 мес у данного пациента отмечен рецидив мышечно-инвазивной опухоли с увеличением степени анаплазии до низкодифференцированного переходно-клеточного рака. Высокодифференцированные переходно-клеточные опухоли диагностированы у 18 (40,0%) пациентов, умереннодифференцированные — у 23 (43,4%), низкодифференцированные — у 8 (15,1%). Щипковая биопсия была отрицательной у всех пациентов. Мышечно-инвазивный рак диагностирован в 7 (13,2%) случаях, причем визуально инфильтративные опухоли отмечали у 12 (22,6%) пациентов.
ТУР является ведущим методом стадирования опухолей мочевого пузыря. Существует необходимость стандартизации метода, что, возможно, повысит его чувствительность и специфичность.














Leave a comment