Неоад’ювантна поліхіміотерапія в лікуванні хворих на інвазивний рак сечового міхура
Стаховський Е.О., Войленко О.А., Вукалович П.С., Котов В.А., Вітрук Ю.В.
Мета: підвищити ефективність комплексного лікування та поліпшити якість життя хворих на інвазивний рак сечового міхура шляхом застосування неоад’ювантної хіміотерапії. Матеріал та методи дослідження: 28 хворих на інвазивний рак сечового міхура, яким проведено неоад’ювантну хіміотерапію з подальшою оцінкою її ефективності за критеріями RECIST. Результати: стабілізацію відмічали у 9 (32,1%) випадках, прогресію — у 3 (10,7%), часткову регресію — у 14 (50%), повну регресію — 2 (7,1%). Висновок: досягнення повної та часткової регресії дозволили виконати пацієнтам органозберігаюче оперативне втручання, що сприяло поліпшенню якості їх життя.

вступ
Рак сечового міхура (РСМ) посідає 4-те місце в структурі загальної онкологічної захворюваності та смертності серед чоловіків. У 2006 р. в Європі діагностовано 104 тис. нових випадків РСМ, що становить 6,6% усієї онкопатології, яку виявляють у чоловіків, та 2,1% – у жінок [1]. При первинній діагностиці РСМ в 70% випадків діагностують поверхневий і в 30% – інвазивний пухлинний процес. У 57% пацієнтів, яким виконано радикальну цистектомію, відмічали інвазію в м’язовий шар на початку захворювання, а в 43% випадків — неінвазивну форму РСМ з прогресуванням незважаючи на органозберігаючу тактику лікування [2, 3].
За даними Національного канцер-реєстру, у 2009 р. в Україні виявлено 4799 (захворюваність 10,4 на 100 тис. населення) первинних хворих на РСМ. Разом з тим, частка хворих, у яких вперше виявляють неінвазивні форми пухлини, досить низька і не перевищує 50%. Тобто, у більшості пацієнтів діагностують занедбані стадії захворювання, що зумовлює високу летальність до 1 року —25,8% [4].
Слід зазначити, що у хворих з інвазивними формами РСМ вже до початку лікування можуть бути мікрометастази в регіонарні лімфовузли (у 40–85% випадків) та пухлинна інвазія в передміхурову залозу, уретру та сім’яні міхурці (10–12; 4–10 та 15% випадків відповідно). Тому в урологів виникають значні труднощі у виборі оптимального методу лікування таких хворих [5].
Радикальна цистектомія при інвазивному РСМ залишається основним методом хірургічного лікування. Дискусійним є питання щодо проведення парціальної цистектомії (резекції стінки сечового міхура) у хворих з поодиноким ураженням стінки або купола сечового міхура. Прибічники органозберігаючої тактики оперативного лікування хворих на інвазивний РСМ стверджують про значно вищий рівень якості життя цієї категорії пацієнтів [6, 7].
На противагу таким твердженням слід відмітити, що при комплексному лікуванні з використанням променевої, внутрішньоміхурової хіміо- чи імунотерапії у значної кількості хворих виявляють зменшення ємності сечового міхура внаслідок склеротичних змін стінки, зниження його скоротливості з розвитком мікроцисту та подальшим значним зниженням якості життя внаслідок дизурії [8]. Це призводить до інвалідизації та соціальної дезадаптації хворих.
Використання хіміотерапії у багатьох наукових центрах в 90-х роках минулого століття не дало очікуваних результатів, однак в окремих рандомізованих дослідженнях відзначено підвищення 5-річної виживаності на 5% [9]. Введення в клінічну практику в останні роки низки нових, малотоксичних хіміопрепаратів дає підстави для перегляду показань та підходів до органозберігаючої тактики лікування хворих на інвазивний рак сечового міхура [10–12].
Дослідження результатів ефективності неоад’ювантної поліхіміотерапії (ПХТ), а саме випадків повної та часткової відповіді на лікування, наштовхують на думку про можливість проведення органозберігаючої тактики лікування РСМ. Незважаючи на вже проведені клінічні дослідження щодо неоад’ювантної ПХТ, її роль в лікуванні інвазивного РСМ залишається не вирішеною.
Мета роботи – підвищити ефективність комплексного лікування та поліпшити якість життя хворих на інвазивний РСМ шляхом застосування неоад’ювантної хіміотерапії.
об’єкт і методи дослідження
Клінічному аналізу підлягали 28 хворих на інвазивний РСМ на стадіях захворювання Т2а–Т4а, яким у 2008–2010 рр. в науково-дослідному відділенні пластичної та реконструктивної онкоурології Національного інституту раку проведено обстеження та оперативне лікування. Вік пацієнтів коливався в межах 36–74 роки і в середньому становив 61,1±11,1 року. Первинний РСМ діагностовано у 22 (78,6%), рецидивний — у 6 (21,4%) пацієнтів. В 11 (39,3%) хворих РСМ спричинив обструкцію інтрамурального відділу сечоводу, що призвело до розвитку уретерогідронефрозу, причому у 2 (7,1%) випадках – двобічного. Хронічна ниркова недостатність не виявлена в жодному випадку. Усім пацієнтам проведено 3–4 курси неоад’ювантної ПХТ за схемою гемцитабін + цисплатин з подальшою оцінкою ефективності за критеріями RECIST та з урахуванням її ефективності; 12 (42,8%) хворим проведено трансуретральну резекцію (ТУР) стінки сечового міхура з Са, 3 (10,7%) – резекцію стінки сечового міхура з Са, а ще 13 (46,4%) виконано простатзберігаючу цистектомію.
Комплексне обстеження пацієнтів передбачало вивчення анамнестичних даних та об’єктивного статусу хворого, клініко-лабораторне, рентгенорадіологічне, інструментальне, ендоскопічне та патоморфологічне дослідження.
Результати та їх обговорення
На сьогодні радикальна цистектомія залишається золотим стандартом лікування хворих з локально розповсюдженим інвазивним РСМ. Незважаючи на вдосконалення хірургічних способів та післяопераційного догляду за пацієнтом, виживаність напряму залежить від глибини інвазії пухлини (Т), гістопатологічної градації (G) і коливається у діапазоні 36–65% [13, 14]. При цьому рівень 5-річної виживаності пацієнтів зі стадіями захворювання Т3–Т4 або метастатичним ураженням реґіонарних лімфатичних вузлів не перевищує 25%. Представлені дані можуть бути зумовлені лише високою агресивністю РСМ та наявністю мікрометастазування на момент виконання цистектомії.
Тобто, окрім радикальної цистектомії необхідне призначення додаткового лікування, яке може вплинути на прогресію як первинної пухлини, так і реґіонарних метастазів. Більш агресивна лімфаденектомія матиме як прогностичну, так і терапевтичну цінність, а ефективна системна терапія буде впливати на мікрометастази і сприятиме поліпшенню результів лікування.
Хіміотерапію можна призначати як до (неоад’ювантна), так і після (ад’ювантна) оперативного втручання для ерадикації субклінічного захворювання та збільшення тривалості життя хворих. На жаль, більшість клінічних досліджень, у яких визначали ефективність хіміотерапії, недооцінені, а тому на сьогодні хіміотерапію використовують не систематично, не завжди та не в усіх клініках.
У літературі є інформація про декілька хіміотерапевтичних агентів, ефективних у лікуванні пацієнтів з метастатичним ураженням сечового міхура. Комбінація препаратів виявилась більш ефективною, ніж застосування одного агента [15]. Дослідники з Memorial Sloan-Kettering Cancer Center (MSKCC) в 1983 р. довели ефективність комплексу препаратів — метотрексат, вінбластин, адріаміцин та цисплатин — у лікуванні пацієнтів з метастатичними уротеліальними карциномами. Автори відмічають ремісію РСМ у більше ніж 70% пацієнтів з медіаною виживання 13 міс. З того часу схему ПХТ MVAC у хворих з IV стадією РСМ дуже широко застосовують у клінічній практиці. В опублікованій літературі усереднену відповідь на хіміотерапію виявляли у 40–72%, а повну клінічну відповідь – у 19–45% пацієнтів. Проте за тривалістю ефекту ПХТ результати дослідження не дуже обнадійливі [16].
Неоад’ювантну хіміотерапію проводять пацієнтам з клінічно операбельним інвазивним РСМ у стадії Т2–Т4а. Доцільність доопераційної хіміотерапії або радіотерапії полягає в спробі лікування мікрометастатичного ураження, яке не виявляють при звичайній діагностиці.
Дотепер у світовій онкоурологічній практиці не існує єдиної методики застосування хіміотерапії у хворих на інвазивний РСМ. Зазвичай проводять 3–6 курсів ПХТ за схемами: MVAC, СМV або GC.
Проаналізувавши дані світової літератури та результати дослідження існуючих схем ПХТ, нами була обрана схема гемцитабін – цисплатин у неоад’ювантному режимі через її високу ефективність та незначну токсичність [17, 18].
Всі хворі отримали 3–4 курси неоад’ювантної ПХТ. Під час проведення ПХТ серйозних побічних проявів не виявлено.
У 9 (32,1%) хворих виникли побічні реакції у вигляді нейтропенії І–ІІ ступеня (5 (17,9 %) хворих); тромбоцитопенії І ступеня (2 (7,1%) пацієнти); анемії ІІ ступеня (2 (7,1%) хворих). Загострення виразкової хвороби шлунка на фоні анемії виявлено у 1 (3,6%) хворого. Усі побічні прояви не потребували повторної госпіталізації, не викликали суб’єктивних проявів. Нейтропенія купірувана за допомогою дексаметазону та нейпогену, при анемії хворому призначено еритропоетин, при виразковій хворобі шлунка — омепразол. В усіх випадках побічні прояви спричинили відстрочення введення хіміопрепаратів не більше ніж на 1 тиж.
Після проведення ПХТ здіснено комплексне контрольне обстеження хворих з оцінкою відповіді пухлини за критеріями RECIST (табл. 1).
| Відповідь на лікування за критеріями RECIST |
Кількість пацієнтів, n (%) | Середнє значення, % регресії за критеріями RECIST |
|---|---|---|
| Повна регресія | 2 (7,1) | 100,0 |
| Часткова регресія | 14 (50,0) | 63,9±17,9 |
| Стабілізація | 9 (32,1) | 13,6±11,3 |
| Прогресія | 3 (10,7) | 33,4±2,9 |
Представлені дані свідчать, що стабілізацію пухлини за критеріями RECIST (регресія на 13,6±11,3%) відмічали у 9 (32,1%) випадках, прогресію виявлено у 3 (10,7%) пацієнтів (прогресія 33,4±2,9%), що стало показанням до виконання органовиносного оперативного втручання — простатзберігаючої цистектомії.
У 14 (50,0%) хворих під час проведення контрольного обстеження відмічено часткову регресію пухлини в середньому на 63,9±17,9%, що дало можливість провести органозберігаюче оперативне лікування.
Повна регресія пухлини (100,0%) після проведення 3 курсів неоад’ювантної ПХТ при контрольному обстеженні діагностована у 2 (7,1%) випадках. Під час контрольної цистоскопії з ТУР-біопсією стінки сечового міхура, патоморфологічне дослідження патології не виявило.
На нашу думку, цікавим було прослідкувати можливу залежність ступеня регресії РСМ від гістологічної структури та ступеня диференціювання пухлини (табл. 2).
| Гістопатологічна градація, G | Кількість пацієнтів, n (%) |
RECIST, % регресії |
|---|---|---|
| G1 | 2 (7,1) | 87,5±17,7 |
| G2 | 17 (60,7) | 46,5±32,0 |
| G3 | 9 (32,1) | 16,9±44,9 |
Представлені в таблиці дані свідчать про наявність прямо пропорційної залежності ефективності неоад’ювантної ПХТ від ступеня диференціювання пухлини. Так, у 2 (7,1%) хворих з високодиференційованим РСМ (G1) ступінь регресії за RECIST становив 87,5±17,7%, при цьому в одному випадку було досягнуто повної регресії пухлини, та ще в одному — часткової регресії злоякісного процесу із зменшенням розмірів пухлини на 75%.
У 17 пацієнтів з помірно диференційованим (G2) РСМ після проведення 3 курсів ПХТ за даними RECIST у 1 (5,9%) хворого отримано повну регресію пухлини (рис. 1, 2), у 9 (52,9%) відмічено часткову регресію злоякісного процесу із зменшенням розмірів пухлини на 35–90% та у 7 (41,2%) — новоутворення зменшилися менше ніж на 35%, що відповідало стабілізації процесу. Середнє значення регресії пухлини у даній групі становило 46,5±32,0%.
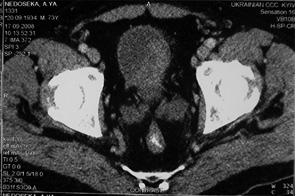
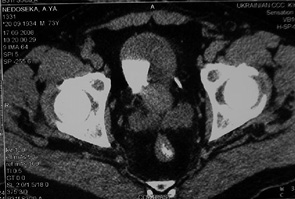
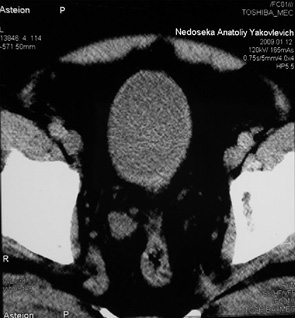
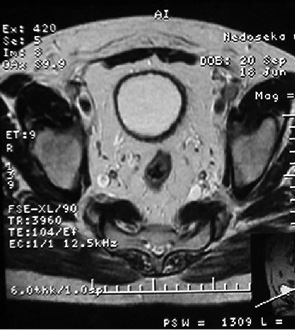
Аналіз результатів оцінки ефективності неоад’ювантної ПХТ за даними RECIST у 9 хворих на РСМ з низьким гістопатологічним диференціюванням (G3) показав, що часткової регресії пухлини досягнуто тільки у 3 (33,4%) хворих, стабілізацію процесу було діагностовано ще у 3 (33,4%). У 3 (33,4 %) хворих зафіксовано прогресію захворювання, що характеризувалася збільшенням розмірів пухлини на 25–35%. Загалом рівень пухлинної відповіді на проведену ПХТ становив 16,9±44,9%.
Результат проведеного нами дослідження — встановлення прямої пропорційної залежності між ступенем диференціювання пухлини (G) та ступенем регресії пухлини під дією ПХТ. Отримані дані є статистично достовірними лише при порівнянні ступеня злоякісності G1 та G3 (p
Оперативне втручання після неоад’ювантної ПХТ дозволило провести рестадіювання РСМ: у 15 (53,6%) випадках відмічено зниження стадії захворювання за системою TMN (усі хворі з перехідно клітинним РСМ), у 2 (7,1%) з них під час проведення патоморфологічного дослідження матеріалу (ТУР) стінки сечового міхура пухлинних тканин виявлено не було (зріла м’язова тканина). Лише в 1 (3,6%) випадку при проведенні рестадіювання глибина інвазії пухлини збільшилась з глибокого м’язового шару (Т2в) до паравезикальної клітковини (Т3в).
У сучасній медицині одним з важливих факторів є оцінка впливу лікування на якість життя хворих, яку проведено у пацієнтів до та після проведення неоад’ювантної ПХТ і представлено в табл. 3.
| Показник | До проведення неоад’ювантної ПХТ | Після проведення неоад’ювантної ПХТ |
|---|---|---|
| QoL, бали | 1,6±1,1 | 2,3±1,2 |
| Статистична обробка | р=0,02 (t-тест) | |
Таким чином, статистично достовірно вищий рівень якості життя хворих відзначають після проведення неоад’ювантної ПХТ, що зумовлено в більшості випадків регресією пухлини та зникненням її клінічних проявів.
Діагностована регресія пухлинного процесу за критеріями RECIST у 57,1% хворих після проведення неоад’ювантної ПХТ дозволила провести в 12 випадках простатзберігаючу цистектомію. Збереження при проведенні цистектомії передміхурової залози, яка включає судинно-нервові пучки та компоненти дистального механізму сфінктера, забезпечує значне поліпшення функціональних результатів. Так, у групі хворих, яким виконано простатзберігаючу цистектомію, еректильну функцію збережено у 10 з 12 пацієнтів (83,3%) при середньому рівні IIEF-5 16,1±4,5 бала порівняно з 53 пацієнтами проспективної групи після радикальної цистектомії, еректильну функцію у яких зберегли лише у 22,6% хворих при середньому рівні IIEF-5 7,3±2,4 бала. Утримання сечі як денного, так і нічного, в групі хворих після простатзберігаючої цистектомії досягнуто в 100 та 87,5% випадків, на противагу радикальній цистектомії 90 та 10% відповідно. Отже, значно кращі показники денного та нічного утримання сечі, низький відсоток еректильної дисфункції та відповідно вищий рівень якості життя характеризує простатзберігаючу цистектомію як один з найбільш прийнятних варіантів лікування хворих на інвазивний РСМ при адекватному відборі пацієнтів (без інвазії РСМ в задню уретру, передміхурову залозу та за відсутності даних про наявність раку передміхурової залози).
Висновки
Неоад’ювантна ПХТ у хворих на інвазивний РСМ в 7,1% випадків привела до розвитку повної, а в 50% – часткової регресії пухлини та дозволила в більшості випадків виконати пацієнтам органозберігаюче оперативне втручання, що сприяло підвищенню якості їх життя.
Проведений аналіз результатів лікування хворих на інвазивний РСМ виявив прямо пропорційну залежність між ступенем диференціювання пухлини (G) та ступенем регресії пухлини під дією неоад’ювантної ПХТ (G1 — 87,5±17,7%; G2 — 52,7±29,3%; G3 — 23,1±43,4% за критеріями RECIST).
Значно кращі показники денного та нічного утримання сечі, низький відсоток еректильної дисфункції характеризують простатзберігаючу цистектомію як один з найбільш прийнятних варіантів лікування хворих на інвазивний РСМ при адекватному відборі пацієнтів.
Література
- 1. Ferlay J., Autier M., Boniol M. et al. (2007) Estimates of the cancer incidence and mortality in Europe in 2006. Ann. Oncol., 18(3): 581–592.
- 9. Vaidya A., Soloway M.S., Hawke C. et al. (2001) De novo muscle invasive bladder cancer: is there a change in trend? J. Urol., 165(1): 47–50.
- 16. Prout G.R., Griffin P.P., Shipley W.U. (1979) Bladder carcinoma as a systemic disease. Cancer., 43(6): 2532–2539.
- 23. Рак в Україні, 2008–2009: захворюваність, смертність, показники діяльності онкологічної служби (2010) За ред. І.Б. Щепотіна. Бюл. Національного канцер-реєстру України, № 11: 102.
- 31. Hautmann R.E., Paiss T. (1998) Does the option of the ileal neobladder stimulate patient and physician decision toward earlier cystectomy? J. Urol., 159: 1845–1850.
- 37. Kageyama Y., Okada Y., Arai G. et al. (2000) Preoperative concurrent chemoradiotherapy against muscle-invasive bladder cancer: results of partial cystectomy in elderly or high-risk patients. Jpn. J. Clin. Oncol., 300(12): 553–556.
- 44. Sternberg C.N., Calabro F. (2001) Neo-adjuvant chemotherapy in invasive bladder cancer. World. J. Urol., 19(2): 94–98.
- 51. Petrovich Z., Jozsef G., Brady L.W. (2001) Radiotherapy for carcinoma of the bladder: a review. Am. J. Clin. Oncol., 24(1): 1–9.
- 58. Hall R.R. (2002) Updates results of a randomized controlled trial of neoadjuvant cisplatin (C), methotrexate (M) and vinblastine (V) chemotherapy for muscle-invasive bladder cancer. Integrational Collaboration of Trialists of the MRC Advanced Bladder Cancer Group. Proc. Am. Soc. Clin. Oncol., 21, Abstr. 710.
- 63. Teramukai S., Nishiyama H., Matsui Y. et al. (2006) Evaluation for surrogacy of end points by using data from observational studies: tumor downstaging for evaluating neoadjuvant chemotherapy invasive bladder cancer. Clin. Cancer Res., 12: 139–143.
- 69. Grossman H.B., Natale R.B., Tangen C.M. et al. (2003) Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N. Engl. J. Med., 349: 859–866.
- 75. Sternberg C.N., Collette L. (2006) What has been learned from meta-analyses of neo-adjuvant and adjuvant chemotherapy in bladder cancer? BJU Int., 98: 487–489.
- 81. Stein J.P., Lieskovsky G., Cote R. et al. (2001) Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1054 patients. J. Clin. Oncol., 19: 666–675.
- 88. Dalbagni G., Geneda E., Hashibe M. et al. (2001) Cystectomy for bladder cancer: a contemporary series. J. Urol., 165: 1111–1116.
- 94. Schrier B.P., Peters M., Barentsz J.O. et al. (2006) Evaluation of chemotherapy with magnetic resonance imaging in patients with regionally metastatic or unresectable bladder cancer. Eur. Urol., 49(4): 698–703.
- 102. Sternberg C.N., Yagoda A., Scher H. et al. (1989) Phase II trial of trimetrexate in patients with advances renal cell carcinoma. Eur. J. Cancer Clin. Oncol., 25(4): 753–754.
- 110. Sternberg C.N., Collette L. (2006) What has been learned from meta-analyses of neo-adjuvant and adjuvant chemotherapy in bladder cancer? BJU Int., 98: 487–489.
- 116. Sternberg C.N., Pansadoro V., Calabro F. et al. (2003) Can patient selection for bladder preservation be based on response to chemotherapy. Cancer, 97: 1644–1652.
Неоадъювантная полихимиотерапия в лечении больных инвазивным раком мочевого пузыря
Национальный институт рака, Киев
Резюме. Цель: повысить эффективность комплексного лечения и улучшить качество жизни больных инвазивным раком мочевого пузыря путем применения неоадъювантной химиотерапии. Материал и методы исследования: 28 больных инвазивным раком мочевого пузыря, которым проведена неоадъювантная химиотерапия с последующей оценкой ее эффективности по критериям RECIST. Результаты: стабилизацию отмечали в 9 (32,1%) случаях, прогрессию — в 3 (10,7%), частичную регрессию — в 14 (50%), полную регрессию — 2 (7,1%). Выводы: достижение полной и частичной регрессии опухоли позволило выполнить пациентам органосохраняющее оперативное вмешательство, что способствовало повышению качества их жизни.
инвазивный рак мочевого пузыря, неоадъювантная полихимиотерапия.














Leave a comment