Післяопераційна когнітивна дисфункція у жінок середнього віку: інцидентність та методи профілактики
Лісний І.І., Воробйова Л.І., Бєлка К.Ю. , Клімчук Л.В., Кабанчук Ю.В. , Катриченко М.О. , Сидоренко К.Д., Балахонов О.І.
Резюме. Представлено проспективне контрольоване дослідження, метою якого було визначити актуальність проблеми післяопераційної когнітивної дисфункції (ПОКД) для жінок середнього віку після гістеректомії, частоту виникнення та можливі фактори ризику розвитку ПОКД, а також дослідити ефективність профілактики ПОКД призначенням нейропротекторних препаратів, зокрема холіну альфосцерату. У дослідження включено 40 пацієнток, по 20 у досліджуваній (група холіну альфосцерату) та контрольній групах. ПОКД діагностували у 3 (15%) пацієнток з групи 1 та у 12 (60%) з групи 2, різниця між інцидентністю ПОКД в групах була статистично достовірною (p=0,004; відношення шансів становить 8,5; 95% довірчий інтервал — 1,57–56,86). Відношення шансів свідчить про те, що ризик виникнення ПОКД в контрольній групі достовірно перевищував ризик ПОКД у досліджуваній групі у 8,5 раза. За результатами даного дослідження, призначення холіну альфосцерату асоціювалося з достовірним зниженням ризику виникнення ПОКД, скороченням часу пробудження та часом до екстубації пацієнтів.

Сучасна демографічна ситуація в багатьох розвинених країнах, а також прискорення темпу життя спричиняють підвищення вимог до якості анестезії та хірургії в цілому. За останні десятиріччя набула актуальності проблема впливу анестезії та хірургічного втручання на когнітивні функції пацієнтів у ранній та віддалений післяопераційний період, зокрема, 10% судових позивів у сфері медицини пов’язані саме з нею [1].
Післяопераційна когнітивна дисфункція (ПОКД) — це когнітивний розлад, який розвивається в ранній та зберігається в пізній післяопераційний період, клінічно проявляється порушеннями пам’яті, ускладненням концентрації уваги та відхиленнями інших вищих функцій кори головного мозку (мислення, мовлення тощо) [3]. Для діагностики ПОКД стандартно рекомендують тестування когнітивних функцій за шкалою оцінки психічного статусу Фолстейна (Mini-Mental State Examination — MMSE), де про розвиток ПОКД свідчить зниження попередніх показників на 10% і більше [2].
За даними деяких публікацій, розвиток ПОКД асоціюється зі збільшенням тривалості госпіталізації, якості життя та задоволеності пацієнтів, а також підвищенням летальності у людей похилого віку [3]. Проте велике значення має ризик виникнення ПОКД у людей середнього віку, після проведення планових оперативних втручань, що значно впливає на їх працездатність та якість життя в цілому [4].
Гістеректомія — друга за розповсюдженістю операція у жінок. Щорічно виконують 600 тис. гістеректомій, кожна третя жінка, старша 60 років, перенесла таку операцію у США. Серед доступних праць у базах Medline, Pubmed, Cochrane публікацій щодо частоти виникнення ПОКД у пацієнток після онкогінекологічних операцій немає, відсутні також вітчизняні публікації. Тому метою нашого дослідження було визначити актуальність проблеми ПОКД для жінок середнього віку після гістеректомії, частоту виникнення та можливі фактори ризику розвитку ПОКД, а також дослідити ефективність профілактики ПОКД призначенням нейропротекторних препаратів, зокрема холіну альфосцерату.
Одним з найбільш ефективних препаратів серед нейропротекторів є похідні екзогенного холіну: цитиколін, холіну альфосцерат [5].
Холін та фосфорилхолін перетворюються в організмі в метаболічно активну форму, здатні проникати через гематоенцефалічний бар’єр й активувати біосинтез ацетилхоліну в пресинаптичних мембранах холінергічних нейронів [6].
У дослідженнях на тваринах показано, що холіну альфосцерат попереджує індукований холінергічний дефіцит, а також розвиток деменції, полегшує процеси навчання та запам’ятовування за рахунок збільшення синтезу та вивільнення ацетилхоліну в мозкових структурах [7].
Іншим механізмом дії холіну альфосцерату є анаболічний ефект, який проявляється стимуляцією мембранного та гліцероліпідного синтезу внаслідок утворення попередників фосфоліпідів мембран з продуктів його метаболічного розпаду [7, 8].
Таким чином, холіну альфосцерат активує холінергічну нейротрансмісію, підвищуючи пластичність тканин мозку, здійснює мембраностабілізуючу та антиоксидантну дію.
Проведено багаточисленні дослідження, які продемонстрували ефективність холіну альфосцерату відносно порушень рухових функцій, рівня свідомості, когнітивних відхилень у хворих у гострий період мозкового інсульту [9–15]. Описано сприятливий вплив холіну альфосцерату на психічну діяльність хворих, пам’ять, відновлення мовленнєвих функцій [9–12].
Застосування холіну альфосцерату асоціювалося зі значним покращенням когнітивних функцій у пацієнтів з хворобою Альцгеймера [16-18]. За результатами огляду 13 клінічних досліджень, в які включено 4054 пацієнти з ішемічним інсультом, холіну альфосцерат має позитивний вплив на когнітивні функції в обстежуваних хворих [19-20].
Перспективним напрямком залишається періопераційне призначення холіну альфосцерату з метою запобігання виникнення ПОКД та післяопераційного делірію у пацієнтів середнього та похилого віку.
Матеріали та методи
На базі відділення анестезіології та інтенсивної терапії Національного інституту раку проведено проспективне контрольоване дослідження. Метою дослідження було визначити частоту розвитку ПОКД у пацієнток після планових онкогінекологічних оперативних втручань, а також ефективність та безпечність холіну альфосцерату для попередження розвитку ПОКД.
У дослідження включали пацієнток, яких готували до планових гістеректомій з приводу раку шийки або тіла матки.
Критеріями включення в дослідження були: згода пацієнтки, вік 60 років або менше, заплановане оперативне втручання під загальною анестезією тривалістю 2 год або більше, анестезіологічний ризик за ASA ІІ–ІІІ (American Society of Anesthesiologists), відсутність у пацієнта вад слуху, зору.
Критеріями виключення були: відмова пацієнтки, вік старше 61 року, вихідна оцінка за шкалою MMSE
Пацієнтів розділили на 2 групи: група 1 — група дослідження — пацієнтам призначали холіну альфосцерат у дозі 2 г внутрішньовенно за 20 хв до кінця операції та 1 г внутрішньовенно через 24 год після її завершення; група 2 — контрольна група — без призначень холіну альфосцерату.
Після отримання інформованої згоди пацієнта за день до операції проводили тестування когнітивних функцій за шкалою оцінки психічного статусу Фолстейна (MMSE). Повторну оцінку когнітивних функцій здійснювали на 3-й та 7-й дні після операції. Крім того, визначали швидкість пробудження пацієнтів після загальної інгаляційної анестезії та час до екстубації.
Час пробудження пацієнтів — час від зупинки інгаляції севофлюрану (з переходом на інгаляцію кисню) до першого продуктивного контакту з пацієнтом (виконання елементарних команд, наприклад відкривання очей). Час екстубації визначали від зупинки інгаляції севофлюрану до екстубації пацієнта при адекватному самостійному диханні.
Критерієм ПОКД було зниження результату тесту оцінювання психічного статусу Фолстейна після операції на 10% та більше.
Проводили моніторинг періопераційного рівня глюкози крові як маркера стресу, тривалості анестезії. Рівень глюкози в крові визначали через 6 та 24 год після операції.
При аналізі отриманих даних визначали інцидентність розвитку ПОКД в післяопераційний період, відношення шансів (ВШ) розвитку ПОКД в контрольній та досліджуваній групах, тривалість часу до пробудження та екстубації, статистичну достовірність оцінювали за допомогою критерію Фішера (Statistica 8,0; WinPepi).
Результати
У дослідження включено 40 пацієнток (група 1 і 2 — по 20 пацієнток відповідно) у віці в середньому 44,2 року (95% довірчий інтервал — ДІ — 41,2–47,3). Групи статистично не відрізнялися за віком та відповідали критеріям включення в дослідження.
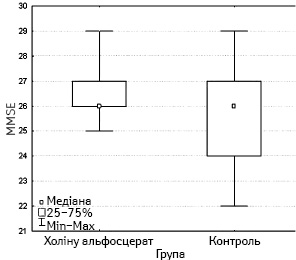
За результатами оцінки когнітивних функцій перед операцією (шкала MMSE) середній показник у групі 1 становив 26,7 (95% ДІ — 26,1–27,3); у групі 2 — 25,8 (95% ДІ — 24,8–26,7), що свідчить про статистично достовірну однорідність груп (р=0,08) (рис. 1).
Усім пацієнткам виконано гістеректомію з приводу раку тіла або шийки матки під загальною інгаляційною анестезією севофлюраном, глибину якої контролювали цільовими показниками МАК- (1,5–2) та BIS-моніторингу (40–60). Для післяопераційного знеболення комбінували нестероїдні протизапальні препарати та опіоїдні анальгетики. Час від зупинки інгаляції анестетика до пробудження хворої й екстубації в групі 1 в середньому становив 8,2 хв (95% ДІ — 7,6–8,8) та 14 хв (95% ДІ — 13,4–14,9) відповідно. У групі 2 (контрольна) час від зупинки інгаляції анестетика до пробудження пацієнтки й екстубації в середньому — 16,5 хв (95% ДІ — 14,7–18,2) та 22,8 хв (95% ДІ — 21,1–24,4) відповідно. Встановлено достовірну відмінність між групами за часом пробудження та часом екстубації (р=0,0001) (таблиця).
Таблиця. Результати за основними досліджуваними показниками у групах
| Група 1 n=20 | Група 2 (контрольна) n=20 | Критерій Фішера | ВШ | |
|---|---|---|---|---|
| ПОКД, 3-тя доба | 3/17 (15%) | 12/8 (60%) | p=0,004 | 8,5 (95% ДІ 1,57–56,86) |
| ПОКД, 7-ма доба | 3/17 (15%) | 8/12 (40%) | p=0,078 | 3,78 (95% ДІ 0,69–25,86) |
| Швидке пробудження (до 10 хв) | 17/3 (85%) | 3/17 (15%) | p=0,001 | 32 (95% ДІ 3,4–45) |
| Екстубація (до 20 хв) | 17/3 (85%) | 4/16 (20%) | p=0,001 | 22,6 (95% ДІ 1,8–31,5) |
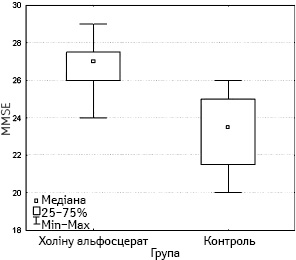
На 3-тю добу після операції всіх пацієнток повторно тестували за шкалою оцінки психічного статусу Фолстейна. Результати наведено в таблиці ПОКД діагностували у 3 (15%) хворих з групи 1 та 12 (60%) пацієнток з групи 2, різниця між інцидентністю ПОКД в групах була статистично достовірною (p=0,004; ВШ=8,5; 95% ДІ — 1,57–56,86). Значення ВШ свідчить про те, що ризик виникнення ПОКД в контрольній групі достовірно перевищував такий у досліджуваній у 8,5 раза (рис. 2).
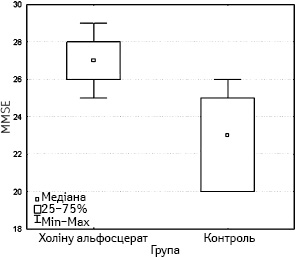
На 7-му добу після операції всіх пацієнток повторно тестували за шкалою оцінки психічного статусу Фолстейна. ПОКД діагностували у 3 (15%) пацієнток з групи 1 та 8 (40%) з групи 2, різниця між інцидентністю ПОКД в групах не була статистично достовірною, проте тенденція до вищої інцидентності ПОКД в контрольній групі зберігалася (p=0,078; ВШ=3,78; 95% ДІ 0,69– 25,86). Значення ВШ свідчить про те, що ризик виникнення ПОКД в контрольній групі достовірно перевищував такий у досліджуваній у 4 рази (рис. 3).
Рівень глюкози в крові статистично не різнився в групах. Через 6 год після операції середнє значення глюкози в крові в групі 1 становило 5,5 ммоль/л (95% ДІ — 4,6– 6,8); в групі 2 — 6,2 ммоль/л (95% ДІ — 5,2–6,9). Через 24 год після операції середній рівень глюкози в групі 1 становив 5,9 ммоль/л (95% ДІ — 4,68–6,8); у групі 2 — 6,0 ммоль/л (95% ДІ — 4,9–6,9; р>0,05).
Середня тривалість оперативного втручання також статистично значимо не відрізнялася в групах і становила в групі 1 — 132 хв (95% ДІ — 122–178), групі 2 — 140 хв (95% ДІ — 125–180; р>0,05).
Обговорення та висновки
Проблема когнітивної дисфункції після планових онкогінекологічних оперативних втручань є актуальною для жінок середнього віку. Частота виникнення ПОКД, за результатами нашого дослідження, може становити до 60% у жінок після онкогінекологічних операцій. За даними зарубіжних авторів, у пацієнтів неонкологічного профілю різного віку частота виникнення ПОКД становить 31–40% [2]. У більшості хворих покращення когнітивної функції відбувається протягом наступних 3 міс [2], проте існує прямий зв’язок між розвитком ПОКД і підвищенням смертності в перший рік після великих некардіологічних операцій [21]. Крім того, ПОКД асоціюється зі збільшенням тривалості госпіталізації, часу відновлення функціональної активності, реабілітації, негативними соціальними наслідками, пов’язаними з погіршенням якості життя [21].
Факторами ризику ПОКД є похилий вік, низький рівень освіти, гостре порушення мозкового кровообігу або транзиторна ішемічна атака в анамнезі, повторні операції, інтраопераційна гіпоксія або велика крововтрата [2]. Крім того, у декількох дослідженнях показано взаємозв’язок між рівнем секреції кортизолу, запальних медіаторів, які є незалежними факторами стрес-реакції, та частотою виникнення ПОКД [22, 23]. Тривалі ефекти анестетиків у формі антихолінергічної або антикатехоламінергічної [24, 25] активності, а також депривація сну [25], пов’язана з госпіталізацією, можуть викликати когнітивні розлади.
У даному дослідженні ми вивчали вплив нейропротектора холіну альфосцерату на частоту розвитку ПОКД, нашою метою було виключити фактори-кофаундери, які могли би впливати на досліджуваний результат (фактори, що спотворюють оцінку впливу досліджуваного фактора на результат через те, що одночасно мають причинний зв’язок і з результатом, і з досліджуваним фактором).
Групи не відрізнялися за віком, рівнем освіти, неврологічним анамнезом, типом операції, анестезії та післяопераційної аналгезії. У всіх пацієнток виконано первинну операцію, групи статистично не різнилися за тривалістю операції, об’ємом крововтрати з виключенням періодів інтраопераційної гіпоксії. Про розвиток стрес-реакції можна опосередковано судити за динамікою глюкози в крові в обох групах, ґрунтуючись на доведенні кореляції між рівнем глюкози в крові та рівнем стрес-факторів (кортизол, прозапальні медіатори) [26]. Динаміка рівня глюкози в крові статистично значимо не відрізнялася в досліджуваних групах. Отже пацієнтки обох груп перебували у відносно однакових умовах, проте частота виникнення ПОКД достовірно різниться у групах.
Таким чином, одним із методів запобігання розвитку ПОКД є періопераційне призначення нейропротекторів, зокрема похідних екзогенного холіну (холіну альфосцерат). За результатами даного дослідження призначення холіну альфосцерату асоціювалося з достовірним зниженням ризику виникнення ПОКД, скороченням часу пробудження та часом до екстубації пацієнтів. Тому періопераційне призначення холіну альфосцерату потенційно може бути профілактикою розвитку ПОКД. Проте для остаточних висновків необхідне проведення подальших досліджень на великих вибірках пацієнтів з наявністю плацебо-контролю.
Список використаної літератури
1. Антонов И.П. (1998) Эффективность применения препарата Глиатилин у больных с острыми нарушениями мозгового кровообращения в раннем восстановительном периоде. Terra Medica, СПб.: 36–44.
2. Вознюк И.А., Одинак М.М., Кузнецов А.Н. (1998) Применение глиатилина у больных с острым нарушением мозгового кровообращения. Сосудистая патология нервной системы. СПб.: 167–172.
3. Голохвастов С.Ю., Цыган Н.В. (2010) Многоцентровое (пилотное) исследование эффективности глиатилина при остром ишемическом инсульте. Клин. неврология, 4 (1): 20–27.
4. Никонов В.В., Савицкая И.Б. (2011) Возможности применения холина альфосцерата для лечения постгипоксической энцефалопатии. Медицина неотложных состояний, 1–2: 101–106.
5. Лесной И.И. (2012) Сравнение эффективности двух подходов к аналгезии у хирургических больных в отделении интенсивной терапии. Укр. журн. клiнiчної та лабораторної медицини, 7: 71–79.
6. Черний Т.В., Андронова И.А., Черний В.И. (2011) Предикторы и фармакологическая коррекция недостаточности модулирующих систем мозга при мозговом инсульте и тяжелой черепно-мозговой травме. Международный неврологический журнал, 2: 40.
7. Abildstrom H., Rasmussen L.S., Rentowl P. et al. (2000) Cognitive dysfunction 1–2 years after non-cardiac surgery in the elderly. Acta Anaesthesiol. Scand., 44: 1246–51.
8. Amenta F., Carotenuto A., Fasanaro A.M. et al. (2010) Analisi comparativa della sicurezza/efficacia degli inibitori delle colinesterasi e del precursore colinergico colina alfoscerato nelle demenze ad esordio nell’eta adulta. G. Gerontol., 58: 64–68.
9. Arrowsmith J.E., Harrison M.J., Newman S.P. et al. (1998) Neuroprotection of the brain during cardiopulmonary bypass: A randomized trial of remacemide during coronary artery bypass in 171 patients. Stroke, 29: 2357–62.
10. Ancelin M.L., Artero S., Portet F. et al. (2006) Nondegenerative mild cognitive impairment in elderly people and use of anticholinergic drugs: Longitudinal cohort study. BMJ, 332: 455–459.
11. Borowicz L.M., Goldsborough M.A., Selnes O.A., McKhann G.M. (1996) Neuropsychologic change after cardiac surgery: A critical review. J. Cardiothorac. Vasc. Anesth., 10: 105–12.
12. Casati A., Aldegheri G., Vinciguerra F. et al. (2003) Randomized comparison between sevoflurane anaesthesia and unilateral spinal anaesthesia in elderly patients undergoing orthopaedic surgery. Eur. J. Anaesth., 20: 640–6.
13. Casati A., Fanelli G., Pietropaoli P. et al. (2005)Continuous monitoring of cerebral oxygen saturation in elderly patients undergoing major abdominal surgery minimizes brain exposure to potential hypoxia. Anesth. Analg., 101: 740–7.
14. Johnson T., Monk T., Rasmussen L.S. et al. (2002) Postoperative cognitive dysfunction in middle-aged patients. Anesthesiology, 96: 1351–7.
15. Jevtovic-Todorovic V., Hartman R.E., Izumi Y. et al. (2003) Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing rat brain and persistent learning deficits. J. Neuroscience, 23: 876–82.
16. Fallbrook A., Turenne S.D., Mamalias N. et al. (1999) Phosphatidylcholine and phosphatidylethanolamine metabolites may regulate brain phospholipid catabolism via inhibition of lysophospholipase activity. Brain Res., 10: 207–210.
17. Khaselev N., Murphy R.C. (2000) Structural characterization of oxidized phospholipid products derived from arachidonate-containing plasmenyl glycerophosphocholine. J. Lipid Res., 41: 564–572.
18. Lopez C.M., Govoni S., Battaini F. et al. (1991) Effect of a new cognition enhancer, alphaglycerylphosphorylcholine, on scopolamine-induced amnesia and brain acetylcholine. Pharmacol. Biochem. Behav., 39, Issue 4: 835–840.
19. Parnetti L., Amenta F., Galla V. (2001) Choline alphoscerate in cognitive decline and in acute cerebrovascular disease: an analysis of published clinical data. Mechanisms of Ageing and Development, 122, Issue 16: 2041–55.
20. Lupien S.J., de Leon M., de Santi S. et al. (1998)Cortisol levels during human aging predict hippocampal atrophy and memory deficits. Nat. Neurosci., 1: 69–73.
21. Nielson W.R., Gelb A.W., Casey J.E. et al. (1990)Long-term cognitive and social sequelae of general versus regional anesthesia during arthroplasty in the elderly. Anesthesiology, 73: 1103–9.
22. Monk T.G., Weldon B. C., Garvan С.W. et al. (2008) Predictors of cognitive dysfunction after major noncardiac surgery. Anesthesiology, 108: 18–30.
23. Biedler A., Juckenhöfel S., Larsen R. et al. (1999)Postoperative cognition disorders in elderly patients. The results of the «International study of postoperative cognitive dysfunction». Anaesthesist., 48(12): 884–895.
24. Pratico C., Quattrone D., Lucanto T. et al. (2005)Drugs of anesthesia acting on central cholinergic system may cause postoperative cognitive dysfunction and delirium. Med. Hypotheses, 65: 972–982.
25. Monk T.G., Weldon B.C., Garvan C.W. et al. (2008) Predictors of cognitive dysfunction after major noncardiac surgery. Anesthesiology, 108: 18–30.
26. Rasmussen L.S., O’Brien J.T., Silverstein J.H. et al., ISPOCD2 Investigators (2005) Is peri-operative cortisol secretion related to post-operative cognitive dysfunction? Acta Anaesthesiol. Scand., 49: 1225–31.
Послеоперационная когнитивная дисфункция у женщин среднего возраста: инцидентность и методы профилактики
Резюме. Проспективное контролированное исследование, целью которого было определить актуальность проблемы послеоперационной когнитивной дисфункции (ПОКД) для женщин среднего возраста после гистерэктомии, частоту возникновения и возможные факторы риска развития ПОКД, а также исследовать эффективность профилактики ПОКД назначением нейропротекторных препаратов, а именно холина альфосцерата. В исследование включены 40 пациенток, по 20 в исследуемой (группа холина альфосцерата) и контрольной группах. ПОКД диагностировали у 3 (15%) пациенток из группы 1 и у 12 (60%) из группы 2, разница между инцидентностью ПОКД в группах была статистически достоверной (p=0,004; отношение шансов составляло 8,5; 95% доверительный интервал — 1,57–56,86). Отношение шансов свидетельствует о том, что риск возникновения ПОКД в контрольной группе достоверно выше риска ПОКД в исследуемой группе в 8,5 раза. По результатам данного исследования назначение холина альфосцерата ассоциируется с достоверным снижением риска возникновения ПОКД, сокращением времени пробуждения и времени до экстубации пациентов.
послеоперационная когнитивная дисфункция, гистерэктомия, холина альфосцерат.














Leave a comment