Використання радіочастотної гіпертермії для підвищення ефективності комплексного лікування хворих на місцево-поширений рак грудної залози
Смоланка І.І., Орел В.Е., Скляр С.Ю., Досенко І.В., Лигирда Н.Ф., Головко Т.С., Лобода А.Д.
Розроблено спосіб неоад’ювантної поліхіміотерапії з радіочастотною гіпертермією у хворих на місцево-поширений рак грудної залози. Визначено, що використання радіочастотної гіпертермії при неоад’ювантному лікуванні хворих на рак грудної залози дозволило збільшити кількість випадків часткової регресії пухлини на 14,4% та регресії метастатичних лімфовузлів — на 16,2%. Доповнення поліхіміотерапії сеансами радіочастотної гіпертермії дозволило збільшити число органозберігаючих операцій на 14,5%, та провести відновні операції 10,5% хворих.

ВСТУП
Рак грудної залози (РГЗ) впродовж останніх років займає 1-ше місце серед злоякісних новоутворень у жінок економічно розвинутих країн та залишається актуальною проблемою сучасної клінічної онкології. Згідно з інформаційними матеріалами, що публікують в бюлетені Національного канцер-реєстру 2008–2009 рр., захворюваність на РГЗ в країні становила 65,7, а летальність — 31,7 випадка на 100 тис. жіночого населення [2].
Вже визнано, що РГЗ — системне захворювання, яке вже на ранніх стадіях може супроводжуватись наявністю віддалених мікрометастазів. Тому особлива увага останнім часом приділяється комплексу протипухлинних системних заходів із застосуванням неоад’ювантної поліхіміотерапії (НПХТ) для збільшення кількості радикальних органозберігаючих операцій та можливості проведення реконструктивних операцій з метою підвищення якості життя пацієнток та покращання результатів лікування.
Актуальним на сьогодні є пошук нових методів протипухлинного лікування з використанням модифікуючих факторів, які б посилювали цитостатичну дію хіміопрепаратів та сприяли підвищенню ефективності лікування [1].
В останні 20 років радіочастотна гіпертермія (РГТ) стала загальновизнаним і досить поширеним методом підвищення ефективності лікування пухлин. РГТ застосовують безпосередньо під час або після проведення хіміо- або променевого лікування при резистентних формах злоякісних новоутворень [6]. Не є винятком і застосування РГТ як компонента неоад’ювантного методу лікування хворих на місцево-поширений РГЗ [3].
Відомо, що для злоякісних пухлин характерна тенденція до зниження швидкості кровотоку, що частково пов’язано зі змінами форми кровоносних судин у пухлині, їх різкими вигинами, звуженнями та розширеннями [4]. Внаслідок цього в пухлинах суттєво знижений інтерстиціальний тиск рідин, що погіршує потрапляння хіміопрепарату до злоякісних клітин [5].
Визнано, що при температурі 38–42 °С в тканинах організму підвищується мікроциркуляція біологічних рідин [8]. Тому поряд із достатньо широким використанням класичної РГТ як синергічного гіпертермічного фактора нагріву пухлин (температура підвищується до 42–46 °С) зараз почали застосовувати і помірну фізіологічну РГТ — магнітотермію (індуктотермію) пухлин до 38–42 °С. В останньому випадку внаслідок дії електричної компоненти електромагнітного поля (ЕМП) ініціюється не лише помірний тепловий фактор впливу, а й дія магнітної компоненти на електронно-транспортні мережі біологічних мембран злоякісних пухлин, що суттєво знижує хіміорезистентність до протипухлинних ліків [7]. Раніше проведені дослідження на резистентних експериментальних моделях пухлин до препаратів доксорубіцину та цисплатину показали, що РГТ, внаслідок опромінення неоднорідним ЕМП, більш суттєво знижує резистентність пухлин. Проте клінічні аспекти РГТ при лікуванні хворих на РГЗ ще не були вивчені.
З огляду на викладене та враховуючи обмежену кількість робіт, присвячених застосуванню РГТ при лікуванні РГЗ, було проведено дослідження з визначення доцільності її застосування як модифікатора цитостатичної дії ПХТ. Метою дослідження було підвищити ефективність лікування та покращити якість життя хворих на РГЗ шляхом розробки та оптимізації методик лікування, спрямованих на збереження органу.
об’єкт і МЕТОДИ ДОСЛІДЖЕННЯ
У роботі проаналізовано результати комплексного лікування 122 хворих на РГЗ IIБ—IIIА стадії. Вік хворих, включених у дослідження, коливався від 29 до 65 років. Основна група досліджених (60 пацієнток) включала хворих на РГЗ, при комплексному лікуванні яких у неоад’ювантному режимі застосовували ПХТ на тлі РГТ. 62 пацієнтки контрольної групи отримували комплексне лікування з НПХТ у стандартному режимі. У всіх хворих діагноз був верифікований методом тонкоголкової або трепан-біопсії.
Критерії залучення пацієнтів у дослідження:
- жінки віком 18–65 років;
- наявність у пацієнта цитологічно або гістологічно підтвердженого діагнозу РГЗ;
- інформована письмова згода пацієнтки на участь у дослідженні;
- здатність пацієнта до адекватного співробітництва у процесі дослідження;
- стан хворого за ЕСОG — 0–2.
Критерії невключення пацієнтів у дослідження:
- період вагітності та годування грудьми;
- гострі запальні та інфекційні процеси;
- системні захворювання крові;
- супутні захворювання, наявність яких здатна істотно вплинути на результати дослідження (серцева недостатність III ступеня, печінкова недостатність, некомпенсовані порушення функції нирок, підшлункової залози, зовнішнього дихання та ін.);
- наявність іншої пухлини (інше злоякісне новоутворення).
У період набору пацієнтів проводили стандартне клініко-лабораторне обстеження кожної хворої, рентгенологічні дослідження — мамографію в прямій та боковій проекціях, аксилографію, комплексне ультразвукове дослідження грудної залози та реґіонарних лімфатичних вузлів (ЛВ), комп’ютерна томографія органів грудної та черевної порожнини, малого тазу, ЕКГ. Розподіл хворих на РГЗ залежно від стадії захворювання був однорідним в обох групах (табл. 1). Дизайн дослідження представлено на схемі.
| Стадія захворювання | Основна група, n (%) | Контрольна група, n (%) | р |
|---|---|---|---|
| IІВ (T2–3N0–1M0) | 38 (63,3±6,2) | 42 (67,7±5,9) | >0,05 |
| IIIА (T2–3N1–2M0) | 22 (36,7±6,2) | 20 (32,3±5,9) | >0,05 |
| Всього | 60 (100,0) | 62 (100,0) | – |
У дослідження включали хворих на РГЗ IІВ (T2–3N0–1M0) та IIIА (T2–3N1–2M0) стадії захворювання, що належать до місцево-поширених форм захворювання, при яких раніше органозберігаючі та реконструктивно-відновні операції не проводили, а виконували розширені мастектомії, що значно погіршувало якість життя пацієнтів.
За гістологічною структурою найчастіше виявляли інфільтруючу долькову карциному: у 33 хворих основної групи (55,0±6,4%) та у 36 пацієнтів контрольної (58,1±6,3%), р>0,05. Інфільтруюча протокова карцинома діагностована у 14 пацієнток основної групи (23,3±5,7%), у 15 контрольної (24,2±5,4%), р>0,05. Медулярна карцинома відмічена у 5 (8,3±3,6%) хворих основної та у 5 (8,1±3,5%) пацієнток контрольної групи, р>0,05; слизова карцинома — у 4 (6,7±3,2%) хворих основної та у 6 (9,7±3,7%) контрольної групи, р>0,05. У 3 хворих основної групи (6,7±3,2%) гістологічна структура пухлини в грудній залозі залишилась не визначеною у зв’язку з майже повною регресією після проведеного до операції лікування. Дані розподілу хворих на РГЗ за гістологічною структурою пухлини наведені у табл. 2. Різниця частки хворих за різними морфологічними типами пухлин в обох досліджуваних групах була недостовірною.
Після встановлення та верифікації діагнозу всі пацієнти були рандомізовані на дві групи: хворі контрольної групи отримали 4 курси НПХТ за схемою FAC (циклофосфамід 500 мг/м, флуороурацил 500 мг/м, доксорубіцин 50 мг/м) з інтервалом у 3 тиж. Хворим основної групи проводили 4 курси НПХТ за схемою FAC з інтервалом у 3 тиж, але на тлі РГТ, яку проводили за допомогою апарата вітчизняного виробництва «Магнітерм» фірми «Радмір» (Україна, свідоцтво про реєстрацію № 7714/2008 від 11 квітня 2008 р.) (рис. 1).
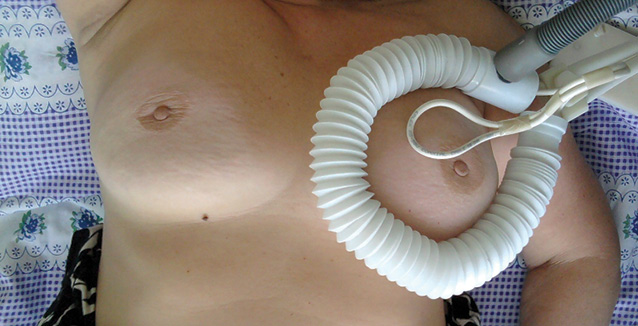
Після повного клінічного обстеження хворим на РГЗ основної групи спочатку вводили внутрішньовенно хіміопрепарати за схемою FAC, після якого проводили сеанс РГТ. Під час сеансу РГТ аплікатор апарату «Магнітерм» розташовували у ділянці пухлини, сеанс проводили при вихідній потужності апарата 65 Вт протягом 30 хв. Під час сеансу РГТ підвищення температури шкіри у зоні дії ЕМП не перевищувало 4 °С. На рис. 2 наведено типове положення хворої на РГЗ під час сеансу РГТ.
| Гістологічна структура пухлини | Основна група, n (%) | Контрольна група, n (%) | p |
|---|---|---|---|
| Інфільтруюча долькова карцинома | 33 (55,0±6,4) | 36 (58,1±6,3) | >0,05 |
| Інфільтруюча протокова карцинома | 14 (23,3±5,7) | 15 (24,2±5,4) | >0,05 |
| Слизова карцинома | 4 (6,7±3,2) | 6 (9,7±3,7) | >0,05 |
| Медулярна карцинома | 5 (8,3±3,6) | 5 (8,1±3,5) | >0,05 |
| Не визначена | 4 (6,7±3,2) | 0 | – |
| Всього | 60 (100,0) | 62 (100,0) | – |
З метою оцінки ефективності НПХТ у хворих на місцево-поширений РГЗ з використанням апарата «Мангітерм» проводили комплексне УЗД грудної залози і реґіонарних лімфатичних вузлів. Для оцінки зміни інтенсивності кровотоку у пухлині після сеансу РГТ проводили імпульсну доплерографію у 10 пацієнтів. УЗД здійснювали на цифровому доплеровському ультразвуковому діагностичному комплексі «ULTIMA» (Радмір, Україна) в масштабі реального часу. Під час дослідження вимірювали параметри кровотоку навколо пухлини.
Дослідження проводили в два етапи. Перший етап обстеження включав безпосередні дослідження до початку лікування, другий — після закінчення сеансу РГТ.
Інтенсивність кровотоку оцінювали за наступними параметрами: максимальна систолічна (S) і мінімальна діастолічна (D) швидкість. Зміну показників кровотоку визначали як відношення відповідних показників:
?S = S/S0, ?D = D/D0,
де S0 — амплітуда швидкості систолічного кровотоку до проведення індуктотермії;
S — амплітуда швидкості систолічного кровотоку після проведення індуктотермії;
D0 — амплітуда швидкості діастолічного кровотоку до проведення індуктотермії;
D — амплітуда швидкості діастолічного кровотоку після проведення індуктотермії;
?S — зміна швидкості систолічного кровотоку;
?D — зміна швидкості діастолічного кровотоку.
Через 3 тиж після останнього курсу ПХТ проводили мамографічне та УЗД грудної залози та реґіонарних ЛВ з метою аналізу результатів лікування хворих обох груп, після чого проводили радикальне оперативне втручання та подальше ад’ювантне лікування згідно з рекомендаціями стандартів лікування МОЗ України. Оцінку ефективності НПХТ проводили за крітеріями RECIST (Response evaluation criteria in solid tumor)з використанням мамографії у фронтальній та сагітальній проекціях та УЗД, залежно від рівня регресії пухлини оцінювали такі параметри: повна, часткова регресія, стабілізація процесу або прогресування.
Обсяг оперативного втручання обирали на підставі отриманих даних клінічної ефективності передопераційної терапії з урахуванням результатів інтраопераційного визначення меж резекції (проведення експрес-біопсії країв резекції під час операції). У разі стабілізації чи прогресування хвороби пацієнтам була виконана мастектомія за Маденом з або без одномоментної реконструкції грудної залози. При повній чи частковій регресії пухлини та досягненні чистоти меж резекції пацієнткам була проведена органозберігаюча операція — квадрантектомія з регіонарною лімфодисекцією або (при розташуванні пухлини в центральному квадранті чи за наявності мультицентричних вогнищ мікрокальцинатів) — підшкірна мастектомія з одномоментним ендопротезуванням. Хворим, у яких інтраопераційно не було досягнуто чистоти меж резекції, виконували мастектомію за Маденом або підшкірну мастектомію з одномоментним ендопротезуванням.
Аналіз безпосередніх результатів проведеного лікування базувався на клінічних, рентгенологічних RECIST-критеріях та морфологічних даних. Статистичний аналіз вірогідності отриманих даних проводили за допомогою t-критерію Стьюдента, використовуючи комп’ютерну програму Statistica 6.0. Статистичну обробку даних також проводили в MS Excel 7.0, використовуючи функції описової статистики та двовибірковий t-тест з різними дисперсіями для визначення вірогідності випадкових розбіжностей (р).
РЕЗУЛЬТАТИ
Безпосередні результати лікування оцінювали у 122 хворих на місцево-поширений РГЗ через 3 тиж після закінчення НПХТ.
Всі пацієнтки основної групи отримали курси НПХТ у визначений термін, перерв у лікуванні не відмічено. При аналізі показників гематологічної токсичності та зміни функції печінки та нирок у досліджуваних не було виявлено достовірних відмінностей між пацієнтами основної та контрольної групи. Встановлено зміни показників гемопоезу, функції печінки не були лімітуючими факторами для застосування поряд з класичною схемою FAC схеми FAC з сеансами РГТ при проведенні неоад’ювантної терапії в комплексному лікуванні хворих на місцево-поширений РГЗ.
За даними клініко-рентгенологічного дослідження, повна регресія пухлин характеризувалася зменшенням її розмірів до встановлення нормальної зональної анатомії, однорідністю ультразвукового сигналу. Набряк та інфільтрація шкіри та кровоносна мережа пухлин протягом лікування повністю зникали. Повну регресію пухлин виявлено у 3 (5,0±2,8%) пацієнток основної групи та у 2 (3,2±2,2%) хворих контрольної групи (p>0,05).
При частковій регресії відзначали зменшення пухлини більше ніж на 30% порівняно з початковими даними, відбувалася її структурна перебудова, але залишалися гіпоехогенні ділянки, зменшувалися розміри ЛВ. Часткову регресію пухлини виявлено у 29 (48,3±6,4%) хворих основної та у 21 (33,9±6,0%) — контрольної групи (р<0,05). Стабілізацію процесу відмічено у 24 (40,0±6,3%) пацієнток основної та у 34 (54,0±6,3%) — контрольної групи (р<0,05). Прогресування пухлинного процесу встановлено у 4 (6,7±3,2%) основної та у 5 (8,1±3,5%) контрольної групи (табл. 3).
| Відповідь пухлини на лікування (за критеріями RECIST) | Основна група, n (%) | Контрольна група, n (%) | р |
|---|---|---|---|
| Повна регресія | 3 (5,0±2,8) | 2 (3,2±2,2) | >0,05 |
| Часткова регресія | 29 (48,3±6,4) | 21 (33,9±6,0) | <0,05 |
| Стабілізація процесу | 24 (40±6,3) | 34 (54±6,3) | <0,05 |
| Прогресування процесу | 4 (6,7±3,2) | 5 (8,1±3,5) | >0,05 |
| Всього | 60 (100) | 62 (100) |
Регресію метастатично уражених реґіонарних ЛВ відмічали у 32 пацієнток (53,3±6,4%) основної та у 23 хворих (37,1±6,1%) контрольної групи (р<0,05).
Після аналізу відповіді на неоад’ювантне лікування проводилося оперативне втручання. При позитивному ефекті лікування з’являлася можливість для проведення органозберігаючого лікування, при стабілізації процесу — переважно виконували мастектомію за Маденом, при прогресуванні — більш розширені операції.
Органозберігаючі операції були виконані у 31 хворої (51,7±6,4%) основної та у 23 хворих (37,1±6,1%) контрольної групи (р<0,05). Реконструкція TRAM-клаптем виконана у 4 (6,7±3,2%) хворих основної та у 3 пацієнток (4,8±2,7%) контрольної групи (p>0,05). Підшкірна мастектомія з одночасним ендопротезуванням — у 10 (16,7±4,8 %) і 5 (8,1±3,5 %) пацієнток основної та контрольної груп відповідно (р<0,05).
Аналіз отриманих результатів лікування хворих на місцево-поширений РГЗ за розробленим методом свідчив, що в грудній залозі після закінчення сеансу РГТ максимальна систолічна Тшвидкість внутрішньопухлинного кровотоку в невеликих судинах збільшувалася в середньому на 94%. Максимальна діастолічна швидкість також мала тенденцію до збільшення. У 2 пацієнтів, в пухлині яких виявляли судини більшого розміру, підвищення максимальної швидкості систоли становило 3,35 раза, а мінімальної діастолічної — 4,87 раза. В табл. 4 представлені зміни кількісних характеристик внутрішньопухлинного кровотоку в малих судинах після проведення протипухлинної терапії за розробленим методом.
| Час дослідження | Доплерографічні показники, M±m | |
|---|---|---|
| S/S0, відн. од. | D/D0, відн. од. | |
| До сеансу РГТ | 1,07 ± 0,17 | 1,08 ± 0,27 |
| Після закінчення сеансу РГТ | 1,94 ± 0,35* | 1,38 ± 0,39 |
На рис. 3 наведені типові зміни доплерограм після лікування хворої К.Г. з діагнозом РГЗ IIIА стадії (первинна історія хвороби № 3202 від 06.04.2010 р). Дані дослідження свідчать про значне підсилення кровотоку у пухлині після проведення сеансу РГТ. Через 2 тиж після проведення ПХТ на фоні РГТ у хворої відмічали зменшення розмірів пухлини на 50% (історія хвороби № 6276 від 26.06.2010 р.).

Вивчення віддалених результатів лікування буде проведено в подальшому.
ВИСНОВКИ
1. Проведення неоад’ювантної поліхіміотерапії з використанням РГТ при комплексному лікуванні хворих на місцево-поширений РГЗ сприяє вірогідному збільшенню об’єктивної відповіді пухлини на лікування (дозволяє збільшити на 14,4% кількість випадків часткової регресії первинної пухлини та на 16,2 % регресію метастатичних ЛВ).
2. Застосування неоад’ювантної терапії з використанням НПХТ на тлі РГТ дозволяє на 14,5% збільшити проведення органозберігаючих операцій та на 10,5% — реконструктивно-відновних операцій.
3. Додавання сеансів РГТ до НПХТ не збільшує токсичність, не має протипоказань, покращує результати неоад’ювантної протипухлинної терапії.
ЛІТЕРАТУРА
- 1. Семиглазов В.Ф., Семиглазов В.В., Клетсель А.Е. (2008) Неоадъювантное и адъювантное лечение рака молочной железы. М.: МИА: 287.
- 2. Федоренко З.П., Гайсенко А.В., Гулак Л.О. та ін. (2010) Рак в Україні, 2006–2007. Захворюваність, смертність, виживаність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, № 11: 50–51.
- 3. Щепотін І.Б., Чешук В.Є., Мотузюк І.М. та ін. (2005) Результати застосування неоад’ювантної поліхіміотерапії комбінації з локальною гіпертермією при лікуванні хворих на рак молочної залози. Науковий вісник Національного медичного університету ім. О.О. Богомольця, 3–4: 73–78.
- 4. Ellegala D.B., Leong-Poi H., Carpenter J.E. et al. (2003) Imaging Tumor Angiogenesis With Contrast Ultrasound and Microbubbles Targeted to avB3Circulation.; 108: 336.
- 5. Jain R.K. (1999) Transport of molecules, particles, and cells in solid tumors. Annu. Rev. Biomed. Eng., 1: 241–263.
- 6. Long G.G., Kimmick B.J., Shelton L.D. et al. (2002) Long-term follow-up of a phase II trial studying a weekly doxorubicin-based multiple drug adjuvant therapy for stage II node-positive carcinoma of the breast //Breast Cancer Res. Treat., 72: 233–243.
- 7. Orel, V.E., Romanov, A.V. (2010) The Effect of Spatially Inhomogeneous Electromagnetic Field and Local Inductive Hyperthermia on Nonlinear Dynamics of the Growth for Transplanted Animal Tumors, In: T. Evans (Ed), Nonlinear Dynamics, INTECH, Сhroatia, p. 285–308.
- 8. Song C.W., Park H.J., Lee C.K. et al. (2005) Implications of increased tumor flow and oxygenation caused by mild tempreture hyperthermia in tumor treatment. International Journal of Hyperthermia, 21(8): 761–767.
Использование радиочастотной гипертермии для повышения эффективности комплексного лечения больных местно-распространенным раком грудной железы
Национальный институт рака, Киев
Резюме. Разработан способ неоадъювантной полихимиотерапии с радиочастотной гипертермией у больных с местно- распространенным раком грудной железы. Установлено, что ис- пользование радиочастотной гипертермии при неоадъювантном лечении больных с местно-распространенным раком грудной железы позволило увеличить количество случаев частичной регрессии первичной опухоли на 14,4% и регрессии метастати- ческих лимфоузлов — на 16,2%. Дополнение полихимиотерапии сеансами радиочастотной гипертермии позволило увеличить число органосохраняющих операций на 14,5%, и провести восстановительные операции 10,5% больных.
рак грудной железы, гипертермия, комп- лексное лечение, неоадъювантная полихимиотерапия, органо- сохраняющие операции, качество жизни больных.














Leave a comment