Лікування пацієнтів із метастазами остеосаркоми в легенях
Ковальчук П.А., Дедков А.Г., Ганул А.В., Бороров Л.В., Волков И.Б., Бойчук С.И., Тихонов В.Г.
Резюме. Проведено аналіз прийнятих у світовій практиці підходів до лікування пацієнтів з остеосаркомою, у яких розвинулися метастази в легенях після комбінованого лікування локального вогнища. Представлено результати власних досліджень впливу системної хіміотерапії другої лінії та радикального хірургічного лікування хворих із виявленими пухлинними вогнищами остеосаркоми в легенях. Результати показали, що більшість із пролікованих пацієнтів переживають 3-річний рубіж, що свідчить про необхідність проведення радикального лікування в цій групі хворих.
Резюме. Проведен анализ принятых в мировой практике подходов к лечению пациентов с остеосаркомой, у которых развились метастазы в легких после комбинированного лечения локального очага. Представлены результаты собственных исследований влияния системной химиотерапии второй линии и радикального хирургического лечения больных с выявленными опухолевыми очагами остеосаркомы в легких. Результаты показали, что большинство из пролеченных пациентов переживают 3-летний рубеж, что свидетельствует о необходимости проведения радикального лечения в данной группе больных.
 Согласно мировым стандартам, пациенты с остеосаркомой должны получать системную полихимиотерапию с последующей операцией и адъювантной химиотерапией [3, 11, 14, 33]. В соответствии с многорежимным подходом к лечению больных остеосаркомой требуется, чтобы медицинскую помощь пациенту предоставляла многопрофильная команда, которая состоит из таких специалистов, как химиотерапевт, онкоортопед, торакальный хирург, патологоанатом, радиолог, специалист по реабилитации. Мультидисциплинарный подход обеспечивает лечение, позволяющее достичь оптимальной выживаемости и качества жизни пациентов.
Согласно мировым стандартам, пациенты с остеосаркомой должны получать системную полихимиотерапию с последующей операцией и адъювантной химиотерапией [3, 11, 14, 33]. В соответствии с многорежимным подходом к лечению больных остеосаркомой требуется, чтобы медицинскую помощь пациенту предоставляла многопрофильная команда, которая состоит из таких специалистов, как химиотерапевт, онкоортопед, торакальный хирург, патологоанатом, радиолог, специалист по реабилитации. Мультидисциплинарный подход обеспечивает лечение, позволяющее достичь оптимальной выживаемости и качества жизни пациентов.
Существует мнение, что большинство больных остеосаркомой на момент первичного обращения или окончания лечения первоисточника опухолевого процесса имеют микрометастазы, не выявляемые с помощью современных методов диагностики. Таким образом, для воздействия на микрометастазы необходима системная терапия. У 40–30% пациентов, которые получили лечение по поводу остеосаркомы кости, возникает рецидив опухоли в виде отдаленных метастазов. У большинства больных (90%) отдаленные метастазы выявляют в легких [38], поскольку этот орган является мишенью клеток остеосаркомы ввиду своих биологических особенностей [21]. Пациенты с метастазами остеосаркомы в легких демонстрируют драматические показатели, так как смертность в этой группе, по результатам различных исследований, варьирует от 90 до 60% [15, 18, 22, 26].
Стремительное развитие молекулярной биологии дает возможность многое понять о процессе метастазирования сарком. Во время изучения механизма внедрения опухоли в органы-мишени рядом исследований доказано, что рецидивная опухоль, которая развивается в виде метастазов в отдаленных от первичного очага органах, имеет несколько другой фенотип, что объясняет ее устойчивость к химиотерапии первой линии [22, 31]. Метастазы состоят из клеточных клонов, которые отличаются от первичных опухолей по плоидности, ферменту профиля, кариотипу и химиочувствительности [15, 28]. Терапевтические схемы предназначены для первичной опухоли, следовательно, вряд ли будут успешными в лечении метастатического заболевания. Изменение биологического поведения метастатических клеток является результатом специфических молекулярных изменений. Метастаз считается окончательным и наиболее важным шагом в онкогенезе злокачественных опухолей [19]. Метастатическим клеткам саркомы необходимо выполнить следующие действия для формирования отдаленного опухолевого узла: 1 — вторжение через внеклеточный матрикс хозяина и вход в кровообращение; 2 — выживание в кровеносном русле; 3 — устойчивость к иммунной системе хозяина; 4 — фиксация и экстравазация в органе-мишени; 5 — адгезия; 6 — выживание в микросреде органов-мишеней; 7 — формирование сосудистой сетки для роста на органе-мишени [23]. Каждый шаг в равной степени важен и должен быть полностью завершен опухолевыми клетками для достижения формирования метастазов. В процессе этого пути клетки саркомы, меняя свой геном, проявляют большую устойчивость, чем в первичном очаге [24, 37, 40].
До конца 80-х бытовало мнение о нецелесообразности проведения какого-либо лечения пациентов с повторно возникшим метастазом остеосаркомы. Но нынче известно, что появление повторного рецидива саркомы в легких после проведенной терапии не является противопоказанием для продолжения лечения. Результатами современных исследований доказано, что применение комбинированных методов лечения при повторном рецидиве опухоли демонстрирует эффективность с медианой выживаемости 33,9 мес (без проявления заболевания от 3 до 179 мес) [17]. Это свидетельствует о том, что пациенту необходимо получить радикальное лечение во всех случаях, когда это возможно.
Эффективное лечение рецидивов остеосаркомы требует локальной и системной терапии. Местная терапия заключается в локальном агрессивном воздействии на опухоль и состоит из оперативного вмешательства, которое направлено на радикальное удаление очагов опухоли, или лучевой терапии, что является паллиативным методом. Системная терапия направлена на устранение опухолевых клеток по всему организму и включает в себя химиотерапию. Комбинация системной терапии в сочетании с локальными методами лечения дает возможность максимизировать шансы пациента на выздоровление.
В историческом аспекте целесообразность проведения радикального лечения больных с метастатическим поражением легких остеосаркомой была доказана исследователями в 70-х годах, когда после удаления всех очагов в легких удалось достичь безрецидивной выживаемости на протяжении 3 лет у 30% пациентов. Даже у лиц с повторяющимися рецидивами при успешном локальном воздействии возможно добиться длительной ремиссии, что было доказано исследователями из Италии [6]. Большое количество публикаций и многочисленные исследования доказывают эффективность радикального лечения в данной группе пациентов. Для больных с легочными метастазами остеосаркомы сочетание радикальной метастазэктомии и химиотерапии является методом улучшения отдаленных результатов или даже потенциального излечения.
Дискутабельным остается вопрос о проведении только хирургического лечения или применении комбинации химиотерапии и хирургичекого удаления очагов в легких. Так, исследователями из Норвегии с вовлечением 60 пациентов с метастазами остеосаркомы в легких достигнута 5-летняя общая выживаемость у 50% из них с использованием комбинации химиотерапии и метастазэктомии, а у 24% — только хирургического лечения [34]. Также в пользу комбинированного лечения метастатического рецидива остеосаркомы в легких высказывались ученые из Istituto Ortopedico Rizzoli (Италия). В наблюдении с участием 162 пациентов с метастазами 5-летнюю общую выживаемость зарегистрировали в 53% случаев с комбинированным лечением и в 12% — только хирургическим [12]. В исследованиях, проведенных итальянской группой ученых, отмечено общую 5-летнюю выживаемость у 40% пациентов с применением неоадъювантной химиотерапии, операции и адъювантной химиотерапии. Также группа американских исследователей утверждает (2005 г.), что при выявлении метастазов в легких у пациентов с остеосаркомой необходимо выполнение хирургического лечения легких с последующей адъювантной химиотерапией. По результатам данного исследования, общая 5-летняя выживаемость достигнута у 35% больных [9].
Анализ литературы о хирургическом удалении метастазов остеосаркомы в легких не оставляет сомнений о необходимости применения этого метода [1]. Многие авторы предоставляют данные о хирургии как о самостоятельном методе лечения отдаленных метатстазов остеосаркомы [7, 29, 35, 36]. Но все же, сопоставляя результаты современных исследований (таблица), можно утверждать, что только комбинация химиотерапии и радикальных хирургических методик позволяет добиться высокой продолжительности жизни у пациентов с метастатическим рецидивом остеосаркомы в легкие. Применение химиотерапии в лечении пациентов с метастазами с плохим патоморфозом (таблица), можно утверждать, что только комбинация химиотерапии и радикальных хирургических методик позволяет добиться высокой продолжительности жизни у пациентов с метастатическим рецидивом остеосаркомы в легкие. Применение химиотерапии в лечении пациентов с метастазами с плохим патоморфозом (
Таблица. Результаты лечения пациентов с метастазами остеосаркомы в легких согласно Cooperative Osteosarcoma Study (COSS)
| Количество пациентов, n | Все (n=576) | p | ||||||
| 2-летняя выживаемость, % | 5-летняя выживаемость, % | |||||||
| Общая | Безрецидивная | Общая | Безрецидивная | |||||
| Всего | 576 | 0,38 | 0,02 | 0,23 | 0,02 | |||
| Химиотерапия второй линии | ||||||||
| Проводилась | 381 | 0,41 | 0,03 | 0,25 | 0,02 | 0,089 | ||
| Не проводилась | 173 | 0,33 | 0,04 | 0,22 | 0,03 | |||
| Типы препаратов | ||||||||
| Препараты платины | 304 | 0,42 | 0,03 | 0,26 | 0,03 | |||
| Топотекан | 228 | 0,44 | 0,03 | 0,28 | 0,03 | |||
| Алкалоиды | 173 | 0,40 | 0,04 | 0,22 | 0,03 | |||
| Антрациклины | 69 | 0,34 | 0,06 | 0,20 | 0,05 | |||
| Метотрексат | 53 | 0,42 | 0,07 | 0,20 | 0,06 | |||
| Карбоплатин + этопозид | 205 | 0,42 | 0,04 | 0,27 | 0,03 | |||
| Лучевая терапия | ||||||||
| Использовалась | 58 | 0,14 | 0,05 | 0,05 | 0,03 | 0,0002 | ||
| Не использовалась | 501 | 0,41 | 0,02 | 0,26 | 0,02 | |||
Доказано, что чем короче период между окончанием лечения и выявлением рецидива опухоли, тем хуже прогноз отдаленных результатов [17]. Анализ данных 1700 пациентов с остеосаркомой в исследовании Cooperative Osteosarcoma Study (COSS) показал, что самый длительный период с окончания лечения до возникновения рецидива опухоли составил 14,3 года [25].
При изучении проблемы метастатической формы остеосаркомы наше внимание было нацелено на исследование факторов риска развития метастазов, применение схем системной полихимиотерапии второй линии, использование методов локального воздействия, изучение безрецидивной и общей выживаемости.
В ретроспективном анализе материалов Национального института рака отмечено: общая 5-летняя выживаемость пациентов с метастатическим поражением легких, которые проходили лечение с 1994 по 2002 г., составила 4%. Такие низкие показатели, вероятно, обусловлены отсутствием алгоритма лечения в данной группе больных, а также критериев отбора по факторам риска и показаниям к проведению радикального специального лечения. Как свидетельствуют данные ретроспективного анализа, в большинстве случаев (84%) при выявлении метастазов в легких пациент получал симптоматическое лечение.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
В период с 1998 по 2013 г. 240 пациентов с локализованной формой остеосаркомы конечностей различной локализации проходили курс комбинированного лечения согласно принятому стандарту лечения сарком костей в Национальном институте рака. Протокол включает: неоадъювантную химиотерапию препаратами цисплатин 120 мг/м², доксорубицин 60 мг/м², метотрексат 12 мг/м²; радикальное хирургическое удаление опухоли с реконструкцией сустава; адъювантную химиотерапию в зависимости от лечебного патоморфоза опухоли [20]: при хорошем ответе использовали те же препараты, но в монорежиме, при плохом — химиотерапию усиливали препаратами ифосфамид 9 мг/м², этопозид 150 мг/м² [2, 4, 5, 10, 13, 16, 30, 32].
В диагностическом долечебном алгоритме в данной группе пациентов обязательными методами являлись компьютерная томография (КТ) органов грудной полости и области первичного поражения, гистологическая верификация процесса.
После окончания химиотерапии все пациенты подлежат наблюдению, которое включает обязательное выполнение КТ органов грудной и брюшной полости, рентген-исследование первично пораженной области каждые 3 мес в течение первого года, каждые 6 мес — на протяжении второго года, в последующем — 1 раз в год.
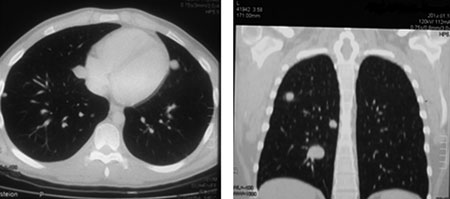
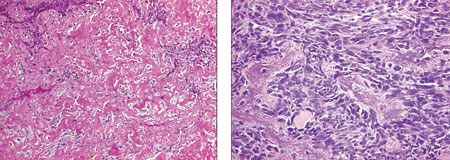
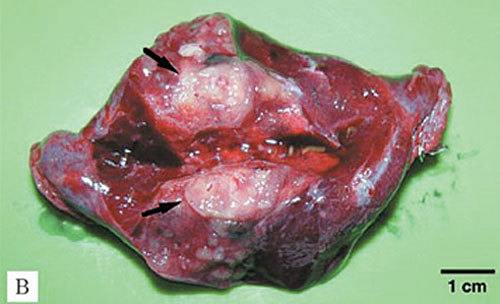
В процессе диспансерного наблюдения у 89 пациентов выявлены метастазы в легких. Медиана наблюдения от окончания лечения до появления метастазов составила 22 мес (6–38 мес). В 86 (96,6%) случаях выявлено двустороннее поражение легких, в 3 (3,4%) — одностороннее. Метастатическое поражение ткани легкого констатировали на основании рентгенологических данных — оценки результатов КТ органов грудной полости в динамике (рис. 1) с последующим сопоставлением с морфологическим анализом (рис. 2) материала удаленных узлов.
Все пациенты начинали лечение с неоадъювантной химиотерапии: карбоплатин 600 мг/м2 (по 300 мг/м2 — 2 дня), этопозид 300 мг/м2 (по 150 мг/м2 — 2 дня) — 1-й и 3-й блоки; ифосфамид 9 г/м2 (по 3 г/м2 — 3 дня), месна (4 г/м2 — 4 дня), этопозид 300 мг/м2 (по 150 мг/м2 — 2 дня) — 2-й блок с интервалом в 21 день [27]. После 3-го курса выполняли КТ-контроль с оценкой ответа на химиотерапию и принимали решение (совместно со специалистом торакальной онкохирургии) о возможности проведения хирургического лечения в объеме радикального удаления очагов опухолевого поражения легких. Схематическое изображение метода представлено на рис. 3.
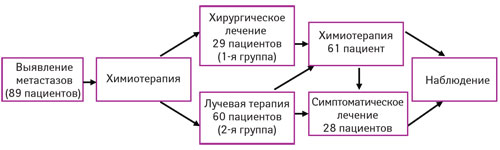
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
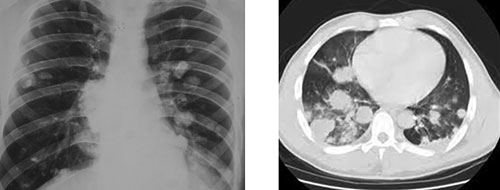
Из 240 пациентов, прошедших лечение в Национальном институте рака по поводу остеосарком конечностей в IIВ стадии, у 89 диагностированы метастазы в легких. Все больные получили 3 блока химиотерапии второй линии. Стабилизация процесса после химиотерапии, которая проявлялась остановившимся ростом уже выявленных узлов и отсутствием новых, достигнута у 61 больного (68,5%). В 28 (31,5%) случаях по результатам КТ легких зарегистрировано появление новых метастазов (рис. 4).
Первую группу исследуемых составили 29 пациентов, которым после 3 блоков химиотерапии выполнено радикальное удаление опухолевых узлов из легких (рис. 5). У 3 больных ранее выявлено одностороннее поражение легких и у 26 — метастатические узлы с двух сторон. При билатеральном поражении 3 пациентам выполнена одномоментная двухсторонняя резекция легких, остальным 23 — хирургическое лечение с интервалом 10–14 дней.
Во вторую группу вошли 60 больных, которые были признаны неоперабельными по одной из двух причин: из-за прогрессирования заболевания или невозможности удаления всех метастазов. В этой группе пациентов проведена паллиативная лучевая терапия на легкие в СОД 30 Гр.
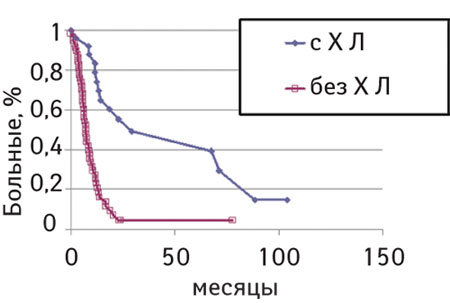
Общая 3-летняя выживаемость пациентов в обеих группах составила 12,3%, в группе с хирургическим лечением — 35,6%, без хирургического лечения — 1,6% (р
Установлена прямая зависимость выживаемости пациентов от количества метастатических узлов и продолжительности ремиссии до появления метастазов. В исследовании лишь 27% больных прожили 3 года с более чем двумя метастатическими узлами в легких, тогда как 3-летняя выживаемость среди пациентов, у которых диагностировано не более двух опухолевых узлов, составила 46%. Лица, рецидив у которых зафиксирован в период до 1 года после окончания лечения, продемонстрировали более низкую 3-летнюю выживаемость, которая составила 16%. У пациентов с периодом выявления метастазов >2 лет 3-летняя выживаемость достигла 41%.
ВЫВОДЫ
Появление рецидива остеосаркомы в виде отдаленных метастазов в легких после комбинированного лечения является показанием к проведению радикальной специальной терапии. Целесообразность назначения лечения у данной группы пациентов доказана продолжительностью жизни и большим процентом положительных ответов на примененную терапию. Большинство из получивших лечение переживают 3-летний рубеж. Данные, приведенные во многих мировых исследованиях, дают повод утверждать, что пациенты с метастатическим рецидивом остеосаркомы в легкие имеют высокий потенциал к полному излечению. В ходе исследования установлены факторы риска развития метастазирования. Доказано, что большая вероятность метастазирования существует у больных с плохим патоморфозом удаленной первичной опухоли кости, которые и составляют группу риска.
Эти данные необходимы для разработки новых методов и средств воздействия для использования в адъювантном лечении пациентов с саркомами костей скелета. Существует прямая зависимость выживаемости от количества диагностированных опухолевых узлов и длительности периода с момента окончания первичного лечения до появления рецидива. Появление более двух метастатических узлов в легких в первый год наблюдения является крайне неблагоприятными фактором отдаленных результатов.
Анализируя данные мировых исследований и учитывая собственный опыт, делаем вывод, что вышеобозначенная проблема требует более детального изучения, так как не существует единого мнения об эффективности проведения второй линии химиотерапии, первоочередности методов лечения (хирургического или химиотерапевтического). Успехом лечения больных с данной патологией все же является индивидуализация терапии, критерии которой на сегодня не разработаны. Все эти нерешенные вопросы наталкивают нас на проведение новых исследований с внедрением в практику новых подходов к лечению пациентов с остеосаркомой.
Несомненно, успех лечения и отдаленные результаты у пациентов с метастатическим рецидивом остеосаркомы в легкие зависят от радикальности удаления очагов в легких, но основным методом является все же комбинация химиотерапии второй линии с хирургическими методиками локального контроля. Наше исследование демонстрирует высокий показатель 3-летней выживаемости (35,6%) пациентов с метастатическим рецидивом остеосаркомы при успешном использовании комбинации методов специального лечения.
Список использованной литературы
1. Antunes M., Bernardo J., Salete M. (1999) Excision of pulmonary metastases of osteogenic sarcoma of the limb. Eur. J. Cardiothorac. Surg., 15: 592–6.
2. Bacci G., Picci P., Ferrari S. et al. (1993) Primary chemotherapy and delayed surgery for nonmetastatic osteosarcoma of the extremities. Results in 164 patients preoperatively treated with high doses of methotrexate followed by cisplatin and doxorubicin. Cancer, 72: 3227–38.
3. Bacci G., Ferrari S., Bertoni F. et al. (2000) Long-term outcome for patients with nonmetastatic osteosarcoma of the extremity treated at Istituto Ortopedico Rizzoli according to the IOR/ OS-2 protocol: an updated report. J. Clin. Oncol., 18: 4016–27.
4. Bacci G., Briccoli A., Ferrari S. et al. (2001) Neoadjuvant chemotherapy for osteosarcoma of the extremity: long-term results of the Rizzoli’s 4th protocol. Eur. J. Cancer, 37: 2030–9.
5. Bacci G., Ferrari S., Longhi A. et al. (2002) High-dose ifosfamide in combination with high-dose methotrexate, doxorubicin and cisplatin in the neoadjuvant treatment of extremity osteosarcoma: preliminary results of an Italian Sarcoma Group/Scandinavian Sarcoma Group pilot study. J. Chemother., 14: 198–206.
6. Briccoli A., Rocca M., Salone M. et al. (2005) Resection of recurrent pulmonary metastases in patients with osteosarcoma. Cancer, 104: 1721–1725.
7. Belli L., Scholl S., Livartowski A. et al. (1989) Resection of pulmonary metastases in osteosarcoma: A retrospective analysis of 44 patients. Cancer, 63: 2546–2550.
8. Kempf-Bielack B., Bielack S.S., Jürgens H. et al. (2005) Osteosarcoma relapse after combined modality therapy: an analysis of unselected patients in the Cooperative Osteosarcoma Study Group (COSS). JCO, 23 (3): 559–568.
9. Chou A.J., Merola P.R., Wexler L.H. et al. (2005) Treatment of osteosarcoma at first recurrence after contemporary therapy: the Memorial Sloan-Kettering experience. Cancer, 104: 2214–2221.
10. EURAMOS 1 Clinical trial protocol Version: 1.3. (2007) Deutsche Krebsstudienregister, 1.3: 23–26.
11. Fuchs N., Bielack S.S., Epler D. et al. (1998) Long-term results of the co-operative German-Austrian-Swiss osteosarcoma study group’s protocol COSS-86 of intensive multidrug chemotherapy and surgery for osteosarcoma of the limbs. Ann. Oncol., 9: 893–9.
12. Ferrari S., Briccoli A., Mercuri M. et al. (2003) Postrelapse survival in osteosarcoma of the extremities: Prognostic factors for long-term survival. J. Clin. Oncol., 21: 710–715.
13. Ferrari S., Mercuri M., Picci P. et al. (1999) Nonmetastatic osteosarcoma of the extremity: results of a neoadjuvant chemotherapy protocol (IOR/OS-3) with high-dose methotrexate, intraarterial or intravenous cisplatin, doxorubicin, and salvage chemotherapy based on histologic response. Tumori, 85: 458–64.
14. Goorin A.M., Schwartzentruber D.J., Devidas M. et al. (2003) Presurgical chemotherapy compared with immediate surgery and adjuvant chemotherapy for nonmetastatic osteosarcoma: Pediatric Oncology Group Study POG-8651. J. Clin. Oncol., 21: 1574–80.
15. Gorlick R., Anderson P., Andrulis I. et al. (2003) Biology of childhood osteogenic sarcoma and potential targets for therapeutic development: meeting summary. Clin. Cancer Res., 9 (15): 5442–5453.
16. Goorin A.M., Schwartzentruber D., Devidas M. et al. (2003) Presurgical chemotherapy compared with immediate surgery and adjuvant chemotherapy for non_metastatic osteosarcoma: Pediatric oncology group POG 8651. J. Clin. Oncol., 21(8): 1574–1580.
17. Bacci G., Briccoli A., Longhi A. et al. (2005) Treatment and outcome of recurrent osteosarcoma: Experience at Rizzoli in 235 patients initially treated with neoadjuvant chemotherapy Acta Oncologica, 44 (23): 748–755.
18. Hawkins D.S., Arndt C.A. (2003) Pattern of disease recurrence and prognostic factors in patients with osteosarcoma treated with contemporary chemotherapy. Cancer, 98: 2447–56.
19. Hanahan D., Weinberg R.A. (2000) The hallmarks of cancer. Cell, 100(1): 57–70.
20. Huvos A.G. (1991) Osteogenic sarcoma: pathologic assessment of preoperative (neoadjuvant) chemotherapy. In Bone Tumors: Diagnosis, Treatment, and Prognosis. Philadelphia: W.B. Saunders,
122–128.
21. Krishnan K., Khanna C., Helman L.J. (2005) The biology of metastases in pediatric sarcomas. Cancer J., 11(4): 306–313.
22. Krishnan K., Khanna C., Helman L.J. (2005) The biology of metastases in pediatric sarcomas. Cancer J., 11(4): 306–313.
23. Krishnan K., Khanna C., Helman L.J. (2005) The biology of metastases in pediatric sarcomas. Cancer J., 11(4): 306–313.
24. Kashima T., Nakamura K., Kawaguchi J. et al. (2003) Overexpression of cadherins suppresses pulmonary metastasis of osteosarcoma in vivo. Int. J. Cancer, 104(2): 147–154.
25. Lau T.W., Wong J.W.K., Chien E.P. et al. (2004) Local recurrence of parosteal osteosarcoma adjacent to prosthesis after 20 years: a case report. J. Orthop. Surg., 12(2): 263–266.
26. Martini N., Huvos A.G., Mike V. et al. (1971) Multiple pulmonary resection for metastatic osteogenic sarcoma. J. Bone Joint Surg. (Am), 12: 271–80.
27. Meyer W.H., Pratt C.B., Poquette C.A. et al. (2001) Carboplatin/ifosfamide window therapy for osteosarcoma: results of the St Jude Children’s Research Hospital OS-91 trial. J.Clin. Oncol., 19(1): 171–82.
28. Nyberg K.A., Michelson R.J., Putnam C.W. et al. (2002) Toward maintaining the genome: DNA damage and replication checkpoints. Ann. Rev. Genet., 36: 617–656.
29. Putnam J.B. Jr., Roth J.A., Wesley M.N. et al. (1983) Survival following aggressive resection of pulmonary metastases from osteogenic sarcoma — Analysis of prognostic factors. Ann. Thorac. Surg., 36: 516–523.
30. Picci P., Ruggieri P., Mercuri M. et al. (1990) Primary chemotherapy and delayed surgery (neoadjuvant chemotherapy) for osteosarcoma of the extremities. The Istituto Rizzoli experience in 127 patients treated peroperatively with intravenous methotrexate (high versus moderate doses) and intraarterial cisplatin. Cancer, 65: 2539–53.
31. Posthuma De Boer J., Witlox M.A., Kaspers G.J.L. (2011) Molecular alterations as target for therapy in metastatic osteosarcoma: a review of literature. Clin. Exp. Metastasis, 28(5): 493–503.
32. Rosen G., Caparros B., Huvos A.G. et al. (1982) Preoperative chemotherapy for osteogenic sarcoma: selection of postoperative adjuvant chemotherapy based on the response of the primary tumor to preoperative chemotherapy. Cancer, 49: 1221–1230.
33. Smeland S., Muller C. Alvegard T. et al. (2003) Scandinavian Sarcoma Group Osteosarcoma Study SSG VIII: prognostic factors for outcome and the role of replacement salvage chemotherapy for poor histological responders. Eur. J. Cancer, 39: 488–94.
34. Saeter G., Hoie J., Stenwig A.E. et al. (1995) Systemic relapse of patients with osteogenic sarcoma: Prognostic factors for long term survival. Cancer, 75: 1084–1093.
35. Spanos P.K., Payne W.S., Ivins J.C. et al. (1976) Pulmonary resection for metastatic osteogenic sarcoma. J. Bone Joint Surg. Am., 58: 624–628.
36. Schaller R.T. Jr., Haas J., Schaller J. et al. (1982) Improved survival in children with osteosarcoma following resection of pulmonary metastases. J. Pediatr. Surg., 17: 546–550.
37. Steeg P.S. (2006) Tumor metastasis: mechanistic insights and clinical challenges. Nat. Med., 12(8): 895–904.
38. Tabone M.D., Kalifa C., Rodary C. et al. (1994) Osteosarcoma recurrences in pediatric patients previously treated with intensive chemotherapy. J. Clin. Oncol., 12: 2614–20.
39. Ward W.G., Mikaelian K., Dorey F. et al. (1994) Pulmonary metastases of stage IIB extremity osteosarcoma and subsequent pulmonary metastases. J. Clin. Oncol., 12(9): 1849–58.
40. Worth L.L., Lafleur E.A., Jia S.F. et al. (2002) Fas expression inversely correlates with metastatic potential in osteosarcoma cells. Oncol. Rep., 9(4): 823–827.














Leave a comment