Експресія bcl-2 і p53 у клітинах нейробластомних пухлин із різним вмістом нуклеїнових кислот
Грабовий О.М., Зарецький М.Б., Перепьолкіна І.В., Василишин О.І.
Резюме. Вища частота експресії bcl-2 та р53 в нейробластомах (НБ) порівняно з гангліонейробластомами (ГНБ) збігається із загальним ступенем анаплазії цих типів пухлин. Але при зіставленні поліплоїдних ГНБ і НБ виявляють значну схожість профілів експресії bcl-2 і р53 серед їх клітин. Відповідно, відмінності між ГНБ і НБ зумовлені перш за все властивостями НБ, які визначаються як диплоїдні. Відсутність чітких кореляційних зв’язків між кількістю ДНК та експресією bcl-2 чи р53 серед клітин нейробластомних пухлин є підставою вважати ці ознаки незалежними один від одного прогностичними критеріями, зумовленими різними патогенетичними механізмами онкогенезу.

Вступ
Нейробластомні пухлини є специфічними новоутвореннями дитячого віку та характеризуються низкою унікальних властивостей і неоднозначним клінічним перебігом. Нейробластома (НБ) досить часто може бути вельми агресивною, з раннім метастазуванням у кістковий мозок і лімфатичні вузли [5], іноді доброякісною та спонтанно регресувати [25]. Особливо слід відзначити випадки, коли у пацієнтів зі сприятливим прогнозом НБ раптово перетворюється на агресивну, дає ранні рецидиви та віддалені метастази [17].
Таким чином, визначення ознак, що вказують на можливий характер перебігу хвороби, може стати приводом до проведення агресивної терапії, навіть якщо вона не виправдана початковим сприятливим прогнозом, що дозволить оптимізувати виживаність [13].
Нині широкого визнання набула думка, що за рівнями експресії маркерів, пов’язаних із регуляцією апоптозу, таких як bcl-2 і p53, можна пояснити агресивну поведінку пухлин, резистентність до терапії. Відповідно, ці маркери мають прогностичне значення у хворих на НБ [6, 7, 9, 10, 12, 15, 18, 24].
Плоїдність клітин нейробластомних пухлин є визнаним фактором прогнозу, який знайшов своє відображення у системі стадіювання INRG [14, 20], хоча як монофактор має обмежене значення [1, 4].
Логічно припустити, що зміни інтенсивності явищ апоптозу, у тому числі зумовлені bcl-2 і p53, можуть призводити до змін клітинного складу нейробластомних пухлин за вмістом ДНК у ядрах пухлинних клітин — змінювати співвідношення між ди- та поліплоїдними клітинами. У зв’язку з цим комплексна оцінка таких прогностичних чинників, як плоїдність, експресія bcl-2 і p53 може підвищити достовірність прогнозу в окремого пацієнта та стати керівництвом до персоніфікації лікувального підходу [1, 8, 13, 18, 21, 22, 23].
Мета роботи — визначити особливості експресії bcl-2 і p53 серед клітин нейробластомних пухлин із різним вмістом нуклеїнових кислот у ядрах.
Об’єкт і методи дослідження
Дослідження проведено на матеріалі біопсій або вилученому при оперативному втручанні у 36 пацієнтів із нейробластомними пухлинами: гангліонейробластомами (ГНБ) — 11, нейробластомами (НБ — власне нейробластома) — 25. Гістологічне типування новоутворень проведено з використанням рутинного (забарвлення гематоксиліном і еозином) та імуногістохімічного дослідження.
Отриманий матеріал фіксували в забуференому 10% формаліні з pH7,4 та ущільнювали у парафіні із застосуванням гістіопроцесора Histos-5 («Milestone», Італія). З парафінових блоків виготовляли гістологічні зрізи товщиною 5 мкм за допомогою мікротома Microm НМ325 («Thermo Scientific», Німеччина). Зрізи забарвлювали гематоксиліном і еозином та азур ІІ-еозином для загальної оцінки пухлини, галоціанін-хромовим галуном за Ейнарсоном (pH1,62, 37 °С, 24 год) для виявлення вмісту нуклеїнових кислот у клітинах [2, 3]. Для кожного випадку частину зрізів обробляли РНКазою («MACHEREY-NAGEL GmbH & Co. KG», Німеччина) для екстракції РНК [2]. Імуногістохімічну реакцію проводили з моноклональним мишачим антитілом проти bcl-2 онкопротеїну людини («Dako», Данія) та з моноклональним мишачим антитілом проти р53 протеїну («Dako», Данія) відповідно до протоколу виробника з використанням системи детекції EnVisionTM FLEX («Dako», Данія). Зрізи дофарбовували гематоксиліном Gill. Для позитивного контролю використовували тканинні зразки з визначеною позитивною реактивністю, для негативного — проводили процедуру без застосування первинних антитіл.
Отримані препарати вивчали та фотографували за допомогою мікроскопа Nikon Eclipse 80i з камерою DS-5SMc/L2 за стандартизованих умов, а зображення (збільшення мікроскопа ×400, 1280×960 пікселів RGB) обробляли із застосуванням системи аналізу ImageJ 1,46. На зображеннях із препаратів, забарвлених галоціанін-хромовим галуном, у 60 клітинах кожної пухлини визначали площу перетину ядра клітини (Narea), інтегративну оптичну щільність ядра клітини (NIntDen) та вміст у ньому сумарної кількості нуклеїнових кислот і ДНК.
Кількість РНК обчислювали як різницю між кількістю нуклеїнових кислот і ДНК. Для визначення вмісту нуклеїнових кислот у ядрах пухлинних клітин за одиницю брали їх вміст у ядрах лімфоцитів. Клітини кожної пухлини ранжирували за вмістом ДНК в ядрі. Отриману послідовність поділяли на ранги з кроком, що дорівнював середньому вмісту ДНК у ядрах лімфоцитів: Р1 — до 1, Р2 — 1–2, Р3 — 2–3 і т. д. Враховуючи те, що клітини з рангом Р5 і далі становили0,05, їх зведено в один ранг Р6+. Для кожного рангу визначали середні розміри ядра [1].
Клітини кожної пухлини при забарвленні для визначення сумарного вмісту нуклеїнових кислот і при виявленні експресії bcl-2 і p53 ранжировано за розмірами ядра відповідно до параметрів, встановлених на препаратах, в яких виявляли ДНК. У межах кожного рангу визначали абсолютну кількість клітин, середні значення Narea, NIntDen, ДНК, нуклеїнових кислот і відсоток клітин, ядра яких експресують bcl-2 чи p53. За середнім вмістом ДНК у ядрах клітини пухлин поділено на три підгрупи: D — середній вміст ДНК у ядрах —2,5. Отримані цифрові дані обробляли за допомогою стандартних статистичних методів.
Результати та їх обговорення
Результати проведених досліджень показали, що середній вміст ДНК у ядрах клітин нейробластомних пухлин у міру підвищення ступеня неопластичної трансформації достовірно зменшується та становить: у гангліоневромах (ГН) 4,68±0,21, ГНБ — 3,07±0,02 і НБ — 2,16±0,03 [1]. При цьому усі ГНБ, що були досліджені в цій роботі, за вмістом ДНК у ядрах належать до групи Т+, а НБ за цим показником розподіляються таким чином: D — 2 (8,3%), D+ — 14 (58,3%) і T+ — 8 (33,3%).
Оцінка експресії bcl-2 у ГНБ і НБ у цілому продемонструвала, що цей маркер наявний в усіх досліджених нами пухлинах, а кількість мічених пухлинних клітин коливається від 28,7 до 100%. Середнє значення останнього показника достовірно більше в НБ (79,6±0,63%), порівняно з ГНБ (69,6±1,42%) (рис. 1), а діапазон його коливань становить відповідно 49,7–98,2% та 28,7–100%. Експресія р53 виявлена в 4 з 11 ГНБ (36,4%) та у 19 з 24 НБ (79,2%). Відповідно, середня кількість мічених клітин у пухлинах, в яких вона визначалася, становила у ГНБ — 13,94±0,83%, у НБ — 21,4±0,74% (див. рис. 1).
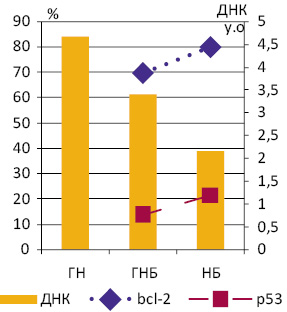
При порівнянні частоти експресії bcl-2 серед клітин ГНБ і НБ, а також груп НБ з різним середнім вмістом ДНК у ядрах пухлинних клітин і між різними їх рангами (Рх) достовірних відмінностей не виявило. У більшості випадків вона становила 70–80% (рис. 2). Рівень кореляції між вмістом ДНК і частотою експресії bcl-2 в окремих пухлинах коливався у межах від 0,2 до −0,2.
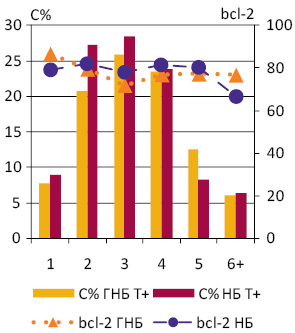
Досліджені НБ різних за вмістом ДНК груп розподілилися за ознакою експресії р53+/р53−: НБ D — 2/0, НБ D+ — 11/3 та Т+ — 6/3. Експресію р53 у ГНБ (Т+) виявляють серед клітин різних рангів в основному в 15–20%, що не становить достовірної різниці (рис. 3). Існує статистично достовірна відмінність між відсотками клітини, які експресують р53, у НБ D+ і НБ Т+ (t=6,4, p0,05). Найбільшу середню частку р53 мічених клітин має НБ D+ (28,3±1,1) із виразною тенденцією до підвищення у рангах Р3–Р4.
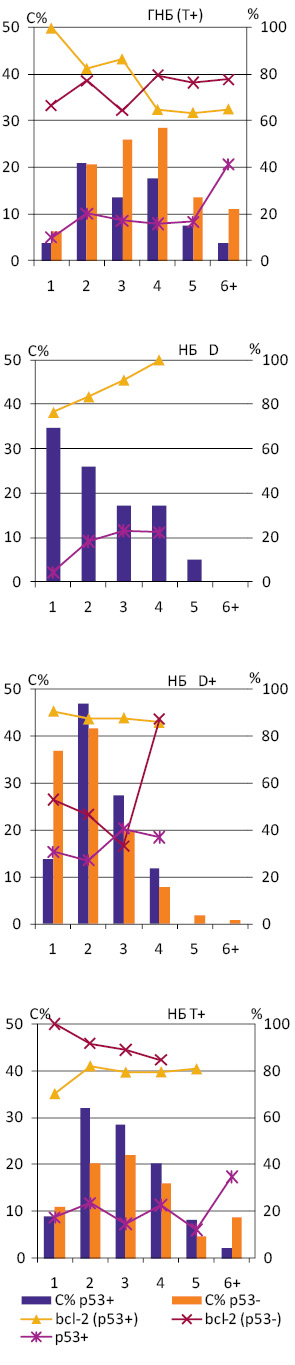
При зіставленні часток bcl-2 позитивних клітин у нейробластомних пухлинах, в яких наявна або відсутня експресія р53, видно певні відмінності. Так, у ГНБ р53+ простежується тенденція до зниження відсотка bcl-2 мічених клітин у міру збільшення вмісту ДНК у їх ядрах. У ГН р53+ різних за вмістом ДНК груп частота експресії bcl-2, що становить в основному 80–90%, не демонструє відмінностей, які можуть бути розцінені як значущі (рис. 3). Серед досліджених ГН р53− відзначають суттєву різницю у відсотках bcl-2-позитивних клітин, яких у групі ГН D+ вдвічі менше, ніж у ГН Т+.
За результатами проведених досліджень не виявлено зв’язку між вмістом РНК у ядрах клітин нейробластомних пухлин [1] та експресією bcl-2 або р53.
Таким чином, представлені дослідження продемонстрували, що нейробластомні пухлини характеризуються виразною гетерогенністю при їх оцінці тільки за такими трьома показниками, як вміст ДНК у ядрі, експресія bcl-2 та р53. Це є достатнім приводом для виділення декількох груп серед НБ і ГНБ (див. рис. 3). У свою чергу, фенотипічна різноманітність клітинного складу нейробластомних пухлин за досліджуваними ознаками дозволяє припустити неоднакову відповідь різних морфофункціональних типів пухлинних клітин (клонів) на терапію, яка має інтегруватися у відповідь пухлини у цілому [19, 23] та, відповідно, позначатися на результатах лікування.
Вища частота експресії bcl-2 та р53 серед клітин НБ порівняно з ГНБ збігається із загальним ступенем анаплазії цих типів пухлин. Але при зіставленні ГНБ Т+ і НБ Т+, які можуть бути визначені як поліплоїдні пухлини, виявляють значну схожість профілів експресії bcl-2 і р53 серед їх клітин (див. рис. 3). Відповідно, відмінності між ГНБ і НБ, виявлені в нашому дослідженні, зумовлені перш за все властивостями НБ D і НБ D+, які можуть бути визначені як диплоїдні.
Відсутність чітких кореляційних зв’язків між кількістю ДНК та експресією bcl-2 чи р53 серед клітин нейробластомних пухлин вказує на різні патогенетичні механізми [11, 16], які зумовлюють прояви цих ознак у пухлинних клітинах та непрямо свідчать про поліклональність пухлин. Виходячи з цього, експресію bcl-2 і р53 можна визначати як незалежний від вмісту ДНК у ядрах пухлинних клітин фактор прогнозу у хворих на НБ, пов’язаний з агресивністю пухлин, резистентністю їх до терапії [7, 10, 12, 15, 18].
Висновки
Нейробластомні пухлини та їх клітинний склад характеризуються виразною гетерогенністю за вмістом ДНК у ядрах пухлинних клітин, експресією ними bcl-2 та р53. Оцінка клітинного складу нейробластомних пухлин може бути підставою для прогнозу не тільки відповіді пухлини на терапію в цілому, а й вірогідності формування за цих умов резидуальних елементів, представлених певним морфофункціональним типом передіснуючих клітин пухлини.
Вища частота експресії bcl-2 та р53 в НБ порівняно з ГНБ збігається із загальним ступенем анаплазії цих типів пухлин. Але при зіставленні поліплоїдних ГНБ і НБ виявляють значну схожість профілів експресії bcl-2 і р53 серед їх клітин. Відповідно, відмінності між ГНБ і НБ зумовлені перш за все властивостями НБ, які визначаються як диплоїдні.
Відсутність чітких кореляційних зв’язків між кількістю ДНК та експресією bcl-2 чи р53 серед клітин нейробластомних пухлин є підставою вважати ці ознаки незалежними один від одного прогностичними критеріями, зумовленими різними патогенетичними механізмами онкогенезу.
Список використаної літератури
1. Грабовий О.М. Зарецький М.Б., Василишин О.І. (2013) Вміст нуклеїнових кислот у ядрах клітин нейробластом різного ступеня диференціювання. Клин. онкол., 2(10): 148–151.
2. Лупа Х. (1980). Основы гистохимии (Пер. с немец.) Мир, Москва, 344 с.
3. Ташке К. (1980) Введение в количественную цитогистологическую морфологию. (Пер. с рум.). Изд-во Акад. Соц. Респ. Румынии, 192 с.
4. Bagatell R., Beck-Popovich M., London W.B. et al. (2009) Significance of MYCN amplification in international neuroblastoma staging system stage 1 and 2 neuroblastoma: a report from the International Neuroblastoma Risk Group database. J. Clin. Oncol., 27(3): 365–370.
5. Brodeur G.M. (2003) Neuroblastoma: Biological insights into a clinical enigma. Nature Rev. Cancer, 3: 203–216.
6. Carr-Wilkinson J., O’Toole K., Wood K.M. et al. (2010) High Frequency of p53/MDM2/p14ARF Pathway Abnormalities in Relapsed Neuroblastoma. Clinical Cancer Research, 16: 1108–1118.
7. Cattelani S., Ferrari-Amorotti G., Galavotti S. et al. (2012) The p53 codon 72 Pro/Pro genotype identifies poor-prognosis neuroblastoma patients: correlation with reduced apoptosis and enhanced senescence by the p53-72P isoform. Neoplasia, 14(7): 634–643.
8. Carvalho Ade C., Parra E.R., Zerbini M.C. et al. (2007) Morphometric evaluation of NB84, synaptophysin and AgNOR is useful for the histological diagnosis and prognosis in peripheral neuroblastic tumors (pNTs). Clinics (São Paulo), 62(6): 731–740.
9. Chen L., Malcolm A.J., Wood K.M. et al. (2007) p53 is Nuclear and Functional in Both Undifferentiated and Differentiated Neuroblastoma. Cell Cycle, 6(21): 2685–2696.
10. Chengyuan Xue, Haber M., Flemming C. et al. (2007) p53 Determines Multidrug Sensitivity of Childhood Neuroblastoma. Cancer Res., 67(21): 10351–10360.
11. Davoli T., de Lange T. (2011) The Causes and Consequences of Polyploidy in Normal Development and Cancer. Ann. Rev. Cell Dev. Biol., 27: 585–610.
12. DeBartolo J., Dutta S., Reich L., Keating A.E. (2012) Predictive Bcl-2 family binding models rooted in experiment or structure. J. Mol. Biol., 422(1): 124–144.
13. de Noronha L., de Barros Araújo D.G.; do Carmo Gozzo P. et. al. (2013) Immunoexpression of cell cycle biomarkers in neuroblastoma samples and its correlation with prognostic factors J. Bras. Patol. Med. Lab., 49(1): 57–63.
14. George R.E., London W.B., Cohn S.L. et al. (2005) Hyperdiploidy plus nonamplified MYCN confers a favorable prognosis in children 12 to 18 months old with disseminated neuroblastoma: a pediatric oncology group study. J. Clin. Oncol., 23(27): 6466–6473.
15. Fulda S. (2009) Apoptosis pathways and neuroblastoma therapy. Curr. Pharm., (4): 430–5.
16. Holland A.J., Cleveland D.W. (2012) Losing balance: the origin and impact of aneuploidy in cancer. EMBO, 13(6): 501–514.
17. Kushner B.H., Cheungk N.V. (2005) Neuroblastoma — from genetic profiles to clinical challenge. N. Engl. J. Med., 353(21): 2215–2217.
18. Li Y., Nakagawara A. (2013) Apoptotic Cell Death in Neuroblastoma. Cells, 2: 432–459.
19. Cheung N.-K.V., Dyer M.A. (2013) Neuroblastoma: developmental biology, cancer genomics and immunotherapy. Nature reviews. Cancer, 13: 397–411.
20. Schneiderman J., London W.B., Brodeur G.M. et al. (2008) Clinical significance of MYCN amplification and ploidy in favorable-stage neuroblastoma: a report from the Children’s Oncology Group. J. Clin. Oncol., 26(6): 913–918.
21. Shi Y., Takenobu H., Kurata K. et al. (2010) HDM2 impairs Noxa transcription and affects apoptotic cell death in a p53/p73-dependent manner in neuroblastoma. Eur. J. Cancer, 46(12): 2324–2334.
22. Shimada H., Nakagawa A. (2006) Pathology of the Peripheral Neuroblastic Tumors. Laboratory Medicine, 37 (11): 684–689.
23. Speleman F., De Preter K., Vandesompele J. (2011) Neuroblastoma genetics and phenotype: a tale of heterogeneity. Semin. Cancer Biol., 21(4): 238–244.
24. Tweddle D.A., Pearson A.D., Haber M. et al. (2003) The p53 pathway and its inactivation in neuroblastoma. Cancer Letters, 197: 93–98.
25. Yamamoto K., Hanada R., Kikuchi A. et al. (1998) Spontaneous regression of localized neuroblastoma detected by mass screening. J. Clin. Oncol., 16: 1265–1269.
Экспрессия bcl-2 и p53 в клетках нейробластомных опухолей с различным содержанием нуклеиновых кислот
Резюме. Более высокая частота экспрессии bcl-2 и р53 в нейробластомах (НБ) по сравнению с ганглионейробластомами (ГНБ) совпадает с общей степенью анаплазии этих типов опухолей. Однако при сопоставлении полиплоидных ГНБ и НБ выявляют значительное сходство профилей экспрессии bcl-2 и р53 среди их клеток. Соответственно, отличие между ГНБ и НБ обусловлены, прежде всего, свойствами НБ, которые определяются как диплоидные. Отсутствие четких корреляционных связей между количеством ДНК и экспрессией bcl-2 или р53 среди клеток нейробластомных опухолей дает основание считать эти признаки независимыми друг от друга прогностическими критериями, обусловленными разными патогенетическими механизмами онкогенеза.
нейробластомные опухоли, bcl-2, p53, нуклеиновые кислоты.














Leave a comment