Імуно-опосередковані механізми антиметастатичної дії карциномаспецифічного фактора переносу в умовах росту експериментальних пухлин у мишей С57BL/6
Фільчаков Ф.В., Льон Г.Д., Шуміліна К.С., Кукушкіна С.М., Гриневич Ю.А.
Резюме. Представлені експериментальні дані свідчать про перспективність методу профілактики метастазів шляхом активного формування протипухлинного імунного захисту організму за допомогою фактора переносу (ФП), специфічного до клітин конкретної пухлини. Ад’ювантна імунотерапія карциномаспецифічним ФП запобігає метастазуванню карциноми легені Льюїс у 50% мишей лінії С57BL/6 та пригнічує ріст уже розвинених метастазів у 75% випадків (при ад’ювантному застосуванні неспецифічного ФП — 22 та 29% відповідно). Застосування карциномаспецифічного ФП у мишей С57BL/6 після видалення меланоми В16 попереджує метастазування лише у 11% тварин, а у інших — затримує ріст легеневих метастазів на 70% (при ад’ювантному застосуванні неспецифічного ФП — 14 та 56% відповідно), що свідчить на користь відповідності карциномаспецифічного ФП антигенному профілю карциноми легені Льюїс. Встановлено, що пухлиноспецифічний ФП здатний переносити реципієнту імунореактивність на антигени цієї пухлини, ініціювати за короткий час розвиток продуктивної імунної відповіді організму на пухлинний ріст та запобігати або гальмувати дисемінацію пухлинного процесу, що є підґрунтям для подальшої розробки цього напрямку біотерапії хворих зі злоякісними новоутвореннями з метою підвищення ефективності основних методів їх лікування.

Вступ
Незважаючи на удосконалення основних методів лікування хворих зі злоякісними новоутвореннями, результати терапії є незадовільними. Смертність від злоякісних новоутворень досі залишається на високому рівні практично в усіх країнах світу. В Україні 5-річна виживаність хворих не перевищує 50% [1]. Головною проблемою в лікуванні пацієнтів із солідними злоякісними новоутвореннями залишається метастазування, що спричиняє смерть у більш ніж 90% випадків [2]. Відомо, що на момент встановлення діагнозу в 60–70% хворих вже є метастази [3]. Після хірургічного видалення первинної пухлини за відсутності ознак її розповсюдження в 15–33% випадків у подальшому розвиваються метастази. Іноді це відбувається через тривалий проміжок часу після радикального хірургічного лікування [4].
У зв’язку з цим актуальним є пошук методів терапії, спрямованих на профілактику метастазування. Застосування ад’ювантної системної цитостатичної терапії у більшості випадків сприяє зменшенню кількості пухлинних клітин, які знищуються клітинами та факторами імунного захисту організму [5]. Роль імунної системи у протипухлинному захисті підтверджується підвищеним ризиком виникнення пухлини на тлі імуносупресії, випадками спонтанної регресії пухлини у пацієнтів з підтвердженим діагнозом та її регресією на тлі імунотерапії [6, 7]. Отже, імунні реакції можуть запобігати або принаймні гальмувати ріст пухлини та її метастазування. Водночас існують механізми, які перешкоджають розвитку протипухлинної імунної відповіді організму, а в деяких випадках імунна система може сприяти прогресуванню захворювання. Це пов’язують з механізмами хронічного запалення та гіпоксії, реалізація яких порушує баланс імунного гомеостазу і створює підґрунтя для метастазування пухлини [8]. У таких умовах цілеспрямована корекція та/або профілактика порушень в імунній системі за допомогою імунотерапії може стати важливою складовою лікування.
У цьому аспекті вивчаються можливості методів імунотерапії, спрямованих на формування пухлиноспецифічної імунної відповіді організму [9]. Перенесення протипухлинного імунітету за допомогою фактора переносу (ФП), отриманого із сенсибілізованих до пухлинних антигенів лімфоцитів, може створити адекватні умови в організмі пацієнта для реалізації всього потенціалу імунного захисту [10]. З цією метою застосовуються препарати ФП, діючою складовою якого є трансферфакторні поліпептиди Т-клітинного походження з малою молекулярною масою (3–12 кДа), що здатні переносити клітинно-опосередковану імунну реакцію на антиген [11]. Перенос антигенспецифічної імунореактивності за допомогою ФП не рестриктований молекулами головного комплексу гістосумісності, отже цей підхід можна застосовувати як в ало-, так і ксеногенній системах [12].
У більшості випадків в імунотерапії хворих онкологічного профілю застосовують препарати ФП, отримані з лейкоцитарної маси практично здорових людей [11]. Такі препарати мають здатність підвищувати деякі показники клітинної ланки імунної системи, проте вони не володіють достатньою пухлиноспецифічною активністю [13]. Навпаки, ФП певної специфічності здатний індукувати у реципієнта формування клітинно-опосередкованих імунних реакцій на пухлинні антигени, результатом чого є гальмування процесу метастазування та підвищення виживаності хворих [14].
На нашу думку, активне формування протипухлинного імунного захисту організму за допомогою пухлиноспецифічного ФП для профілактики метастазування солідних злоякісних новоутворень є перспективним напрямком біотерапії. Представлена робота присвячена визначенню антиметастатичної дії карциномаспецифічного ФП в умовах експериментальної моделі росту карциноми легені Льюїс (КЛЛ) та меланоми В16 у мишей лінії С57BL/6.
Об’єкт і методи дослідження
Експерименти проведено на 20 нелінійних щурах-самцях масою тіла 100–120 г з віварію Національного інституту раку та 110 мишах лінії C57BL/6 масою 18–20 г, отриманих з віварію Інституту фізіології ім. О.О. Богомольця НАН України. Утримання тварин і робота з ними здійснювалися відповідно до загальноприйнятих міжнародних правил проведення досліджень на експериментальних тваринах. Дослідження було схвалено Комісією з питань етики Національного інституту раку.
Ксеногенний карциномаспецифічний ФП був отриманий із пула лімфоцитів селезінки 10 щурів на 14-ту добу після внутрішньоочеревинної імунізації живими клітинами мишачої пухлини — КЛЛ [15]. Неспецифічний ФП отримували в такий самий спосіб з пула лімфоцитів селезінки 10 інтактних щурів.
Антиметастатичну дію ФП визначали на моделі підшкірного росту КЛЛ та меланоми В16 у мишей лінії С57BL/6. Для цього клітини КЛЛ або меланоми В16 (5×105) перещеплювали під шкіру стопи задньої лапи миші. Як донора КЛЛ або меланоми В16 використовували мишей С57BL/6 на 14-ту добу росту підшкірної пухлини. На 24-ту добу після щеплення у всіх тварин під наркозом (тіопентал натрію («Київмедпрепарат», Україна) в дозі 60 мкг, підшкірно) видаляли первинну пухлину шляхом відсікання дистального відрізку ураженої кінцівки з попереднім накладанням лігатури. У подальшому тваринам дослідних груп проводили імунотерапію карциномаспецифічним або неспецифічним ФП (внутрішньоочеревинно в дозі 200 пг в об’ємі 0,2 side effects when using viagra мл 0,9% розчину NaCl, починаючи з 2-ї доби після операції і потім кожні 7 діб, всього 3 ін’єкції); тваринам контрольної групи вводили у ті самі строки 0,2 мл фізіологічного розчину. Антиметастатичний ефект оцінювали на 44-ту та 49-ту добу відповідно після щеплення КЛЛ або меланоми В16 за такими показниками:
- частота метастазування (%);
- кількість метастазів;
- кількість метастазів в аваскулярній фазі росту (d≤0,5 мм);
- об’єм метастазів (V, мм) за формулою:
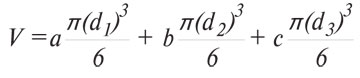 ,
,
де a, b, c — кількість метастазів відповідного діаметру; d1, d2, d3 — діаметр метастазів (мм);
- індекс пригнічення метастазування (ІПМ, %) за формулою:
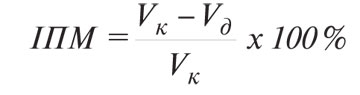 ,
,
де Vк та Vд — середній об’єм метастазів у мишей контрольної та дослідної груп відповідно.
Дослідження імунотропних властивостей карциномаспецифічного ФП проводили на 1-шу, 3-тю та 7-му добу після одноразового внутрішньоочеревинного введення в дозі 100 пг мишам лінії order generic viagra С57BL/6 у тестах пригнічення адгезії макрофагів (ПАМ-тест), проліферативному та цитотоксичному в присутності клітин КЛЛ.
Формування клітинно-опосередкованої імунної відповіді визначали за допомогою спектрофотометричного варіанта ПАМ-тесту [16], використовуючи макрофаги перитонеального ексудату (МФПЕ) та клітини КЛЛ у співвідношенні 50:1. Результати визначали на плашковому фотометрі Uniscan-ІІ («Labsystems», Фінляндія) та оцінювали за зміною індексу адгезії (ІА, %):
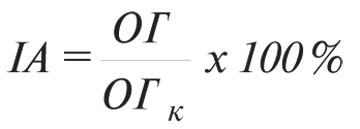 ,
,
де ОГ — оптична густина дослідної лунки (МФПЕ, адгезовані в присутності тест-антигену); ОГк — оптична густина контрольної лунки (спонтанно адгезовані МФПЕ). За достовірний вважали ІА ≤80%.
Проліферативну відповідь лімфоцитів селезінки у змішаній культурі in vitro з клітинами КЛЛ (у співвідношенні 20:1) оцінювали за допомогою цитофлуориметричного методу [17]. Проліферативний індекс (ПІ, %) розраховували за формулою:
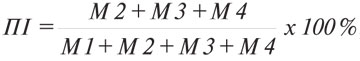
де М1 — кількість клітин у стані спокою (%); М2–М4 — кількість клітин, що проліферують (%).
Цитотоксичну активність лімфоцитів селезінки проти клітин КЛЛ (у співвідношенні 50:1) визначали цитофлуориметричним методом [17]. Аналіз зразків проводили на проточному цитофлуориметрі FACScan («Becton Dickinson», США) за допомогою програми «Cell Quest». Цитотоксичний індекс (ЦІ, %) обчислювали за формулою:
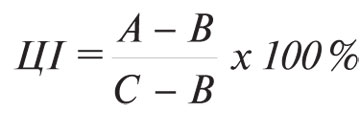
де А — кількість мертвих клітин-мішеней в досліді; В — кількість мертвих клітин-мішеней у контролі; С — загальна кількість клітин-мішеней.
У кожній групі — по 10 тварин.
Статистичну обробку результатів проводили з використанням програм Excel (MS Office 2003, XP) та STATІSTІCA 6,0 (StatSoft Inc., США). Результати дослідження були перевірені на нормальність розподілу за допомогою критерію Шапіро — Уїлка. Для визначення вірогідності розбіжностей (р) між показниками у досліджуваних групах при нормальному розподілі значень застосовували t-критерій Стьюдента, для значень, розподіл яких відрізнявся від нормального, використовували непараметричний критерій Манна — Уїтні [18]. Результати дослідження представлені як M±m, де M — середнє арифметичне значення, m — його стандартна похибка. Розбіжності оцінювали як вірогідні при р<0,05.
Результати та їх обговорення
Для визначення антиметастатичної дії карциномаспецифічного ФП в умовах експериментальної моделі росту КЛЛ у мишей лінії С57BL/6 було обрано ад’ювантний режим його застосування (рис. 1).
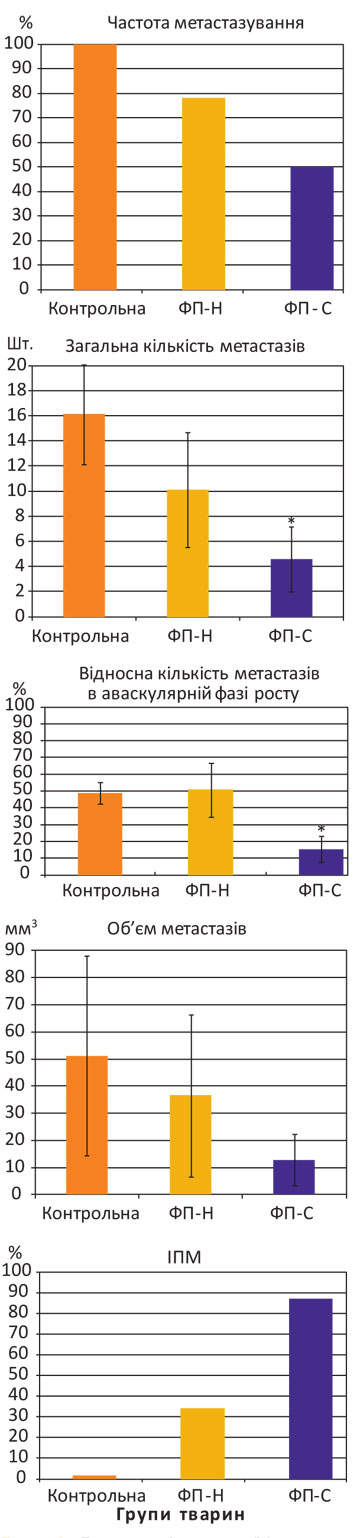
Примітка: ФП-Н — неспецифічний ФП, ФП-С — карциномаспецифічний ФП; *розбіжності при зіставленні з показниками у мишей контрольної групи статистично вірогідні (р<0,05).
Як свідчать дані, представлені на рис. 1, у тварин із підшкірною КЛЛ, які отримали тільки хірургічне лікування (контрольна група), метастази в легенях виникли в 100% випадків загальною кількістю 16,11±3,98 шт.; частка в аваскулярній фазі росту — 32,06±4,50%; об’єм — 51,23±36,74 мм3. Після ад’ювантного застосування неспецифічного ФП частота метастазування знизилася до 78%, проте кількість та об’єм метастазів у легенях мишей залишилися на рівні значень у контрольній групі (відповідно 10,11±4,55 шт.; 33,33±10,91%; 36,54±29,83 мм3; р>0,05). При цьому ІПМ становив 29%.
І навпаки, ад’ювантна імунотерапія карциномаспецифічним ФП суттєво гальмує процес метастазування КЛЛ: метастази в легенях виникли лише у 50% мишей, їх загальна кількість та частка в аваскулярній фазі значно зменшилися (відповідно 4,59±2,58 шт. і 9,16±5,21%) при порівнянні з показниками у тварин контрольної групи (р0,05). При цьому ІПМ у тварин з метастазами КЛЛ в легенях становив 75%.
Отже, можна стверджувати, що застосування карциномаспецифічного ФП в ад’ювантному режимі є ефективним засобом запобігання розвитку метастазів КЛЛ у мишей лінії С57BL/6. Проте залишається нез’ясованою селективність антиметастатичної дії карциномаспецифічного ФП в умовах росту іншої за гістогенезом пухлини у buy generic cialis мишей С57BL/6. Відповідність такої дії карциномаспецифічного ФП, отриманого при імунізації щурів клітинами КЛЛ, умовам переносу імунореактивності саме на її антигени була предметом перевірки на експериментальній моделі росту меланоми В16 у мишей С57BL/6.
Ад’ювантне застосування ФП (дози та схеми введення зразків аналогічні попередньому експерименту) у мишей С57BL/6 з меланомою В16 виявило дещо іншу відповідь на терапію (рис. 2).
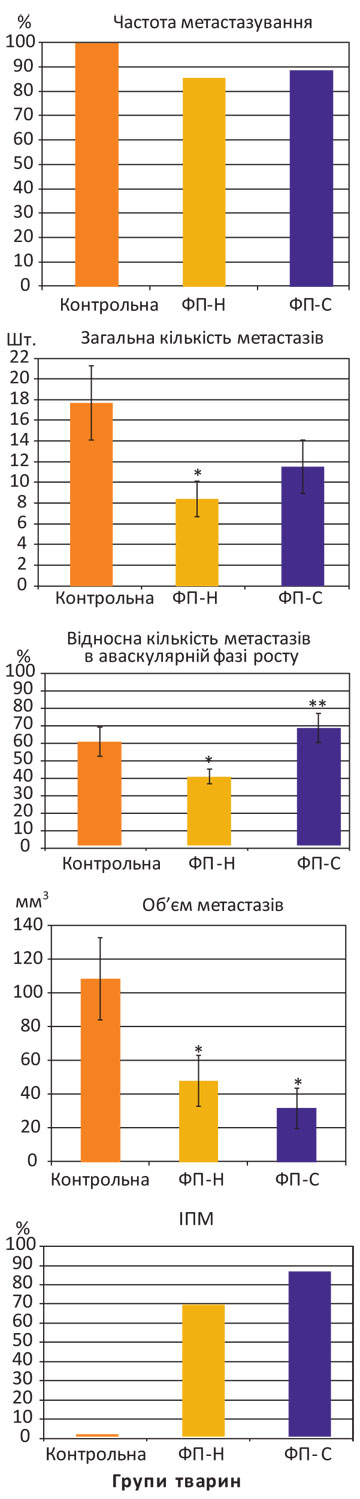
Примітка: ФП-Н — неспецифічний ФП, ФП-С — карциномаспецифічний ФП; *розбіжності при зіставленні з показниками у мишей контрольної групи статистично вірогідні (р<0,05); **розбіжність при порівнянні з дією ФП-Н статистично вірогідна (р<0,05).
Як свідчать дані рис. 2, метастази в легенях тварин контрольної групи після видалення первинної меланоми виникли у 100% випадків (17,71±3,61 шт.); частка в аваскулярній фазі росту — 43,14±6,08%; об’єм — 108,84±24,43 мм3. Після ад’ювантного застосування неспецифічного ФП частота метастазування становила 85,7%, кількість метастазів та їх об’єм значно зменшилися (відповідно до 8,43±1,73 шт. та 48,27±14,92 мм3) із часткою в аваскулярній фазі росту 28,67±3,12% при зіставленні з аналогічними показниками у мишей контрольної групи (р<0,05). ІПМ за таких умов застосування неспецифічного ФП дорівнював 56%.
Після ад’ювантної імунотерапії карциномаспецифічним ФП отримано схожі результати: метастази меланоми В16 в легенях мишей виникли у 88,9% випадків, зареєстровано тенденцію (р>0,05) до зменшення кількості метастазів до 11,56±2,57 шт. із вірогідним зменшенням їх об’єму до 32,13±11,91 мм3 при порівнянні з такими у тварин контрольної групи. Проте суттєвої різниці при зіставленні з показниками у мишей після застосування неспецифічного ФП не виявлено, за винятком кількості метастазів в аваскулярній фазі росту (48,90±6,00%), що вірогідно відрізнялася від такої після застосування неспецифічного ФП, але відповідала контрольному значенню. ІПМ — 70%.
Отже, суттєвої різниці у антиметастатичній дії неспецифічного і карциномаспецифічного ФП в умовах ад’ювантного застосування у мишей С57BL/6 з меланомою В16 не виявлено, що може свідчити на користь більшої відповідності карциномаспецифічного ФП антигенному профілю КЛЛ.
Характерною ознакою ФП є перенос імунореактивності на антиген від імунного донора неімунному реципієнту, що визначається in vitro за допомогою ПАМ-тесту, дані якого добре корелюють з відтворенням гіперчутливості уповільненого типу (ГУТ) in vivo [19]. Відомо, що антигенспецифічна імунореактивність, індукована ФП, може бути серійно перенесена від невеликої кількості лімфоцитів у системі in vitro, втягуючи в такий спосіб у реакцію ГУТ значну популяцію несенсибілізованих клітин [20]. Очевидно, що структура ФП визначає антигензв’язуючі властивості і таким чином забезпечує специфічне розпізнавання [21]. ФП ініціює формування імунореактивності протягом короткого проміжку часу, але реакція ГУТ, що перенесена за допомогою ФП, спостерігається більше року [19].
У цьому дослідженні здатність до переносу несенсибілізованому реципієнту імунореактивності на антигени КЛЛ in vivo за допомогою карциномаспецифічного ФП була підтверджена результатами ПАМ-тесту (рис. 3 а).
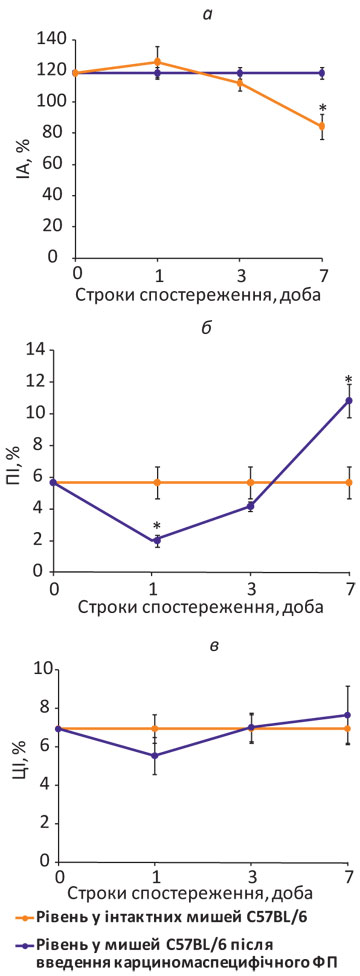
Примітка: *розбіжності при порівнянні з показником у інтактних тварин статистично вірогідні (р<0,05).
Як видно з даних, наведених на рис. 3 а, клітинно-опосередкована імунна відповідь на антигени КЛЛ у мишей С57BL/6 після введення карциномаспецифічного ФП формується поступово на 7-му добу, про що свідчить ІА макрофагів у присутності клітин КЛЛ in vitro, який становить 84,4±8,0 проти 118,5±3,8% у інтактних тварин (p<0,05). Таку динаміку можна пояснити тим, що ФП адсорбується насамперед на цитоплазматичній мембрані Th1-клітин [19] і діє головним чином на ефекторні механізми клітинно-опосередкованого імунітету, індукуючи продукцію Th1-цитокінів (зокрема, ІФН-γ, ІЛ-1 та -2), що спрямовує розвиток імунної відповіді за Th1-сценарієм, який відіграє важливу роль у протипухлинному захисті організму [22].
Крім того, формування клітинно-опосередкованого імунітету до антигенів КЛЛ на 7-му добу після введення карциномаспецифічного ФП мишам С57ВL/6 підтверджується динамікою проліферації лімфоцитів у змішаній культурі з клітинами КЛЛ in vitro (рис. 3 б). Як свідчать дані рис. 3 б, на 1-шу добу після введення ФП проліферативна відповідь лімфоцитів на стимулюючі клітини знижується (2,00±0,37 проти 5,67±0,99% у інтактних тварин; р<0,05), на 3-тю — відновлюється (4,15±0,31%), а на 7-му — здатність лімфоцитів до проліферації in vitro в присутності клітин КЛЛ значно підвищується (10,83±1,05%; р<0,05).
При одноразовому внутрішньоочеревинному введенні ФП інтактним мишам С57ВL/6 генерації in vivo пухлиноспецифічних клітин-ефекторів не спостерігалося, про що свідчить цитотоксичність лімфоцитів проти клітин КЛЛ in vitro (рис. 3 в). Так, на 1-шу, 3-тю та 7-му добу після введення ФП цитотоксична активність лімфоцитів селезінки проти клітин КЛЛ не змінюється: відповідно 5,56±0,97; 7,04±0,74 та 7,67±1,51%, що не відрізняється від показника у інтактних тварин (6,97±0,73%; р>0,05).
Отже, карциномаспецифічний ФП здатний переносити імунореактивність на антигени КЛЛ інтактним тваринам та ініціювати розвиток імунної відповіді упродовж 7 днів після введення у низькій дозі, але не здатний індукувати за цей час генерацію in vivo цитотоксичних Т-лімфоцитів, специфічних до клітин КЛЛ, без наявної пухлини в організмі.
Підсумовуючи отримані дані, можна стверджувати, що карциномаспецифічний ФП ініціює в організмі мишей формування імунних реакцій до антигенів КЛЛ, що проявляється in vitro активною проліферацією лімфоцитів та продукуванням фактора, який пригнічує адгезію макрофагів, у присутності клітин КЛЛ. Крім того, як показано нами раніше [23], ад’ювантне застосування карциномаспецифічного ФП у мишей з КЛЛ призводить до підвищення вмісту лімфоцитів у периферичній крові та відновлення маси й клітинності органів імуногенезу, що може бути об’єктивним критерієм оцінки ефективності комбінованого pharmacy online лікування мишей з КЛЛ. У свою чергу, підвищення функціональної активності імунної системи корелює з вираженим антиметастатичним ефектом, що забезпечує запобігання розвитку метастазів КЛЛ в легенях або гальмування їх росту у випадку виникнення, що вказує на системний характер розвитку протипухлинного імунного захисту організму.
Для створення протективного імунітету ми використовували пікограмові концентрації карциномаспецифічного ФП, які не є токсичними та не стимулюють ріст первинної пухлини [23], що важливо для розробки на цій основі більш ефективних схем лікування. Патогенетично обґрунтованим є використання імунотерапії у комбінації з цитостатичною та/або променевою терапією, що сприяє досягненню синергізму їх дії [5, 24]. Зокрема, як продемонстровано раніше [25], ад’ювантне застосування карциномаспецифічного ФП у комбінації з циклофосфамідом у мишей С57BL/6 з КЛЛ ефективно попереджує метастазування в легені, що обґрунтовує доцільність використання в схемах лікування ФП, специфічного до клітин конкретної пухлини.
Таким чином, пухлиноспецифічний ФП здатний переносити реципієнту імунореактивність на антигени цієї пухлини, ініціювати за короткий час розвиток продуктивної імунної відповіді організму на пухлинний ріст і запобігати або гальмувати дисемінацію пухлинного процесу, що є підґрунтям для розробки методу імунопрофілактики метастазування злоякісних новоутворень.
Список використаної літератури
1. Федоренко З.П., Гайсенко А.В., Гулак Л.О. та ін. (2010) Рак в Україні, 2008–2009. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. нац. канцер-реєстру України, 10, Київ: 111 с.
2. Kraljevic Pavelic S., Sedic M., Bosnjak H. et al. (2011) Metastasis: new perspectives on an old problem. Mol. Cancer, 10: 22.
3. Hunter K.W., Crawford N., Alsarraj J. (2008) Mechanisms of metastasis. Breast Cancer Res., 10(1): 2.
4. Осинский С.П., Глузман Д.Ф. (2006) Диссеминированные опухолевые клетки в крови и костном мозге (молекулярный прогноз в клинической онкологии). Онкология, 8(2): 102–108.
5. Ménard C., Martin F., Apetoh L. et al. (2008) Cancer chemotherapy: not only a direct cytotoxic effect, but also an adjuvant for antitumor immunity. Cancer Immunol. Immunother., 57(11): 1579–1587.
6. Chodorowski Z., Anand J.S., Wiśniewski M. et al. (2007) Spontaneous regression of cancer — review of cases from 1988 to 2006. Przegl. Lek., 64(4–5): 380–382.
7. Caspi R.R. (2008) Immunotherapy of autoimmunity and cancer: the penalty for success. Nat. Rev. Immunol., 8(12): 970–976.
8. Осинский С., Ваупель П. (2009) Микрофизиология опухолей. Наук. думка, pharmacy online Київ, 256 с.
9. Zhang T., Herlyn D. (2009) Combination of active specific immunotherapy or adoptive antibody or lymphocyte immunotherapy with chemotherapy in the treatment of cancer. Cancer Immunol. Immunother., 58(4): 475–492.
10. Гріневич Ю.Я., Фільчаков Ф.В., Шуміліна К.С. та ін. (2008) Фактор переносу: отримання та протипухлинні властивості. Журн. АМН України, 14(4): 617–635.
11. Berron-Perez R., Chaves-Sanches R., Estrada-Garcia I. et al. (2007) Indications, usage, and dosage of the transfer factor. Rev. Alerg. Mex., 54(4): 134–139.
12. Lawrence H.S., Borkowsky W. (1996) Transfer factor — current status and future prospects. Biotherapy, 9(1–3): 1–5.
13. Гриневич Ю.А., Фильчаков Ф.В., Шумилина Е.С. и др. (2008) Фактор переноса: получение, биологическая характеристика, влияние на противоопухолевую резистентность организма. Специфічна імунотерапія в онкології, за ред. Ю.Я. Гріневича. Київ, Здоров’я: 293–328.
14. Levine P.H., Pizza G., Ajmera K. et al. (2011) Transfer factor in virus-associated malignancies: an underestimated weapon in prevention and treatment of cancer. Advances in Tumor Virology, 2: 7–20.
15. Пат. на кор. модель 43728, Україна, МПК А 61 35/28. Спосіб отримання фактора переносу, специфічного до клітин ксеногенної пухлини / Фільчаков Ф.В., Шуміліна К.С., Льон Г.Д., Гріневич Ю.Я.; заявник та патентовласник Нац. ін-т раку. — № u200903731; заявл. 16.04.09; опубл. 25.08.09, Бюл. № 16. 6 с.
16. Хаитов Р.М., Пинегин Б.В., Истамов Х.И. (1995) Экологическая иммунология. ВНИРО, Москва, 219 с.
17. Пинегин Б.В., Ярилин А.А., Симонова А.В. и др. (2001) Применение проточной цитометрии для оценки функциональной активности иммунной системы человека. Пособие для врачей-лаборантов. Москва, 55 с.
18. Лапач С.Н., Чубенко А.В., Бабич П.Н. (2001) Статистические методы в медико-биологических исследованиях с использованием Excel. Морион, Киев, 408 с.
19. Арала-Чейвз М.П., Хорсманхейлео М., Гоуст Дж.М., Фуденберг Х.Х. (1982) Биологические и клинические аспекты фактора переноса. Иммунологическая инженерия, под ред. Д.У. Джирша. Медицина, Москва, 53–104.
20. Fazio M., Carnevale-Shianca F., Sabidussi A. (1995) Serial in vitro transfer of hypersensitivity to cancer antigens by sensitised lymphocytes. Panminerva med., 37(4): 186–189.
21. Kirkpatrick C.H. (1993) Structural nature and functions of transfer factors. Ann. N.Y. Acad., 685: 362–368.
22. Zitvogel L., Tesniere A., Kroemer G. (2006) Cancer despite immunosurveillance: immunoselection and immunosubversion. Nat. Rev. Immunol., 6(10): 715–727.
23. Гріневич Ю.Я., Льон Г.Д., Фільчаков Ф.В. та ін. (2010) Експериментальне обґрунтування можливості застосування пухлиноспецифічного фактора переносу в біотерапії хворих зі злоякісними новоутвореннями. Онкология (спец. выпуск), 12(1): 127–133.
24. Formenti S.С., Demaria S. (2009) Systemic effects of local radiotherapy. Lancet Oncol., 10(7): 718–726.
25. Фильчаков Ф.В., Лён А.Д., Шумилина Е.С. и др. (2011) Возможности профилактики метастазирования опухолеспецифическим фактором переноса. Вопр. онкологии, 57(1): 81–85.
Иммуно-опосредованные механизмы антиметастатического действия карциномаспецифического фактора переноса в условиях роста экспериментальных опухолей у мышей С57BL/6
Резюме. Представленные экспериментальные данные свидетельствуют о перспективности метода профилактики метастазов путем активного формирования противоопухолевой иммунной защиты организма с помощью фактора переноса (ФП), специфического к клеткам конкретной опухоли. Адъювантная иммунотерапия карциномаспецифическим ФП предотвращает метастазирование карциномы легкого Льюис у 50% мышей линии С57BL/6 и угнетает рост уже развившихся метастазов в 75% случаев (при адъювантном применении неспецифического ФП — 22 и 29% соответственно). Применение карциномаспецифического ФП у мышей С57BL/6 после удаления меланомы В16 предупреждает метастазирование только у 11% животных, у остальных — тормозит рост легочных метастазов на 70% (при адъювантном применении неспецифического ФП — 14 и 56% соответственно), что свидетельствует в пользу соответствия карциномаспецифического ФП антигенному профилю карциномы легкого Льюис. Установлено, что опухолеспецифический ФП способен переносить реципиенту иммунореактивность на антигены этой опухоли, инициировать за короткое время развитие продуктивного иммунного ответа организма на опухолевый рост и предотвращать или тормозить диссеминацию опухолевого процесса, что является основой для дальнейшей разработки этого направления биотерапии больных со злокачественными новообразованиями с целью повышения эффективности основных методов их лечения.
иммунотерапия, карциномаспецифический фактор переноса, карцинома легкого Льюис, меланома В16, иммунотропные эффекты, антиметастатическое действие.














Leave a comment