Біологічні ритми функцій імунної системи та можливість їх регуляції у хворих зі злоякісними новоутвореннями (огляд літератури і результати власних досліджень)
Лабунец И.Ф. 1, Гриневич Ю.А. 2
- 1ГУ «Институт генетической и регенеративной медицины НАМН Украины», Киев
- 2Національний інститут раку, Київ
Резюме. Резюме. В огляді наведено дані про основні складові контролю добових і сезонних біоритмів функцій органів і систем організму в нормі та при пухлинному процесі, зокрема ролі епіфіза в цьому контролі. Наводяться дані про біоритми функцій імунної системи у здорових людей, їх зв’язок із ритмічністю ендокринної функції тимуса, а також про формування у хворих онкологічного профілю внутрішньосистемного десинхронозу за участю тимуса. Відображено значення порушення взаємовідношень біоритмів мелатонінутворювальної функції епіфіза та глюкокортикоїдної функції кори надниркових залоз в механізмах розвитку десинхронозу центральної і периферичної ланок імунної системи при пухлинному процесі. Обґрунтовується важливість використання хронобіологічних підходів як для оцінки порушень функціонування імунної та ендокринної систем, так і для призначення синхронізуючих факторів епіфіза самостійно або в поєднанні з препаратами тимуса в схемах основного лікування пацієнтів з онкологічними захворюваннями, для профілактики рецидивів, метастазів і виникнення новоутворень.
Резюме. В обзоре представлены данные об основных составляющих контроля суточных и сезонных биоритмов функций органов и систем организма в норме и при опухолевом процессе, в частности роли эпифиза в этом контроле. Приводятся данные о биоритмах функций иммунной системы у здоровых людей, их связи с ритмичностью эндокринной функции тимуса, а также о формировании у больных онкологического профиля внутрисистемного десинхроноза с участием тимуса. Отражено значение нарушений взаимоотношений биоритмов мелатонинобразующей функции эпифиза и глюкокортикоидной функции коры надпочечников в механизмах развития десинхроноза центрального и периферического звеньев иммунной системы при опухолевом процессе. Обосновывается важность использования хронобиологических подходов как для оценки нарушений функционирования иммунной и эндокринной систем, так и назначения синхронизирующих факторов эпифиза самостоятельно или в сочетании с препаратами тимуса в схемах основного лечения пациентов со злокачественными заболеваниями, для профилактики рецидивов, метастазов и возникновения новообразований.

Классификация биоритмов, их регуляция в норме и при опухолевом процессе
Ритмичность организации физиологических процессов во времени — важное свойство живых организмов [4, 17, 29]. Биологические ритмы с периодами, которые близки к определенным геофизическим константам (циркаритмы), имеют эндогенную природу, относительную стабильность периода и способны к «захвату» внешними колеблющимися факторами [4, 17, 47]. Среди таких внешних факторов, как освещенность, температура, геомагнитное поле и влажность именно фотопериод имеет наиболее стабильные синхронизирующие свойства в отношении циркадианных (суточных) и цирканнуальных (сезонных) ритмов функций отдельных органов и систем организма. Если в организме циркадианные ритмы обеспечивают быструю адаптацию функций организма к смене дня и ночи, то цирканнуальные — контроль потенциальных возможностей функций и процессов дифференцировки [9, 15].
Система контроля циркаритмов включает в себя три ключевых компонента:
- центральные часы — пейсмекер, генерирующий ритм;
- афферентный путь, определяющий последний в соответствии с астрофизическим временем;
- эфферентный путь, по которому сигналы передаются от пейсмекера к периферическим органам, где есть периферические осцилляторы; экспрессия последних согласована с влияниями внешних синхронизирующих факторов [4, 48].
Функцию основного водителя биоритмов в организме выполняют супрахиазматические ядра (СХЯ) гипоталамуса, получающие через ретиногипоталамический путь информацию о состоянии внешнего освещения, согласно которой модулируется их пейсмекерная активность и меняется экспрессия «часовых генов» (Per1, Per2, Per3, Cry1, Cry2, Clock, Bmall|Mop3,Tim) [29, 59]. Из СХЯ гипоталамуса трансформированные сигналы поступают в центры этого органа, влияющие на деятельность лимбических структур, периферических эндокринных желез, в первую очередь надпочечниковых.
В контроле биоритмов функций организма СХЯ гипоталамуса взаимодействуют с другими структурами головного мозга, среди которых главенствующее место занимает эпифиз (пинеальная железа) [39, 66]. Эпифиз регулирует биоритмы благодаря ритмическому синтезу и секреции основного гормона индольной природы мелатонина. Эти процессы тормозятся на свету и усиливаются в темную фазу суток. Продукция мелатонина увеличивается также с укорочением фотопериода, тем самым подтверждая его участие в механизмах сезонных перестроек ряда функций организма [2, 72]. Мелатонин включается в функционирование СХЯ гипоталамуса по механизму обратной связи, действуя через свои рецепторы, плотность и аффинитет которых в ядрах изменяются в течение суток, повышаясь в темноте [29, 46]. Продемонстрирована также связь мелатонина с осцилляторами в периферических тканях, в качестве которых выступают «часовые гены» [1].
При опухолевом росте изменения взаимодействий основных составляющих системы циркаритмов могут быть связаны с их морфофункциональными нарушениями [2, 18, 41, 42, 51]. У опухоленосителей нарушения структуры СХЯ гипоталамуса и пинеалоцитов сочетаются с изменениями в этих органах соответственно уровня биогенных аминов и мелатонина [1]. Снижение уровня мелатонина при опухолевом процессе обусловлено ослаблением его синтеза в эпифизе в результате снижения активности ключевых ферментов, количества пинеальных β-адренорецепторов и/или их чувствительности к стимуляции норадреналином, с дисбалансом нейромедиаторов в мозгу и с изменением метаболизма этого гормона [18, 71]. В свою очередь, доказано, что угнетение мелатонинобразующей функции эпифиза ускоряет развитие опухолей, тогда как ее усиление или введение экзогенного мелатонина действуют противоположным образом [1, 7, 41, 55]. Мелатонин оказывает синхронизирующее влияние на измененную амплитуду и фазу ритмов некоторых функций у животных с новообразованиями. Такие изменения сопровождаются увеличением продолжительности их жизни, уменьшением массы опухоли, антиметастатическим эффектом [63].
При развитии новообразований нарушение контроля мелатонином экспрессии «часовых генов» в периферических тканях ставит под угрозу темп деления клеток, а значит, может способствовать усилению роста опухолей [1, 34, 69]. Так, мыши с мутацией гена Per2 более склонны к спонтанному канцерогенезу, а снижение экспрессии генов группы Per, связанных с апоптозом, приводит к неконтролируемой пролиферации клеток, которая сопряжена с повреждениями ДНК.
Таким образом, при опухолевом процессе результатом нарушения функционирования основных компонентов системы контроля биоритмов функций органов и систем организма может быть десинхроноз последних. К одной из систем организма, функциональное состояние которой в норме подчинено ритмическим колебаниям, относят иммунную систему.
Биоритмы функций центрального и периферического звеньев иммунной системы в норме и при онкологических заболеваниях
Здоровые люди. Известно, что для функционирования периферического звена иммунной системы молодых здоровых людей свойственны циркадианные и цирканнуальные ритмы [35, 45, 56, 58, 64, 70]. Так, в их периферической крови в темное время суток повышается содержание лимфоцитов, в частности Т- и В-популяций, СD4+-лимфоцитов, наблюдается сдвиг в балансе Т-хелперов I и II типа в сторону первых, возрастает уровень таких цитокинов, как интерлейкин (ИЛ)-1β, ИЛ-2, фактор некроза опухоли α, гранулоцитарно-макрофагальный колониестимулирующий фактор, интерферон (ИФ)-γ. В дневное время повышается содержание гранулоцитов, естественных клеток-киллеров (ЕКК), СD8+-лимфоцитов, основных классов иммуноглобулинов (Ig) и ИЛ-6. В течение суток изменяются значения показателей метаболической активности лимфоцитов периферической крови. Показано, что в крови молодых здоровых людей содержание Т-лимфоцитов и Т-хелперов повышается летом и осенью, Т-супрессоров — зимой, В-лимфоцитов и IgG — в осенне-зимний период года.
В свою очередь, доказана зависимость функционирования иммунной системы от влияния гормонов ее центрального органа — тимуса [3, 16, 36, 37]. В частности, показано, что тимический сывороточный фактор (ТСФ), или тимулин, который является высокоактивным гормоном этой железы, влияет на все этапы дифференцировки Т-лимфоцитов, функциональные свойства их регуляторных субпопуляций, активность макрофагов, ЕКК и др. [13, 16, 57]. Установлены изменения уровня тимулина в крови животных и человека в течение суток [61]. Более того, получены доказательства, что ритмические изменения функций иммунной системы в первую очередь отражают особенности внутрисистемных взаимоотношений [31, 33]. Поэтому мы исследовали у молодых здоровых людей связь циркадианных и цирканнуальных ритмов уровня ТСФ, с одной стороны, и показателей состояния иммунной системы, с другой [14, 20, 21, 23].
Уровень ТСФ в крови людей (log2 титра) оценивали по следующему методу [40]. В периферической крови определяли количество Т- и В-лимфоцитов, Т-лимфоцитов с супрессорными и хелперными функциями, содержание Ig классов M, G, A, а также ИФ и ИЛ-1β [11, 13, 23]. О степени зрелости циркулирующих в крови Т-лимфоцитов судили по их чувствительности in vitro к биологически активному фактору тимуса тимостимулину (ТС) в тесте спонтанного розеткоообразования с эритроцитами барана.
Установлено, что у молодых здоровых людей эндокринная функция тимуса активируется в ночное время и ослабевает в дневное (рис. 1). Уровень в крови ТСФ колеблется также и в течение года, составляя соответственно весной, летом, осенью и зимой 3,8±0,6; 4,7±0,3; 5,2±0,3 и 3,3±0,3; при этом осенью содержание гормона выше, чем зимой и весной, а летом выше, чем зимой (р<0,05) [21, 23, 52].
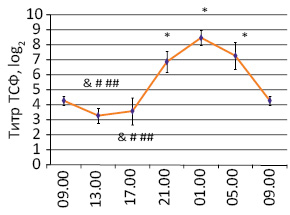
Рис. 1. Циркадианный ритм уровня ТСФ в крови молодых здоровых людей (M±m) [20, 21]. *р<0,05 по сравнению с 9.00; #р<0,05 по сравнению с 21.00; ##p<0,05 по сравнению с 1.00; &p<0,05 по сравнению с 5.00
Оказывается, что повышение в крови уровня ТСФ ночью сочетается с увеличением количества Т-лимфоцитов, а осенью — Т- и В-лимфоцитов, а также повышением концентрации IgG и уменьшением количества Т-супрессоров [14, 23]. При этом во все времена года циркулирующие в крови Т-лимфоциты были «зрелыми» и нечувствительными in vitro к ТС.
Итак, у молодых здоровых людей биоритмы показателей клеточного и гуморального звеньев иммунной системы сопряжены с особенностями ритмичности в крови уровня тимического гормона.
Больные онкологического профиля. Из данных литературы известно о том, что при новообразованиях циркадианные ритмы количества в крови лимфоцитов и их Т-популяции нарушены, а сезонные вариации в росте опухолей в значительной степени связаны со степенью выраженности дисфункции иммунной системы [5, 28, 62]. Поскольку у больных раком нарушения функционального состояния иммунной системы формируются на уровне ее центрального органа тимуса [13, 16], представляется важным выявить у них наличие связи десинхроноза эндокринной функции тимуса и функционирования периферического звена иммунной системы.
Циркадианные ритмы показателей состояния иммунной системы изучены у больных раком пищевода и кардии (РПиК) стадии T2–4N0–3M0–1 обоих полов в возрасте от 50 до 73 лет [25]. Кровь для исследований брали у больных из локтевой вены с интервалом 12 ч: в 9.00 и 21.00. Период обследования — октябрь–ноябрь.
Цирканнуальные ритмы показателей изучены у пациентов в возрасте от 20 до 40 лет: у мужчин и женщин, больных меланомой кожи (МК) в стадии Т1–2N0М0, тимомой и раком желудка (РЖ) в III–IV стадии; у женщин с неметастатической формой хорионкарциномы матки (ХКМ); у мужчин, больных раком грудной железы (РГЖ) в стадии Т3–4N0–1М0 [21, 23, 54]. Кроме того, были обследованы пациенты с предопухолевыми заболеваниями в том же возрасте: мужчины с гинекомастией и женщины с пузырным заносом [23]. Кровь для исследований брали из локтевой вены больных в утренние часы (9.00–10.00) в разное время года (весна, лето, осень, зима).
У больных РПиК установлена сопряженность особенностей нарушений суточных колебаний эндокринной функции тимуса, с одной стороны, и содержания в крови Т-клеток и IgG, с другой [25]. При этом у пациентов онкологического профиля с монотонным ритмом титра ТСФ увеличения в темное время суток количества Т-лимфоцитов и снижения концентрации IgG не отмечено.
Нарушения цирканнуальных колебаний титра ТСФ при онкопатологии характеризуются монотонностью (МК, тимома, РГЖ) или смещением сезонной акрофазы (ХКМ), что сочетается со снижением уровня гормона в отдельные сезоны года по сравнению со здоровыми людьми (рис. 2). Сочетание монотонности эндокринной функции тимуса с ее ослаблением характерно также для больных РЖ и пузырным заносом [23].
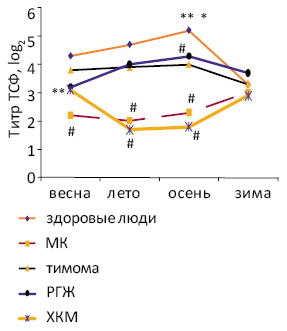
Рис. 2. Цирканнуальные колебания титра ТСФ в крови больных онкологического профиля и здоровых людей [21, 23, 54]. *p<0,05 по сравнению с зимой; **p<0,05 по сравнению с летом; #p<0,05 по сравнению со здоровыми людьми в тот же сезон
Оказывается, что особенности цирканнуальных колебаний количества Т-лимфоцитов в периферической крови больных раком во многом напоминают таковые уровня тимического гормона. Так, у пациентов с МК и РЖ, в отличие от здоровых людей, число Т-лимфоцитов осенью уменьшается, у больных ХКМ сезонный пик значений показателя смещается на весну, а при РГЖ и тимоме колебания последнего становятся монотонными [23]. Изменение сезонных колебаний количества Т-лимфоцитов в крови регистрируют уже при предопухолевых заболеваниях (пузырный занос) [23].
Результаты наших хронобиологических исследований, а также данные литературы, свидетельствующие об изменении чувствительности Т-лимфоцитов к влияниям гормонов тимуса при патологических состояниях [32], были предпосылкой к изучению ее сезонных особенностей у больных онкологического профиля. По нашим данным, сезонная реакция Т-лимфоцитов периферической крови пациентов со злокачественными заболеваниями на действие факторов тимуса in vitro извращена [23]. Если у здоровых людей количество Е-розеткообразующих клеток (Е-РОК) не изменяется после инкубации in vitro с ТС, то в группе больных онкологического профиля с таким же числом Е-РОК в отдельные сезоны его значения после обработки фактором тимуса уменьшаются (РГЖ — осенью) или повышаются (МК — зимой, РЖ — летом). У больных пузырным заносом Т-лимфоциты на инкубацию с ТС осенью практически не реагируют, несмотря на резкое уменьшение их количества.
Количество теофиллинчувствительных клеток, среди которых, как известно, преобладают Т-супрессоры, не изменяется в течение года в крови больных ХКМ; в случае сохранения при МК характера ритмичности показателя повышение его значений зимой относительно осени было все-таки более выраженным, чем в норме, что сопровождалось увеличением сезонной разницы количества Т-супрессоров с 1,3 до 1,9 раза [11, 23].
На фоне изменений количества В-лимфоцитов в крови больных раком мы наблюдали монотонность колебаний показателя (МК, ХКМ, РГЖ), смещение его сезонной акрофазы (тимома) или инверсию ритма (РЖ) [23]. У пациентов с онкологическими заболеваниями, в отличие от здоровых людей, отмечается устойчивая тенденция к снижению концентрации IgG зимой и отсутствие изменений уровня ИФ и ИЛ-1β в течение всего года [23].
Результаты анализа сочетаний нарушений цирканнуального ритма исследованных иммунологических показателей свидетельствуют о том, что во всех группах обследованных больных раком проявляются те или иные признаки внутрисистемного десинхроноза, которые затрагивают взаимосвязи, с одной стороны, показателей периферического звена иммунной системы, с другой — их же и тимического гормона (табл. 1).
Таблица 1. Сочетание нарушений цирканнуального ритма иммунологических показателей у больных онкологического профиля [23]
| Сочетаниенарушений ритмапоказателей | МК | Тимома | ХКМ | РГЖ | РЖ |
| ТСФ и Т-клетки | (+) | (+) | (+) | (+) | (+) |
| ТСФ и ИФ, ИЛ-1β | Н.а. | (+) | Н.а. | Н.а. | Н.а. |
| ТСФ иТ-супрессоры | (+) | Н.а. | (+) | Н.а. | Н.а. |
| ТСФ и В-клетки | (+) | (+) | (+) | (+) | Н.а. |
| Т-клетки и ихреакции на ТС | (+) | (–) | (+) | (+) | (+) |
| В-клетки и IgG | (+) | (+) | (+) | Н.а | (+) |
(+) – есть в определенные времена года; (−) — отсутствует в отдельные времена года; Н.а.– не анализировали.
Известно влияние гормонов тимуса именно на те процессы в клетках иммунной системы (миграция, пролиферация, дифференцировка), циркадные взаимоотношения которых определяют содержание лимфоцитов в лимфоидных органах и в циркуляции [13, 33]. Наличие у больных раком корреляционной связи между колебаниями титра ТСФ и количества Т-лимфоцитов, в том числе и с регуляторными функциями, дает основание полагать, что их ритмы при злокачественных новообразованиях взаимосвязаны. Более того, в реализации действия гормонов тимуса на Т-лимфоциты имеет значение не только время их введения, но и синхронизация ритма продукции гормонов и чувствительности лимфоцитов к их влиянию, что может быть связано с цикличностью экспрессии на Т-лимфоцитах соответствующих рецепторов [32]. Нарушение взаимоотношений биоритмов уровня в крови тимического гормона и сезонной чувствительности Т-лимфоцитов к его влиянию характерно для больных как с опухолевыми, так и с предопухолевыми заболеваниями.
В организме гормоны тимуса контролируют синтез целого ряда цитокинов, которые являются посредниками при многих иммунологических реакциях и, в свою очередь, подвержены ритмическим изменениям [64]. Противоопухолевые свойства ИФ хорошо изучены [8, 16]. Поскольку изменения уровней ИФ и ТСФ при некоторых видах онкопатологии положительно коррелируют между собой, а тимические факторы способны потенцировать интерфероногенез при опухолевом процессе, мы полагаем, что десинхроноз эндокринной функции тимуса и уровня этого медиатора у обследованных нами больных взаимосвязаны [16, 23].
Из литературы известно о влиянии гормонов тимуса на дифференцировку В-лимфоцитов в костном мозгу и их взаимодействие с другими клетками иммунной системы при реализации иммунного ответа, а также о способности тимических факторов восстанавливать сниженный уровень антител в крови людей и животных с иммунодефицитом [6, 16]. Нами в эксперименте показана возможность восстановления факторами тимуса нарушенных цирканнуальных ритмов антителообразования, что, по-видимому, связано с адекватным сезонным образованием Т-супрессоров в таких условиях [19]. Действительно, при МК на фоне десинхроноза эндокринной функции тимуса мы отмечали значительное усиление сезонного размаха колебаний количества Т-супрессоров в крови пациентов с онкопатологией. Как установлено, не только снижение, но и повышение амплитуды ритмов сопряжено с ослабленим адаптационных возможностей организма [17].
Таким образом, у больных с новообразованиями различного генеза нарушение биоритмов эндокринной функции тимуса можно отнести к одному из важных патогенетических механизмов изменений ритмичности функций клеточного и гуморального звеньев иммунной системы. Возможные механизмы связи дисфункции тимуса и изменений иммунологических показателей при опухолевом процессе подробно проанализированы в обзоре [13]. В свою очередь, десинхроноз функционального состояния тимуса при опухолевом росте может быть обусловлен и нарушением межсистемных взаимоотношений этой железы с функционированием других органов эндокринной системы [16]. В отличие от них, тимус выполняет не только эндокринную, но и цитокринную функцию. Особый интерес представляют взаимоотношения ритмичности функционирования тимико-лимфатической системы с такими компонентами циркадной системы, как эпифиз и кора надпочечников.
Роль дисфункции эпифиза и коры надпочечников в эндокринных механизмах внутрииммунного десинхроноза у больных с опухолями
Биоритмы функций эпифиза и коры надпочечников у больных онкологического профиля. Авторами отмечено, что свойственный здоровым людям ночной пик концентрации в крови мелатонина снижается при ряде злокачественных новообразований (РГЖ, РЖ, рак щитовидной железы, легкого и предстательной железы) [18, 41]. При этом выраженность снижения уровня гормона коррелирует как с клиническим течением заболевания, в значительной степени зависящим от его стадии, биологических свойств опухоли и ее локализации, так и с продолжительностью жизни пациентов с онкопатологией. При начальных стадиях опухолевого процесса и относительно хорошо дифференцированных новообразованиях уровень мелатонина в крови и моче может даже не отклоняться от нормы.
Эпифиз значительную часть своего влияния в организме реализует через гипоталамо-гипофизарно-надпочечниковую систему, гормоны которой чрезвычайно важны для развития адаптационных реакций организма [10, 44, 49, 66]. Развитие гиперкортицизма при опухолевом процессе сочетается с прогрессированием заболевания, возникновением рецидивов и метастазов [11, 16]. Единичные данные литературы свидетельствуют о монотонности циркадианного ритма уровня кортизола в крови больных раком, тогда как у молодых здоровых людей концентрация гормона утром повышается, а реакция последнего на влияние адренокортикотропного гормона изменяется в течение суток [16, 49].
Мы не только установили факт нарушения циркадианных и цирканнуальных ритмов функции эпифиза и коры надпочечников у больных онкологического профиля, но также показали наличие их взаимосвязи [21, 23, 25]. Уровень мелатонина в крови людей определяли радиоиммунологическим методом, используя наборы «Melatonin-125» («Biosource», Бельгия, и «DRG», США). Содержание в крови кортизола исследовали радиоиммунологическим (набор «CORTCTK-125» фирмы «Cea-Ire-Sorin», Франция — Италия) и иммуноферментным (наборы «ИФАКортизол», «Биотехнол» фирмы «Хема», Россия) методами.
Установлено, что у молодых здоровых людей концентрация мелатонина в крови начинает повышаться вечером и существенно возрастает в ночное время (рис. 3), тогда как у здоровых людей в возрасте старше 50 лет разница между значениями показателя утром и вечером уменьшается до 2 раз (p<0,05) [20, 21, 26]. У больных с новообразованиями изменения циркадианного ритма концентрации в крови мелатонина проявляются по-разному (рис. 4) [21, 25]. Так, показано, что у большинства обследованных больных РПиК уровень в крови гормона не повышается в 21.00 по отношению к 9.00, а в ряде случаев вечером бывает даже ниже, чем утром (больные с монотонным или инвертированным ритмом гормона). У части больных, несмотря на повышение концентрации мелатонина в 21.00, ее значения были ниже, чем в возрастном контроле. При этом активацию функции эпифиза в вечернее время мы наблюдали преимущественно у больных РПиК во II стадии, тогда как ее отсутствие — у пациентов с III–IV стадией заболевания [25].
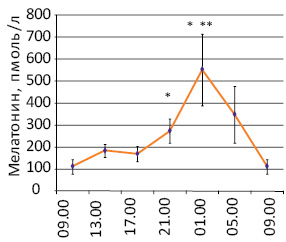
Рис. 3. Циркадианный ритм уровня мелатонина в крови молодых здоровых людей [20, 21]. *p<0,05 по сравнению с 9.00; **p<0,05 по сравнению с 17.00
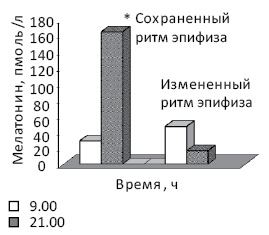
Рис. 4. Концентрация мелатонина в крови больных РПиК в зависимости от времени суток [25]. *p<0,05 по сравнению с утром
Анализ зависимости особенностей циркадианного ритма концентрации в крови кортизола от характера дисфункции эпифиза у больных РПиК позволил установить следующее. В случае монотонности или инверсии циркадианного ритма функции эпифиза размах суточных колебаний уровня кортизола был значительно выше (в 18 раз), чем у больных с активацией функции эпифиза вечером (8 раз) и у лиц группы возрастного контроля (3 раза). Это может указывать на перенапряжение у таких больных глюкокортикоидной функции коры надпочечников, вероятно, вследствие развития хронического стресса [10, 21, 25]. При этом у пациентов с раком увеличение суточной разницы отмечали в основном за счет повышения утренних значений показателя.
При исследовании цирканнуальных ритмов функции эпифиза установлено, что свойственный здоровым людям зимний пик концентрации в крови мелатонина снижается во всех обследованных группах больных со злокачественными образованиями (табл. 2), в результате чего у большинства пациентов сезонные колебания уровня гормона становятся монотонными, а у больных РЖ его максимальные значения смещаются на весну [23, 50, 53]. Ранее у больных МК нами показана монотонность сезонной экскреции с мочой метаболита гормона — 6-оксисульфатмелатонина [12, 54]. У мужчин, больных гинекомастией, активация функции эпифиза зимой отсутствует, а уровень в крови мелатонина был ниже, чем у здоровых людей.
Иммуноэндокринные взаимосвязи у больных раком.Есть доказательства того, что один из механизмов онкостатического эффекта мелатонина связан с его иммуномодулирующим действием, в значительной степени опосредованным нормализацией баланса цинка и уровня тимулина, активацией гемопоэза [1, 60]. Усиление мелатонинобразующей функции эпифиза у животных с трансплантированными и химически индуцированными опухолями тормозит их развитие, что происходит на фоне одновременной активации эндокринной функции тимуса [38]. По мнению D.P. Cardinali и соавторов [43], именно тимус является первичным органом-мишенью для действия мелатонина.
У обследованных нами больных со злокачественными опухолями для формирования нарушений биоритмов функций тимуса и периферического звена иммунной системы имеет важное значение изменение не только ритмичности мелатонинобразующей функции эпифиза и глюкокортикоидной функции коры надпочечников, но и характера их взаимоотношений; по мере распространения опухолевого процесса проявления межсистемной десинхронизации усиливаются [21, 23, 25]. Так, активацию функции тимуса у больных РПиК вечером (титр ТСФ в 9.00 и 21.00 составил соответственно 4,0±0,6 и 5,6±0,5; р<0,05) отмечают только в случае повышения в это время суток концентрации в крови мелатонина. При монотонности или инверсии ритма функции эпифиза ритмичность эндокринной функции тимуса также была монотонной (титр ТСФ утром и вечером соответственно 5,3±0,8 и 4,8±0,5; p>0,05).
Показано, что мелатонин способен непосредственно влиять на синтез и секрецию гормонов тимусом, в эпителиальных клетках которого выявлены высокоаффинные рецепторы к этому гормону [43, 67]. Мы в эксперименте регистрировали повышение уровня ТСФ в супернатанте культивированной in vitro стромы тимуса при добавлении к ней физиологических концентраций мелатонина [22].
Возможен также опосредованный путь влияния эпифиза на эндокринную функцию тимуса через изменение функционирования гипоталамо-гипофизарно-надпочечниковой системы [49, 65, 68]. Так, глюкокортикоиды в высокой концентрации оказывают угнетающее влияние на эндокринную функцию тимуса, действуя через рецепторы в эпителиальном компоненте органа [16, 68]. На фоне кратковременного гипокортицизма повышается эффективность препаратов тимуса [11, 16]. В то же время у обследованных нами больных РПиК с инверсией суточного ритма функции эпифиза и повышенным в крови утренним уровнем кортизола титр ТСФ практически не отличался от возрастного контроля. Отсутствие угнетающего влияния избытка глюкокортикоидов на эндокринную функцию тимуса может быть обусловлено либо кратковременностью гиперкортицизма, либо изменением количества и/или чувствительности к ним рецепторов в клетках этой железы, цикличность экспрессии которых, в свою очередь, контролируется мелатонином [67].
Известно, что у людей в возрасте старше 40 лет частота рака каждые последующие 5 лет удваивается [30]. В связи с этими данными обращает на себя внимание выявленный нами факт, свидетельствующий о том, что у больных онкологического профиля в возрасте 20–40 лет особенности иммунноэндокринных отношений напоминают картину у здоровых людей пожилого возраста [21, 23]. Так, у пациентов младше 40 лет сезонный пик концентрации мелатонина регистрируют весной, а не зимой, как в возрастном контроле, который при этом превышает значения у здоровых людей того же возраста. Ритм титра ТСФ, в отличие от возрастного контроля, становится монотонным, а количество Т-лимфоцитов — инвертированным с наивысшими значениями весной. Эти данные дают основание для предположения о возможном ускорении у пациентов с онкопатологией возрастных изменений цирканнуального ритма функций эпифиза, тимуса, а также значений иммунологических показателей. Результаты исследований у больных раком в возрасте младше 40 лет изменений сезонности реакции Т-лимфоцитов периферической крови на регуляторные влияния факторов тимуса также подтверждают такую возможность. Подобные изменения внутрисистемных взаимодействий мы наблюдали в эксперименте, когда у старых животных изменялась реакция тимоцитов на колебания в крови уровня ТСФ [21].
Перспективы хронобиологических исследований иммуноэндокринных взаимодействий в онкологии
С учетом данных литературы и результатов собственных работ проведение подобных исследований важно в следующих аспектах.
Во-первых, учет биоритмов функций иммунной и эндокринной систем может оказаться полезным при диагностике, разработке критериев прогноза и выделении факторов риска развития злокачественных новообразований или рецидивов и метастазов после проведения основного лечения. Это связано с тем, что при патологических состояниях наиболее ранние нарушения функций организма затрагивают именно их хронобиологическую структуру и регистрируются уже до появления клинических признаков заболевания [18, 33]. Установлено, что ритмичность функционирования эпифиза, тимуса, содержания Т-клеток и ответа последних на влияние факторов тимуса отличается от таковых у здоровых людей уже при предопухолевых заболеваниях, причем формирование десинхроноза мелатонинобразующей функции эпифиза носит опережающий характер [21, 23].
Не исключено, что в ряде случаев при обследовании пациентов с онкологическими заболеваниями отсутствие четких отклонений от нормы значений иммунологических и эндокринологических показателей можно объяснить недостатком методических подходов для их оценки. Так, показано, что при некоторых видах патологии уровни этих показателей, полученные только в утренние часы, почти не отличались от нормы [32, 33]. Однако в вечернее время значения показателей изменяются по сравнению со здоровыми людьми, что в итоге может свидетельствовать о нарушении амплитуды их суточного ритма. Поэтому для объективизации оценки функций иммунной и эндокринной систем больных онкологического профиля, позволяющей выявить наличие нарушений, является целесообразным исследование именно их циркадианного ритма (по крайней мере утром и вечером), а не только фиксация утренних значений показателя.
Во-вторых, оценку направленности влияния иммуномодулирующих средств на функции иммунной системы онкологических больных следует проводить с учетом сезона. При этом необходимо принимать во внимание возможность существования извращенности сезонной реакции лимфоцитов на их воздействие в отдельные времена года.
В-третьих, учет циркадианных и цирканнуальных ритмов пролиферативной активности лимфоидных и костномозговых клеток [19, 28], а значит и их чувствительности к повреждающему действию химио-, лучевой и гормонотерапии, позволит индивидуализировать режимы последних. Перспективность использования достижений хронобиологии для развития принципа индивидуального подхода к терапии уже показана при сердечно-сосудистых заболеваниях [27].
И наконец, в качестве фармакологических средств, реабилитирующих при опухолевом процессе не только функции иммунной системы (препараты тимического происхождения [11, 13, 16]), но и их нарушенные ритмы, могут быть использованы факторы эпифиза. Последние изменяют фазу и/или амплитуду ритмов, регулируют цикличность экспрессии рецепторов к гормонам на лимфоцитах, реализуют свое синхронизирующее влияние на иммунную систему через ее центральный орган тимус, взаимодействуя при этом с корой надпочечников [1, 2, 11, 21, 39, 66, 67]. К препаратам с подобным механизмом действия следует относить как мелатонин, так и эпифизарные пептиды (эпиталамин, эпиталон), которые повышают содержание мелатонина в организме [1]. Поэтому как синхронизирующие средства препараты эпифиза можно применять самостоятельно или в сочетании с основными методами лечения больных онкологического профиля, которые не только приводят к дальнейшему истощению эндокринной функции тимуса и нарушениям периферического звена иммунной системы, но и способствуют появлению или усилению десинхроноза функций иммунной и эндокринной систем [13, 24].
Поскольку, по нашим данным, у больных раком характер колебаний показателей состояния иммунной и эндокринной систем во многом напоминает таковой у здоровых людей более старшего возраста, схемы введения препаратов эпифиза должны базироваться на возрастных особенностях чувствительности систем к их влиянию [21]. Результативность использования подобных подходов уже доказана при курсовом лечении мелатонином и пептидами эпифиза десинхронозов функций иммунной и эндокринной систем, связанных с нарушением взаимоотношений функционирования тимуса, эпифиза и коры надпочечников, у пациентов с сердечно-сосудистыми заболеваниями [21].
Заключение
Таким образом, в обзоре литературы обоснована важность включения в план основного лечения больных онкологического профиля эпифизарных препаратов по оптимизированным схемам, что будет способствовать улучшению внутри- и межсистемных взаимодействий, и, как результат, может существенно повысить его эффективность. В качестве синхронизирующих средств препараты эпифиза будут эффективными для профилактики рецидивов и метастазов у пациентов со злокачественными образованиями после проведения стандартного лечения, а также при первичной профилактике онкологических заболеваний у людей в группах риска, людей пожилого и старческого возраста с признаками десинхроноза функций иммунной и эндокринной систем. Эпифизарные препараты также могут быть полезными в онкологической практике при применении в комбинации с препаратами тимического происхождения в адъювантном режиме при проведении противорецидивных курсов. Для получения максимальной эффективности такую иммунотерапию целесообразно проводить в вечерние часы, курсами (желательно 2 раза в год), с оценкой направленности ее влияния, учитывая время года.
Список использованной литературы
1. Анисимов В.Н. (2008) Эпифиз, биоритмы и старение организма. Успехи физиол. наук, 39 (4): 40–64.
2. Анисимов В.Н., Виноградова И.А., Букалев А.В. и др. (2013) Световой десинхроноз и риск злокачественных новообразований у человека: состояние проблемы. Вопр. онкологии, 59 (3): 302–313.
3. Арион В.Я., Зимина И.В., Москвина С.Н. (2008) Иммунобиологические свойства и клиническое применение тимозинов и других препаратов тимуса. В кн.: Иммунопатол. аллергол. и инфектол., 1: 26–40.
4. Ашофф Ю.А. (1984) Обзор биологических ритмов. В кн.: Биологические ритмы. Пер. с англ. Под ред. Ю. А. Ашоффа. Т.1. Мир, Москва: 12–21.
5. Бережная Н.М., Чехун В.Ф. (2005) Иммунология злокачественного роста. Наукова думка, Киев, 732 с.
6. Бутенко Г.М. (1998) Старение иммунной системы. Пробл. старения и долголетия, 7 (3): 100–108.
7. Виноградова И.А., Букалев А.В., Забежинский М.А. и др. (2007) Влияние светового режима и мелатонина на гомеостаз, продолжительность жизни и развитие спонтанных опухолей у самок крыс. Успехи геронтол., 20 (4): 40–47.
8. Воронцова А.Л., Кудрявец Ю.И., Жильчук В.Е., Безденежных Н.А. (2013) Экспериментальное и клиническое обоснование применения препаратов интерферона при онкопатологии. Consilium medicum Ukraina, Прилож. № 21, Том 7: 15–18.
9. Гвиннер Э. (1984) Годовые ритмы: общая перспектива. В кн.: Биологические ритмы. Пер. с англ. Под ред. Ю.А. Ашоффа. Т.2. Мир, Москва: 44–54.
10. Гриневич Ю.А., Барабой В.А. (2010) Новообразовательный процесс и стрессовая патология. Логос, Киев, 156 с.
11. Гриневич Ю.А., Каменец Л.Я., Билынский Б.Т., Лобода В.И. (1990) Иммунология и иммунотерапия опухолей молочной железы. Здоров’я, Киев, 176 с.
12. Гриневич Ю.А., Лабунец И.Ф. (1990) Возрастные особенности эндокринной и иммунной систем организма при меланоме. Физиология человека, 16 (5): 103–110.
13. Гриневич Ю.А., Лабунец И.Ф. (2013) Нарушение эндокринной функции тимуса при меланоме кожи: связь с изменениями функционирования периферического звена иммунной системы (обзор литературы и результатов собственных исследований). Клиническая онкология, (3): 150–155.
14. Гриневич Ю.А., Лабунец И.Ф., Беньковская Н.П. (1989) Влияние внутривенного лазерного облучения на некоторые иммунологические и гормональные показатели периферической крови человека. В кн.: Действие низкоэнергетического лазерного излучения на кровь. Тез. докл. Всесоюз. Конф (Киев, 1989). Киев, 1989: 10–11.
15. Заморский И.И., Пишак В.П. (2003) Функциональная организация фотопериодической системы головного мозга. Успехи физиол. наук, 34 (4): 37–53.
16. Иммунобиология гормонов тимуса (1989) Под ред. Ю.А. Гриневича, В.Ф. Чеботарева. Здоров’я, Киев, 160 с.
17. Комаров Ф.И., Рапопорт С.И. (2000) Хронобиология и хрономедицина. Триада–Х, Москва, 488 с.
18. Комаров Ф.И., Рапопорт С.И., Малиновская Н.К. и др. (2004) Мелатонин в норме и патологии. Медпрактика, Москва, 308 с.
19. Лабунець І.Ф. (2001) Вікові зміни циркадних і циркануальних коливань величини імунної відповіді та числа клітин у лімфоїдних органах тварин: можливий зв’язок з факторами тимуса. Фізіол. журнал, 47 (5): 54–62.
20. Лабунец И.Ф. (2005) Влияние мелатонина на биоритмы функционального состояния тимуса, иммунной системы и коры надпочечников у пожилых людей. Пробл. старения и долголетия, 14 (4): 313–322.
21. Лабунець І.Ф. (2012) Роль епіфіза в регуляції біоритмів функцій імунної системи при старінні. Автореф. дис… д-ра. мед. наук. Київ, 39 с.
22. Лабунец И.Ф., Бутенко Г.М., Драгунова В.А., Азарскова М.В. (2003) Влияние in vitro факторов эпифиза на способность тимуса к секреции гормонов и клеточный состав костного мозга взрослых и старых мышей линии СВА. Пробл. старения и долголетия, 12 (4): 343–348.
23. Лабунец И.Ф., Гриневич Ю.А. (2004) Особенности ритмических колебаний иммунологических показателей при опухолевых заболеваниях. Онкология, 6 (1): 16–22.
24. Лабунец И.Ф., Гриневич Ю.А., Бендюг Г.Д., Югринова Л.Г. (2003) Хронобиологические подходы к оценке и коррекции нарушений функций иммунной и эндокринной систем при опухолевых заболеваниях. В кн.: Проблеми онкоіммунології: наукові та прикладні аспекти. Матеріали наук.-практ. конф. (Київ, 22-23 травня 2003 р.). Онкологія, 5 (2): 137–138.
25. Лабунец И.Ф., Гриневич Ю.А., Киркилевский С.И. и др. (2007) Циркадианный ритм мелатонинобразующей функции эпифиза при опухолевых заболеваниях: связь с ритмичностью функционального состояния тимуса и коры надпочечников. Онкология, 19 (1): 17–20.
26. Лабунець І.Ф., Шатило В.Б., Магдич Л.В. (2004) Циркадіанні взаємовідносини функцій тимуса, епіфіза та гіпофізарно-надниркової системи у молодих людей і людей похилого віку. Ендокринологія, 9 (1): 70–77.
27. Остапенко А.А., Порту Р.М. (2013) Хроноструктура суточного профиля показателей гемостазиограммы у больных ишемической болезнью сердца. Науковий журнал МОЗ України, 3 (4): 101–106.
28. Пилипенко М.І., Никифорова Н.А., Ревенкова С.І. (2002) Циркадні варіації гематологічних показників онкологічних хворих. Буков. мед. вісник, 6 (3–4): 74–77.
29. Пішак В.П., Булик Р.Є. (2009) Центральні механізми циркадіанних ритмів ссавців. Мед. університет, Чернівці, 320 с.
30. Справочник по онкологии [Справочное издание] (2008). Под ред.: С.А.Шалимова, Ю.А.Гриневича, Д.В.Мясоедова. 2-е изд., перераб. и доп. Здоров’я, Киев, 576 с.
31. Труфакин В.А., Шурлыгина А.В. (2006) Проблемы центральной регуляции биоритмов иммунной системы. Роль мелатонина. Вестник РАМН, (9–10): 121–127.
32. Труфакин В.А., Шурлыгина А.В., Дергачева Т.И., Литвиненко Г.М. (1995) Циркадные вариации метаболической реакции лимфоцитов крови людей на гормональные стимулы в норме и при развитии иммунодефицита. Бюлл. эксперим. биол. мед., (2): 181–183.
33. Труфакин В.А., Шурлыгина А.В., Дергачева Т.И. и др. (1999) Хронобиология иммунной системы. Вестник РАМН, 4: 40–43.
34. Шишко Е.Д., Гамалея Н.Ф., Минченко А.Г. Суточный ритм, циркадианные гены и злокачественные новообразования. Онкология, 12 (4): 316–320.
35. Шурлыгина А.В., Литвиненко Г.И., Дергачева Т.И., Труфакин В.А. (1998) Суточные и сезонные вариации активности дегидрогеназ лимфоцитов крови при вторичном иммунодефицитном состоянии у женщин с острым воспалительным гинекологическим заболеванием неспецифической этиологии. Бюл. эксперим. биол. и мед., 125 (5): 576–578.
36. Ярилин А.А., Беляков И.М. (1996) Тимус как орган эдокринной секреции. Иммунология, 1: 4–10.
37. Ярилин А.А., Пинчук В.Г., Гриневич Ю.А. (1991) Структура тимуса и дифференцировка Т-лимфоцитов. Наукова думка, Киев, 248 с.
38. Anisimov V.N. Zhukova O.V., Labunets I.F. et al. (1995) The inhibitory effect of light deprivation on N-nitrozomethylurea-induced carcinogenesis and on the growth of transplantated tumors in rodents: possible involvement of the pineal gland and the immune system. Exp. Oncol., 17 (1): 47–54.
39. Arendt J. (2005) Melatonin: Characteristics, concerns, and prospects. J. Biol. Rhythms, 20: 291–303.
40. Bach J.F., Dardenne M., Bach M.A. (1973) Demonstration of a circulating thymic hormone in mouse and in man. Transplant. Proc., 1(1): 99–104.
41. Bartsch Ch., Bartsch H., Peschke E. (2009) Light, melatonin and cancer: current results and future perspectives. Biol. Rhythm Res., 40 (1): 17–35.
42. Blask D.E. (2009) Melatonin, sleep disturbance and cancer risk. Sleep Med. Rev., 13 (4): 257–264.
43. Cardinali D.P., Esquifino A.I., Srinivasan V., Pandi-Perumal S.R. (2008) Melatonin and the immune system in aging. Neuroimmunomodulation, 15 (4–6): 272–278.
44. Dickmeis Th. (2009) Glucocorticoids and the circadian clock. J. Endocrinol., 200 (1): 3–22.
45. Dimitrov S., Lange T., Tieken S. et al. (2004) Sleep associated regulation of Thelper1/Thelper2 cytokine balance in humans. Brain Behav. Immun., 18 (4): 341–348.
46. Dubocovich M.L. (2007) Melatonin receptors: Role on sleep and circadian rhythm regulation. Sleep Med. Suppl., 3: 34–42.
47. Duffy J.F., Wright K.P. (2005) Entrainment of the human circadian system by light. J. Biol. Rhythms. 20 (4): 326–338.
48. Erren T.C., Reiter R.J. (2009) Defining chronodisruption. J. Pineal Res., 46 (3): 245–247.
49. Ferrari E., Arcaini A., Gornati R. et al. (2000) Pineal and pituitary-adrenocortical function in physiological aging and in senile dementia. Exp.
Gerontol., 35 (9–10): 1239–1250.
50. Grinevich Yu.A., Labunets I.F. (1986) Melatonin, thymic serum factor, and cortisol levels in healthy subjects of different age and patients with skin melanoma. J. Pineal Research, 3(3): 263–275.
51. Klerman E.B. (2005) Clinical aspects of human circadian rhythms. J. Biol. Rhythms, 20: 375–386.
52. Labunets I.F. (1996) Age-related biorhythmical disfunction of the pineal gland, thymus and hypophysial-adrenal system in healthy subjects. Aging Immunol. Infect. Dis., 6 (3–4): 167–176.
53. Labunets I.F. (2013) Sex peculiarities of age-related changes in circannual rhythms of pineal gland, hypothalamo-pituitary-adrenal axis, and thymus in healthy subjects. Advances in gerontology, 3 (4): 290–296
54. Labunets I.F., Grinevich Yu.A. (2003) Activity of the pineal gland, thymus and hipophisial-adrenal system in oncological patients. Exp. Oncol., 25 (2): 138–142.
55. Lehrer S. (1981) Blindness increases life span of male rats: pineal effect on longevity. J. Chron. Dis., 34: 427–429.
56. Logan R. W., Sarkar D.K. (2012) Circadian nature of immune function. Moll. Cell. Endocrinol., 349 (1): 82–90.
57. Lunin S.M., Novoselova E.G. (2010) Thymus hormones as a prospective anti-inflamatory agents. Expert. Opin. Ther. Targets, 14 (8): 775–786.
58. Maes M., Stevens W., Sharpe S. et al. (1994) Seasonal variation in peripheral blood leukocyte subsets and in serum interleukin-6 and soluble interleukin-2 and -6 receptor concentrations in normal volunteers. CMLS, 50 (9): 821–829.
59. Maywood E.S., O’Neill J.S., Chesham J.E., Hastings M.H. (2007) Minireview: The circadian clockwork of the suprachiasmatic nuclei — analysis of a cellular oscillator that drives endocrine rhythms. Endocrinology, 148 (12): 5624–5634.
60. Mocchegiani E., Perissin L., Santarelli L. et al. (1999) Melatonin administration in tumor-bearing mice (intact and pinealectomized) in relation to stress, zinc, thymulin and IL–2. Int. J. Immunopharmacol., 21 (1): 27–46.
61. Molinero P., Soutto M., Benot S. et al. (2000) Melatonin is responsible for nocturnal increase observed in serum and thymus of thymosin alpha1 and thymulin concentrations: observations in rats and humans. J. Neuroimmunol., 103 (2): 180–188.
62. Nelson R.J., Blom J.M.C. (1994) Photoperiodic effects on tumor development and immune function. J. Biol. Rhythms, 9 (3–4): 233–249.
63. Otalora B.B., Madrid J.A., Alvarez N. et al. (2008) Effects of exogenous melatonin and circadian synchronization on tumor progression in melanoma-bearing C57Bl6 mice J. Pineal Res., 44 (3): 307–315.
64. Petrovsky N., Harrison L.C. (1998) The chronobiology of human cytokine production. Int. Rev. Immunol., 16 (5–6): 635–649.
65. Reggiani C., Morel G.R., Console G.M. et al. (2009) Thymus-neuroendocrine axis. Physiology, molecular biology, and therapeutic potential of the thymic peptide thymulin. Ann. N. Y. Acad. Sci., 1153 (1): 98–106.
66. Reiter R.J., Rosales-Corral S., Coto-Montes A. et al. (2011) The photoperiod, circadian regulation and chronodisruption: requisite interplay between the suprachiasmatic nuclei and the pineal and gut melatonin. J. Physiol. Pharmacol., 62 (3): 269–274.
67. Saintz R.M., Mayo J.C., Reiter R.J. et al. (1999) Melatonin regulates glucocorticoid receptor: an answer to its antiapoptotic action in thymus. FASEB J., 13 (12): 1547–1556.
68. Savino W., Dardenne M. (2000) Neuroendocrine control of thymus physiology. Endocrine reviews, 21 (4): 412–443.
69. Stevens R.G. (2005) Circadian disruption and breast cancer. From melatonin to clock genes. Epidemiology, 16: 254–258.
70. Suzuki S., Toyabe S., Moroda T. et al. (1997) Circadian rhythm of leucocytes and lymphocyte subsets and its possible correlation with the function of the autonomic nervous system. Clin. Exp. Immunol., 110: 500–508.
71. Touitou Y. (2001) Human aging and melatonin. Clinical relevance. Exp. Gerontol., 36 (7): 1083–1101.
72. Wehr T.A. (1996) A «clock for all seasons» in the human brain. Prog. Brain. Res., 111: 321–342.














Leave a comment