D2 лімфодисекція: на шляху до імплементації в європейській популяції хворих на рак шлунка (огляд літератури)
Ярема Р.Р.1, Манзоні Д. де2, Фецич Т.Г.1, Огорчак М.А.3
- 1Львівський національний медичний університет імені Данила Галицького
- 2Медичний Університет м. Верони. Міжнародна асоціація раку шлунка, Верона, Італія
- 3Львівський державний онкологічний регіональний лікувально-діагностичний центр, Львів
Резюме. Покращення віддалених результатів хірургічного лікування хворих на рак шлунка залишається актуальною проблемою клінічної онкології. Наведений огляд висвітлює етапи та результати екстраполяції «східної» доктрини розширених хірургічних втручань на європейську популяцію пацієнтів із раком шлунка в умовах доказової медицини. D2 лімфодисекцію сьогодні все частіше розглядають як стандарт хірургічного лікування хворих на рак шлунка у європейських спеціалізованих центрах.

Cовременная хирургия рака желудка — в значительной степени хирургия лимфатических коллекторов. Хирург обязан в полной мере использовать возможности широкой превентивной лимфодиссекции как важнейшего независимого фактора прогноза.
М.И. Давыдов (2011) [1]
Радикальні операції з приводу злоякісних пухлин традиційно включають етап обов’язкового моноблокового видалення регіонарних лімфатичних вузлів (ЛВ). Такий підхід, запропонований більше 100 років тому американським хірургом W.S. Halsted, до сьогодні визначає тактику хірургічного лікування пацієнтів з раком основних локалізацій, в тому числі з пухлинами шлунково-кишкового тракту. Незважаючи на високу клінічну ефективність та безапеляційну стандартизацію в Азійському регіоні, розширений обсяг лімфодисекції (ЛД) (так звана D2 ЛД) при хірургічному лікуванні хворих на рак шлунка (РШ) до сьогодні не набув широкого застосування серед хірургів у Європі та Америці.
На необхідності розширеного обсягу ЛД при втручаннях у хворих на РШ наголошували ще кілька десятиліть тому Г.В. Бондар [2], А.А. Клименков, Ю.І. Патютко [3] та М.З. Сигал [4]. Проте до останніх років у європейських онкологічних клінічних рекомендаціях D2 ЛД не пропонується для широкого хірургічного загалу як стандарт надання хірургічної допомоги таким хворим [5].
Актуальність цієї проблематики підтверджується також результатами центральних рандомізованих досліджень, що стали основою для створення національних стандартів комбінованого лікування РШ у західних країнах. Так, у MAGIC trial, результати якого лягли в основу стандарту комбінованого лікування РШ у Європейському Союзі, D2 ЛД виконували лише у 42,5% пацієнтів [6]. Північноамериканський стандарт комбінованого лікування РШ базується на результатах дослідження INT 0116 trial [7], у якому розширений обсяг ЛД проводили лише у 10% хворих. У дизайні масштабного клінічного дослідження ефективності периопераційної хіміопроменевої терапії CRITICS trial, що проходить сьогодні у Європі, взагалі заплановано обсяг ЛД, менший за D2 [8]. Отже, проблема стандартизації обсягу регіонарної ЛД при хірургічному лікуванні РШ в європейській популяції пацієнтів залишається актуальною.
Процес лімфовідтоку від шлунка перебуває в рамках комплексної та мультидирекційної системи [9]. Дренаж лімфи з різних відділів шлунка здійснюється обов’язково у парааортальний колектор ЛВ по системі одного із 4 магістральних шляхів лімфовідтоку: лівий піддіафрагмальний шлях (проходить через ЛВ у басейні лівої нижньої діафрагмальної артерії), черевний шлях (проходить через ЛВ уздовж лівої шлункової, селезінкової, загальної печінкової артерій та черевного стовбура), верхній мезентеріальний шлях (отримує лімфу від субпілоричних ЛВ та проходить уздовж верхньої брижової артерії) та ретропанкреатичний шлях (пов’язаний з ЛВ гепатодуоденальної зв’язки, верхніх брижових судин та загальної печінкової артерії). Лівий піддіафрагмальний та черевний шляхи дренують лімфу від верхньої третини шлунка, лімфовідтік від тіла шлунка відбувається в основному через систему черевного шляху, а лімфовідтік від дистальних відділів шлунка здійснюється через черевний, верхній мезентеріальний та ретропанкреатичний шляхи [10].
Метастази у регіонарних ЛВ виявляють у 37–65% хворих на рак тіла шлунка, у 44–80% пацієнтів з пухлинами проксимальних відділів шлунка та у 50–59% випадків пухлин, локалізованих у дистальних відділах шлунка [11, 12]. Ураження регіонарних ЛВ прямо пропорційно залежить від глибини інвазії первинної пухлини: при інтра- та субепітеліальних пухлинах регіонарні лімфогенні метастази діагностують у 0–5,5 та 19–31% відповідно [1, 11, 13]. При інвазії м’язової оболонки чи субсерозного шару рівень ураження регіонарних ЛВ зростає до 30–62%, серозної оболонки — до 74% та досягає 90–91% при інфільтрації суміжних органів [1, 11].
Уперше моноблокову дисекцію клітковини зон регіонарного лімфогенного метастазування при хірургічному лікуванні РШ виконав у 1962 р. D. Jinnai [14]. З того часу концепція радикальної розширеної ЛД стає невід’ємним етапом стратегії хірургічного лікування РШ в Японії. Дослідження в галузі топографії ЛВ та клінічної ефективності розширеної ЛД стали основою для першого видання «Основних правил з вивчення раку шлунка», що були опубліковані на початку 60-х років минулого століття під егідою Японського дослідного товариства з вивчення РШ (Japanese Research Society for Gastric Cancer — JRSGC) [15]. Перше англомовне видання зазначених правил побачило світ в Європі лише у 1995 р. Сьогодні на основі результатів роботи Японської асоціації з РШ (Japanese Gastric Cancer Association — JGCA) опубліковано друге англомовне видання класифікації РШ JGCA [16] та Японські рекомендації лікування РШ (Japanese Gastric Cancer Treatment Guidelines — JGCTG) JGCA [17], згідно з якими вирізняють групи ЛВ шлунка (таблиця, рис. 1).
Таблиця. Лімфатична система шлунка [16]
| Групи ЛВ | Топографія ЛВ |
| № 1 | Праві паракардіальні ЛВ |
| № 2 | Ліві паракардіальні ЛВ |
| № 3 | ЛВ уздовж малої кривизни шлунка |
| № 4sa | ЛВ уздовж коротких судин шлунка |
| № 4sb | ЛВ уздовж лівих шлунково-сальникових судин |
| № 4d | ЛВ уздовж правих шлунково-сальникових судин |
| № 5 | Супрапілоричні ЛВ |
| № 6 | Інфрапілоричні ЛВ |
| № 7 | ЛВ уздовж лівої шлункової артерії |
| № 8а | ЛВ уздовж загальної печінкової артерії (передньоверхня група) |
| № 9 | ЛВ біля черевного стовбура |
| № 10 | ЛВ у воротах селезінки |
| № 11р | ЛВ уздовж проксимальних відділів селезінкової артерії |
| № 11d | ЛВ уздовж дистальних відділів селезінкової артерії |
| № 12a | ЛВ гепатодуоденальної зв’язки (уздовж печінкової артерії) |
| № 12b | ЛВ гепатодуоденальної зв’язки (уздовж гепатикохоледоха) |
| № 12р | ЛВ гепатодуоденальної зв’язки (уздовж портальної вени) |
| № 13 | Ретропанкреатодуоденальні ЛВ |
| № 14а | ЛВ уздовж верхньої мезентеріальної артерії |
| № 14v | ЛВ уздовж верхньої мезентеріальної вени |
| № 15 | ЛВ уздовж середніх товстокишкових судин |
| № 16 | Парааортальні ЛВ |
| № 17 | ЛВ на передній поверхні головки підшлункової залози |
| № 18 | ЛВ уздовж нижнього краю підшлункової залози |
| № 19 | Піддіафрагмальні ЛВ |
| № 20 | ЛВ стравохідного отвору діафрагми |
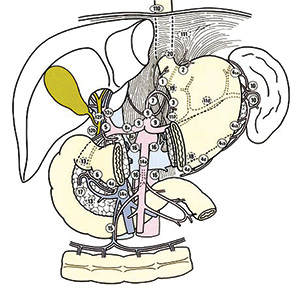
Відповідно до класифікації РШ JGCA (1998) [16] лімфатична система шлунка складається з трьох груп ЛВ, кожна з яких є тимчасовим бар’єром на шляху пухлинних клітин до системного лімфотоку. Розподіл лімфатичних колекторів шлунка на групи є підставою для визначення градації категорії «N» при стадіюванні та теоретичною основою для обґрунтування обсягу подальшої ЛД. Так, ураження метастатичним процесом ЛВ груп 1–6 класифікується як N1, груп 7–12а — N2, а ураження ЛВ груп 12b, p та вище — N3 (у класифікації прирівнюється до віддалених метастазів). Слід зазначити, що у класифікації TNM Міжнародного протиракового союзу (Union for International Cancer Control — UICC) [18] категорія «N» визначається не топографією, а кількістю уражених регіонарних ЛВ. Згідно з Японськими рекомендаціями лікування РШ JGCA (2011) [17] ЛВ від 1 до 12а групи включно відносять до регіонарних. Виняток становлять лише групи ЛВ № 2, 4sa, 10 та 11d, які при дистальних пухлинах шлунка не є регіонарними та розглядаються як віддалені лімфогенні метастази, та групи ЛВ № 5, 6, 12а, які при проксимальних пухлинах шлунка вважають віддаленими метастазами [16, 17].
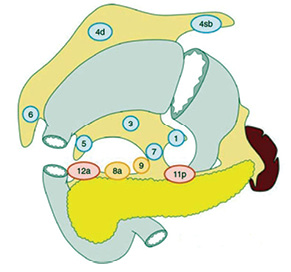
Таким чином, згідно з класифікацією РШ JGCA та Японськими рекомендаціями лікування РШ JGCA [16, 17] варіант хірургічної ЛД визначають на основі останньої видаленої групи регіонарних ЛВ залежно від локалізації пухлини в шлунку. Так, при виконанні дистальної субтотальної резекції шлунка градація ЛД є такою:
- D0: ЛД в обсязі менше ніж D1;
- D1: ЛВ № 1, 3, 4sb, 4d, 5, 6, 7;
- D1+: D1 плюс ЛВ № 8а, 9;
- D2: D1 плюс ЛВ № 8а, 9, 11р, 12а (рис. 2).
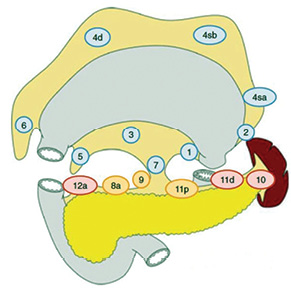
При виконанні гастректомії градація ЛД є такою:
- D0: ЛД в обсязі менше ніж D1;
- D1: ЛВ № 1–7;
- D1+: D1 плюс ЛВ № 8а, 9, 11р;
- D2: D1 плюс ЛВ № 8а, 9, 10, 11р, 11d, 12а (рис. 3).
Градація ЛД при виконанні проксимальної субтотальної резекції шлунка:
- D0: ЛД в обсязі менше ніж D1;
- D1: ЛВ № 1, 2, 3а, 4sa, 4sb, 7;
- D1+: D1 плюс ЛВ № 8а, 9, 11р (рис. 4).
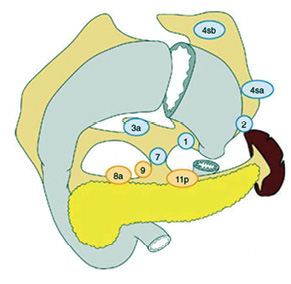
Розширена ЛД у більших за вищезазначені обсяги класифікується як D2+. Її ефективність до сьогодні залишається дискутабельною, тому вона не є рекомендованою для рутинного застосування у клінічній практиці [17].
Високу ефективність застосування класифікації РШ JGCA (1998) продемонстровано в низці клінічних досліджень [9, 19, 20]. Розподіл ЛВ за топографічним принципом в основі класифікації JGCA дозволяє розглядати її як анатомічну на противагу доволі механістичному кількісному підходу класифікації UICC. Це дає можливість достовірніше відображати розповсюдженість процесу та прогноз захворювання. На підтвердження цієї тези продемонстровано кореляцію виживаності хворих з ураженням різних груп ЛВ: при однаковій кількості регіонарних лімфогенних метастазів виживаність різнилася залежно від ураження різних колекторів ЛВ [21]. Отже, локалізація метастатично уражених регіонарних ЛВ має вірогідне прогностичне значення, так само як і їхня кількість. Так, за даними Y. Noguchi [22], при N0, ураженні ЛВ груп 1–6 (N1 згідно з JGCA), груп 7–12 (N2) та груп 13–16 (N3) 5-річна виживаність становила 85; 60; 25 та 11% відповідно.
Іншою перевагою класифікації РШ JGCA, з погляду практичного застосування, є її прямий зв’язок із обсягом ЛД, що базується на принципі етапності лімфогенного метастазування. Слід пам’ятати, що в японській класифікації термін «регіонарний лімфовузол» визначається не тільки топікою ЛВ, а й локалізацією первинної пухлини в шлунку; у класифікації UICC відповідне диференціювання відсутнє.
Так, нарешті, однією з очевидних переваг класифікації JGCA є можливість екстраполяції даних про стан регіонарних ЛВ на класифікацію UICC, тоді як зворотний процес є неможливим, що не дозволяє проводити порівняльний аналіз у ретроспективних дослідженнях різних клінік.
Критика японської класифікації РШ західними патологами та хірургами скерована в основному на складність та трудомісткість прецизійної картографії видалених ЛВ у площині практичного застосування. Таким чином, «східна» та «західна» класифікації РШ нині продовжують тривалий шлях до «зближення». Результати таких тенденцій можна спостерігати в останніх переглядах класифікації TNM UICC та версіях Japanese Gastric Cancer Treatment Guidelines JGCA [17, 18].
Уперше результати ретроспективного аналізу застосування D2 ЛД опубліковано в Японії у 1970 р. M. Mine та співавторами [23]. Автори повідомили про незначне підвищення виживаності в групі пацієнтів з рN0 та вірогідне підвищення 5-річної виживаності в групі рN+ з 10 до 21%. Подібні результати отримано у дослідженні Y. Kodama та співавторів [24]: відзначено зростання 5-річної виживаності в загальній групі пацієнтів з 33 до 58%.
У 70–80-х роках минулого століття японські хірурги активно розвивали доктрину агресивної превентивної хірургії РШ, що базується на розширених (D2), а також суперрозширених (на той час так звана D3 ЛД) обсягах ЛД [25], тоді як найбільш розповсюдженими обсягами ЛД в Європі та США залишалися D0–1 ЛД. Враховуючи значно нижчі рівні захворюваності, європейські та американські хірурги перебували на етапі переосмислення ідеології та опанування методики розширених втручань при РШ аж до кінця 90-х років. Усе це слугувало причиною для певного наукового конфлікту між «східною» та «західною» хірургічними школами: японські хірурги безапеляційно використовували D2 ЛД у хірургічній практиці, а європейські наполягали на повторному проведенні клінічних досліджень у європейській популяції пацієнтів, аргументуючи це певними біологічними відмінностями РШ «східного» типу [26].
Одним із найбільш презентативних проспективних досліджень того часу в європейській популяції хворих на РШ було дослідження F. Paccelli та співавторів [27]: науковці повідомили про вірогідне зростання 5-річної виживаності з 30% (D1 ЛД) до 49% (D2, 3 ЛД) при ІІІ стадії РШ та з 50 до 65% — у загальній групі хворих.
Подібні результати отримала група німецьких хірургів, очолювана J.R. Siewert, у рамках проспективного мультицентрового дослідження за участю майже 2,5 тис. пацієнтів [28]: вірогідне підвищення виживаності відзначено у хворих на РШ ІІ–ІІІА стадії, проте у хворих з рN2 (TNM UICC), а також з пухлинною інвазією серозної оболонки шлунка на широкій площі D2 ЛД не забезпечувала поліпшення виживаності.
Однак із плином часу дослідники все частіше звертали увагу на низьку достовірність нерандомізованих досліджень. Результати перших рандомізованих досліджень, опубліковані D.M. Dent та співавторами [29] і C.S. Robertson та співавторами [30], характеризувалися високими рівнями післяопераційних ускладнень та летальності, проте через малу кількість рандомізованих пацієнтів не могли претендувати на високу достовірність.
Протягом 90-х років організовано перші масштабні рандомізовані мультицентрові дослідження ефективності D2 ЛД в європейській популяції хворих на РШ: голландська група дослідників (Dutch Gastric Cancer Group) виконала Dutch trial [31] (рандомізовано 1078 пацієнтів), а англійські хірурги провели British MRS (Medical Research Council) trial [32] (рандомізовано 400 пацієнтів). Перші результати згаданих досліджень попередньо опубліковано та оприлюднено у 1997 р. на ІІ Міжнародному конгресі з питань РШ (International Gastric Cancer Congress — IGCC) у Мюнхені, Німеччина. У зв’язку з необхідністю дотримання повного обсягу D2 ЛД різко зросла частота спленектомій у дослідних групах (до 37% — у голландському протоколі та до 65% — у британському) і резекцій підшлункової залози (до 30% — у голландському дослідженні та до 56% — у британському). Окрім того, продемонстровано різке підвищення показників післяопераційних ускладнень при виконанні D2 ЛД (з 25%, при виконанні D0-1 у контрольній групі, до 43% — у Dutch trial та з 28 до 46% — у British trial), а також підвищення рівня післяопераційної летальності (з 4 до 10% — у Dutch trial та з 6,5 до 13% — у British trial) [31, 32]. Водночас у східноазійських клінічних дослідженнях рівень післяопераційних ускладнень становив 17–21% [33, 34]. Післяопераційна летальність при виконанні D2 ЛД у східних клініках також була значно нижчою, ніж у європейських дослідженнях: в Японському загальнонаціональному реєстрі становила <2% [35], у спеціалізованих клініках — <1% [34] або була нульовою [33].
Після 5-річного спостереження за пацієнтами, які брали участь в європейських рандомізованих дослідженнях, очікуваного зростання виживаності у групі D2 ЛД не отримано: 5-річна виживаність у Dutch trial становила 45% у групі D1 ЛД та 47% — D2 ЛД; у British trial — 35% у групі D1 ЛД та 33% — D2 ЛД [36, 37].
Отже, базуючись на принципах доказової медицини та спираючись на результати двох найбільших західних рандомізованих досліджень, в європейських онкологічних колах зроблено попередній висновок щодо неефективності розширеного обсягу ЛД в європейській популяції хворих на РШ. Проте вже у 1999 р. під час ІІІ Міжнародного конгресу з питань РШ (IGCC) у Сеулі M. Sasako (Токіо, Японія), який був головним консультантом під час проведення Dutch trial, представив детальний аналіз цього дослідження та розкрив потенційні причини відсутності позитивного результату. Резюме цього аналізу опубліковано пізніше в журналі «New England Journal of Medecine» [38]. Отже, незважаючи на добрий дизайн та детальний статистичний аналіз, у дослідженні було допущено низку серйозних помилок, що не дозволяють розглядати його результати однозначно, а саме:
- значна кількість хірургічних центрів-учасників (близько 80 клінік) зумовила низький рівень практичного досвіду виконання розширених втручань хірургами в рамках дослідження; так, окремі хірурги проводили менше 5 операцій з D2 ЛД протягом року;
- відсутність стандартизації хірургічних втручань (не було чітких критеріїв виконання спленектомії чи спленозберігаючої дисекції 10-ї групи ЛВ, апаратного чи мануального анастомозу тощо);
- відсутність індивідуальної спеціалізації у проблемі розширених операцій при РШ у значної кількості хірургів потенційно вплинула на рівень післяопераційних ускладнень та летальності, а також призвела до зменшення кількості видалених ЛВ при D2 ЛД та, як наслідок, — до зниження радикалізму втручань [38].
На противагу останньому факту, для прикладу, хірурги-учасники рандомізованого дослідження, проведеного на Тайвані, виконували щонайменше 80 втручань з D2 ЛД до початку участі у дослідженні. Результати дослідження засвідчили вірогідне зростання виживаності на фоні проведення розширених обсягів ЛД [39].
Медіана кількості видалених ЛВ є важливим показником якості проведення ЛД. Сьогодні відомо про значні географічні коливання цього показника при виконанні D2 ЛД: від діаметрально полярних значень у європейських рандомізованих дослідженнях (у британському дослідженні медіана кількості видалених ЛВ становила 17 [32], у голландському — 30 [36]) до 25–26 ЛВ у західних ретроспективних дослідженнях [40, 41] та до рівня 54 ЛВ в японських спеціалізованих центрах [34]. Мінімальна адекватна кількість видалених ЛВ при втручанні з причини РШ згідно з вимогами TNM UICC (2009) [18] становить 15 ЛВ. Такий рівень ЛД забезпечується у західних ретроспективних дослідженнях у 86–95% [40, 41] пацієнтів та у 100% хворих — в рамках японських досліджень [34]. На думку J.R. Siewert [28], якість виконання ЛД може відповідати стандартам D2 лише при видаленні не менше 26 ЛВ.
Середня частота ураження метастазами ЛВ групи № 10 (ЛВ воріт селезінки) при різних локалізаціях пухлини у шлунку становить 8,8% та вірогідно погіршує прогноз [42]. Застосування спленектомії з принципових міркувань (з метою дисекції 10-ї групи ЛВ) до сьогодні переконливо не підтвердило своєї ефективності у хворих на РШ. Так, у невеликому корейському дослідженні W. Yu та співавторів [43] продемонстровано тенденцію до зростання виживаності при виконанні спленектомії в ході хірургічного втручання, яка, проте, не була статистично вірогідною. Проведений у 2009 р. K. Yang та співавторами [44] метааналіз також не підтвердив вірогідного зростання 5-річної виживаності у хворих на РШ при виконанні спленектомії. За даними інших авторів [42], виконання спленектомії, окрім виконання за умови прямого проростання пухлини в селезінку, є необхідним лише при ураженні ЛВ групи № 4sa. Тому, незважаючи на те, що дисекція 10-ї групи ЛВ є регламентованою Японськими рекомендаціями лікування РШ JGCA (2011) [17] для виконання гастектомії, її місце та роль як стандартного етапу D2 ЛД залишаються дискутабельними. Відповідь на це питання може бути отримана найближчим часом після оприлюднення результатів великого японського рандомізованого дослідження ефективності спленектомії у хворих на рак верхньої третини шлунка JCOG 0110, що стартувало у Японії у 2002 р. [45].
Незважаючи на попередні песимістичні результати, у 2001 р. H. Hartgrink та співавтори [46] провели повторний аналіз «голландського матеріалу», за даними якого відмічено вірогідне зростання виживаності в групі D2 ЛД у пацієнтів з метастазами у ЛВ першого етапу метастазування (N1 згідно із JGCA). Після 15-річного спостереження за пацієнтами Dutch trial вірогідної різниці виживаності у групах спостереження знову не зафіксовано, проте після виключення з аналізу найбільш дискутабельної групи хворих — пацієнтів із спленектоміями та резекціями підшлункової залози, 15-річна виживаність різко зросла з 22% при D1 ЛД до 35% при D2 ЛД (р=0,006) [47].
У 2013 р. опубліковано результати метааналізу 12 найбільших європейських контрольованих рандомізованих досліджень ефективності D2 ЛД, котрий також однозначно підтвердив тезу щодо підвищення ризику післяопераційних ускладнень при виконанні D2 ЛД та вірогідного зростання виживаності хворих лише в групі без спленектомії та резекції підшлункової залози [48]. Тому у найновіших європейських онкологічних клінічних рекомендаціях D2 ЛД пропонують як стандартну хірургічну процедуру, проте виключно у високоспеціалізованих центрах з великим досвідом проведення подібних оперативних втручань та ведення післяопераційного періоду [49].
Згідно з Японськими рекомендаціями лікування РШ JGCA (2011) [17] алгоритм хірургічної тактики у хворих на РШ є таким, як представлено на рис. 5.
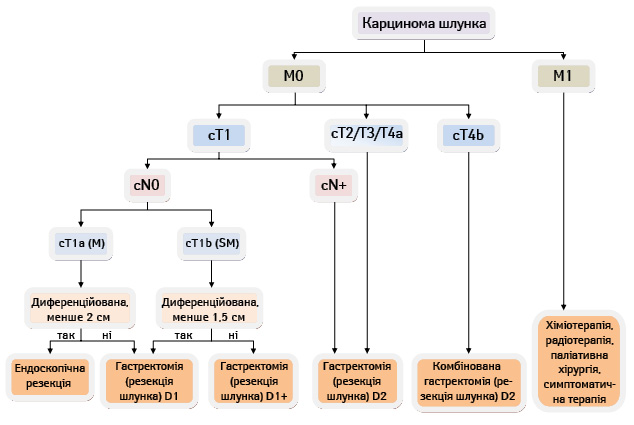
Отже, протягом тривалого часу найбільш обговорюваним на сторінках медичної періодики розділом хірургії РШ залишалося питання визначення необхідного обсягу ЛД при хірургічному лікуванні цієї патології. Однак сьогодні через призму доказової медицини можна спостерігати за результатами цієї складної еволюції поглядів: D2 ЛД розглядають як однозначний стандарт хірургічного лікування РШ у спеціалізованих центрах згідно з національними рекомендаціями Німеччини [50], Великобританії [51], Італії [52], а також відповідно до об’єднаних рекомендацій Європейських товариств медичних онкологів, онкологічних хірургів та променевих терапевтів (ESMO-ESSO-ESTRO) [49]. Такий консенсус «східної» та «західної» хірургічних шкіл став можливим завдяки багаторічному науково-практичному пошуку шляхів покращення результатів хірургічного лікування РШ у площині доказової медицини. Тому нині у західній хірургічній термінології D2 ЛД називають стандартним обсягом втручання, розширеною операцією вважають втручання з виконанням D2+ ЛД.
Дискусія щодо ефективності розширених (D2+ ЛД) втручань при РШ до сьогодні залишається відкритою. У широковідомому клінічному дослідженні M. Sasako та співавторів [38] не продемонстровано підвищення виживаності хворих при виконанні D2+ парааортальної ЛД у хворих на резектабельний РШ. Проте в низці недавніх досліджень продемонстровано можливість підвищення виживаності при застосуванні розширеної ЛД у відібраної групи хворих з високим ризиком метастазування у ЛВ 16-ї групи [53, 54]. Нез’ясованим залишається питання щодо ефективності лапароскопічної D2 ЛД при РШ. Сьогодні продовжується клінічне дослідження KLASS-2 trial, що має на меті визначити ефективність таких втручань. Відкритим є також питання щодо впливу втручань з D1+, D2 та D2+ ЛД на ризик інтраперитонеального прогресування РШ після хірургічного лікування [1, 10].
Таким чином, з урахуванням вищезазначеного нині можна стверджувати, що D2 ЛД вірогідно покращує прогноз у європейській популяції хворих на РШ, проте тільки у випадку забезпечення адекватної хірургічної якості виконання ЛД. У рамках проведення X Міжнародного конгресу з питань РШ (IGCC) у Вероні (Італія) у 2013 р. екс-президент Європейської спілки онкологічних хірургів (ESSO) професор С. van de Velde у своїй експертній лекції зазначав, що «єдиним шляхом підвищення ефективності хірургічного лікування РШ у Європі є концентрація пацієнтів у спеціалізованих хірургічних центрах, навчання та індивідуальна спеціалізація хірургів у проблемі D2 ЛД, а також об’єктивний та перманентний аудит якості лімфаденектомії кожного хірургічного центру».
Список використаної літератури
1. Давыдов М.И., Туркин И.Н., Давыдов М.М. (2011) Энциклопедия хирургии рака желудка. Эксмо, Москва, 536 с.
2. Бондарь Г.В., Думанский Ю.В., Попович А.Ю. и др. (2000) Рак желудка, 30 лет поиска: успехи и проблемы. Архив клин. эксперимент. мед., 4: 520–523.
3. Клименков А.А., Патютко Ю.И., Губина Г.И. (1988) Опухоли желудка. Медицина, Москва, 256 с.
4. Сигал М.З., Ахметзянов Ф.Ш. (1987) Гастрэктомия и резекция желудка по поводу рака. Изд. Казанского Университета, Казань, 272 с.
5. Тюляндин С.А., Носов Д.А., Переводчикова Н.И. (2009) Минимальные клинические рекомендации Европейского общества медицинской онкологии (ESMO) (рус. пер.). Издательская группа РОНЦ им. Н.Н. Блохина РАМН, Москва, 288 с.
6. Cunningam D., Allum W.H., Stenning S.P. et al. (2006) Perioperative chemotherapy versus surgery alone for resectable gastro-esophageal cancer. N. Engl. J. Med., 355: 11–20.
7. Macdonald J.S., Smalley S.R., Benedetti J. et al. (2001) Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N. Engl. J. Med., 345: 725–730.
8. Randomized phase III trial of adjuvant chemotherapy or chemoradiotherapy in resectable gastric cancer (CRITICS). http://www.clinicaltrials.gov (identifier NCT00407186).
9. Maruyama K., Gunven P., Okabayashi K. et al. (1989) Lymph node metastases of gastric cancer. General pattern in 1931 patients. Ann. Surg., 210(5): 596–602.
10. de Manzoni G., Roviello F., Siquini W. (2012) Surgery in the multimodal management of gastric cancer. Milan: Springer-Verlag Italia, 266 p.
11. Di Leo A., Marrelli D., Roviello F. et al. (2007) Lymph node involvement in gastric cancer for different tumor site and T stage. Italian Research Group for Gastric Cancer (IRGGC) experience. J. Gastrointest. Surg., 11(9): 1146–1153.
12. Shen K.H., Wu C.W., Lo S.S. et al. (1999) Factors correlated with number of metastatic lymph nodes in gastric cancer. Am. J. Gastroenterol., 94(1): 104–108.
13. Gotoda T., Yanagisawa A., Sasako M. et al. (2000) Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer., 3(4): 219–225.
14. Jinnai D., Tanaka S. (1962) Technique of extended radical operation for gastric cancer. Geka. Chiryo., 7: 316–324.
15. Japanese Research Society for Gastric Cancer (1963) The general rules for gastric cancer study. Jpn. J. Surg., 16: 121–123.
16. Japanese Gastric Cancer Association (1998) Japanese Classification Of Gastric Cancer. 2 English ed. Gastric Cancer, 1(1): 10–24.
17. Japanese Gastric Cancer Association (2011) Japanese Gastric Cancer Treatment Guidelines 2010 (ver. 3). Gastric Cancer, 14: 113–123.
18. Sobin L.H., Gospodarowicz M.K., Wittekind Ch. (2010) TNM classification of malignant tumors. 7 ed. — Blackwell Publishing, 310 p.
19. de Manzoni G., Verlato G., di Leo A. et al. (1999) Perigastric lymph node metastasis in gastric cancer: comparison of different staging systems. Gastric Cancer, 2: 201–205.
20. Maruyama K., Sasako M., Kinoshita T. et al. (1996) Surgical treatment for gastric cancer: the Japanese approach. Semin. Oncol., 23(3): 360–368.
21. Isozaki H., Okajima K., Kawashima Y. et al. (1993) Prognostic value of metastatic lymph nodes in gastric cancer with radical surgery. J. Surg. Oncol., 53(4): 247–251.
22. Noguchi Y., Imada T., Matsumoto A. et al. (1989) Radical surgery for gastric cancer: a review of Japanese experience. Cancer (Philad.), 64(10): 2053–2062.
23. Mine M., Majima S., Harada M., Etani S. (1970) End results of gastrectomy for gastric cancer: effect of extensive lymph node dissection. Surg., 68(5): 753–758.
24. Kodama Y., Sugimachi K., Soejima K. et al. (1981) Evaluation of extensive lymph node dissection for carcinoma of the stomach. World J. Surg., 5: 241–248.
25. Maeta M., Yamashiro H., Saito H. et al. (1999) A prospective pilot study of extended (D3) and superextended para-aortic lymphadenectomy (D4) in patients with T3 or T4 gastric cancer managed by total gastrectomy. Surgery, 125(3): 325–331.
26. Jatzko G., Pertl A., Jagoditsch M. (1999) Chirurgische therapie und ergebnisse beim magenfrühkarzinom. Chir. Gastroenterol., 15(3): 223–226.
27. Paccelli F., Doglietto G.B., Bellantone R. (1993) Extensive versus limited lymph node dissection for gastric cancer: a comparative study of 320 patients. Brit. J. Surg., 80(8): 1153–1156.
28. Siewert J.R., Bottcher K., Roder J.D. et al. (1993) Prognostic relevance of systemic lymph node dissection in gastric carcinoma. German Gastric Cancer Study Group. Brit. J. Surg., 80(8): 1015–1018.
29. Dent D.M., Madden M.V., Price S.K. (1988) Randomized comparison of R1 and R2 gastrectomy for gastric carcinoma. Brit. J. Surg., 75(2): 110–112.
30. Robertson C.S., Chung S.C., Woods S.D. et al. (1994) A prospective randomized trial comparing R1 subtotal gastrectomy with R3 total gastrectomy for antral cancer. Ann. Surg., 220(2): 176–182.
31. Bonenkamp J.J., Songun I., Hermans J. et al. (1995) Randomised comparison of morbidity after D1 and D2 dissection for gastric cancer in 996 Dutch patients. Lancet, 345(8952): 745–748.
32. Cuschieri A., Fayers P., Fielding J. et al. (1996) Postoperative morbidity and mortality after D1 and D2 resections for gastric cancer: preliminary results of the MRC randomised controlled surgical trial. Lancet, 347(9007): 995–999.
33. Wu C.W., Hsiung C.A., Lo S.S. et al. (2004) Randomized clinical trial of morbidity after D1 and D3 surgery for gastric cancer. Br. J. Surg., 91(3): 283–287.
34. Sano T., Sasako M., Yamamoto S. et al. (2004) Gastric cancer surgery: morbidity and mortality results from a prospective randomized controlled trial comparing D2 and extended para-aortic lymphadenectomy — Japan Clinical Oncology Group Study 9501. J. Clin. Oncol., 22(14): 2767–2773.
35. Fujii M., Sasaki J., Nakajima T. (1999) State of the art in the treatment of gastric cancer: from the 71 Japanese Gastric Cancer Congress. Gastric Cancer, 2(3): 151–157.
36. Bonenkamp J.J., Hermans J., Sasako M., van de Velde C.J.H. for the Dutch Gastric Cancer Group (1999) Extended lymph node dissection for gastric cancer. N. Engl. J. Med., 340: 908–914.
37. Cuschieri A., Weeden S., Fielding J. et al., for the Surgical Co-operative Group (1999) Patients survival after D1 and D2 resections for gastric cancer: long term results of the MRC surgical trial. Br. J. Cancer, 79(9/10): 1522–1530.
38. Sasako M., Sano T., Yamamoto S. et al. for the Japan Clinical Oncology Group (2008) D2 lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer. N. Engl. J. Med., 359(5): 453–462.
39. Wu C., Hsiung C., Lo S. et al. (2004) Nodal dissection for patients with gastric cancer: a randomized controlled trial. Lancet Oncol., 7: 309–315.
40. Smith B.R., Stabile B.E. (2006) Aggressive D2 lymphadenectomy is required for accurate pathologic staging of gastric adenocarcinoma. Am. Surgeon, 72: 849–852.
41. de Manzoni G., Verlato G., Guglielmi A. et al. (1996) Prognostic significance of lymph node dissection in gastric cancer. Br. J. Surg., 83: 1604–1607.
42. Hu J., Chen X., Yang K. et al. (2013) Metastasis, risk factors and prognostic significance of splenic hilar lymph nodes in gastric adenocarcinoma. The 10international gastric cancer congress (Verona), abstract book: 46–47.
43. Yu W., Choi G.S., Chung H.Y. (2006) Randomized clinical trial of splenectomy versus splenic preservation in patients with proximal gastric cancer. Br. J. Surg., 93(5): 559–563.
44. Yang K., Chen X.Z., Hu J.K. et al. (2009) Effectiveness and safety of splenectomy for gastric carcinoma: a meta-analysis. World J. Gastroenterol., 15(42): 5352–5359.
45. Sano T., Yamamoto S., Sasako M.; Japan Clinical Oncology Group Study JCOG 0110-MF (2002) Randomized controlled trial to evaluate splenectomy in total gastrectomy for proximal gastric carcinoma: Japan Clinical Oncology Group Study JCOG 0110-MF. Jpn. J. Clin. Oncol., 32(9): 363–264.
46. Hartgrink H.H., van de Velde C.J.H. (2001) On behalf of the Dutch Gastric Cancer Group. Update of the Dutch D1 vs D2 gastric cancer trial. The 4 international gastric cancer congress (New-York), abstract book: 665.
47. Songun I., Putter H., Meershoek-Klein Kranenbarg E. et al. (2010) Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial. Lancet Oncol., 11: 439–449.
48. Jiang L., Yang K.H., Guan Q.L. et al. (2013) Survival and recurrence free benefits with different lymphadenectomy for resectable gastric cancer: a meta-analysis. J. Surg. Oncol., 107(8): 807–814.
49. Waddell T., Verheij M., Allum W. et al. (2013) Gastric cancer: ESMO-ESSO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 24 (suppl. 6): 57–63.
50. Meyer H.J., Hölscher A.H., Lordick F. et al. (2012) Current S3 guidelines on surgical treatment of gastric carcinoma. Chirurg, 83(1): 31–37.
51. Allum W.H., Blazeby J.M., Griffin S.M. et al.; on Behalf of the Association of Upper Gastrointestinal Surgeons of Great Britain and Ireland, the British Society of Gastroenterology and the British Association of Surgical Oncology (2011) Guidelines for the management of oesophageal and gastric cancer. Gut., 60(11): 1449–1472.
52. de Manzoni G., Baiocchi G.L., Framarini M. et al (2014) The SIC-GIR CG 2013 Consensus conference on gastric cancer. Updates Surg., 66(1): 1–6.
53. Roviello F., Pedrazzani C., Marrelli D. et al. (2010) Super-extended (D3) lymphadenectomy in advanced gastric cancer. Eur. J. Surg. Oncol., 36: 439–446.
54. de Manzoni G., Di Leo A., Roviello F. et al. (2011) Tumor site and perigastric nodal status are the most important predictors of para-aortic nodal involvement in advanced gastric cancer. Ann. Surg. Oncol., 18: 2273–2280.
D2 лимфодиссекция: на пути к имплементации в европейской популяции больных раком желудка (обзор литературы)
Львовский национальный медицинский университет имени Данила Галицкого
Медицинский Университет г. Вероны. Международная ассоциация по раку желудка, Верона, Италия
Львовский государственный онкологический регионарный лечебно-диагностический центр
Резюме. Улучшение отдаленных результатов хирургического лечения больных раком желудка остается актуальной проблемой клинической онкологии. Приведенный обзор демонстрирует этапы и результаты экстраполяции «восточной» доктрины расширенных хирургических вмешательств на европейскую популяцию пациентов с раком желудка в условиях доказательной медицины. D2 лимфодиссекцию сегодня все чаще рассматривают в качестве стандарта хирургического лечения рака желудка в европейских специализированных центрах.
рак желудка, регионарные лимфоузлы, D2 лимфодиссекция
Адреса:
Ярема Роман Романович
79010, Львів, вул. Пекарська, 69
Львівський національний медичний
університет імені Данила Галицького
Тел.: (032) 295-37-61
E-mail: yaremarom@rambler.ru














Leave a comment